Особенности ортопедической реабилитации больных детского возраста с незавершенным формированием скелета при поражении первичными опухолями костей голени
Автор: Балаев Павел Иванович, Борзунов Дмитрий Юрьевич
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 1, 2013 года.
Бесплатный доступ
Цель исследования. Оценить эффективность применения метода чрескостного остеосинтеза по Илизарову при лечении первичных опухолей костей голени у детей. Материал и методы. Проведен анализ результатов лечения 22 пациентов с первичными опухолями костей голени детского возраста c применением чрескостного остеосинтеза аппаратом Илизарова. У больных с саркомой кости технологии чрескостного остеосинтеза использовали после предварительного этапа лечебных мероприятий, включающих радикальную и абластичную резекцию опухоли с соответствующим комплексом неоадьювантной химиотерапии. В группе больных с доброкачественными опухолями реабилитационные мероприятия по анатомо-функциональному восстановлению оперированной конечности выполнялись в один этап. Результаты. В группе больных (12) с доброкачественными опухолями рецидивов не было. Выживаемость больных (10) со злокачественными опухолями соответствовала средним статистическим данным мировой литературы, составила в течение трех лет 73,6 % и была пятилетней у 52,6 % лечившихся. Оценка анатомо-функциональных исходов ортопедической реабилитации свидетельствовала о том, что технологии чрескостного остеосинтеза по Илизарову были эффективны у 97,5 % пациентов, закончивших лечение. Заключение. Применение технологий чрескостного остеосинтеза по Илизарову позволило заместить пострезекционные дефекты кости и осуществить оптимальную реконструкцию конечности у всех пациентов в исследованной группе.
Дети, кости голени, опухоли, чрескостный остеосинтез по илизарову
Короткий адрес: https://sciup.org/142121648
IDR: 142121648
Текст научной статьи Особенности ортопедической реабилитации больных детского возраста с незавершенным формированием скелета при поражении первичными опухолями костей голени
Первичные опухоли костей встречаются сравнительно редко, но в большинстве случаев они возникают у лиц детского возраста и в основном локализуются в длинных трубчатых костях. При этом опухолевой процесс преимущественно поражает кости нижних конечностей с излюбленной локализацией в области коленного сустава [1, 2, 3]. Доброкачественная опухоль костей голени встречается в 36 % клинических ситуаций и в 40 % наблюдений опухоль имеет злокачественный характер. Для лечения костных опухолей с учетом их гистогенеза применяются хирургический, лучевой и лекарственный методы. Общепризнано, что для большинства больных хирургический метод лечения является основным и занимает главное место в комплексном лечении, а при доброкачественных опухолях единственно эффективным. При хирургическом методе лечения больных с опухолями костей голени у пациентов детского возраста является высокоактуальной разработка органосохранных операций. Целью оперативного вмешательства у лиц детского возраста является не только ликвидация патологического процесса и адекватное замещение образующегося после операции дефекта кости, но и сохранение способности конечно- сти к росту и восстановление её опорно-двигательной функции. У пациентов детского возраста для замещения резецированного фрагмента кости используют эндопротезы, а также различные костно-пластические материалы, алло- и аутотрансплантаты [4, 5, 6, 7]. Ограниченные возможности использования свободных аллотрансплантатов у данной группы пациентов в костной онкологии, в первую очередь, связаны с длительной реваскуляризацией реплантатов. Полноценного восстановления медуллярного кровотока в массивных свободных трансплантатах не происходит, органотипическая перестройка трансплантата затягивается до 3 лет, что обусловливает значительное отставание оперированной конечности в росте [8, 5]. Более обоснованным методом свободной трансплантации является аутопластика. Однако возможности её применения у пациентов детского возраста ограничены и связаны с необходимым объемом донорского материала, травматичностью дополнительного оперативного вмешательства при взятии реплантата, опасностью патологического перелома, неадекватностью замещения объема потери костной ткани при замещении обширных костных дефектов и, следовательно, необходимостью длительной дополнительной иммобилизации конечности [9, 10]. Нагноение, отторжение, рассасывание, несраще-ния и патологические переломы алло- и аутотрансплантатов являются типичными проблемами свободной костной пластики при замещении обширных пострезекционных дефектов [11, 12].
В настоящее время для ортопедической реабилитации больных детского возраста с первичными опухолями костей широко применяется эндопротезирование. Эндопротезирование является стандартом при восстановительном лечении пациентов с костными опухолями околосуставной локализации и позволяет быстро замещать резецированный суставной конец кости и сохранять подвижность в суставе, а также в ряде случаев выполнять и тотальное эндопротезирование сегмента при его диафизарном поражении [1, 12, 2, 3, 13, 14]. После эндопротезирования вероятность рецидива опухолевого процесса невелика, вместе с тем, рядом исследователей отмечается высокий процент осложнений, связанных, в первую очередь, с инфекцией и нестабильностью протеза и требующих выполнения ревизионных вмешательств [1, 12, 13, 14]. Помимо указанных проблем, при эндопротезировании у детей имеются определенные трудности при применении протезов после обширных резекций проксимального и дистального суставных концов большой берцовой кости из-за развития нестабильности ножек эндопротеза, при замещении резецированного диафиза большой берцовой кости и у детей раннего возраста с незавершенным формированием скелета [13, 14, 15]. Применение у них удлиняющих, телескопических эндопротезов и реэндопротезирование не позволяют решить проблему устранения укорочения оперированной конечности. Согласно данным американских исследователей, у пациентов с незавершенным формированием скелета сохранить эндопротез в сроке до 5 лет возможно у 69 %, а в сроке до 10 лет - только у 44 % детей [6]. При околосуставной локализации опухоли альтернативным оперативным вмеша- тельством является артродезирование резецированных суставных концов, образующих голеностопный и коленный суставы [7, 15, 16, 24].
Одним из эффективных способов замещения обширных пострезекционных дефектов является использование аутотрансплантатов на сосудистой ножке. В качестве пластического материала чаще используется малоберцовая кость. Основным недостатком метода, кроме тромбоза артерио-венозных шунтов, является необходимость длительной перестройки и гипертрофии трансплантата после восполнения дефекта большеберцовой кости [18, 4]. Этого недостатка также не лишена методика транс -плантации малоберцовой кости в пострезекционный дефект, в том числе и в условиях чрескостного остеосинтеза [18, 19].
В литературе имеется немного публикаций, посвященных проблеме ортопедической реабилитации пациентов детского возраста с первичными опухолями костей голени методом несвободной костной пластики по Г.А. Илизарову [15, 20, 21, 22, 23, 24, 25]. Возможности несвободной костной пластики позволили разработать новые способы замещения дефектов костей, мышц, ликвидировать укорочение конечностей, управлять ростом тканей в соответствии с поставленными клиническими задачами. В настоящее время метод широко применяется в ортопедии и травматологии и не популярен в онкологии.
Мы располагаем клиническим опытом успешного применения чрескостного остеосинтеза по Илизарову в ортопедической реабилитации больных с первичными опухолями костей голени. Популяризация метода, обобщение, систематизация клинического материала с определением дифференцированных рекомендаций по применению технологий чрескостного остеосинтеза по Илизарову и онкологических подходов в системе реконструктивно-восстановительного лечения пациентов с этой тяжелой формой костной патологии является востребованным и актуальным.
МАТЕРИАЛ И МЕТОДЫ
Работа основана на результатах лечения 22 больных детского возраста от 10 до 17 лет с морфологически верифицированным диагнозом первичной опухоли кости голени. Пациенты проходили лечение в хирургическом отделении онкологического диспансера г Кургана и отделении дефектов и костных опухолей Российского научного центра «Восстановительная травматология и ортопедия» им. акад. Г.А. Илизарова. Пациентов мужского пола было 14, женского – 8. У 10 (45,5 %) больных была выявлена злокачественная опухоль (остеогенная саркома – 7, злокачественная фиброзная гистиоцитома – 1, «адамантинома» длинных костей – 2), у 12 (55,5 %) – доброкачественная (гигантоклеточная опухоль - 8, хондробластома - 2, хондромиксоидная фиброма - 1, десмо- пластическая фиброма – 1). Опухоль локализовалась в проксимальном суставном конце большеберцовой кости у 11, в диафизе большеберцовой – у 9 и у двух больных был поражен дистальный суставной конец большеберцовой кости. В исследовании применялись антропометрический, рентгенологический, морфологический методы.
Распределение больных со злокачественными опухолями в зависимости от хирургической стадии заболевания по Enneking W.F. et al. представлено в таблице 1. У 5 (22,3 %) больных размеры опухоли выходили за пределы одной анатомической структуры, опухоль обладала высокой степенью злокачественности, что затрудняло выполнение органосохранных операций и ухудшало отдаленный прогноз лечения.
Таблица 1
Распределение больных с костными саркомами в зависимости от хирургической стадии заболевания
|
Нозология |
Стадия |
|||||
|
I A |
I B |
II A |
II B |
III |
Всего |
|
|
Остеогенная саркома |
1 |
1 |
2 |
3 |
– |
7 |
|
Злокачественная фиброзная гистиоцитома |
– |
– |
– |
1 |
– |
1 |
|
Адамантинома большеберцовых костей |
– |
– |
1 |
1 |
– |
2 |
|
ВСЕГО |
1 |
1 |
3 |
5 |
– |
10 |
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
C учетом показаний 8 (80,0 %) больным со злокачественными опухолями костей (остеогенная саркома – 7, злокачественная фиброзная гистиоцитома – 1) была проведена неоадьювантная химиотерапия, согласно методикам, разработанным в РОНЦ им. Н.Н. Блохина РАМН. Эффективность проведенного в предоперационном периоде адьювантного лечения оценивали по степени лечебного патоморфоза опухоли согласно схеме, предложенной Huvos A.G. et al. У 3 (37,5 %) пациентов была достигнута 3 степень лечебного патомор-фоза опухоли, у 5 (62,5 %) установлена 1-2 степень.
Пострезекционные дефекты кости составили от 5 до 15 см. Для их замещения были применены варианты моно- и полилокального удлинения отломков, смежных сегментов и межкостного синостозирования, а также разработанный вариант свободной аутопластики в сочетании с чрескостным остеосинтезом по Илизарову при околосуставной локализации доброкачественной опухоли.
Анализ результатов лечения показал, что в группе больных (12) с доброкачественными опухолями рецидивов не было. Выживаемость больных (10) со злокачественными опухолями соответствовала средним статистическим данным мировой литературы и составила в течение трех лет 73,6 % и была пятилетней у 52,6 % лечившихся. Оценка анатомо-функциональных исходов ортопедической реабилитации свидетельствовала о том, что технологии чрескостного остеосинтеза по Илизарову были эффективны у 97,5 % пациентов, закончивших лечение.
Приводим клинические наблюдения. Больная И., 16 лет. Поступила на лечение с жалобами на ноющие боли в левом коленном суставе после физической нагрузки и наличие опухоли в верхней трети голени.
Шесть месяцев назад после травмы левого коленного сустава появилась боль в суставе, припухлость мягких тканей. После рентгенологического исследования в проксимальном метафизе левой большеберцовой кости была обнаружена опухоль в виде очага литической деструкции кости. Предложено оперативное лечение.
При поступлении по передней поверхности левой голени в проекции проксимального метафиза большеберцовой кости обнаружена болезненная мягкотканная
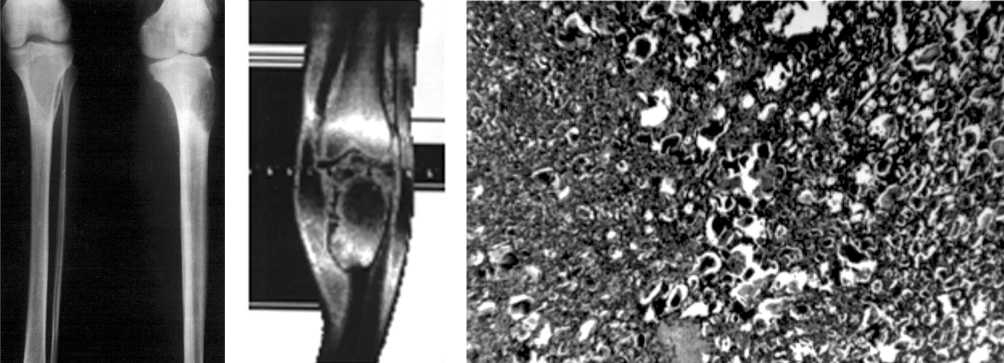
Рис. 1. Рентгенограммы области левого коленного сустава больной И. до лечения
Рис. 2. МРТ области левого коленного сустава больной И. до лечения опухоль 5×4 см, незначительная атрофия бедра и голени. Объем движений в коленном суставе изменен за счет сгибания до угла 90°.
На рентгенограммах (рис. 1) в проксимальном метадиафизе левой большеберцовой кости очаг литической деструкции размерами 8×4 см. Кость вздута, кортикальный слой истончен, по передней поверхности разрушен. Реакции надкостницы не видно. Диагноз: гигантоклеточная опухоль проксимального метадиафиза левой большеберцовой кости. С целью уточнения истинных размеров опухоли и особенности ее распространения в проксимальном направлении на эпифизарную область кости выполнили магнитно-резонансную томографию (рис. 2). На томограмме в проксимальном метадиафизе левой большеберцовой кости новообразование 8×4×4 см с четкими контурами частично разрушает область эпифиза. Диагноз гигантоклеточной опухоли кости не вызывал сомнения. Выполнили трепанобиопсию опухоли. Данные морфологического исследования препарата ткани опухоли подтвердили диагноз гигантоклеточной опухоли. Учитывая морфологическое строение опухоли, ее локализацию, размеры, целостность проксимального эпифиза, возраст пациентки, приняли решение выполнить сегментарную резекцию проксимального эпиметадиафиза левой большеберцовой кости с сохранением собственной связки надколенника, операционный дефект заместить путем удлинения дистального отломка большеберцовой кости на двух уровнях, применив билокальный последовательный дистракционно-компрессионный остеосинтез. Микроскопическое исследование препарата ткани опухоли показало картину гигантоклеточной опухоли (рис. 3).
Под наркозом произвели операцию по запланированной методике. Длина послеоперационного дефекта кости составила 9 см (рис. 4, а).
Послеоперационный период протекал без осложнений. На шестые сутки в зоне остеотомии начали выполнять дистракцию и перемещать остеотомированный фрагмент дистального отломка большеберцовой кости (снизу вверх). Через два месяца выполнили дополнительную остеотомию перемещаемого фрагмента. Дистракцию осуществляли в течение четырех месяцев. Фиксация конечности в аппарате продолжалась семь месяцев (рис. 4, б).
Рис. 3. Микрофото препарата больной И. Гигантоклеточная опухоль кости
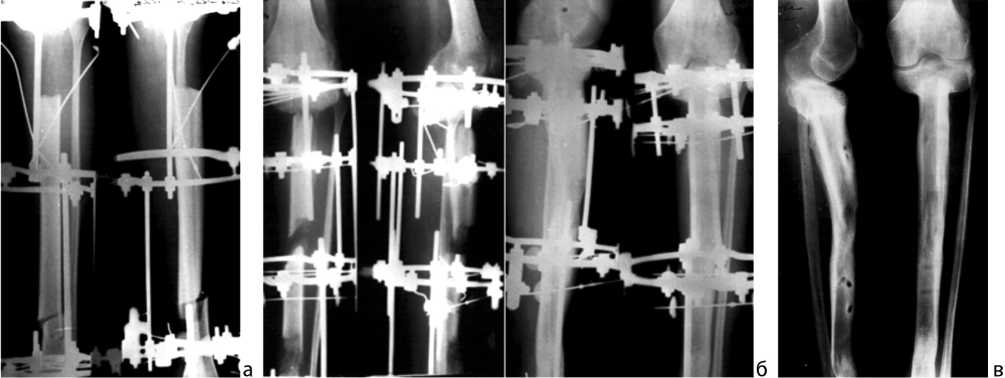
Рис. 4. Рентгенограммы левой голени больной И.: а – после операции; б – в процессе лечения; в – через 1,5 года после операции
Осмотрена через 1,5 года после операции. Жалоб нет. Ходит свободно. Движения в коленном суставе в полном объеме. Учится в институте. На контрольных рентгенограммах (рис. 4, в) отмечается восстановление целостности большеберцовой кости, данных, указывающих на рецидив опухоли, нет.
Приводим следующее клиническое наблюдение. Больной В., 15 лет. Поступил на лечение с жалобами на постоянные ноющие боли в правом коленном суставе и наличие опухоли в верхней трети правой голени. Два месяца назад впервые появились ноющие боли в правом коленном суставе, а затем отек мягких тканей в области сустава. После рентгенологического исследования была обнаружена опухоль проксимального метаэпифиза правой большеберцовой кости. При поступлении по передней поверхности правой голени в проекции проксимального метафиза большеберцовой кости обнаружена болезненная опухоль 5×6 см, незначительная атрофия мышц бедра и голени. Объем движений в коленном суставе не изменен. На рентгенограммах (рис. 5, а) правой голени в проксимальном метафизе большеберцовой кости участок уплотнения костной ткани с неровными контурами, размерами 5×3 см, по передней поверхности периостальный козырек Кодмана. Диагноз: остеогенная саркома проксимального метаэпифиза правой большеберцовой кости.
Выполнили трепанобиопсию опухоли. Данные морфологического исследования препарата ткани опухоли подтвердили диагноз остеогенной саркомы.
Учитывая данные обследования, возраст больного, приняли решение выполнить органосохраняющую операцию с комплексом химиотерапии, операционный дефект заместить удлинением дистального отломка большеберцовой кости на двух уровнях, создать ти-био-феморальный артродез, сохранить проксимальную, дистальную ростковые зоны на бедре, дистальную ростковую зону на голени, для остеосинтеза применить билокальный чередующийся дистракционно-компрессионный остеосинтез. Лечение выполнить в два этапа. На первом этапе в предоперационном периоде провести химиотерапию внутриартериальной инфузией платидиа-ма в дозе 150 мг/м2. В зависимости от ее эффективности провести от двух до шести курсов с интервалом 3-4 недели. В дальнейшем выполнить сегментарную резекцию проксимального суставного конца правой большеберцо- вой кости с формированием хронического дефекта кости. Вопрос о послеоперационной химиотерапии решить в зависимости от лечебного патоморфоза опухоли. После завершения послеоперационной химиотерапии при отсутствии рецидива и метастатического поражения легких выполнить второй этап, дефект проксимального суставного конца правой большеберцовой кости заместить путем удлинения дистального отломка кости на двух уровнях с созданием тибио-феморального артродеза.
Больному провели два курса внутриартериальной инфузии платидиама в суммарной дозе 300 мг/м2. В результате лечения купировался болевой синдром, но уменьшение размера опухоли не было отмечено. Через две недели под наркозом выполнили сегментарную резекцию проксимального метаэпифиза правой большеберцовой кости и сформировали хронический дефект кости. Длина послеоперационного дефекта проксимального суставного конца правой большеберцовой кости составила 15 см (рис. 5, б). Микроскопическое исследование гистологического препарата показало картину остеогенной саркомы, остеопластический вариант, лечебный патоморфоз опухоли II-III степени (рис. 5, в). Послеоперационный период протекал без осложнений. Операционная рана зажила первичным натяжением. Послеоперационную химиотерапию с учетом определения у пациента II-III степени лечебного па-томорфоза опухоли проводили в режиме, альтернативном предоперационному. Спустя две недели после операции применили химиотерапию по схеме САР. Провели семь курсов с интервалом в четыре недели.
Через год после резекции опухоли и семи курсов химиотерапии при отсутствии рецидива и метастатического поражения легких выполнили остеосинтез правого бедра и голени по запланированной методике (рис. 6, a). На шестые сутки после операции в зоне остеотомии начали выполнять дистракцию и перемещать остеотомированный фрагмент дистального отломка большеберцовой кости в сторону дефекта (снизу вверх). В процессе замещения дефекта с целью сокращения срока лечения выполнили дополнительную остеотомию перемещаемого фрагмента. Дистракцию продолжали в течение пяти месяцев до стыка перемещаемого фрагмента с нижним краем бедренной кости. Последующая фиксация конечности в аппарате продолжалась пять месяцев (рис. 6, б). Восстановлена опороспособная функция конечности с созданием тибио-фемо-рального артродеза.
Осмотрен через три года после резекции опухоли. Жалоб нет, ходит свободно без вспомогательных средств опоры, слегка прихрамывая на правую ногу. На кон- трольных рентгенограммах восстановлена целостность большеберцовой кости, анкилоз коленного сустава, рецидива опухоли нет (рис. 6, в, г). Продолжает учебу.
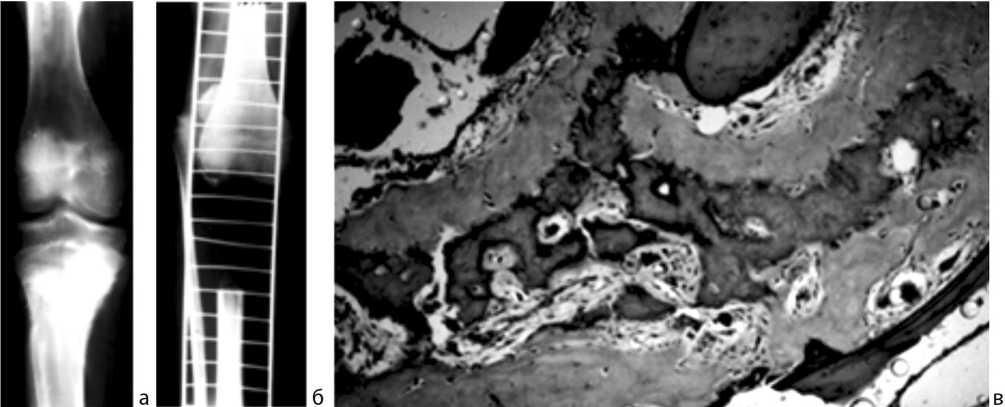
Рис. 5. Рентгенограммы области правого коленного сустава больного В.: а – до лечения; б – после операции; в – микрофото гистологического препарата, остеогенная саркома, остеопластический вариант, лечебный патоморфоз II-III степени
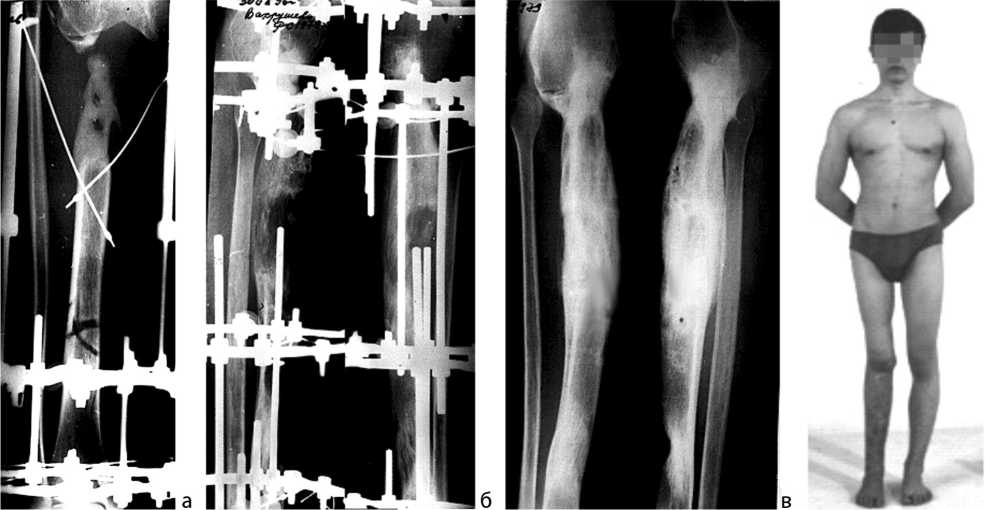
Рис. 6. Рентгенограммы правой голени больного В.: a – после операции; б – в процессе лечения; в – через 3 года после резекции опухоли; г – фото больного B. через 3 года после резекции опухоли
ОБСУЖДЕНИЕ
Несмотря на успехи в реконструктивно-восстановительном лечении пациентов с первичными опухолями длинных костей, по-прежнему является проблемой полноценное восстановление длины конечности при формировании обширных костных дефектов, длительные сроки перестройки реплантатов, ограниченные возможности восстановления полноценного внутрикостного кровообращения и гипертрофии репланта-тов. Особую сложность представляет реконструкция костного остова голени у детей, связанная, в первую очередь, не только с необходимостью восстановления целостности сегмента после резекции опухоли и ги- пертрофической перестройкой аутотрансплантатов, но и уравниванием длины конечности при ее незавершенном формировании на отдаленных этапах наблюдения пациентов [4, 6]. При замещении обширных пострезекционных дефектов длинных костей применение эндопротезирования ограничено инфекционными осложнениями, нестабильностью массивных металлоконструкций на отдаленных этапах наблюдения [1, 12, 13, 14]. Представляет определенные трудности использование эндопротезов у пациентов детского возраста с незавершенным формированием скелета. Ревизионное эндопротезирование и телескопическое удлинение ножек эндопротеза полностью не решает проблему полноценной ортопедической реабилитации пациентов этой группы [6]. Необходимо признать отсутствие широкого применения в клинической практике при лечении пациентов с первичными костными опухолями технологий чрескостного остеосинтеза. Вместе с тем, наш скромный опыт свидетельствует об эффективности методик чрескостного остеосинтеза при реабилитации онкологических больных, и позволяет рекомендовать их как альтернативные. Несвободная костная пластика по Г.А. Илизарову эффективна во всех возрастных группах и позволяет замещать пострезекционные дефекты кости и осуществлять оптимальную реконструкцию конечности не только у взрослых, но и у детей с незавершенным формированием скелета. У больных с саркомой кости с учетом показаний технология чрескостного остеосинтеза используется только после предварительного комплекса неоадью-вантной химиотерапии и радикальной, абластичной резекции опухоли. Проведение ортопедического этапа замещения оперированного дефекта конечности может проводиться в сочетании с послеоперационной химиотерапией либо после её завершения. При резекции доброкачественных костных опухолей реабилитационные мероприятия по анатомо-функциональному восстановлению оперированной конечности должны выполняться одноэтапно.
ВЫВОДЫ
Таким образом, наш опыт применения чрескост-ного остеосинтеза при лечении больных детского возраста с незавершенным формированием скелета с первичными опухолями костей голени позволяет сделать следующие выводы:
-
1. Технологии чрескостного остеосинтеза по Илизарову высокоэффективны и позволяют замещать пострезекционные дефекты кости и осуществлять оптимальную реконструкцию конечности не только у взрослых, но и у детей с незавершенным формированием скелета.
-
2. У больных с саркомой кости с учетом показа-
- ний технология чрескостного остеосинтеза используется только после предварительного комплекса неоадьювантной химиотерапии и радикальной, абла-стичной резекции опухоли. Проведение ортопедического этапа замещения оперированного дефекта конечности может проводиться в сочетании с послеоперационной химиотерапией либо после её завершения.
-
3. При резекции доброкачественных костных опухолей реабилитационные мероприятия по анатомо-функциональному восстановлению оперированной конечности должны выполняться одноэтапно.


