Особенности ответа на неоадъювантную химиотерапию у больных с агрессивными биологическими подтипами рака молочной железы II-III стадий (оригинальное исследование)
Автор: Морозов Д. А., Колядина И. В., Ганьшина И. П., Хохлова С. В., Кометова В. В., Родионов В. В., Поддубная И. В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 4 т.11, 2021 года.
Бесплатный доступ
Цель: проанализировать ответ опухоли на НАХТ при агрессивных биологических подтипах рака молочной железы (РМЖ) II-III стадии с учетом современных систем оценки остаточной патоморфологической стадии и остаточной опухолевой нагрузки по системе RCB. Материалы и методы: В анализ включено 172 пациентки с РМЖ II-III стадий с агрессивными биологическими подтипами опухоли (тройным негативным - 34,3 %, HER2 + раком - 28,5 %, люминальным B HER2- негативным РМЖ - 37,2 %). Медиана возраста пациенток - 47 лет (24-81 года); преобладал размер опухоли сT2 (65,1 %), поражение регионарных лимфоузлов имели 69,8 %; степень злокачественности G3-62,8 %, Ki67 ≥ 30 % выявлен в 90,7 % случаев. Все больные получали современную неоадъювантную химиотерапию (НАХТ), при HER2 + раке - с анти-HER2-блокадой и последующее хирургическое лечение. Морфологическая оценка включала оценку остаточной морфологической стадии - ypTN и остаточной опухолевой нагрузки по системе RCB. Результаты: Полный патоморфологический ответ (отсутствие остаточной инвазивной опухоли в молочной железе или регионарных лимфоузлах - tpCR) был отмечен у 69 из 172 больных (40,1 %), что соответствовало морфологической стадии уpT0N0 и классу RCB-0. Частота достижения tpCR была максимальна при HER2 + раке (63 % - при нелюминальном HER2 + подтипе и 59,1 % - при люминальном HER2 + РМЖ) и при тройном негативном варианте заболевания - 50,8 %. При этом, у пациенток с люминальным HER2- негативным РМЖ частота достижения tpCR составила всего 15,6 %, p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Рак молочной железы ii-iii стадии, тройной негативный рак, her2 + подтип, люминальный b her2- негативный подтип, неоадъювантная химиотерапия, двойная анти-her2-блокада, платино-содержащая химиотерапия, полный патоморфологический ответ - tpcr, остаточная патоморфологическая стадия-yptn
Короткий адрес: https://sciup.org/140290754
IDR: 140290754 | DOI: 10.18027/2224-5057-2021-11-4-5-13
Текст научной статьи Особенности ответа на неоадъювантную химиотерапию у больных с агрессивными биологическими подтипами рака молочной железы II-III стадий (оригинальное исследование)
ОСОБЕННОСТИ ОТВЕТА НА НЕОАДЪЮВАНТНУЮ ХИМИОТЕРАПИЮ У БОЛЬНЫХ С АГРЕССИВНЫМИ БИОЛОГИЧЕСКИМИ ПОДТИПАМИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ II–III СТАДИЙ (ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ)
Актуальность
Рак молочной железы (РМЖ) является социально значимой онкопатологией, лидирующей как в структуре заболеваемости, так и в структуре летальности от злокачественных новообразований в нашей стране [1]. Открытие ключевых опухолевых маркеров: рецепторов эстрогенов (ER), прогестерона (PR), эпидермального фактора роста 2 типа (HER2) и индекса пролиферации Ki67 привело к выделению основных биологических подтипов РМЖ, что изменило стратегию лечения при ранних стадиях заболевания [2]. Общемировым трендом в лечении агрессивных вариантов РМЖ II–III стадии (тройного негативного рака, HER2+ подтипа и люминального B HER2-негативного РМЖ) стало проведение неоадъювантной химиотерапии (НАХТ) [3–5]. Лекарственный этап в качестве стартового позволяет улучшить не только непосредственные результаты лечения пациентов (сократить локорегионарное лечение), так и добиться улучшения выживаемости за счет селекции больных на группу благоприятного прогноза (достигших полного регресса опухоли на неоадъювантном этапе) и группу высокого риска рецидива (с остаточной опухолью), нуждающуюся в эскалации последующей адъювантной терапии [6–9].
Ключевым вопросом остается оценка патоморфологи-ческого ответа опухоли на НАХТ, поскольку данный параметр является стратегическим для выработки дальнейшего лечебного алгоритма и оценки прогноза при РМЖ. Введение системы оценки остаточной опухолевой нагрузки RCB (Residual Cancer Burden) у пациенток, получивших неоадъювантное лечение, позволило стандартизировать оценку патоморфологического ответа, что чрезвычайно важно для клинической практики [10,11]. Однако, остается открытым вопрос конкордантности систем оценки остаточной патоморфологической стадии и остаточной опухолевой нагрузки при агрессивных биологических подтипах РМЖ. Кроме того, недостаточно изучены особенности распределения классов RCB (минимальной, умеренной или значимой остаточной опухолевой нагрузки) после современных режимов неоадъювантной химиотерапии с включением препаратов платины (при тройном негативном раке) и с двойной анти-HER2-блокадой (при HER2+ РМЖ), что и послужило обоснованием для проведения данного анализа.
Цель
Проанализировать ответ опухоли на НАХТ при агрессивных биологических подтипах РМЖ II–III стадии с учетом современных систем оценки остаточной патоморфо-логической стадии и остаточной опухолевой нагрузки по системе RCB.
Материалы и методы
В анализ включено 172 пациентки с РМЖ II–III стадий, получивших комплексное лечение по поводу основного забо- левания в ФГБУ «НМИЦ им. Н. Н. Блохина» и ФГБУ «НМИЦ АГП им. В. И. Кулакова» с 2017 по 2021 гг. Все больные имели агрессивные биологические подтипы РМЖ (тройной негативный рак, HER2+ подтип или люминальный B HER2-негатив-ный вариант), получали неоадъювантную химиотерапию (НАХТ), при HER2+ раке — с анти-HER2-блокадой, и последующее хирургическое лечение. Морфологическая оценка ответа на НАХТ учитывала остаточную патоморфологиче-скую стадию ypTN, а также оценку остаточной опухолевой нагрузки по шкале RCB с использованием online калькулятора cfm?pagename=jsconvert3).
КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА БОЛЬНЫХ
Возраст больных, включенных в исследование, составил от 24 лет до 81 года, медиана возраста — 47 лет. Большинство женщин было пременопаузального возраста (107 больных; 62,2%), в менопаузе было 65 пациенток (37,8%). Доля пациенток в возрасте до 40 лет составила 28,5% (n=49), в возрасте 40–50 лет — 30,2% (n=52), 50–60 лет — 19,8% (n=34), старше 60 лет было 37 женщин (21,5%).
Медико-генетическое консультирование на предмет носительства значимых герминальных мутаций генов BRCA1/2 и CHEK2 проведено 128 пациенткам; патогенные мутации выявлены в 23 случаев (18%). Среди патогенных мутаций доминировали мутации в гене BRCA1 — 18 из 23 случаев (78,3%), мутации гена BRCA2 отмечены у 3 из 23 больных (13%), и в 2 случаях выявлены мутации гена CHEK2 (8,7%).
Размер первичной опухоли соответствовал cT1 (≤2,0 см) у 9 больных (5,2%), cT2 (от 2 до 5 см) — у 112 (65,1%), cТ3 (более 5,0 см) — у 14 пациенток (8,1%), cT4 — в 37 случаях (21,5%). Статус регионарных лимфоузлов оценивался перед началом НАХТ по результатам клинического, рентгенологического и ультразвукового исследований, все подозрительные или измененные регионарные лимфоузлы были верифицированы при тонкоигольной биопсии или core-биопсии под контролем УЗИ. Поражение регионарных лимфоузлов было подтверждено у 120 больных; статус сN1 отмечен в 91 случае (52,9%), сN2 — в 14 (8,1%), статус сN3 имели 15 пациенток (8,7%). Распределение клинический стадий было следующим: IIA, IIB, IIIA, IIIB и IIIC стадии установлены у 53 (30,8%), 59 (34,3%), 15 (8,7%), 30 (17,4%) и у 15 женщин (8,7%), соответственно. Таким образом, первично-операбельные стадии РМЖ (T1– 3N0–1) были отмечены у большинства больных (120 случаев, 69,8%), а местнораспространенный рак (T4; N2–3 статус) имели 52 пациентки (30,2%).
МОРФОЛОГИЧЕСКАЯ ХАРАКТЕРИСТИКА РМЖ ПЕРЕД НАЧАЛОМ НАХТ
Всем пациенткам выполнена биопсия первичной опухоли; в биопсийном материале оценивались следующие факторы: гистологический подтип опухоли, степень ее злокачественности, статус рецепторов ER, PR, HER2, индекс пролиферативной активности Ki67, а также наличие лимфоваскулярной инвазии опухоли и уровень TILs. На основании сочетания ER, PR, HER2 и Ki67 выделены основные биологические подтипы опухоли.
Инвазивный протоковый рак был доминирующим гистологическим вариантом РМЖ (143 случая; 83,1 %), инвазивный дольковый рак был отмечен у 8 больных (4,7%), другие гистологические варианты (медуллярный, метапластический, слизистый) отмечены у 21 женщины (12,2%). Большинство карцином (108 случаев; 62,8%) было низкодифференцированными (G3), тогда как умереннодифференцированный рак G2 был выявлен у 64 женщин (37,2%); пациентки с высокодифференцированным РМЖ (G1) отсутствовали в исследовании.
Уровень Ki67 в первичной опухоли колебался от 10 до 98%, медиана Ki67 составила 53%. Доля пациенток с низким уровнем Ki67<30% составила всего 9,3% (16 случаев), у подавляющего большинства пациенток (90,7%, n=156) индекс Ki67 был высоким (≥30%).
Наличие опухоль-инфильтрирующих лимфоцитов (TILs) в биопсийном материале изучено у 155 больных; уровень TILs варьировал от 0 до 90%, медиана — 10%. В половине случаев (48,4%) был отмечен низкий уровень TILs <10%, уровень от 10 до 20% выявлен у 19 больных (12,3%), и в 61 случае (39,4%) уровень TILs превысил 20%.
Распределение биологических подтипов РМЖ было следующим: наиболее часто (64 случая; 37,2%) был диагностирован люминальный B HER2-негативный подтип; люминальный HER2+ рак имели 22 пациентки (12,8%), нелюминальный HER2+ подтип — 27 женщин (15,7%), тройной негативный рак отмечен в 59 случаях (34,3%).
ХАРАКТЕРИСТИКАНЕОАДЪЮВАНТНОГО ЛЕЧЕНИЯ
Всем пациенткам с узловой формой РМЖ перед началом НАХТ была проведена маркировка первичной опухоли ± регионарных метастазов с помощью рентгеноконтрастных титановых маркеров, для мониторинга эффективности лечения, ориентира при выполнении последующей операции и морфологической оценки ответа на лечение.
НАХТ проведена всем больным и включала 4 режима химиотерапии, одобренных Клиническими рекомендациями Минздрава РФ [2]:
-
1) 4 цикла АС (доксорубицин 60 мг/м2 + циклофосфамид 600 мг/м2) с последующим переключением на доцетаксел 75 мг/м2 или паклитаксел 175мг/м2, каждые 3 недели — у 47 больных, 27,3 %;
-
2) 4 цикла АС (доксорубицин 60 мг/м2 + циклофосфамид 600 мг/м2) с последующим переключением на 12 еженедельных введений паклитаксела в дозе 80 мг/м2 — у 57 пациенток, 33,1 %;
-
3) 4 цикла АС (доксорубицин 60 мг/м2 + циклофосфамид 600 мг/м2) с последующим переключением на такса-
- ны (паклитаксел или доцетаксел) и карбоплатин — в 33 случаях, 19,2%;
-
4) Безантрациклиновый режим: доцетаксел 75 мг/м2 + карбоплатин AUC6 — у 35 пациенток, 20,3%.
Дозоуплотненные режимы с введением препаратов каждые 2 недели использованы у 14 женщин (8,1 %). Все больные с HER2+ РМЖ получали анти-HER2-терапию в составе неоадъювантного лечения, причем, у 6/49 больных с HER2+ РМЖ использовался трастузумаб в дозе 8 мг/ кг (нагрузочная доза, далее 6 мг/кг), каждые 3 недели, а у 43 из 49 пациенток (87,8%) — комбинация трастузумаба и пертузумаба.
ХАРАКТЕРИСТИКАХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ
После окончания НАХТ всем пациенткам выполнена радикальная операция: мастэктомия ± первичная реконструкция (в 124 случаях, 72,1%) либо органосохраняющее лечение (у 48 больных, 27,9%). Первичная реконструкция молочной железы после мастэктомии выполнена 58 больным; 33,7%. Сочетание локального и регионарного лечения был следующим:
-
– радикальная мастэктомия с регионарной лимфодис-секцией (РМЭ + РЛД) выполнена в 99 случаях (57,9%);
– радикальная мастэктомия с биопсией сигнальных лимфоузлов (РМЭ + БСЛУ) произведена 24 больным (14,0 %);
– радикальная резекция молочной железы с регионарной лимфодиссекцией (РР + РЛД) — 25 пациенткам (14,6%);
– радикальная резекция молочной железы с БСЛУ выполнена в 23 случаях (13,5%).
Клиническая и морфологическая характеристика материала наглядно представлена в табл. 1.
ОЦЕНКА ПАТОМОРФОЛОГИЧЕСКОГО ОТВЕТА ОПУХОЛИ НА НАХТ
Оценка патоморфологического ответа опухоли на проведенную неоадъювантную системную терапию у всех больных включала оценку остаточной опухолевой нагрузки по системе RCB и оценку остаточной пато-морфологической стадии по системе ypTN. Определена конкордантность данных систем оценки патоморфологи-ческого ответа опухоли на НАХТ между собой. Проведена оценка патоморфологического ответа опухоли на НАХТ для общей группы и в подгруппах женщин с различными биологическими подтипами РМЖ. Статистический анализ результатов исследования проведен с использованием международной статистической программы SPSS (v. 22.0 for Windows), непараметрические данные анализировались с использованием теста χ2 или точного критерия Фишера, различия считались статистически достоверными при р<0,05.
ОСОБЕННОСТИ ОТВЕТА НА НЕОАДЪЮВАНТНУЮ ХИМИОТЕРАПИЮ У БОЛЬНЫХ С АГРЕССИВНЫМИ БИОЛОГИЧЕСКИМИ ПОДТИПАМИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ II–III СТАДИЙ (ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ)
Таблица 1. Клиническая и морфологическая характеристика материала
|
Характеристика материала |
Число больных N=172 |
% |
|
Возраст женщин |
||
|
Медиана |
47 лет |
|
|
Разброс |
24–81 |
|
|
<40 лет |
49 |
28,5% |
|
40–50 лет |
52 |
30,2% |
|
50–60 лет |
34 |
19,8% |
|
Старше 60 лет |
37 |
21,5% |
|
Менструальный статус |
||
|
Пременопауза |
107 |
62,2% |
|
Менопауза |
65 |
37,8% |
|
Размер опухоли сТ |
||
|
T1 |
9 |
5,2% |
|
T2 |
112 |
65,1% |
|
T3 |
14 |
8,1% |
|
T4 |
37 |
21,5% |
|
Статус лимфоузлов N |
||
|
N0 |
52 |
30,3% |
|
N1 |
91 |
52,9% |
|
N2 |
14 |
8,1% |
|
N3 |
15 |
8,7% |
|
Клиническая стадия до НАХТ |
||
|
IIA |
53 |
30,8% |
|
IIB |
59 |
34,3% |
|
IIIA |
15 |
8,7% |
|
IIIB |
30 |
17,4% |
|
IIIC |
15 |
8,7% |
|
Операбельный статус |
||
|
Первично-операбельные стадии (T1–3N0–1) |
120 |
69,8% |
|
Местно-распространенные стадии (T4 или N2–3) |
52 |
30,2% |
|
Значимые герминальные мутации |
||
|
Не выявлены |
105 |
82% |
|
Выявлены |
23 |
18% |
|
Гистологический тип инвазивного РМЖ |
||
|
Протоковый (НСТ) |
143 |
83,1% |
|
Дольковый |
8 |
4,7% |
|
Другие типы |
21 |
12,2% |
|
Характеристика материала |
Число больных N=172 |
% |
|
Степень злокачественности G |
||
|
G2 |
64 |
37,2% |
|
G3 |
108 |
62,8% |
|
Уровень Ki67 |
||
|
Медиана |
53% |
|
|
Границы |
10–98% |
|
|
<30% |
16 |
9,3% |
|
≥30% |
156 |
90,7% |
|
Биологический подтип опухоли |
||
|
Люминальный B HER2-негативный |
64 |
37,2% |
|
Люминальный HER2+ |
22 |
12,8% |
|
Нелюминальный HER2+ |
27 |
15,7% |
|
Тройной негативный рак |
59 |
34,3% |
|
Уровень TILs |
||
|
Медиана |
10% |
|
|
Границы |
0–90% |
|
|
<10% |
75 |
48,4% |
|
10–20% |
19 |
12,3% |
|
>20% |
61 |
39,4% |
|
Режим НАХТ |
||
|
4 × АС — 4 × Т |
47 |
27,3% |
|
4 × АС — 12 × Р |
57 |
33,1% |
|
4АС-таксаны + карбоплатин |
33 |
19,2% |
|
6 × ТС |
35 |
20,3% |
|
Анти-HER2-терапия при HER2+ РМЖ |
||
|
Трастузумаб + пертузумаб |
43 |
87,8 % |
|
Трастузумаб |
6 |
12,2% |
|
Объем операции на молочной железе |
||
|
РМЭ ± реконструкция |
124 |
72,1% |
|
Органосохраняющее лечение |
48 |
27,9 % |
|
Локорегионарное лечение |
||
|
РМЭ + лимфодиссекция |
99 |
57,9% |
|
РМЭ + БСЛУ |
24 |
14% |
|
Радикальная резекция + |
25 |
14,6% |
|
лимфодиссекция |
||
|
Радикальная резекция + БСЛУ |
23 |
13,5% |
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Конкордантность современных систем оценки патоморфологического ответа опухоли на НАХТ при агрессивных биологических подтипах РМЖ
Полный патоморфологический ответ (отсутствие остаточной инвазивной опухоли в молочной железе или регионарных лимфоузлах — tpCR) был отмечен у 69 из 172 больных в нашем исследовании (40,1 %), что соответствовало морфологической стадии уpT0N0 и классу RCB-0.
У 103 женщин с наличием остаточной опухоли в молочной железе и/или лимфоузлах была оценена остаточная опухолевая нагрузка по системе RCB. Класс RCB-I выявлялся редко — всего в 11 случаях (6,4%); основная доля приходилась на класс RCB-II и RCB-III (30,2 и 23,3%, соответственно).
При анализе размера остаточной опухоли в молочной железе после НАХТ было отмечено, что в каждом третьем случае (32,6%) размер опухоли не превышал 2,0 см (ypT1); размер от 2 до 5,0 см (ypT2) был выявлен у 18,6% женщин, остаточные опухоли размером ypT3 и ypT4 отмечены наиболее редко — по 2,9% случаев. Статус лимфоузлов после НАХТ соответствовал ypN1, ypN2 и ypN3 в 22,2%, 10,5% и 1,8% соответственно.
Распределение остаточной патоморфологической стадии после НАХТ ypTN было весьма вариабельно, но наиболее часто отмечены патоморфологические стадии ypT1a-bN0 (7,6 %), ypT1cN0 (10,5 %), ypT1cN1 (8,1 %) и ypT2N2 (8,1%).
Данные по анализу ответа на НАХТ резюмированы в табл. 2.
При анализе конкордантности классов RCB и остаточной патоморфологической стадии были получены важные особенности (p < 0,0001): класс RCB-I в 81,8 %
Таблица 2. Характеристика различных систем оценки ответа опухоли на НАХТ
Интересно отметить, что только одна патоморфо-логическая стадия ypT2N0 встречалась у пациенток с любым классом RCB: в 9,1 % случаев — при RCB-I, в 13,5% — при RCB-II и в 5% случаев — при классе RCB-III (табл. 3).
Особенности ответа на НАХТ при различных биологических подтипах РМЖ
Частота достижения полного патоморфологического ответа на НАХТ (tpCR/RCB-0/ypT0N0) значимо отличалась среди пациенток с различными биологическими подтипа-
Таблица 3. Соответствие класса RCB и остаточной патоморфологической стадии ypTN, р<0,0001
Несмотря на то, что при тройном негативном и HER2+ подтипах РМЖ отмечена одинаково высокая частота достижения полного патоморфологического ответа на НАХТ, распределение классов остаточной опухолевой нагрузки RCB I–II-III при данных вариантах заболевания значимо отличалось (p<0,0001). Так, у пациенток с ТН РМЖ практически отсутствовал класс минимальной остаточной опухоли RCB-I (всего 1,7%), класс RCB-II выявлен в 25,4%, а в 23,7% случаев пациентки имели массивную остаточную опухолевую нагрузку (класс RCB-III). В противоположность этому, у пациенток с HER2+ РМЖ доля пациенток с минимальной остаточной опухолью класса RCB-I достигла 9,1% (при люминальном) и 11% (при нелюминальном варианте); класс RCB-II был отмечен у каждой четвертой пациентки с HER2+ подтипом заболевания, а класс RCB-III был выяв-
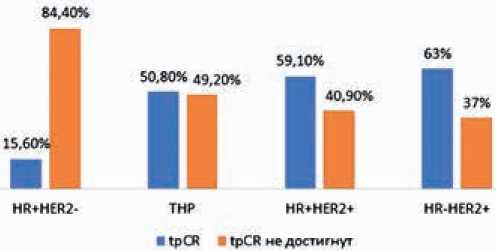
Рисунок 1. Частота достижения tpCR при разных биологических подтипах РМЖ II–III стадий.
ОСОБЕННОСТИ ОТВЕТА НА НЕОАДЪЮВАНТНУЮ ХИМИОТЕРАПИЮ У БОЛЬНЫХ С АГРЕССИВНЫМИ БИОЛОГИЧЕСКИМИ ПОДТИПАМИ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ II–III СТАДИЙ (ОРИГИНАЛЬНОЕ ИССЛЕДОВАНИЕ)
лен всего в 9% случаев при люминальном HER2+ раке и полностью отсутствовал при нелюминальном HER2+ подтипе заболевания.
Пациентки с люминальным B HER2-негативным РМЖ имели в большинстве случаев остаточную опухолевую нагрузку, соответствующую классу RCB-II и RCB-III — в 39,1% и 37,5 % случаев, соответственно (рис. 2).
Таким образом, биологические подтипы опухоли имеют не только значимые различия в частоте достижения полного патоморфологического ответа на НАХТ, но и существенные особенности в распределении классов остаточной опухолевой нагрузки, что может транслироваться в дальнейший прогноз заболевания.
ЗАКЛЮЧЕНИЕ И ВЫВОДЫ
Полученные нами результаты исследования подтверждают выводы крупного мета-анализа, представленного FDA в 2014 году [12]: доля полных патоморфо-логических ответов максимальна высока при HER2+ и тройном негативном подтипе заболевания и минимальна при люминальном HER2-негативном варианте. Частота достижения tpCR у пациенток с HER2+ раком в нашем исследовании достигла 63% при нелюминальном HER2+ подтипе и 59,1% — при люминальном HER2+ РМЖ, что подтверждает значимую роль двойной таргетной блокады (трастузумаб + пертузумаб) в неоадъювантных режимах для достижения полного регресса опухоли и дальнейшего благоприятного прогноза заболевания [13]. Высокая частота достижения tpCR при тройном негативном раке (50,8%) обусловлена, вероятнее всего, включением карбоплатина в неоадъювантные режимы у 77,9%
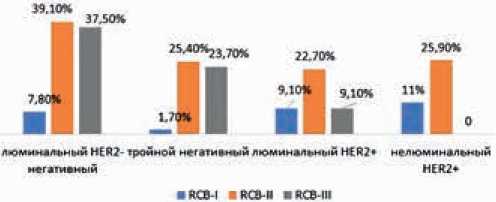
Рисунок 2. Распределение классов RCB при различных биологических подтипах РМЖ у пациенток с остаточной опухолью после НАХТ.
пациенток с данным вариантом заболевания, что полностью сопоставимо с данными российских и зарубежных исследований [14,15]. Нами отмечено, что патоморфо-логическая стадия взаимосвязана с классом остаточной опухолевой нагрузки RCB, а распределение классов RCB-I, RCB-II и RCB-III имеют закономерности при разных биологических подтипах опухоли.
Таким образом, проведение современных режимов НАХТ с двойной анти-HER2-блокадой при HER2+ РМЖ характеризуется высокой частотой достижения полных патоморфологических ответов, а при наличии резидуальной опухоли — минимальной или умеренной остаточной опухолевой нагрузкой (класс RCB I/II). Проведение плати-но-содержащей НАХТ у больных с ТН РМЖ характеризуется высокой частотой достижения tpCR, однако, при недостижении полного ответа — высокой долей классов RCB II и RCB-III. Люминальный HER2-негативный РМЖ малочувствителен к НАХТ; частота полных регрессов минимальна, а остаточная опухолевая нагрузка весома.
Список литературы Особенности ответа на неоадъювантную химиотерапию у больных с агрессивными биологическими подтипами рака молочной железы II-III стадий (оригинальное исследование)
- Состояние онкологической помощи населению России в 2018 году. Под ред. А. Д. Каприна, В. В. Старинского, Г. В. Петровой. М.: МНИОИ им. П. А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2019 [The state of cancer care for the population of Russia in 2018. Ed. A. D. Kaprina, V. V. Starinsky, G. V. Petrova. Moscow: Herzen MNIOI - branch of the Federal State Budgetary Institution «National Medical Research Center of Radiology» of the Ministry of Health of Russia, 2019 (in Russian)].
- Клинические рекомендации «Рак молочной железы» Министерства здравоохранения Российской Федерации, 2020 год https://oncology-association. ru/wp-content/uploads/2020/09/rak_molochnoj_zhelezy. pdf
- Колядина И. В. и др. Эволюция неоадъювантного подхода при первично-операбельном раке молочной железы в последнюю декаду: модный тренд или реальная клиническая практика? //Современная онкология. 2017. Т. 19. № 1. С. 9-16.
- Колядина И. В. и др, Особенности хирургического лечения больных раком молочной железы, получающих предоперационную лекарственную терапию// Современная онкология. 2016. Т. 18. № 1. С. 50-54.
- Колядина И. В., Данзанова Т. Ю., Хохлова С. В и др. Современный взгляд на вопросы диагностики и верификации поражения аксиллярных лимфатических узлов при раннем раке молочной железы. Современная онкология. 2020. Т. 22. № 1. С. 46-52.
- Колядина И. В., Завалишина Л. Э., Ганьшина И. П. и др. Роль кластерной амплификации гена HER2 как маркера «особой» чувствительности к неоадъювантной анти-HER2 терапии трастузумабом при раке молочной железы II-III стадии. Архив патологии. 2019. Т. 81. № 6. С. 56-62.
- Bonnefoi H. et al. Pathological complete response after neoadjuvant chemotherapy is an independent predictive factor irrespective of simplified breast cancer intrinsic subtypes: A landmark and two-step approach analyses from the EORTC 10994/BIG 1-00 phase III trial // Ann. Oncol. 2014. Т. 25. № 6. С. 1128-1136
- Fayanju O. M. et al. The Clinical Significance of Breast-only and Node-only Pathologic Complete Response (pCR) after Neoadjuvant Chemotherapy (NACT): A Review of 20,000 Breast Cancer Patients in the National Cancer Data Base (NCDB)// Ann Surg. 2018 October; 268 (4): 591-601.
- Павликова О. А., Колядина И. В., Комов Д. В. и др. Факторы-предикторы достижения полного лекарственного патоморфоза при неоадъювантной химиотерапии первично-операбельного рака молочной железы. Современная онкология. 2017. Т. 19. № 1. С. 24-29.
- Provenzano E. et al. Standardization of pathologic evaluation and reporting of postneoadjuvant specimens in clinical trials of breast cancer: Recommendations from an international working group // Mod. Pathol. 2015. Т. 28. № 9. С. 1185-1201.
- Anne-Sophie Hamy, Lauren Darrigues, Enora Laas et all. Prognostic value of the Residual Cancer Burden index according to breast cancer subtype: Validation on a cohort of BC patients treated by neoadjuvant chemotherapy. PLoS One. 2020 Jun 24;15 (6):e0234191. doi: 10.1371/journal. pone. 0234191.
- Cortazar P. et al. Pathological complete response and long-term clinical benefit in breast cancer: The CTNeoBC pooled analysis // Lancet. 2014. Т. 384. № 9938. С. 164-172.
- Колядина И. В., Поддубная И. В. Ключевые исследования, изменившие историю и принципы лечения раннего HER2 + рака молочной железы: фокус на индивидуализацию терапии. Опухоли женской репродуктивной системы. 2020. Т. 16. №3. С. 46-56.
- Pandy J. G. P. et al. Triple negative breast cancer and platinum-based systemic treatment: a meta-analysis and systematic review // BMC Cancer. 2019. Т. 19. № 1. С. 1-9.
- Гордеева О. О., Колядина И. В., Жукова Л. Г. и др. Эффективность и безопасность неоадъюватной химиотерапии в режиме PlaTax у больных трижды негативным раком молочной железы II-III стадий. Опухоли женской репродуктивной системы. 2020. Т. 16. № 2. С. 25-37.


