Особенности полиморфизма авенинов сортов культурных видов овса
Автор: Любимова А.В., Еремин Д.И.
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Сельскохозяйственные науки
Статья в выпуске: 11, 2017 года.
Бесплатный доступ
Исследования проводили в 2015-2017 гг. с целью изучить полиморфизм авенин-кодирующих локусов и компонентный состав авенина культурных видов овса разных групп плоидности - Avena strigosa Schreb. (2n = 14), Avena abyssinica Hochst. (4n = 28), Avena byzantina C. Koch. (6n = 42) и Avena sativa L. (6n = 42). В результате идентификации алле-лей авенин-кодирующих локусов гексаплоидных видов овса установлено, что по локусу Avn A наибольшую частоту встречаемости имел вариант А1, по локусу Avn B - варианты В1 и В4, по локусу Avn C - С3, С2 и С1. Выявлены ранее не идентифицированные блоки компо-нентов авенина, контролируемые локусом Avn С. Этим блокам присвоены номера С4*, С6*, С6a и С6b. В ходе анализа компонентного состава проламинов исследованных видов вы-явлено 12 белковых фракций, встречающихся в спектрах образцов трех различных видов. Оценена роль этих компонентов в формиро-вании блоков компонентов авенинов. Установ-лено, что компонент № 119, общий для спек-тров гексаплоидов и абиссинского овса, входил в состав блоков компонентов авенина С1, С2 и С7. Среди компонентов проламина, общих для посевного, византийского и песчаного овса, выявлены компонент № 51, входящий в состав аллельных блоков С1 и С2, компонент № 62 - в состав блоков С4*, С6*, С6b и С6a, а также компонент № 95 - в состав блока С3. Компо-нент № 38 входил в состав блока В1, а № 67 - блоков В1, В4 и В5. По нашему мнению, гены, контролирующие синтез вышеназванных об-щих компонентов у образцов песчаного и абис-синского овса, были исходными для последую- щего формирования кластеров генов гексап-лоидных видов.
Культурные виды овса, электрофоретический спектр, запасные спирторастворимые белки, аlcohol-soluble storage proteins, компонентный состав авенина, блоки компонентов пролами-на, авенин-кодирующие локусы, полиморфизм
Короткий адрес: https://sciup.org/140224182
IDR: 140224182 | УДК: 581.19:631.52:633.13
Текст научной статьи Особенности полиморфизма авенинов сортов культурных видов овса
Введение . В настоящее время при создании новых высокоурожайных и устойчивых к неблагоприятным факторам среды сортов применяются не только традиционные способы селекции, но и достижения генетики и физиологии. Большой вклад в селекционный процесс вносят биотехнологические методы, в том числе применение биохимических маркеров, к которым относятся различные белки и метаболиты [1, 2]. Использование белковых маркеров в анализе селекционного материала дает возможность осуществлять контроль над включением геномов, хромосом или особенностей генотипа исходных форм в создаваемые гибриды и сорта. В растениеводстве такие маркеры применяются для идентификации образцов коллекций, сортов, биотипов, линий, а также для оценки генетической дифференциации генофонда и регистрации генетических ресурсов. Особенно широко используют запасные спирторастворимые белки семян – проламины [3–6].
Для генов проламинов характерны два основных типа организации – рассеянные по геному и кластеризованные. Кластерами генов кодируются блоки компонентов, обладающие высокой стабильностью: при скрещивании они наследуются без изменений, а частота рекомбинаций внутри блоков крайне низка [6]. Аллельные варианты блоков компонентов проламинов связаны с адаптивными свойствами генотипов. Идентификация блоков компонентов запасных белков, преобладающих в генотипах особей, произрастающих в районах с неблагоприятными условиями, а также маркирующих важные хозяйственные признаки, позволяет выделить ценные ассоциации генов и использовать их в селекции [8, 9].
При анализе исходного материала по овсу успешно применяются авенины [10–12]. Исследования по изучению генетического контроля и характера наследования авенинов ведутся с 70-х гг. ХХ в. [13–15]. Однако на сегодняшний день не существует единой системы регистрации и интерпретации электрофоретических спектров авенинов, что затрудняет сопоставление данных, полученных разными исследователями.
Цель исследования : изучить полиморфизм авенин-кодирующих локусов и компонентный состав авенина культурных видов овса.
Материалы и методы исследования . Исследование проводили в лаборатории сортовой идентификации семян Агробиотехнологического центра ФГБОУ ВО ГАУ Северного Зауралья в период с 2015 по 2017 г. Материалом для анализов послужили индивидуальные зерновки 250 сортов овса из коллекции ФГБНУ «Федеральный исследовательский центр Всероссийский институт генетических ресурсов растений имени Н.И. Вавилова» и ФГБНУ «НИИСХ Северного Зауралья». Были проанализированы сорта культурных видов овса трех уровней плоидно-сти: Avena strigosa Schreb. (2n = 14), Avena abyssinica Hochst. (4n = 28), Avena byzantina C. Koch. (6n = 42) и Avena sativa L. (6n = 42), – происхождением из России и 37 зарубежных стран.
Для одномерного электрофореза авенинов применяли стандартную методику [16] с некоторыми модификациями [17]. Для анализа от каждого сорта методом случайной выборки отбирали по 20 зерен. Белки экстрагировали 70 % этанолом из муки индивидуальных зерновок. В полученный супернатант вносили по 3 капли красителя на основе алюминий-лактатного буфера с добавлением метиленового зеленого, 80 % раствора сахарозы и двухмолярного раствора мочевины. Электрофорез проводили в вертикальных пластинах полиакриламидного геля при постоянном напряжении 500 V в течение 3,5 ч. После окончания электрофоретического разделения белков гели помещали на 30 мин в 10 % раствор трихлоруксусной кислоты, а затем окрашивали раствором Кумасси R-250 в течение 8 ч. Идентификацию аллельных состояний авенин-кодирующих локусов (АКЛ) осуществляли на основании каталога генетической номенклатуры, разработанного В.А. Портянко и др. [15]. Согласно исследованиям данных авторов, авенины наследуются блоками, а их синтез контролируется тремя независимыми локусами Avn A , Avn B и Avn C, расположенными в трех гомеоло-гичных хромосомах группы А. В качестве стандарта использовали зерновки овса посевного сорта Астор ( Avn A2B4C2). Обработку данных проводили с использованием пакета программ STATISTICA 10 (StatSoft, Inc. (2011). STATISTICA (data analysis software system), version 10).
Результаты исследования . В результате проведенных анализов установлено, что 46,7 % сортов были гомогенными по компонентному составу проламина. В составе гетерогенных сортов было от 2 до 12 биотипов. Для того чтобы наиболее полно охарактеризовать компонентный состав авенина исследованных сортов, все обнаруженные биотипы рассматривались нами как самостоятельные образцы. Таким образом, число исследованных образцов составило 577 шт.
Для образцов гексаплоидных видов овса были идентифицированы аллели АКЛ. В случае если вариант блока компонентов по какому-либо локусу не был определен, вместо его порядкового номера в генетической формуле записывалось сочетание ned.
Установлено, что самым распространенным аллелем локуса Avn A был А2, частота встречаемости которого составила 40,1 %. Варианты А1 и А4 обнаружены в спектрах 8,1 и 7,1 % образцов соответственно. Частота встречаемости остальных аллелей этого локуса находилась в пределах от 0,5 до 2,5 %.
По локусу Avn B максимальную встречаемость имел аллель В1, идентифицированный в спектрах 25,8 % образцов. На втором месте по распространенности был аллель В4 этого локуса (16,1 % образцов). Остальные аллельные варианты локуса Avn B имели частоту встречаемости в пределах 4,4–8,5 %.
В результате идентификации аллелей локуса Avn С установлено, что самыми распространенными были варианты С3, С2 и С1, выявленные в спектрах 27,2; 17,8 и 14,8 % образцов соответственно. Частота встречаемости остальных аллелей локуса Avn С варьировала от 2,5 до 8,3 %.
Нами не обнаружены образцы с аллелями С4 и С6. Однако в процессе анализа коллекции выделены комбинации компонентов авенина, не входящие в состав блоков, контролируемых локусами Avn A и Avn B, и встречающиеся с высокой частотой в спектрах разных образцов. По нашему мнению, это ранее не идентифицированные блоки компонентов проламина, контролируемые локусом Avn С. Этим комбинациям были присвоены номера: 4*, 6*, 6a и 6b, что подчеркивает их сходство с аллельными вариантами блоков компонентов С4 и С6 (рис. 1).
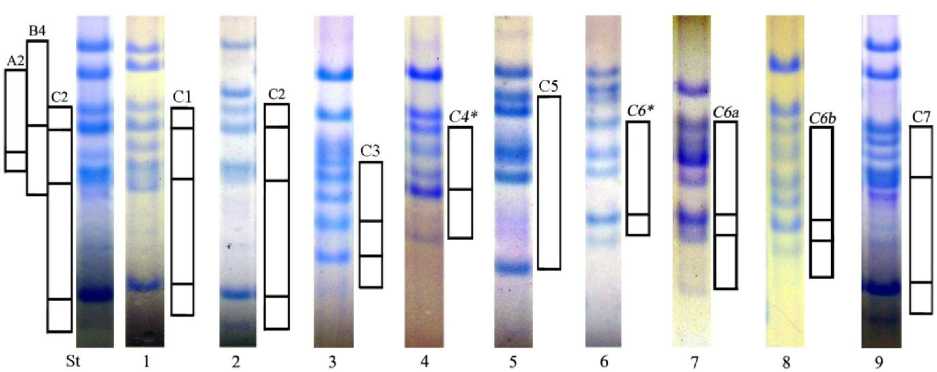
Рис. 1. Варианты блоков компонентов проламина, контролируемых локусом Avn С, обнаруженные при анализе коллекции гексаплоидных образцов рода Avena L.: 1 – К-15132 (Местный), Франция; 2 – К-14583 (Flamingsgelb), Германия; 3 – К-15133 (Местный), Польша;
4 – К-14959 (Кемеровский 90), Россия; 5 – К-14584 (Praefkt), Германия; 6 – К-14771 (Coken 60-178), США; 7 – К-14438 (1-6 1113), Польша; 8 – К-1766 (Местный), США; 9 – К-15187 (Эклинс), Россия; St – Астор (стандарт)
Отличия в частоте встречаемости аллелей АКЛ могут быть вызваны тем, что варианты А2, В1, В4, С3, С2 и С1 сцеплены с адаптивно значимыми или хозяйственно ценными ассоциациями генов, дающими преимущества несущим их особям. В ходе селекционной работы отбираются генотипы, обладающие этими ассоциациями генов, а, следовательно, возрастает и частота встречаемости маркирующих их аллелей.
Количество образцов с неидентифицирован-ными аллелями по авенин-кодирующим локусам варьировало от 10,1 % (по локусу Avn С) до 39,9 % (по локусу Avn В). Нами не проведена идентификация аллелей АКЛ для песчаного и абиссинского овса, так как ди- и тетраплоидные виды отсутствуют в каталоге генетической номенклатуры. Для того чтобы оценить полиморфизм проламинов всей исследуемой коллекции с учетом образцов с неидентифицированными аллелями АКЛ, был охарактеризован компонентный состав авенинов проанализированных видов.
Исследованные виды овса отличались по общему количеству обнаруженных в спектрах образцов компонентов проламина. В результате анализа коллекции образцов абиссинского овса было обнаружено наименьшее число компонентов авенина – 7. В спектрах запасных белков образцов вида A. strigosa выявлено 24 различных белковых компонента, A. byzantina – 59,
A. sativa – 160. Таким образом, наибольший уровень полиморфизма авенинов характерен для гексаплоидных видов овса, что является следствием активно ведущейся с ними селекционной работы.
Всего в результате анализа электрофоретических спектров образцов овса нами обнаружено 173 различных компонента авенина, отличающихся по скорости движения в полиакриламидном геле. Все выявленные компоненты нумеровались, начиная с самого медленноподвижного. Подвижность компонентов авенина возрастала с увеличением плоидности видов: в спектрах образцов песчаного овса быстроподвижные проламины отсутствовали полностью, а в спектрах образцов посевного овса такие белки присутствовали в максимальном количестве. Из всего числа обнаруженных компонентов авенина 65,8 % выявлены в электрофореграммах образцов только одного вида овса, что указывает на их видоспецифичность. Установлено, что 12 белковых фракций встречались в спектрах образцов трех различных видов. Для видов A. sativa, A. byzantina и A. strigosa общими были 9 компонентов; для A. sativa, A. byzantina и A. abyssinica – 2; для A. sativa, A. abyssinica и A. strigosa – 1. Появление одних и тех же компонентов авенина в спектрах образцов разных видов может быть следствием родства этих видов и их геномов [3]. В частности, в геномный состав всех исследованных нами видов входит геном А и обнаруженные общие компоненты могут выступать в качестве его маркеров.
Известно, что кластеры генов, контролирующих синтез проламинов, возникают в результате последовательных множественных дупликаций и дивергенции предковых генов [18]. Нами была оценена роль компонентов, общих для исследованных ди-, тетра- и гексаплоидных видов, в формировании блоков компонентов авенинов.
Для этого выявленные 12 общих белковых фракций из спектров образцов песчаного и абиссинского овса были сопоставлены с компонентами, входящими в состав блоков, контролируемых локусами Avn A, Avn B и Avn C гексап-лоидных видов. В результате установлено, что компонент № 119, общий для спектров гексап-лоидов и абиссинского овса, входил в состав блоков С1, С2 и С7 (рис. 2) .
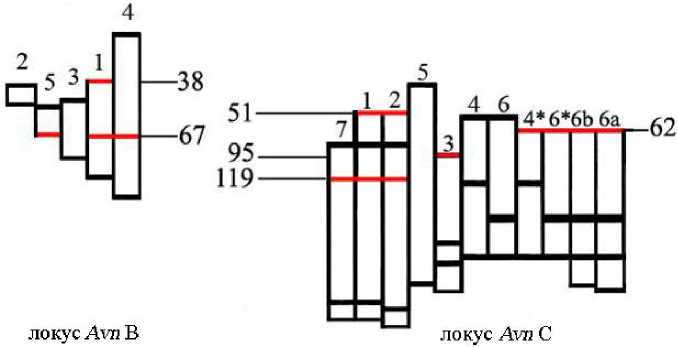
Рис. 2. Компоненты авенина образцов A. strigosa и A. abyssinica, входящие в состав блоков компонентов проламина гексаплоидных культурных видов рода Avena L., контролируемых локусами Avn B и Avn C. Красным цветом выделены компоненты авенина, общие для ди-, тетра- и гексаплоидных видов овса
Из белковых фракций, общих для посевного, византийского и песчаного овса, компонент № 51 входил в состав аллельных блоков С1 и С2, компонент № 62 – в состав блоков С4*, С6*, С6b и С6a, а № 95 – в состав блока С3. Компонент № 38 выявлен в составе блока В1, а № 67 – блоков В1, В4 и В5, контролируемых локусом Avn B. Известно, что дивергенция кластеров генов, контролирующих синтез проламинов, приводит к появлению семейств блоков проламинов [15]. Таким образом, присутствие одних и тех же компонентов авенина в нескольких блоках указывает на процесс дивергенции авенин-кодирующих кластеров и принадлежность таких блоков к одному семейству. По нашему мнению, гены, контролирующие синтез вышеназванных общих компонентов у образцов A. strigosa и A. abyssinica , были исходными для последующего формирования кластеров генов гексапло-идных видов.
Выводы
-
1. В результате идентификации аллелей авенин-кодирующих локусов образцов культурных гексаплоидных видов овса установлено, что по локусу Avn A максимальную частоту встречаемости имел аллель А1, по локусу Avn B – аллели В1 и В4, по локусу Avn C – С3, С2 и С1. Выявлены ранее неидентифицированные блоки компонентов авенина, контролируемые локусом Avn С, которым присвоены номера С4*, С6*, С6a и С6b.
-
2. Пранализированные виды овса отличались по общему количеству обнаруженных в спектрах образцов компонентов авенина. В спектрах образцов A. strigosa выявлено 24 различных белковых компонента, A. Abyssinica – 7, A. byzantina – 59, A. sativa – 160. Высокий уровень полиморфизма авенинов гексаплоидных видов овса является следствием активно ведущейся с ними селекционной работы.
-
3. В ходе анализа электрофоретических спектров проламинов образцов культурных видов овса выявлено 173 различных компонента авенина, из которых 12 встречались в спектрах образцов трех различных видов и маркировали геном А .
-
4. В спектрах песчаного и абиссинского овса обнаружено 6 компонентов авенина, входивших в состав блоков компонентов проламина гекса-плоидных видов. По нашему мнению, гены, контролирующие синтез этих компонентов у образцов A. strigosa и A. abyssinica , были исходными для последующего формирования кластеров генов гексаплоидных видов.
Список литературы Особенности полиморфизма авенинов сортов культурных видов овса
- Лоскутов И.Г. Генетические ресурсы овса и ячменя -источник результативной селек-ции в России//Генетические ресурсы куль-турных растений в XXI веке: состояние, проблемы, перспективы: докл. II Вавилов-ской междунар. конф. (Санкт-Петербург, 26-30 ноября 2007 г.). -СПб.: Изд-во ВИР, 2009. -С. 200-205.
- Летяго Ю. А., Тоболова Г.В., Белкина Р.И. Оценка сортов мягкой яровой пшеницы по технологическим свойствам и биохимиче-ским признакам//Агропродовольственная политика России. -2015. -№ 5. -С. 64-67.
- Лоскутов И.Г. Роль молекулярно-биологических исследований в познании ге-нофонда овса и его эффективном использо-вании в селекции//Аграрная Россия. -2008. -№ 3. -С. 14-19.
- Зобова Н.В., Шевцова Л.Н., Сурин Н.А. Сор-товая идентификация и семенной контроль ячменя по запасным белкам семян -гор-деинам//Вестн. КрасГАУ. -2004. -№ 6. -С. 77-80.
- Остапенко А.В., Тоболова Г.В. Примене-ние метода электрофореза проламинов ов-са для определения гибридной природы зерен F1//Вестн. КрасГАУ. -2017. -№ 2. -С. 14-21.
- Новосельская-Драгович А.Ю. и др. Изуче-ние генетического разнообразия сортов мягкой озимой пшеницы по глиадинкоди-рующим локусам//Генетика. -2015. -Т. 51. -№ 3. -С. 324-334.
- Ананьев Е.В., Чернышев А.И. Молекуляр-ная организация генома растений//Орга-низация генома: сб. науч. тр. -М.: Наука, 1989. -С. 218-236.
- Зобова Н.В., Онуфриенок Т.В., Чуслин А.А. Особенности полиморфизма проламинов сортов ячменя, возделываемых в Краснояр-ском крае//Достижения науки и техники АПК. -2014. -№ 6. -С. 7-10.
- Alnaddaf L.M., Moualla M.Y., Kalhout A.R. Genetic Variability in Some Syrian Wheat Genotypes using Storage Proteins//Asian Journal of Agricultural Sciences. -2011. -V. 3(6). -P. 506-515.
- Ибрагимова М.З., Остапенко А.В. Харак-теристика генетического разнообразия си-бирских сортов овса Avena L. по спектрам авенина//Вестн. КрасГАУ. -2016. -№ 6. -С. 126-133.
- Gubareva N.K. et al. Avenins as markers in oat breeding and seed production//The 10th International Oat Conference: Innovation for the Food and Health: Abstracts of oral and poster presentation. -2016. -P. 167-168.
- Фомина М.Н., Тоболова Г.В., Остапенко А.В. Использование метода электрофореза проламинов в первичном семеноводстве на примере сорта овса Отрада//Достижения науки и техники АПК. -2016. -Т. 30. -№ 12. -С. 14-16.
- Kim S.J., Charbonnier L., Mosse J. Heteroge-neity of avenin, the oat prolamin. Fractiona-tion, molecular weight and amino acid compo-sition//Biochem. Biophys. Acta. -1978. -V. 537. -P. 22-30.
- Souza E., Sorrells M.E. Inheritance and distri-bution of variation at four avenin loci in North American oat germ plasm//Genome. -1990. -V. 33. -№ 3. -P. 416-424.
- Портянко В.А. и др. Генетический контроль авенинов и принципы их классификации//Генетика. -1987. -Т. 23. -С. 845-853.
- Bushuk W., Zillman R.R. Wheat cultivar identi-fication by gliadin electrophoregrams. I. Appa-ratus, method and nomenclature//Canadian Journal of Plant Science. -1978. -V. 58 (2). -P. 505-515.
- Остапенко А.В., Тоболова Г.В. Анализ час-тоты встречаемости аллелей авенин-кодирующих локусов у сортов овса//Аграрный научный журнал. -2015. -№ 12. -С. 24-26.
- Конарев А.В. Использование молекулярных маркеров в решении проблем генетических ресурсов растений и селекции//Аграрная Россия. -2006. -№ 6. -С. 4-23.


