Особенности поведения благородных металлов при сульфидно-щелочном выщелачивании мышьяково-сурьмянистых концентратов
Автор: Петров Г. В., Кобылянский А. А., Григорьева В. А., Гордеев Д. В.
Журнал: Журнал Сибирского федерального университета. Серия: Техника и технологии @technologies-sfu
Рубрика: Исследования. Проектирование. Опыт эксплуатации
Статья в выпуске: 5 т.15, 2022 года.
Бесплатный доступ
Для минерально-сырьевой базы металлургии цветных и благородных металлов месторождения полиметаллических руд являются основным источником сырья. На фоне глобальной тенденции к снижению доли богатых руд в общем объеме добычи и переработки и ухудшению качественных характеристик рудного сырья ведется отработка запасов руд, содержащих в виде примесей мышьяк и сурьму. Авторами была изучена возможность применения ASL-технологии при атмосферном давлении для гидрометаллургического кондиционирования низкокачественного медного концентрата. Исследования осуществлялись на флотационном концентрате следующего состава (%): 16,1 Cu; 5,3 Zn; 23,8 Fe; 0,84 Pb; 1,36 As; 0,21 Sb; 1,94 SiO2; 0,82 Al2O3, до 24,0 г/т Ag, до 4,0 г/т Au. В результате выполненных исследований были выявлены особенности поведения благородных металлов в сульфидно-щелочной среде в процессе выщелачивания мышьяково-сурьмянистых концентратов Учалинского ГОКа. Установлена доминирующая роль сульфида натрия при образовании полисульфид- и тиосульфат-ионов, выполняющих роль окислителей золота и серебра. Анализ кинетических показателей свидетельствует о лимитировании процесса выщелачивания благородных металлов скоростью химической реакции при отсутствии внутридиффузионных ограничений, обусловленных возможной пассивацией теннантита, формирующимися вторичными сульфидами меди. Определены минимальные пороговые концентрации сульфида и полисульфидов, при которых возможен переход в раствор выщелачивания золота и серебра: для сульфида более 20 г/л-1, для полисульфидов более 2 М. При проведении ASL-процесса с указанными параметрами кек выщелачивания представляет собой кондиционный медно-цинковый концентрат, содержащий 0,2 % мышьяка и благородных металлов до 100 г/т. Потери благородных металлов в ходе процесса отсутствуют.
Сульфидное выщелачивание, полисульфиды, благородные металлы, мышьяк, сурьма
Короткий адрес: https://sciup.org/146282498
IDR: 146282498 | УДК: 669.053.4 | DOI: 10.17516/1999-494X-0415
Текст научной статьи Особенности поведения благородных металлов при сульфидно-щелочном выщелачивании мышьяково-сурьмянистых концентратов
Цитирование: Петров, Г. В. Особенности поведения благородных металлов при сульфидно-щелочном выщелачивании мышьяково-сурьмянистых концентратов / Г. В. Петров, А. А. Кобылянский, В. А. Григорьева, Д. В. Гордеев // Журн. Сиб. федер. ун-та. Техника и технологии, 2022, 15(5). С. 541–552. DOI: 10.17516/1999-494X-0415
лических руд мышьяково-сурьмянистые минералы демонстрируют схожие с сульфидами меди флотационные свойства, что препятствует эффективному отделению нежелательных примесных компонентов. По данным [5–7], при флотации мышьяксодержащих медных руд извлечение мышьяка в медный концентрат составляет 50-80 % [8-13]. Переработка теннантитсодержа-щего медного сырья в рамках существующих обогатительных схем позволяет получить мышьяковистые медные концентраты и полупродукты (6–16 % Cu) с содержанием благородных металлов до 100 г/т [2–4] [14; 15; 19].
В РФ колчеданные руды с элементами полиметаллической специфики - свинцом, цинком, мышьяком, благородными металлами, перерабатываются на Учалинском ГОКе (ОАО «УГМК»). В настоящее время объем запасов руд с повышенным содержанием теннантита составляет до 82 % от общего объема балансовых запасов предприятия, при этом около 36 % приходится на теннантитсодержащие руды Узельгинского месторождения, где в наиболее золотоносных минералах пирита (6–11 г/т Au) и сфалерита (1,5–4,5 г/т Au) присутствуют серебро (130–150 г/т) и селен (0,01–0,02 %). Золото находится в виде мелких выделений электрума (60–70 мас.% Au и 40-30 мас.% Ag) и микровключений минералов золота, представленных его соединениями c Sb, Se и Hg. В галените содержится 0,05–0,2 мас.% Au, наряду с ним присутствуют Pd 0,03–0,14 мас.%. В халькопирите обычно 1,5–3 г/т Au, при максимальной золотоносности (до 16 г/т) характерные примеси - Ag, As, Hg. Основным концентратором серебра является блеклая руда (0,1–0,6 мас.% Ag). В рудах Учалинского месторождения золото в основном рассеяно в пирите и халькопирите в тонкодисперсном виде. В галените важными являются примеси селена (0,4 мас.%), серебра (до 0,52 мас.%) и висмута (1,3 мас.%); установлена необычная разновидность - сульфоселенид свинца Pb2SeS. Теллуриды, редко встречающиеся в рудах обоих месторождений, в основном представлены алтаитом PbTe, гесситом Ag2Te и калаверитом Au2Te [36]. Во флотационных медных концентратах Учалинского ГОКа содержание золота, серебра и селена достигает соответственно 5, 100 и 200 г/т [14].
Существующая практика переработки сульфидных концентратов на пирометаллургических переделах создает высокую техногенную нагрузку на окружающую среду за счет значительного объема отходящих газов, содержащих летучие токсичные оксиды [2; 15]. [34]. В связи с постоянным ужесточением природоохранных требований и развитием ESG-стратегии в промышленности необходимым условием является максимально полное удаление сурьмы и мышьяка и утилизация их соединений в стабильной форме [18–21; 33, 38].
Наряду с максимальным использованием возможностей обогатительного цикла в мировой практике для повышения качества продукции и снижения логистических затрат существует тенденция к внедрению гидрометаллургических технологий кондиционирования флотационных мышьяксодержащих концентратов непосредственно на обогатительных фабриках [23–27].
Значительный интерес представляет технология Alkaline Sulfide Leaching (ASL), которая базируется на использовании сульфидно-щелочной системы Na2S- NaOH - H2O в ходе процесса выщелачивания. Селективное растворение мышьяка и сурьмы из энаргита, теннантита и тетраэдрита может быть соответственно представлено уравнениями:
2Cu2AsS4(тв) + 3Na2S(F)^ 3Cu2S(тв) + 3Na 3 AsS 4 ( p)
2Cu 12 As 4 S 13(тв) + 2Na 2 S (р) → 3Cu 2 S (тв) + 2CuS (тв) + 4NaAsS 2(р) (2)
Cu 12 Sb 4 S 13(тв) + 2Na 2 S (р) → 3Cu 2 S (тв) + 2CuS (тв) + 4NaSbS 2(р) (3)
Опыт промышленного использования технологии ASL существует: в США Sunshine Silver Mine (SSMRC), The Equity Silver Mine (Goldcorp Canada Ltd), в Австралии Mount Carlton (Evolution Mining Ltd), а также на предприятиях КНР и в странах СНГ. Применение ASL возможно в атмосферном и автоклавном вариантах для кондиционирования энаргитовых концентратов. В частности, выщелачивание энаргитового золотосодержащего концентрата (18 % Cu, 3,1 % As и 16,5 % Fe) в течение 10–12 часов при плотности пульпы 300 г/л, температуре 100 °C, концентрации 20 г/л NaOH и 40 г/л S2- позволяет извлекать мышьяк в раствор на 93,5 %. При этом растворения минералов золота и серебра не наблюдается [8; 9]. Переработка энаргит-луцонитового концентрата (33,15 % Cu; 12,55 % As; 9,16 % Fe и 90,25 г/т Au) под давлением (200–250 кПа) при 85–115 °C, в присутствии 0,42 М Na2S и 2,5 М NaOH приводит к растворению мышьяка на 98 %. В ходе процесса медь, связанная с мышьяком, при контакте с сульфид-ионами формирует сульфиды меди (Сu2S; Сu39S28; Cu1,5S; Cu9S8) и остается в твердой фазе наравне с железом. Отмечено, что золото переходит в раствор частично и лишь при высоких концентрациях ионов серы (HS-, Sx2- и политионатов) [13; 32].
Поведение благородных металлов в ходе ASL-процесса, по-видимому, определяется характеристиками сульфидно-щелочной среды и формированием полисульфид- и тиосульфат-ионов в присутствии элементарной серы, выполняющих роль окислителей золота и серебра с последующим образованием их растворимых комплексов:
4S0 + 6NaOH → 6Na2S + Na2S2O3 + 3H2O(4)
(x-1) S0 + Na2S → Na2Sx, где x = 2–5(5)
S0 + Na2SO3→ Na2S2O3
Известно, что полисульфиды в щелочных растворах образуют сульфидный комплекс Au (I). При изучении электрохимического поведения золотого электрода в растворе полисульфидов показано, что растворение золота происходит в результате адсорбции полисульфида на его поверхности с одновременным окислением реагента: на аноде реализуются реакции:
Au/S2-x→ AuS- + (x-1) S0 + e-(7)
Au/S2-x→Au/Sx + 2e-(8)
Основной катодной реакцией является образование сульфид-иона:
S0 + 2e-→S2-(9)
Катодная реакция показывает, что элементарная сера при растворении золота действует как окислитель, поэтому его добавление к полисульфидным растворам не требуется. Вместе с тем для получения удовлетворительного извлечения золота необходима высокая концентрация полисульфида. В частности, известно несколько попыток использования полисульфида аммония (>2 М) для переработки мышьяковистых золотосодержащих концентратов [28; 29].
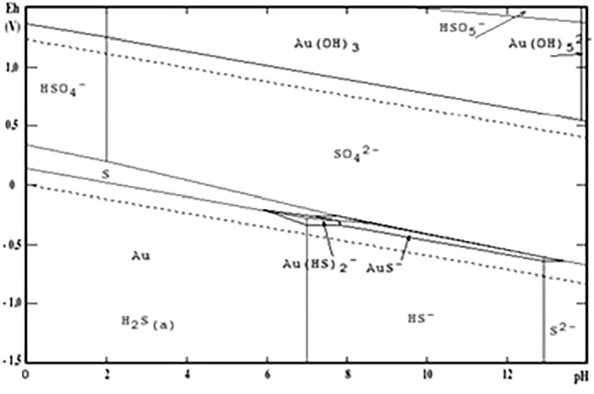
Рис. 1. Диаграмма Eh-pH для соединений серы и золота в сульфидно-щелочной среде [32]
Fig. 1. Eh-pH diagram for sulfur and gold compounds in sulfide-alkaline media [32]
Существуют данные, что растворение золота в системе [HS- - H2S- H2O] при нейтральных значениях pH протекает с образованием гидросульфидных соединений Au (I) (рис. 1) в соответствии с реакцией:
Au + H2S + HS > Au(HS)2- + 0,5H2 (10)
В кислой и щелочной среде образуются менее растворимые комплексы [Au(OH)HS]- и [Au2(HS)2S]2-. Так как скорость диффузии ионов (HS-) и молекул H2S меньше, чем для ионов CN- и молекул О2, это определяет меньшую растворимость золота в гидросульфидных растворах по сравнению с цианированием (при равной концентрации реагентов).
Композиция [HS- + H2S + S0] была опробована для извлечения золота из низкосортных руд компаниями Placer Dome Inc., Newmont Corporation. Показано, что реакция выщелачивания сопровождается также образованием полисульфидов, принимающих участие в растворении золота:
Au + 0,5S2- x + HS- + 0,5H2S ^ Au(HS)2- + 0,5S2-x-1 (11)
Au + 0,5xS0 + 0,5S;\> AuS-x (12) где х = 2÷8.
Оптимальные условия, при которых достигалось 83-87 % извлечение золота в раствор: содержание твердого в пульпе 26 % масс., давление H2S около 400 кПа при 0,55 М NaHS и 1 г/дм 3 S0 [29; 30; 32].
Необходимым условием использования сульфидно-щелочных сред для кондиционирования медных флотационных концентратов, выделенных из отечественного мышьяковистого медного сырья, является исключение потерь золота, серебра и селена с растворами, направляемыми на вывод мышьяка и сурьмы в форме малотоксичных нерастворимых соединений.
Объекты и методы исследований
Исследования сульфидного щелочного выщелачивания осуществлялись на флотационном концентрате следующего состава (%): 16,1 Cu; 5,3 Zn; 23,8 Fe; 0,84 Pb; 1,36 As; 0,21 Sb; 1,94 SiO2; 0,82 Al 2 O 3 , до 24,0 г/т Ag, до 4,0 г/т Au Опыты проводились в атмосферных условиях в термостатированном стеклянном реакторе объемом 1000 мл. Навеска материала – 50 г. Перемешивание пульпы осуществлялось пропеллерной мешалкой. Изучено влияние основных технологических параметров процесса (температуры 80–95 °C; концентрации NaOH 2,5–4 М и Na2S 0,5–1,5 М; Ж: Т=5:1÷10:1; скорости перемешивания 600 об/мин; продолжительности до 6 часов) на полноту извлечения мышьяка, сурьмы и благородных металлов в раствор.
Изучение поведения селенидов меди и серебра в сульфидно-щелочной среде осуществлялось на синтезированных пробах, подвергнутых «старению» в течение 2 месяцев для окончательного формирования кристаллической решетки. Селенид меди получен цементацией селена медным порошком из раствора селенистой кислоты (100 г/л) при температуре 25 °C. Содержание селена в нем составило 42,4–49,6 % в форме соединений Cu 3 Se 2 (более 85 %), Сu 2 Se и CuSe. Селенид серебра получен при взаимодействии полиселенидного раствора (80 г/л Se, 120 г/л NaOH) и металлического порошкообразного серебра по методике [37].
Синтезированные халькогениды выщелачивались полисульфидными растворами при вариантных значениях расхода реагента (2–17 от теорет. необх.), продолжительности (1–3 час), отношения жидкого к твердому (5–20). Степень полисульфидности n = 2÷4 растворов задавалась введением серы при щелочности 5 г/л. Расчет теоретически необходимого количества полисульфида производился на основании следующих реакций:
Cu3Se2 + 3Na2S2 = 3CuS + 3Na2SSe0,7(13)
2Cu3Se2 + 3Na2S3 = 6CuS + Na2SSe2 + 2Na2SSe(14)
Cu3Se2 + Na2S4 = 3CuS + Na2SSe2
Ag2Se + Na2S3 = Ag2S + Na2S2Se(16)
Эксперименты проводились на навесках 2,5–10 г в стандартном химическом реакторе при механическом перемешивании пропеллерной мешалкой (200 об/мин), с аналитическим контролем продуктов по селену.
Для установления химического и минералогического состава проб концентрата были использованы дифрактометр D 2 PHASER (CuKα) и микроскоп Leica DM 4500 P, видеокамеры Leica DFC 490 с анализатором «МИНЕРАЛ С7». Для изучения гранулометрического состава использовался лазерный анализатор частиц МicroSizer 201С. Анализ продуктов процесса выщелачивания осуществлялся на рентгено-флуоресцентном спектрометре ARL 9900 Work Station; растворов – на атомно-эмиссионном спектрометре с индуктивно-связанной плазмой ICPE 9000.
Результаты и их обсуждение
В процессе выщелачивания реального медного концентрата увеличение концентрации щелочи с 0,1 до 3,5 моль/л сопровождается повышением степени извлечения мышьяка в рас-– 546 – твор с 58 % до его полного растворения. Также процесс растворения мышьяка протекает более полно (извлечение достигает 88,7 %) при наличии даже малых количеств сульфида натрия (0,5 моль/л), что говорит о существенно большем влиянии сульфида натрия на показатели вскрытия арсенидных минералов (рис. 2).
Поведение сурьмы вне зависимости от технологических параметров процесса (температуры и концентрации реагентов) хорошо коррелируется с показателями мышьяка (рис. 3), что свидетельствует о схожем механизме образования триатиоантимонита натрия (Na 3 [SbS 3 ])
Наличие в твердой фазе пульпы вторичных сульфидов меди, халькогенидных минеральных форм серебра, золота и меди обусловливает возможность их взаимодействия с щелочными растворами с высокой концентрацией полисульфид-ионов, образующимися в присутствии элементарной серы.
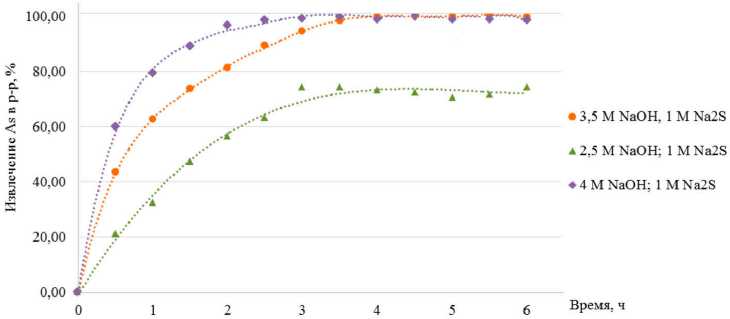
Рис. 2. Влияние концентрации NaOH и N2S моль/л и продолжительности процесса на степень извлечения мышьяка (температура 95 °C, Ж: Т = 5)
Fig. 2. Influence of NaOH and N2S concentration mol/l and process duration on the degree of arsenic extraction (temperature 95 °C, L: S = 5)
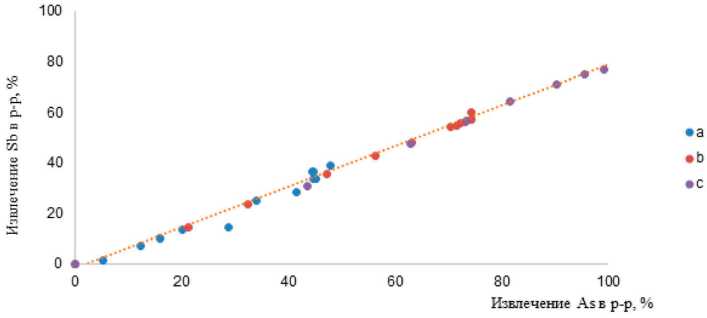
Рис. 3. Зависимость извлечения Sb от извлечения As в раствор: 6 ч, Ж: Т = 5 (a – NaOH 3,5 моль/л и Na2S 1 моль/л, 65 °C; b – NaOH 2,5 моль/л и Na2S 1 моль/л, 95 °C; с – NaOH 3,5 моль/л и Na2S 1 моль/л, 95 °C)
Fig. 3. Dependence of Sb recovery on As extraction into solution: 6 h, L: S = 5 (a – NaOH 3.5 mol/l and Na 2 S 1 mol/l, 65 °C; b – NaOH 2.5 mol/l and Na 2 S 1 mol/l, 95 °C; c – NaOH 3.5 mol/l and Na 2 S 1 mol/l, 95 °C)
Экспериментальные данные свидетельствуют, что при разложении синтетического селенида меди с повышением полисульфидности раствора с 2 до 3 переход селена в жидкую фазу увеличивается с 48 до 61 %. Далее рост извлечения селена обусловлен преимущественно увеличением расхода реагента при неизменном отношении жидкого к твердому пульпы. Увеличение концентрации реагента при одинаковом его расходе не сказывается на полноте извлечения селена. Понижение температуры с 90 до 70 °C приводит к снижению извлечения селена с 79 % до 70 %. Увеличение продолжительности выщелачивания с одного до трех часов незначительно сказывается на результатах, увеличивая извлечение селена с 81 до 86 %, что свидетельствует о достигнутом за один час равновесии в щелочной системе CuхSey-Na 2 S n -H 2 O.
При выщелачивании модельного селенида серебра извлечение селена в трисульфидный раствор с образованием дисульфидселенид-ионов менее значительно – 41,7 % при 8-кратном избытке реагента и Ж: Т=10 (табл. 4).
Полученные экспериментальные данные подтверждают принципиальную возможность разложения халькогенидов благородных металлов и меди сульфидно-щелочными растворами с переходом селена в виде сульфоселенид-ионов в жидкую фазу.
Таблица 1. Взаимодействие селенида меди с полисульфидными щелочными растворами
Table 1. Interaction of copper selenide with polysulfide alkaline solutions
|
№ оп |
n |
Избыток Na2Sn, от т.н. |
[ Sn ], м/л |
ж: т |
Время, час |
Т, °С |
εSe в раствор, % |
Выход кека, % |
CSe в кеке, % |
|
1 |
2 |
2 |
0,9 |
20 |
2 |
90 |
48 |
96 |
27 |
|
2 |
3 |
2 |
1,7 |
5 |
1 |
90 |
61 |
90 |
17,5 |
|
3 |
3 |
4,5 |
1,8 |
10 |
1 |
90 |
62 |
92 |
18,6 |
|
4 |
3 |
8,5 |
1,8 |
20 |
1 |
90 |
81 |
85 |
14,2 |
|
5 |
3,5 |
10 |
1,8 |
20 |
1 |
90 |
83 |
68 |
12,6 |
|
6 |
4 |
12 |
1,8 |
20 |
1 |
90 |
74 |
83 |
15,3 |
|
7 |
3 |
8,5 |
3,6 |
10 |
1 |
90 |
81 |
87 |
8,49 |
|
8 |
3 |
8,5 |
3,6 |
10 |
1 |
90 |
79 |
89 |
10,36 |
|
9 |
3 |
8,5 |
3,6 |
10 |
1 |
70 |
70 |
91 |
14 |
|
10 |
3 |
8,5 |
3,6 |
10 |
3 |
90 |
86 |
86 |
6,81 |
|
11 |
3 |
17 |
3,6 |
20 |
1 |
90 |
85 |
83 |
7,5 |
Таблица 2. Поведение модельного селенида серебра в сульфидно-щелочном растворе
Table 2. Behavior of model silver selenide in sulfide-alkaline solution
|
№ п.п. |
Избыток Na 2 S 3 , от т.н. |
[ Sn ], м/л |
ж: т |
Время, час |
Т, °С |
εSe в раствор,% |
|
1 |
2 |
0,68 |
10 |
1 |
90 |
26,2 |
|
2 |
5 |
1,67 |
10 |
1 |
90 |
28,1 |
|
3 |
8 |
2,71 |
10 |
1 |
90 |
31,7 |
Однако результаты экспериментальных исследований данной работы и [34] демонстрируют лишь незначительный переход драгоценных металлов в раствор в ходе ASL-процесса, так исходная концентрация Ag до 100 г/т сохраняется в кеках выщелачивания и составляет 85-96 г/т. Это объясняется тем, что сульфид является доминирующим выщелачивающим реагентом и комплексообразователем, а полисульфид - окислителем. Для достижения значительного перевода драгоценных металлов в раствор в данной системе необходима концентрация сульфида более 20 г/л-1 [32].
При сульфидно-щелочном выщелачивании Учалинского флотационного концентрата в оптимальных параметрах переход благородных металлов в раствор не наблюдался, что подтверждает отсутствие в системе необходимой для формирования растворимых сернистых комплексов благородных металлов концентрации полисульфидов (более 2 М). Серебро и золото полностью оставались в кеке, содержащем не более 0,2 % мышьяка и представляющем собой кондиционный медно-цинковый концентрат, удовлетворяющий требованиям ГОСТ Р 52998–2008, пригодный для дальнейшей эффективной переработки в рамках пирометаллургических технологий.
Выводы
Выявлены особенности поведения благородных металлов в сульфидно-щелочной среде в процессе выщелачивания мышьяково-сурьмянистых концентратов Учалинского ГОКа. Установлена доминирующая роль сульфида натрия при образовании полисульфид- и тиосульфат-ионов, выполняющих роль окислителей золота и серебра.
Определены минимальные пороговые концентрации сульфида и полисульфидов, при которых возможен переход в раствор выщелачивания золота и серебра: для сульфида более 20 г/л-1, для полисульфидов более 2 М.
При проведении ASL-процесса при оптимальных параметрах, обеспечивающих полное вскрытие теннантита с переходом мышьяка в сульфидно-щелочной раствор, кек представляет собой кондиционный медно-цинковый концентрат, содержащий 0,2 % мышьяка и до 100 г/т суммы благородных металлов. Потери благородных металлов с мышьяковистыми щелочными растворами, направляемыми на обезвреживание, отсутствуют.
Список литературы Особенности поведения благородных металлов при сульфидно-щелочном выщелачивании мышьяково-сурьмянистых концентратов
- Аксенов С. А. и др. О состоянии и использовании минерально-сырьевых ресурсов российской федерации в 2019 году: Государственный доклад. 2020. [Aksenov S. A. et al. On the state and use of mineral resources of the russian federation in 2019: State Report. 2020. (in Russian)]
- Чугаев Л. В. и др. Металлургия благородных металлов. М.: Металлургия. 1987. [Chugaev L. V. et al. Metallurgy of precious metals. M.: Metallurgy. 1987. (in Russian)]
- International Copper Study Group et al. The world copper factbook 2019. Lisbon, Portugal: International Copper Study Group. 2018.
- Петров Г. В., Грейвер Т. Н., Лазаренков В. Г. Современное состояние и технологические перспективы производства платиновых металлов из хромитовых руд. СПб. Недра. 2001. [Petrov G. V., Graver T. N., Lazarenkov V. G. The current state and technological prospects for the production ofplatinum metals from chromite ores. SPb. The bowels. 2001. (in Russian)]
- Изоитко В. М. Технологическая минералогия и оценка руд. СПб.: Наука. 1997. [Izoitko V. M. Technological mineralogy and evaluation of ores. Spb.: Science. 1997. (in Russian)]
- Мозгова Н. Н., Цепин А. И. Блеклые руды: (Особенности химического состава и свойств). Наука, 1983. [Mozgova N. N., Tsepin A. I. Pale ores: (Features of chemical composition and properties). Science, 1983. (in Russian)]
- Пшеничный Г. Н. Блеклые руды колчеданных месторождений. Л.: Наука, 1987. [Wheat G. N. Pale ores of pyrite deposits. L.: Nauka, 1987. (in Russian)]
- Anderson C. G., Nordwick S. M., KrySL. E. Processing of antimony at the Sunshine mine. Residues and Effluents: Processing and Environmental Considerations. 1992. 349-366.
- Anderson C. G. The chemical analysis of industrial alkaline sulfide hydrometallurgical processes. The Society of Mineral Analysts and the Canadian Mineral Analysts Annual Meeting, Spokane, Washington. 2002. 236.
- Awe S. A., Samuelsson C., Sandstrom A. Dissolution kinetics of tetrahedrite mineral in alkaline sulphide media. Hydrometallurgy. 2010. 103. № . 1-4. 167-172.
- Awe S. A. Hydrometallurgical upgrading of a tetrahedrite-rich copper concentrate: дис. Lulea tekniska universitet, 2010.
- Balaz P., Achimovicova M. Selective leaching of antimony and arsenic from mechanically activated tetrahedrite, jamesonite and enargite. International Journal of Mineral Processing. 2006. 81. № . 1. 44-50.
- Curreli L. et al. Arsenic leaching from a gold bearing enargite flotation concentrate. Hydrometallurgy. 2009. 96. № . 3. 258-263.
- Ягудина Ю. Р. Разработка и обоснование параметров комбинированной технологии переработки теннантитсодержащих руд медно-колчеданных месторождений Урала: дис. Магнитог. гос. техн. ун-т им. Г. И. Носова, 2015. [Yagudina Yu. R. Development and substantiation ofparameters of the combined technology for processing tennantite-containing ores of copper-pyrite deposits of the Urals: dis. Magnetog. gos. tech. G. I. Nosov Univ., 2015. (in Russian)]
- Мастюгин С. А. и др. Шламы электролитического рафинирования меди и никеля. Екатеринбург: УрФУ 2013. [Mastyugin S. A. et al. Electrolytic refining slurries of copper and nickel. Yekaterinburg: UrFU. 2013. (in Russian)]
- Davenport W.G., King M. J., Rogers B., Weissenberger A. Sulfuric acid manufacture. Proceeding of Southern African Pyrometallurgy International Conference. Johannesburg, 2006, 1-16.
- Baba A. A. et al. A review on novel techniques for chalcopyrite ore processing. International journal of mining engineering and mineral processing. 2012.
- Черемисина О. В., Эль-Салим С. З. Современные методы аналитического контроля промышленных газов. Записки Горного института. 2017. 228. [Cheremisina O. V., El-Salim S. Z. Modern methods of analytical control of industrial gases. Notes of the Mining Institute. 2017. 228. (in Russian)]
- Csavina J. et al. A review on the importance of metals and metalloids in atmospheric dust and aerosol from mining operations. Science of the Total Environment. 2012. 433. 58-73.
- Lane D. J. et al. Selective leaching of penalty elements from copper concentrates: A review. Minerals Engineering. 2016. 98. 110-121.
- Nazari A. M., Radzinski R., Ghahreman A. Review of arsenic metallurgy: Treatment of arsenical minerals and the immobilization of arsenic. Hydrometallurgy. 2017. 174. 258-281.
- Александрова Т. Н., Ушаков Е. К., Орлова А. В. Метод типизации медно-цинко-вых руд сложного состава с применением нейросетевых моделей. Горный информационно-аналитический бюллетень (научно-технический журнал). 2020. 5. [Alexandrova T. N., Ushakov E. K., Orlova A. V. Method of typing copper-zinc ores of complex composition using neural network models. Mining information and Analytical bulletin (scientific and technical journal). 2020. 5. (in Russian)]
- Aleksandrova T., Romanenko S., Arustamian K. Research of slurry preparation before selective flotation for sulphide-polymetallic ores. IMPC 2018-29th International Mineral Processing Congress. 2019. 2071-2078.
- Dreisinger D. Copper leaching from primary sulfides: Options for biological and chemical extraction of copper. Hydrometallurgy. 2006. 83. 1-4. 10-20.
- Ivanov B. S. et al. Conditioning of low grade concentrates produced by autoclave oxidation leaching of copper-zinc ore. Non-ferrous Metals. 2015. 1. 21-24.
- Иванов Б. С. и др. Возможность гидрометаллургического кондиционирования низкосортных концентратов, полученных при переработке медно-цинковых колчеданных руд. Цветные металлы. 2014. 11. 42-46. [Ivanov B. S. et al. The possibility of hydrometallurgical conditioning of low-grade concentrates obtained during the processing of copper-zinc pyrite ores. Non-ferrous metals. 2014. 11. 42-46. (in Russian)]
- Aulmore M., Muir D.. Minerals Eng. 2001. 14. 2. 135-174; Miner. Metall. Process. 2001. 18. 4. 221-227.
- Seward T. M. Thio complexes of gold and the transport of gold in hydrothermal ore solutions. Geochimica et Cosmochimica Acta. 1973. 37. 3. 379-399.
- Stefansson A., Seward T. M. Gold (I) complexing in aqueous sulphide solutions to 500 C at 500 bar. Geochimica et Cosmochimica Acta. 2004. 68. 20. 4121-4143.
- Adams M. D. (ed.). Advances in gold ore processing. Elsevier, 2005.
- Parada F., Jeffrey M. I., Asselin E. Leaching kinetics of enargite in alkaline sodium sulphide solutions. Hydrometallurgy. 2014. 146. 48-58.
- Anderson C. G. Alkaline sulfide gold leaching kinetics. Minerals Engineering. 2016. 92. 248-256.
- Фокина С. Б. Методы очистки мышьяксодержащих сточных вод металлургических производств. Горный информационно-аналитический бюллетень (научно-технический журнал). 2012. 2. 406-409. [Fokina S. B. Methods of purification of arsenic-containing wastewater of metallurgical industries. Mining information and Analytical bulletin (scientific and technical journal). 2012. 2. 406-409. (in Russian)]
- Черемисина О. В., Пономарева М. А., Болотов В. А. Сорбционная очистка технологических газов металлургического производства от серосодержащих компонентов. Вестник Южно-Уральского государственного университета. Серия: Металлургия. 2019. 19. 2. 71-78. [Cheremisina O. V., Ponomareva M. A., Bolotov V. A. Sorption purification of technological gases of metallurgical production from sulfur-containing components. Bulletin of the South Ural State University. Series: Metallurgy 2019. 19. 2. 71-78. (in Russian)]
- Фещенко Р. Ю. и др. Повышение окислительной стойкости графитированных блоков для электролитического производства магния методом пропитки фосфатными растворами. Цветные металлы. 2022. 1. 24-29. [Feshchenko R. Yu. et al. Increasing the oxidative resistance of graphite blocks for electrolytic production of magnesium by impregnation with phosphate solutions. Non-ferrous metals. 2022. 1. 24-29. (in Russian)]
- Викентьев И. В. Новое в минералогии колчеданных месторождений Урала. Вестник Российского университета дружбы народов. Серия: Инженерные исследования. 2009. 1. 17-22. [Vikentiev I. V. New in mineralogy of pyrite deposits of the Urals. Bulletin of the Peoples' Friendship University of Russia. Series: Engineering Research. 2009. 1. 17-22. (in Russian)]
- Грейвер Т. Н., Зайцева И. Г., Косовер В. М. Селен и теллур. Металлургия. 1977. 3. [Graver T. N., Zaitseva I. G., Kosover V. M. Selenium and tellurium. Metallurgy. 1977. 3. (in Russian)]
- Kovyazin, O. Gureva, M. Skachkova, M. Shubina. Provision of green spaces in urbanized areas of St. Petersburg. IOP Conference Series: Earth and Environmental Science: 6, Politics, Industry, Science, Education, St. Petersburg, 26-28 мая 2021 года. St. Petersburg, 2021. 012043. DOI 10.1088/1755-1315/876/1/012043. EDN QFAQAB.


