Особенности применения интраоперационного ультразвукового эписканирования аорты в зависимости от клинической ситуации
Автор: Ким Г.И., Дадашов М.С., Филиппов А.А., Новиков М.А., Иванов Д.В., Каменских М.С., Шматов Д.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 1 т.40, 2025 года.
Бесплатный доступ
Одной из важных целей при хирургическом лечении заболеваний сердечно-сосудистой системы является минимизация осложнений. Наиболее опасными осложнениями являются периоперационное острое нарушение мозгового кровообращения и энцефалопатия. Риск их возникновения значительно возрастает без тщательной предоперационной и интраоперационной оценки. Проведение компьютерной томографии (КТ) перед операцией является «золотым стандартом» для исключения кальциноза аорты. Однако данных КТ не достаточно для полноценной визуализации атероматозных изменений. Интраоперационное ультразвуковое эпиаортальное сканирование (ЭпиУЗИ) позволяет с высокой точностью выявить наличие или отсутствие атероматозного изменения восходящей части и дуги аорты. В то же время применение ЭпиУЗИ не получило широкого распространения. В статье представлены три клинических случая коронарного шунтирования, демонстрирующих использование предоперационной КТ и интраоперационного ЭпиУЗИ пациентам, которым проводили коронарное шунтирование. На основе данных визуализирующих методик изменялась хирургическая тактика во время операции: смена места канюляции, использование методики «Single clamp» и операция на работающем сердце. Предоперационная КТ и интраоперационное ЭпиУЗИ в совокупности позволяют выбрать правильную тактику хирургического лечения и тем самым снизить риск осложнений.
Сердечно-сосудистая хирургия, эпиаортальное узи, компьютерная томография, периоперационный инсульт, неврологические осложнения
Короткий адрес: https://sciup.org/149147868
IDR: 149147868 | УДК: 616.132-089.844-073 | DOI: 10.29001/2073-8552-2025-40-1-177-186
Текст научной статьи Особенности применения интраоперационного ультразвукового эписканирования аорты в зависимости от клинической ситуации
Кардиохирургические операции сопряжены с риском возникновения неврологических осложнений, включающих инсульты, транзиторные ишемические атаки, судороги, галлюцинации, делирий [1]. Одним из самых грозных осложнений является инсульт. Частота явного клинического инсульта после операции на сердце, по разным данным, составляет от 1,2 до 6%, в то время как клинически бессимптомный инсульт, выявляемый исключительно с помощью диффузионно-взвешенной магнитно-резонансной томографии, встречается у 50% прооперированных пациентов [2]. Помимо инсультов еще одним серьезным осложнением после кардиохирургических операций является энцефалопатия, включающая спутанность сознания, делирий, судороги, а то и длительные изменения психического состояния, агрессивность и возбуждение [3]. Все эти неврологические осложнения непосредственно связаны с повышением уровня госпитальной летальности, инвалидизации, снижением качества жизни, а так- же со значительным увеличением экономических затрат на ведение таких пациентов [4].
Большинство периоперационных неврологических осложнений в кардиохирургической практике имеют эмболическое происхождение. При этом основным источником атероэмболизации являются манипуляции на восходящем отделе аорты в ходе операции (канюляция и пережатие аорты) [5]. Использование искусственного кровообращения включает в себя обширные механические манипуляции на аорте. Неотъемлемыми этапами операции по реваскуляризации сердца с использованием аппарата искусственного кровообращения являются наложение кисетных швов на аорту, введение аортальной канюли, а также канюли для кардиоплегии, пережатие восходящей аорты и наложение бокового зажима для формирования проксимальных анастомозов. При этом манипуляции на относительно нормальной сосудистой стенке можно выполнять с минимальным риском. При наличии же атероматозных изменений аорты определенный маневр в ходе операции может привести к разрыву атеросклеротической бляшки на аорте с высвобождением ее частиц, которые впоследствии могут вызвать эмболизацию и стать причиной ишемического повреждения головного мозга [6].
Именно поэтому необходимо применение точных методик диагностики и верификации патологических изменений аорты. Использование компьютерной томографии (КТ) грудной клетки перед операцией может легко продемонстрировать распространение кальцификации в стенках аорты. Так, например, с высокой точностью можно идентифицировать «фарфоровую аорту» [7] (крайне выраженное атеросклеротическое поражение корня и восходящего отдела аорты).
Однако КТ-диагностики не всегда достаточно для полноценной оценки восходящей части и дуги аорты. Чтобы снизить риск манипуляций на пораженном участке рекомендуется использование интраоперационного ультразвукового эпиаортального сканирования (ЭпиУЗИ), что позволяет предотвратить разрушение атеросклеротических бляшек в ходе манипуляций и уменьшить риск цереброваскулярных осложнений [8]. ЭпиУЗИ аорты представляет собой быструю и высокочувствительную методику [5]. После стернотомии и рассечения перикарда с помощью специального линейного ультразвукового датчика, находящегося в стерильном рукаве, производится исследование. Датчик (7 МГц) помещается непосредственно на аорту (корень, восходящий отдел и дугу аорты), а двухмерные изображения в нескольких плоскостях просвета и стенок аорты появляются на мониторе аппарата УЗИ (рис. 1 А, Б, В). Несмотря на наличие в арсенале такой методики, многие хирурги по-прежнему полагаются лишь на мануальную пальпацию аорты, которая имеет очень низкую чувствительность [5].
Американское общество эхокардиографии рекомендует пять позиций для проведения ЭпиУЗИ: позиции по короткой оси проксимального отдела аорты, средней восходящей аорты, дистального отдела восходящей аорты, по длинной оси восходящей аорты, а также проксимальной дуги аорты [9]. Эта же ассоциация рекомендует использовать методику ЭпиУЗИ пациентам с эмболическим риском (анамнезом цереброваскулярных или периферических сосудистых заболеваний, имеющим признаки атеросклероза аорты, например, по результатам предоперационной эхокардиографии (ЭхоКГ) или же КТ) [9]. Однако в нашей клинике ЭпиУЗИ применяется рутинно всем пациентам, которым проводятся операции на открытом сердце, так как опыт показывает в ряде случаев выявление атероматозно измененного грудного отдела аорты у пациентов без каких-либо предоперационно установленных рисков.
Описание клинических случаев
С 2017 г. в нашей клинике рутинно применяется предоперационное КТ-исследование органов грудной клетки, а также ЭпиУЗИ всем пациентам, подвергающимся открытым операциям на сердце. Это позволило значительно снизить количество неврологических осложнений за счет смены тактики хирургического подхода по каждому отдельному случаю. Приводим собственные наблюдения, демонстрирующие возможности тактических решений в зависимости от клинической ситуации.
Клинический случай 1 – смена места канюляции
Пациентка С., 73 года, поступила в клинику с жалоба- ми на давящую боль в области грудной клетки при физической нагрузке, купирующуюся в покое через несколько часов, возникающую несколько раз в неделю; на повышение артериального давления (АД) до 170/100 мм рт. ст.; умеренную одышку при физической нагрузке. Был выставлен диагноз: Нестабильная стенокардия с исходом в стенокардию напряжения II функционального класса (ФК). Пароксизмальная форма фибрилляции предсердий. Сопутствующее заболевание: Хронический гастрит, ремиссия. Желчекаменная болезнь, холецистэктомия.
По данным трансторакальной ЭхоКГ: полости сердца не расширены. Миокард левого желудочка (ЛЖ) утолщен. Концентрическая гипертрофия ЛЖ. Межжелудочковая перегородка S-образной формы. Зон нарушения локальной сократимости ЛЖ не выявлено. Глобальная сократительная способность ЛЖ сохранена. Сократительная способность свободной стенки правого желудочка (ПЖ) не нарушена. Диастолическая дисфункция ЛЖ. Фракция выброса (ФВ) Simpson 62%, конечно-диастолический объем – 66 мл, конечный систолический объем – 25 мл.
Коронарная ангиография: правый тип коронарного кровообращения. Ствол левой коронарной артерии (ЛКА) – кальцинированное поражение со стенозом просвета до 50%. Передняя межжелудочковая артерия (ПМЖА) – протяженное кальцинированное поражение со стенозом просвета до 90%, огибающая артерия – кальциноз в проксимальном отделе, в дистальном отделе хроническая окклюзия. Ветвь тупого края (ВТК1) протяженное поражение со стенозом просвета до 90%. Правая коронарная артерия (ПКА) – кальцинированное протяженное поражение в проксимальном среднем сегменте дистально со стенозом 85%.
По КТ органов грудной клетки (рис. 2 A, Б, B) были выявлены посттравматическая деформация грудины; консолидированные переломы III–VI ребер слева; кальциноз задней стенки восходящего отдела аорты, дуги аорты, а также кальцинат по передней стенке восходящего отдела аорты перед устьем брахиоцефального ствола.
Принято решение о проведении аортокоронарного шунтирования (АКШ) с использованием искусственного кровообращения. После стернотомии и вскрытия перикарда было выполнено эписканирование аорты, которое позволило выявить выраженный кальциноз восходящего отдела аорты (рис. 2 Г, Д). С использованием ультразвуковой навигации были выбраны участки аорты для канюляции, свободные от поражения (рис. 2 Е). Далее проведено коронарное шунтирование по стандартной методике с использованием искусственного кровообращения. Время окклюзии составило 57 мин. Зарегистрировано самостоятельное восстановление сердечной деятельности на 1-й мин в синусовый ритм. Боковое отжатие и формирование проксимальных анастомозов (между аортой и аутовенами от ВТК2 и ЗМЖВ) также производилось с учетом ЭпиУЗИ.
Послеоперационный период протекал без осложнений. Пациентка была выписана в удовлетворительном состоянии. При этом неврологической симптоматики в послеоперационном периоде выявлено не было.
Как видно из приведенного клинического случая, смена места канюляции позволяет избежать повреждения атеросклеротической бляшки и тем самым уменьшает риск возникновения атероэмболии. Причем постановка канюль для подключения к аппарату искусственного кровообращения может осуществляться в различные
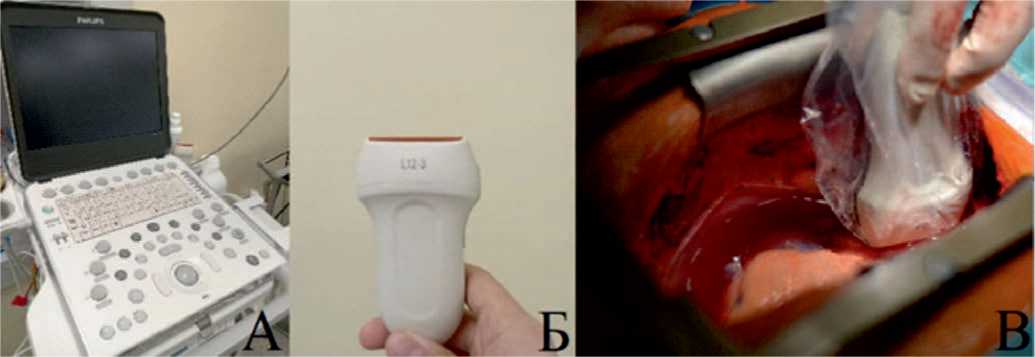
Рис. 1. А – портативный ультразвуковой аппарат высокого класса Philips CX50; Б – специальный датчик для выполнения ЭпиУЗИ; В – интраоперационное фото применения ЭпиУЗИ
Fig. 1. A – portable high-end ultrasound machine Philips CX50; Б – special sensor for performing EU; В – intraoperative photo of using EU
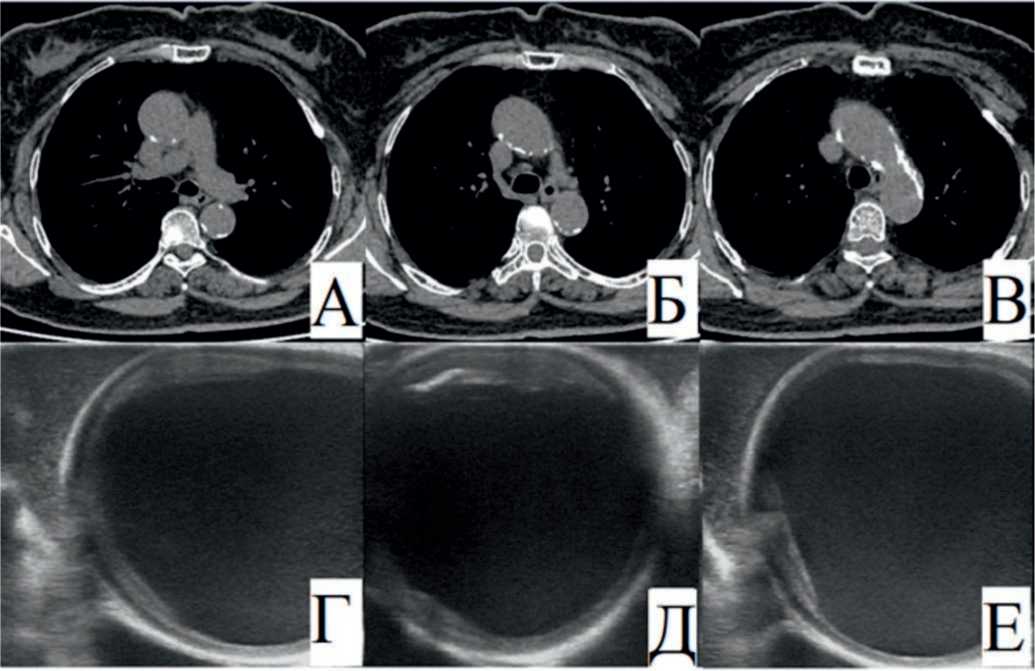
Рис. 2. A, Б, В – компьютерная томография органов грудной клетки до операции – выявлен выраженный кальциноз задней и передней стенки восходящего отдела аорты; Г, Д – выраженный кальциноз аорты по результатам ЭпиУЗИ; Е – найден свободный от кальциноза участок
Fig. 2. A, Б, В – CT scan of the chest before surgery revealed severe calcification of the posterior and anterior walls of the ascending aorta; Г, Д – severe calcification of the aorta according to the results of EU; Е – an area free of calcification was found
локализации: дугу аорты, брахиоцефальный ствол, подключичную и бедренную артерию. По этой методике пережатие аорты происходит дважды: для выполнения кардиоплегии и остановки сердца, а также боковое отжатие для выполнения проксимальных анастомозов с аортой и кондуитами.
Клинический случай 2 – «Single clamp»
Пациент К., 72 года, с жалобами на давящую боль в области грудной клетки при физической нагрузке, которая купируется в покое, возникает несколько раз в неделю, повышение АД до 180/100 мм рт. ст., умеренную одышку при физической нагрузке. Основной диагноз:
Ишемическая болезнь сердца. Стенокардия III ФК. Фоновое заболевание: Гипертоническая болезнь III стадии. Риск 4. Сопутствующее заболевание: Хронический гастрит, ремиссия. Варикозная болезнь вен нижних конечностей. Посттромбофлебитическая болезнь правой и левой нижних конечностей. Ожирение 1-й степени.
По данным трансторакальной ЭхоКГ: полости сердца не расширены (по индексам объема). Миокард ЛЖ незначительно утолщен. Концентрическое ремоделирование ЛЖ. Гипокинез верхушки ЛЖ. Аорта не расширена (при индексации), стенки ее уплотнены. ФВ Simpson 60%, конечно-диастолический объем 88 мл, конечно-систолический объем – 35 мл.
Коронарная ангиография: стеноз ПМЖА 95%, ПКА – стеноз 80%, диагональная артерия – стеноз 50%.
По КТ органов грудной клетки: выявлен кальциноз в проекции проксимальных сегментов коронарных артерий, небольшие кальцинаты в стенках восходящего отдела и дуги аорты (рис. 3 A, Б, В).
Было принято решение о проведении операции (АКШ задняя межжелудочковая ветвь (ЗМЖВ) ПКА, маммарно-коронарное шунтирование (МКШ) ПМЖА). Особенностью пациента явилось отсутствие возможности забора в качестве кондуитов вен нижних конечностей по причине их варикозного расширения. Кондуитом для шунтирования ЗМЖВ ПКА была выбрана левая лучевая артерия.
Несмотря на отсутствие (по данным предоперационной КТ) крупных кальцинированных бляшек в стенках восходящего отдела аорты, по результатам проведенного ЭпиУЗИ восходящий отдел аорты (перед брахиоцефальным стволом) оказался с выраженным атероматозом и участками кальциноза (рис. 3 Г). Было принято решение выполнить операцию по методике однократного пережатия аорты («Single Clamp»). Время окклюзии составило 51 мин. Восстановление сердечной деятельности на 1-й мин в синусовый ритм.
Послеоперационный период протекал без осложнений. Пациент был выписан через 7 дней после операции в удовлетворительном состоянии. Ангинозных болей после операции не описывал. Неврологическая симптоматика после операции отсутствовала.
Данный клинический случай демонстрирует два принципиальных момента. Во-первых, как было сказано ранее, предоперационная КТ не может выявить атероматоз без выраженного кальциноза. Именно поэтому КТ необходимо дополнять ЭпиУЗИ. Во-вторых, в ряде случаев имеет место смена тактики в виде однократного пережатия аорты. «Single clamp» (однократное пережатие аорты, формирование проксимальных и дистальных анастомозов) осуществляется на пережатой аорте. Тем самым уменьшается риск эмболии от наложения бокового зажима, как это делается при стандартной методике АКШ.
Клинический случай № 3 – «off-pump»
Пациент С., 65 лет, поступил с жалобами на сжимающий дискомфорт в области грудной клетки, с иррадиацией в левую лопатку при ходьбе на 100 м; одышку при ускорении темпа ходьбы, при подъеме по лестнице выше 1–2-го этажа; отеки нижних конечностей. Был поставлен диагноз: Ишемическая болезнь сердца. Стенокардия напряжения III ФК. Постинфарктный кардиосклероз (инфаркт миокарда без подъема сегмента ST неуточненной локализации от 2023 г.). Фоновое: Гипертоническая болезнь 3-й стадии, контролируемая артериальная гипер- тензия. Ожирение 3-й степени (индекс массы тела – 40). Риск сердечно-сосудистых осложнений 4 (очень высокий). Осложнение: Хроническая сердечная недостаточность 2а стадии, ФК II по NYHA. Риск тромбоэмболических осложнений по шкале CHA2DS2VASc 3 балла. Риск геморрагических осложнений по шкале HAS-BLED – 2 балла. Сопутствующие: Атеросклероз брахиоцефальных артерий: стеноз правой внутренней сонной артерии до 60%. Хроническая обструктивная болезнь легких вне стадии обострения. Псориаз. Резидуальный период после острого нарушения мозгового кровообращения по ишемическому типу в вертебро-базилярном бассейне (левая гемисфера мозжечка) от 2021 г.
По результатам ЭхоКГ перед операцией: стенки ЛЖ утолщены. Полость ЛЖ не расширена. Глобальная сократительная способность ЛЖ сохранена. Локальных нарушений сократительной способности стенок ЛЖ не выявлено. ЛП незначительно увеличено. Стенки аорты уплотнены. Конечно-диастолический объем – 115 мл, конечно-систолический объем – 47 мл, ФВ Simpson – 59%.
По КТ органов грудной клетки перед операцией: данных за кальциноз восходящего отдела аорты не получено (рис. 4 А, Б, В).
Коронарная ангиография: стеноз ствола ЛКА до 20%, стеноз ПМЖВ на границе проксимальной и средней трети до 70%, в средней трети стеноз 75%, огибающая артерия – без особенностей, стеноз ПКА в средней трети до 75%.
Было принято решение о проведении операции АКШ.
При ЭпиУЗИ аорты (рис. 4 Г) отмечается выраженный атероматоз аорты, атеросклеротические бляшки, флотирующие в просвете аорты, в связи с чем полное пережатие аорты невозможно. Принято решение о проведении МКШ-ПМЖА и АКШ-ЗМЖВ ПКА на работающем сердце (off-pump методика без пережатия аорты и использования искусственного кровообращения) при помощи стабилизатора миокарда Octopus.
После операции у пациента оставались жалобы на общую слабость, однако в динамике отмечалось улучшение самочувствия. Неврологическая симптоматика в виде осложнения после операции в любой форме отсутствовала.
Состояние пациента обсуждено командой Heart Team, включающей заведующего отделением, сердечно-сосудистого хирурга и аритмолога. Пациенту показано проведение радиочастотной аблации кава-трикуспидального истмуса 2-м этапом.
Данный клинический случай демонстрирует ситуацию, когда по данным ЭпиУЗИ выявляется выраженное поражение восходящего отдела аорты. При коронарном шунтировании используется методика хирургической реваскуляризации миокарда, при которой не выполняется ни канюляция, ни пережатие аорты. Возможность реваскуляризации при таких условиях возможна только за счет формирования шунтов, не останавливая сердце. В данном случае были сформированы анастомозы МКШ ПМЖА и АКШ ЗМЖВ ПКА с использованием специальной стабилизирующей миокард системы.
Обсуждение
Методы визуализации, включающие предоперационную КТ и ЭпиУЗИ аорты, позволяют модифицировать тактику в зависимости от выраженности и локализации атеросклеротического поражения [10]. В случае выявления выраженного атероматоза восходящей части и дуги
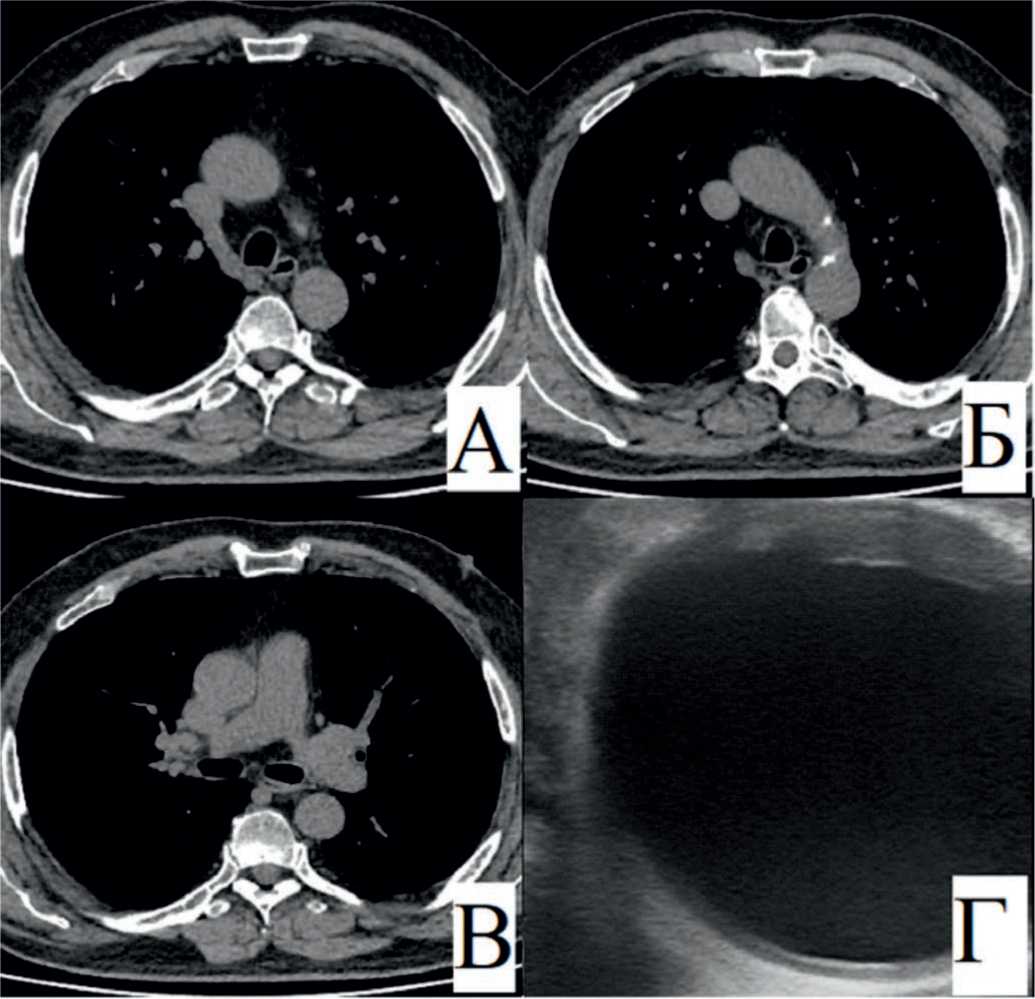
Рис. 3. А, Б, В – компьютерная томография органов грудной клетки перед операцией – небольшие кальцинаты в стенках восходящего отдела и дуги аорты. Г – по результатам ЭпиУЗИ выраженный атероматоз с участками кальциноза
Fig. 3. А, Б, В – CT scan of the OGK before surgery – there are no calcified changes in the ascending section and aortic arch. Г – according to the results of EU, pronounced atheromatosis with areas of calcification
аорты необходимо выбрать альтернативную хирургическую тактику [11]. К таким решениям можно отнести смену локализации места канюляции, коронарное шунтирование на работающем сердце (off-pump), техники «Single-clamp», «No-touch aorta» и другие хирургические методы, позволяющие избежать воздействия на атероматозно измененную аорту [6, 12].
Смена места аортальной и кардиоплегической канюляции при выявлении с помощью ЭпиУЗИ атероматозного поражения стенки аорты является наиболее простой альтернативой. Суть заключается в поиске с помощью ультразвуковой навигации места, свободного от поражения. Например, возможно установить аортальную канюлю в область дуги аорты при выраженном изменении стенки аорты в области ее восходящего отдела. При отсутствии возможности такой канюляции в дугу аорты можно использовать иную методику канюляции, например, в бедренную артерию.
Классическая методика с наложением бокового зажима для формирования проксимальных анастомозов после завершения работы с дистальными анастомозами может вести также к увеличению риска эмболических осложнений при выраженных атероматозных изменениях в аорте. Причиной является повторное воздействие, так как зажимы накладываются несколько раз. В этом случае возможно применение методики однократного пережатия
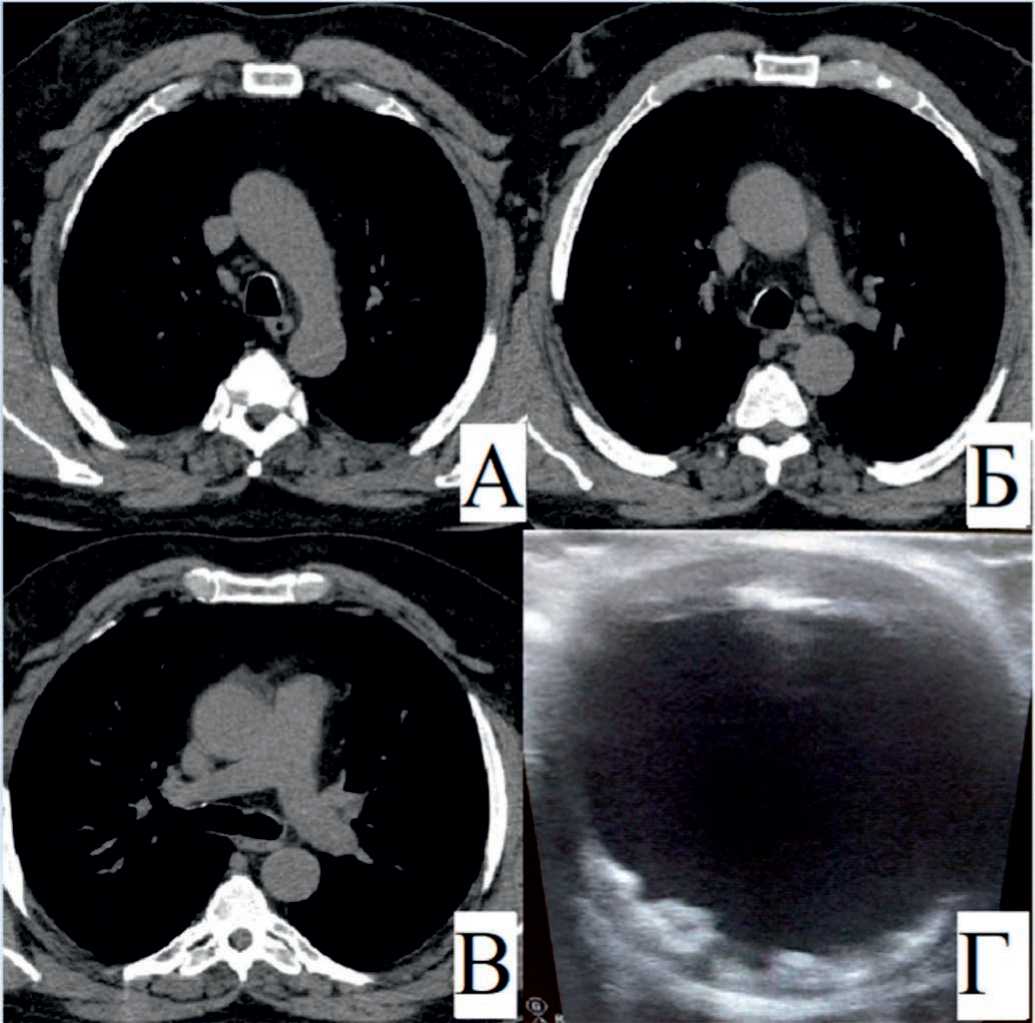
Рис. 4. А, Б, В – компьютерная томография органов грудной клетки до операции. Г – эписканирование (атеросклеротические бляшки, флотирующие в просвете аорты)
Fig. 4. A, Б, В – CT scan of the chest before surgery. Г – episcanning (atherosclerotic plaques floating in the aortic lumen)
аорты (техника «Single-clamp»). В результате уменьшается воздействие на аорту и потенциальный риск неврологических последствий после операции. Однако есть и минус данной техники, так как формирование всех анастомозов при полном однократном пережатии аорты (без снятия зажима) происходит на остановленном сердце, и таким образом увеличивается время искусственного кровообращения.
Одной из наиболее современных техник, снижающих манипуляции на стенке аорты, является применение специальной системы для наложения проксимальных анастомозов «Heartstring Proximal Seal System». Такое устройство позволяет накладывать швы без использования поперечного или бокового зажима и, соответственно, уменьшать повреждение измененной аорты.
Также одним из возможных вариантов является бесконтактная техника коронарного шунтирования («No-touch aorta»). В частности речь идет о шунтировании на работающем сердце («off-pump coronary artery bypass grafting»). Для такой методики необходимо использовать приборы, фиксирующие миокард и позволяющие оставлять участок коронарной артерии обездвиженным, в то время как сердце будет сокращаться. При этом не требуется подключение аппарата искусственного кровообра- щения, а значит, и манипуляции на аорте минимальны.
В одном из наиболее крупных исследований по применению методики ЭпиУЗИ команда P. Rosenberger и соавт. провела ретроспективный анализ 6 051 кардиохирургического пациента. Исследование показало, что в 4,1% случаев во время операции была изменена тактика хирурга. Кроме того, они сообщили о снижении частоты случаев острого нарушения мозгового кровообращения в группе с использованием данной методики (на 2,9% меньше, чем в группе без применения ЭпиУЗИ) [13]. Исследование M. Duda и соавт. показало необходимость рутинного использования эписканирования. По результатам в группе пациентов, где применяли ЭпиУЗИ, чаще выявляли изменения аорты, требующие изменения методики оперативного вмешательства [14]. В результате частота периоперационных инсультов в данной группе пациентов была значительно ниже по сравнению с контрольной [13]. Аналогичные результаты получили исследователи из команды A. Yamaguchi и соавт. Они подтвердили данные выводы в своем исследовании: в группе из 909 пациентов, где применялось эписканирование, полностью отсутствовали какие-либо грубые неврологические нарушения [15]. Согласно результатам REGROUP, хирургическая стратегия была изменена у 7,1% пациентов, которым делали ЭпиУЗИ (19 из 269). Исследование не показало разницы в частоте неврологических осложнений между пациентами, у которых проводилось эписканирование, и теми, кому его не проводили. Несмотря на это, авторы указывают на потенциал снижения вреда для пациентов при использовании данной методики [5].
Недавняя работа D.P. Taggart и соавт. REQUEST представляет собой многоцентровое проспективное исследование, предназначенное для оценки эффекта от проведения интраоперационной оценки с помощью ЭпиУЗИ аорты у 1016 пациентов, перенесших операцию АКШ. У 25,2% из всех пациентов были внесены какие-либо изменения в запланированную изначально хирургическую стратегию. Кроме того, авторы подчеркнули, что в их работе уровень внутрибольничной смертности и осложнений был достаточно низкий, что свидетельствует о необходимости проведения интраоперационной оценки качества с помощью метода ЭпиУЗИ [16]. Таким образом, применение ЭпиУЗИ может улучшить качество, безопасность и эффективность процедур АКШ, а значит, должно рассматриваться как рутинный процедурный аспект во время кардиохирургических операций.
Имеются данные по сравнительной оценке чувствительности имеющихся на данный момент методик, визуализирующих атероматозные изменения стенки аорты. К ним относятся пальпация аорты, проведение предоперационной КТ, чреспищеводная ЭхоКГ, а также ЭпиУЗИ [17]. Пальпация аорты, которая проводится повсеместно, является крайне низко чувствительной. Такая мануальная методика позволяет выявить кальцинированные бляшки. Однако некальцинированные атероматозные изменения, которые потенциально могут быть более опасными, с точки зрения периферической эмболизации, пропускаются при использовании исключительно пальпации. КТ также значительно уступает интраоперационным методикам, так как выявляет либо значительно измененные, либо кальцифицированные участки. Но такая методика важна в качестве предоперационного планирования, и ее применение обязательно перед каждой операцией на открытом сердце. Чреспищеводная ЭхоКГ имеет высокую чувствительность, но такая методика не совершенна в силу наличия «слепого пятна», вызванного заполненной воздухом трахеей, которая находится между пищеводом и аортой. Таким образом, чреспищеводная ЭхоКГ не может дать полноценной картины пораженности аортальной стенки. При ЭпиУЗИ точная визуализация восходящей части аорты, как проксимальной, так и дистальной, а также дуги аорты возможна в полном объеме и с крайне высокой чувствительностью [17]. Однако выявленные изменения могут повлиять на тактику лишь интраоперационно. Поэтому важно применение как предоперационного скрининга в виде КТ, так и интраоперационного уточнения с помощью метода ЭпиУЗИ.
Помимо уже доказанного наличия атероматоза, имеются данные об эффективном использовании методики в предсимптомной диагностике различных патологий стенки аорты, включая расслоение аорты, с применением ЭпиУЗИ с датчиками высочайшего разрешения [18]. Такое направление является достаточно перспективным, однако в настоящее время находится на этапе изучения.
Также не стоит забывать о таком грозном состоянии, как интраоперационное расслоение аорты, которое может оказаться фатальным [19]. Именно такая методика, как ЭпиУЗИ позволяет быстро и точно идентифицировать диссекцию и тем самым сэкономить критически важное время для устранения патологического состояния во время операции.
Заключение
Рутинное использование комбинации предоперационной КТ и ЭпиУЗИ в качестве визуализирующих методов диагностики и планирования операции позволяет подходить индивидуально в каждом конкретном случае и потенциально снижать частоту неврологических осложнений за счет выбора оптимальной тактики. Выбор интраоперационного плана может осуществляться с применением большого диапазона существующих кардиохирургических стратегий, что было продемонстрированно в вышеуказанных клинических случаях.


