Особенности проявления модифицирующих свойств радиопротекторов при действии излучений разного качества на эукариотические клетки
Автор: Купцова П.С., Жураковская Г.П., Белкина С.В.
Рубрика: Научные статьи
Статья в выпуске: 4 т.30, 2021 года.
Бесплатный доступ
Модификация действия ионизирующего излучения химическими веществами, используемая как для усиления его действия, так и для ослабления, известна и широко применяется в медицинской радиологии. В работе проведён сравнительный анализ модифицирующих свойств трёх химических радиопротекторов (цистамин, цистеин и цистеамин) при их одновременном действии с g-квантами, a-частицами и УФ-светом на дрожжевые клетки. Цель исследования - сравнить особенности проявления свойств химических веществ в отношении защиты клеток от УФ-подобных повреждений при действии ионизирующего излучения или от повреждений, индуцируемых УФ-светом. В исследовании показано, что цистамин защищает клетки как от повреждающего действия g-квантов, так и УФ-света, в отличие от цистеамина и цистеина, защищающих их исключительно от действия ионизирующего излучения. Более того, цистамин не модифицирует действие a-частиц, обладающих высокой плотностью ионизации вещества, но практически не вызывающих процессы возбуждения в биообъектах. Полученные данные позволяют предположить, что цистамин реализует свои протекторные свойства в отношении повреждений, обусловленных УФ-светом и УФ-подобных повреждений, возникающих в результате действия g-квантов за счёт возбуждения молекул или УФ-составляющей свечения Вавилова-Черенкова, сопровождающего действие ионизирующего излучения.
G-кванты, a-частицы, уф-свет, радиопротекторы, эукариотические клетки, возбуждение и ионизация молекул и атомов, свечение вавилова-черенкова, выживаемость, цистамин, цистеин, цистеамин
Короткий адрес: https://sciup.org/170191713
IDR: 170191713 | УДК: 576.3:615.849.015.25 | DOI: 10.21870/0131-3878-2021-30-4-52-60
Текст научной статьи Особенности проявления модифицирующих свойств радиопротекторов при действии излучений разного качества на эукариотические клетки
Модификации действия ионизирующего излучения посвящено большое количество публикаций, известно достаточное количество химических веществ, усиливающих или ослабляющих действие ионизирующего излучения [1-4]. Но при их разработке и использовании никоим образом не учитывают фактически комбинированное действие ионизации и возбуждения молекул, существующих одновременно при действии ионизирующих излучений и направленных на разные клеточные мишени, вызывая повреждения разного характера. Проблема оценки вклада процессов электронного возбуждения молекул в биологические эффекты ионизирующего излучения до настоящего времени не получила своего решения, а вкладом УФ-повреждений, инициируемых возбуждением молекул при действии ионизирующего излучения, фактически пренебрегают. Чем же обусловлена важность понимания роли возбуждения молекул в эффекте ионизирующего излучения высоких энергий? С открытием свечения Вавилова-Черенкова, сопровождающего излучение высоких энергий и возникающего при движении заряженных частиц со скоростью, превышающей фазовую скорость света в среде [5], возник вопрос о его биологической значимости [6]. Эта проблема становится ещё более актуальной в настоящее время, когда свечение Вавилова-Черенкова начинает широко использоваться в современной медицине [7] в качестве метода мониторинга лучевой терапии in vivo для визуализации поверхностных органов пациентов [8], а также для контроля параметров терапевтического излучения в режиме реального времени [9, 10]. Основная часть свечения Вавилова-Черенкова находится в непрерывном ультрафиолетовом спектре [11, 12]. Свидетельством возникновения УФ-подобных повреждений, обусловленных
Купцова П.С.* – мл. науч. сотр.; Жураковская Г.П. – вед. науч. сотр., д.б.н.; Белкина С.В. – зав. лаб., к.б.н. МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
ингибирующим действием возбуждения молекул при действии ионизирующего изучения на биологические объекты, является их восстановление под действием видимого света или фотореактивация [6]. Существование повреждений такого рода было прямым подтверждением ингибирования клеток при действии ионизирующего излучения одновременно двумя физическими факторами, возникающими при ионизации и возбуждении молекул и атомов. Основополагающие работы по фотореактивации клеток после действия ионизирующего излучения были выполнены в 80-х годах [6, 13-15]. Однако, изучение фотобиологических аспектов радиационного поражения клеток не может ограничиваться только анализом вклада фотореактивируемых повреждений в биологические эффекты ионизирующего излучения, потому что УФ-излучение индуцирует в клетках различные повреждения (фотогидраты пиримидиновых оснований, сшивки ДНК-белок, одно-нитевые разрывы и др.), среди которых только пиримидиновые димеры являются фотореактиви-руемыми [6]. Выявление вклада нефотореактивируемых повреждений в летальный эффект одного УФ-света представляет собой сложную задачу, поскольку, с одной стороны, трудно вычленить какой-то конкретный тип повреждений, а с другой, отсутствуют такие же специфические методы анализа вклада этих повреждений, каким является фотореактивация для анализа пиримидиновых димеров.
Невозможность практически разделить действие ионизации и возбуждения молекул и представить их независимыми воздействующими факторами на данном этапе исследований, привела к решению смоделировать действие возбуждения молекул коротковолновым УФ-светом и сравнить модифицирующие способности химических веществ, известных как радиопротекторы, при действии излучений разного качества: γ-квантов, α-частиц и УФ-света. Таким образом, цель исследования – сравнить особенности проявления свойств химических веществ (цистеамин, цистеин и цистамин) в отношении защиты клеток от УФ-повреждений, обусловленных действием ионизирующего излучения высоких энергий и от повреждений, индуцируемых коротковолновым УФ-светом.
Материалы и методы
Объект. Эукариотические клетки – диплоидные дрожжи Saccharomyces cerevisiae дикого типа, штамм XS800.
Тест. Клоногенный анализ, капельный метод [16].
Химические вещества. Цистамин (0,01 М), цистеамин (0,01 М) и цистеин (0,01 М). До облучения клетки выдерживали в 0,01 М растворе химических веществ 30 мин. Токсического действия веществ в использованной концентрации не наблюдалось.
Физические факторы . α-частицы (239Pu, 25 Гр/мин), γ-кванты (60Co, 32 Гр/мин) и УФ-свет (254 нм, интенсивность 4,5 Вт/м2).
Условия облучения . Суспензию клеток (5 мл) облучали γ-квантами в пробирках в присутствии или отсутствии химического вещества; α-частицами облучали монослой клеток. Для этого 0,1 мл суспензии помещали на голодный агар. Воздействие УФ-света осуществляли в открытых стеклянных кюветах, направляя облучение сверху, толщина слоя облучаемой клеточной суспензии 2 мм. Во избежание фотореактивации, облучение всеми видами излучений проводили без доступа света, разведение и другие процедуры выполнялись при красном свете, пострадиационная инкубация клеток происходила в темноте.
Каждая серия опытов повторялась 3-5 раз. Статистическая обработка результатов выполнялась с применением критерия Стьюдента.
Результаты и обсуждение
Радиопротекторные свойства выбранных химических веществ на дрожжевых клетках достаточно хорошо изучены [17]. В работе было важно проверить наличие защитных свойств при действии не только ионизирующего излучения, вызывающего ионизацию и возбуждение молекул и атомов облучаемого вещества, но и УФ-света, повреждающее действие которого обусловлено процессами возбуждения. Т.е. осуществлялся поиск химических веществ, защищающих клетки одновременно и от повреждений, возникающих при действии ионизирующего излучения, и УФ-света. Следует отметить, что для сравнительного анализа кроме собственных экспериментальных данных по действию УФ-света и α-частиц на дрожжевые клетки в присутствии химических радиопротекторов в работе использовали опубликованные ранее данные комбинированного действия исследованных химических веществ с γ-квантами [17].
Цистеамин известен в медицинской практике как радиопротектор, обладающий наиболее выраженным протекторным свойством. На рис. 1 представлен результат действия ионизирующего излучения (60Со) без цистеамина (панель А, светлые значки) и в его присутствии (панель А, тёмные значки) на дрожжевые клетки. Фактор изменения дозы (ФИД), определяемый отношением изоэффективных доз D o , составляет 2,0. На панели Б представлены результаты действия УФ-света без цистеамина (светлые значки) и с цистеамином (тёмные кружки) на те же клетки. Видно, что ФИД практически не отличается от 1. Данные рис. 1 свидетельствуют о значимых протекторных свойствах цистеамина по отношению к действию γ-излучения и очень незначительных по отношению к ультрафиолетовому свету.
Доза, Гр Доза Уф-света, Дж/м
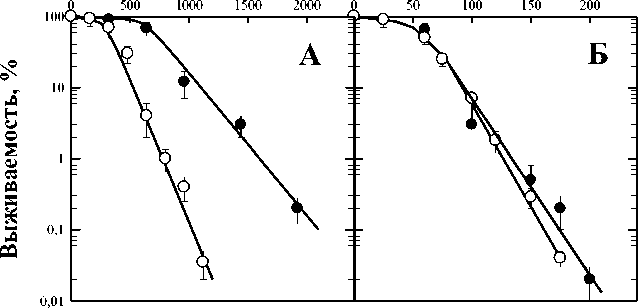
Рис. 1. Влияние цистеамина на выживаемость диплоидных дрожжевых клеток S. cerevisiae дикого типа (штамм XS800), облучённых γ-квантами (панель А) и УФ-светом (панель Б).
Светлые значки – действие излучения, тёмные – результат действия излучения в присутствии цистеамина.
Далее, на рис. 2 представлены результаты исследования действия цистеина, также известного своими радиопротекторными свойствами. В работе мы проверили его свойства при действии на дрожжевые клетки в присутствии ионизирующего излучения (панель А) и УФ-света (панель Б). Наглядно продемонстрировано отсутствие влияния цистеина на эффективность действия ультрафиолетового света.
Доза, Гр Доза Уф-света, Дж/м
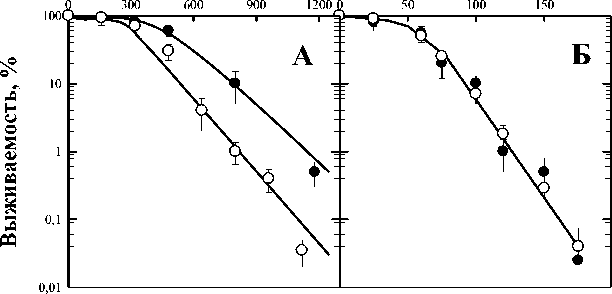
Рис. 2. Влияние цистеина на выживаемость диплоидных дрожжевых клеток S. cerevisiae дикого типа (штамм XS800), облучённых γ-квантами (панель А) и УФ-светом (панель В).
Светлые значки – действие излучения, тёмные – результат комбинированного действия излучения и цистеина.
Третьим веществом, исследованным в работе с точки зрения модификации действия УФ-излучения на дрожжевые клетки, был цистамин. Его защитные свойства по отношению к ионизирующему излучению изучены и долгие годы препарат цистамин является одним из рекомендуемых при разработке средств защиты населения при радиационном воздействии [18].
Доза, Гр
Доза, Гр Доза Уф-света, Дж/м2
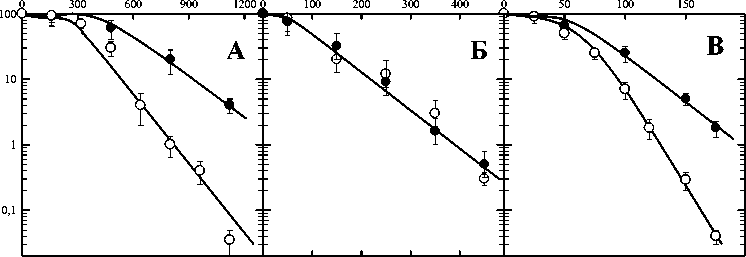
Рис. 3. Влияние цистамина на выживаемость диплоидных дрожжевых клеток S.cerevisiae дикого типа (штамм XS800), облучённых γ-квантами (панель А), α-частицами (панель Б) и УФ-светом (панель В).
Светлые значки – действие излучений, тёмные – результат комбинированного действия излучения и химического препарата.
На рис. 3 представлены результаты сравнительного анализа действия цистамина в сочетании с излучениями разного качества. Панель А на этом рисунке демонстрирует кривые выживаемости дрожжевых клеток после действия γ-квантов (светлые значки) и одновременного действия излучения и цистамина. ФИД в этом случае составил 1,6. Результаты действия одного α-излучения (панель Б, светлые значки) и действие в присутствии цистамина (тёмные значки) на клетки дрожжей не отличаются. Наибольший интерес заслуживают кривые выживаемости, представленные на панели В. Хорошо видно, что наибольшим протекторным действием вещество цистамин обладает при одновременном действии с ультрафиолетовым светом (тёмные значки).
Таким образом, из трёх проверенных в работе химических веществ только цистамин отвечает тем требованиям, которые были поставлены перед исследованием к радиопротекторам в начале работы, значимо защищает клетки от ультрафиолетового воздействия (ФИД=1,8).
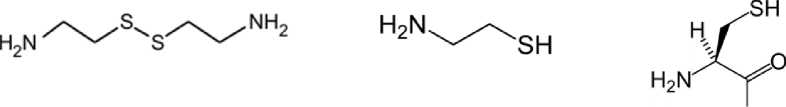
С одной стороны, эффективность защиты клеток от УФ-излучения цистамином вполне объяснима. Наибольшей чувствительностью к коротковолновому УФ-свету (рис. 4) отличаются дисульфидные мостики (-S-S-), разрываемые при поглощении фотона [19]. Следовательно, молекулы цистамина в растворе могут конкурировать за фотоны света с аминокислотами, входящими в состав клеток, способствуя их защите.
Цистамин (0,01 М) Цистеамин (0,01 М) Цистеин (0,01 М)
ОН
Рис. 4. Химические формулы цистамина, цистеамина, цистеина.
Но, с другой стороны, если придерживаться выдвинутой гипотезы, что результат действия ионизирующего излучения является совокупностью эффектов от ионизации и возбуждения молекул, а УФ-света только от их возбуждения, тогда можно предположить, что протекторное действие цистамина при действии ионизирующего излучения направлено в большей степени на защиту клеток от ингибирующего действия возбуждений, обусловленных УФ-составляющей ионизирующего излучения. И тогда становится полностью объяснимо отсутствие протекторного действия цистамина при облучении клеток α-частицами. α-излучение несёт значительную энергию и большой импульс, что позволяет ему выбивать электроны из атомов и даже сами атомы из молекул. Но следует понимать, что пробег α-частиц в биологических объектах весьма незначителен, и возникающее при этом возбуждение молекул может быть очень мало.
Если выдвигаемая гипотеза о взаимодействии повреждений, обусловленных ионизацией и возбуждением молекул и атомов, которое может быть и аддитивным, и синергическим, и антагонистическим, получит своё подтверждение, тогда поиск модифицирующих веществ может реализовываться иным путём, разделяя модификацию обеих составляющих и приводя защиту до максимально требуемого уровня, что в конечном счёте на практике может существенно повлиять на эффективность использования ионизирующего излучения в медицине.
Прямых экспериментов, в которых бы оценивалась биологическая эффективность возбуждений, инициируемых ионизирующим излучением, нет. Имеются лишь косвенные данные, понять которые можно, приняв, что возбуждение молекул существенно для поражающего действия биологических объектов ионизирующим излучением. Продемонстрированный в работе модельный подход исследования модификации результатов влияния УФ-составляющей свечения Вавилова-Черенкова, возникающего при действии ионизирующего излучения высоких энергий, химическими веществами, позволяет предложить новый сценарий к оценке вклада возбуждений молекул с одной стороны, а с другой – открывает новые возможности поиска эффективных, модифицирующих действие ионизирующего излучения, факторов.
Выводы
-
1. Сравнительный анализ результатов одновременного действия радиопротекторов цистеина, цистеамина и цистамина с γ-квантами, α-частицами или УФ-светом на дрожжевые клетки дикого типа показал существенную зависимость проявления модифицирующих свойств от качества излучения. Более того, из исследованных радиопротекторов только цистамин оказался химическим веществом, одновременно защищающим клетки от повреждений, обусловленных как ионизирующим излучением, так и УФ-светом.
-
2. Протекторная избирательность цистамина по отношению к повреждениям, обусловленным УФ-светом и УФ-подобным повреждениям, вызванным ионизирующим излучением, может быть связана с тем, что молекула цистамина содержит дисульфидную связь, за счёт которой молекулы цистамина в растворе могут конкурировать за фотоны света с белками, входящими в состав дрожжевых клеток.
-
3. Полученные в работе данные позволяют предположить, что эффективность протекторов или сенсибилизаторов действия ионизирующего излучения можно существенно увеличить, если поиск химических веществ осуществлять с учётом их влияния как на процессы ионизации молекул, так и возбуждения.
Список литературы Особенности проявления модифицирующих свойств радиопротекторов при действии излучений разного качества на эукариотические клетки
- Gaba N. Radioprotectors and Radiosensitizers. Lambert Academic Publishing, 2011. 200 p.
- Raviraj J., Bokkasam V.K., Kumar V.S., Reddy U.S., Suman V. Radiosensitizers, radioprotectors, and radiation mitigators //Indian J. Dent. Res. 2014. V. 25, N 1. P. 83-90.
- Некласова Н.Ю., Жаринов Г.М., Гребенюк А.Н. Модификация радиочувствительности нормальных и опухолевых тканей при лучевой терапии злокачественных новообразований //Радиационная биология. Радиоэкология. 2014. Т. 54, № 6. С. 597-605.
- Mallick S., Rath G.K., Benson R. Practical Radiation Oncology. Springer, 2020. 300 p.
- Болотовский Б.М. Свечение Вавилова-Черенкова. М.: Наука, 1964. 94 с.
- Мясник М.Н., Скворцов В.Г., Соколов В.А. Фотобиологические аспекты радиационного поражения клеток. М: Энергоатомиздат, 1985. 152 с.
- Helo Y., Kacperek A., Rosenberg I., Royle G., Gibson A.P. The physics of Cerenkov light production during proton therapy //Phys. Med. Biol. 2014. V. 59, N 23. P. 7107-7123.
- Krohn J., Chen Y. C., Stabo-Eeg N.O., Hamre B. Cherenkov luminescence imaging for assessment of radioactive plaque position in brachytherapy of uveal melanoma: an in vivo feasibility study //Transl. Vis. Sci. Technol. 2020. V. 9, N 7. P. 1-10.
- Xie Y., Petroccia H., Maity A., Miao T., Zhu Y., Bruza P., Pogue B.W., Plastaras J.P., Dong L., Zhu T.C. Cherenkov imaging for total skin electron therapy (TSET) //Med. Phys. 2020. V. 47, N 1. P. 201-212.
- Jarvis L.A., Hachadorian R.L., Jermyn M., Bruza P., Alexander D.A., Tendler I.I., Williams B.B., Gladstone D.J., Schaner P.E., Zaki B.I., Pogue B.W. Initial clinical experience of Cherenkov imaging in external beam radiation therapy identifies opportunities to improve treatment delivery //Int. J. Radiat. Oncol. Biol. Phys. 2021. V. 109, N 5. P. 1627-1637.
- Беспалов В.И. Взаимодействие ионизирующих излучений с веществом. Томск: Изд-во Томского политехнического университета, 2008. 369 с.
- Valkovic V. Radioactivity in the Environment. Elsevier Science, 2019. 810 p.
- Petin V.G., Komarov V.P. Photoreactivation of damage induced by ionizing radiation in yeast cells //Radiat. Environ. Biophys. 1985. V. 24, N 4. P. 281-286.
- Ley R.D., Applegate L.A., Fry R.J., Sanchez A.B. Photoreactivation of ultraviolet radiation-induced skin and eye tumors of Monodelphis domestica //Cancer Res. 1991. V. 51, N 24. P. 6539-6542.
- Ley R.D. Photoreactivation in humans //Proc. Natl. Acad. Sci. USA. 1993. V. 90, N 10. P. 4337.
- Морозов И.И. Метод определения числа жизнеспособных микроорганизмов //Лабораторное дело. 1983. № 9. С. 60-62.
- Петин В.Г. Генетический контроль модификаций радиочувствительности клеток. М.: Энергоатомиздат, 1987. 208 с.
- Степанов А.В., Тарасова О.А., Любин А.В., Перепелицин Н.И. Средства защиты населения при массовом поражении населения. Чита: ИИЦ ЧГМА, 2009. 83 с.
- Конев С.В., Волотовский И.Д. Фотобиология. Минск: БГУ, 1979. 348 с.


