Особенности пролиферации и апоптоза эпителиоцитов толстой кишки крыс после облучения в дозе 8 гр
Автор: Саакян С.В., Каракаева Э.Б.Г., Шаповалова Е.Ю., Зорин И.А., Демяшкин Г.А.
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.31, 2023 года.
Бесплатный доступ
Эпителиальные клетки кишечника характеризуются высокой митотической активностью и обладают высокой радиочувствительностью ко всем видам ионизирующего облучения, которые вызывают их повреждение. В современной морфологии и радиологии отсутствуют данные о воздействии активных электронов на слизистую оболочку кишечника, несмотря на перспективность и активное внедрение этого вида излучения для терапевтических целей в онкологии. Цель исследования: иммуногистохимическая оценка пролиферации и апоптоза клеток эпителия толстой кишки самцов крыс линии Вистар после локального облучения электронами в дозе 8 Гр. Облучение животных производили на линейном ускорителе NOVAC-11, при мощности дозы 1 Гр/мин, энергии 10 МэВ и частоте 9 Гц, диаметр поля облучения тазово-абдоминальной области составил 100 мм. Животных из каждой группы выводили из эксперимента на первые и третьи сутки. Гистологические препараты ободочной кишки (n=30) двух групп, первой - контрольной (n=10) и второй, опытной группы (n=20) исследовали иммуногистохимическим методом с антителами к Ki-67 и Cas3. В препаратах крыс, выведенных через сутки после облучения, выявили преобладание апоптотических процессов. Количество позитивных клеток на окраску с антителами к каспазе 3 было увеличено в 1,5 раза в опытной группе по сравнению с контрольной, а количество Ki-67-позитивных клеток, напротив, было снижено, в 1,5 раза. На 3 сутки после облучения электронами в эпителии толстой кишки количество иммунопозитивных клеток не отличалось от контрольных значений. Таким образом, при локальном однократном облучении электронами тазово-абдоминальной области крыс в дозе 8 Гр через сутки отмечается снижение количества стволовых эпителиальных клеток кишечных крипт ободочной кишки, что подтверждено сдвигом пролиферативно-апоптотического баланса в сторону гибели клеток. В динамике наблюдения на третьи сутки эксперимента наблюдается увеличение пула пролиферирующих клеток с последующим восстановлением кишечных крипт.
Слизистая оболочка толстой кишки, ионизирующее облучение энтероциты, апоптоз, пролиферация, иммуногистохимия
Короткий адрес: https://sciup.org/143181185
IDR: 143181185 | DOI: 10.20340/mv-mn.2023.31(3).790
Текст научной статьи Особенности пролиферации и апоптоза эпителиоцитов толстой кишки крыс после облучения в дозе 8 гр
Саакян С.В., Каракаева Э.Б-Г., Шаповалова Е.Ю., Зорин И.А., Демяшкин Г.А. Особенности пролиферации и апоптоз эпителиоцитов толстой кишки после облучения электронами в дозе 8 Гр. Морфологические ведомости. 2023;31(3):790. mn.2023.31(3).790
Saakian SV, Karakaeva EB-G, Shapovalova EY, Zorin IA, Demyashkin GA. Eatures of proliferation and apoptosis of colonic epitheliocytes after electron irradiation at a dose of 8 Gy. Morfologicheskie Vedomosti – Morphological newsletter. 2023;31(3):790. (3).790
Введение. Эпителиальные клетки толстой кишки характеризуются высокой митотической активностью. Считается, что они обладают повышенной радиочувствительностью ко всем видам излучения, причем не только к локальному (тазовоабдоминальному), но и к общему облучению [1-2]. Влияние радиоизлучения на эпителиальные стволовые клетки кишечных крипт было подробно изучено в предыдущих работах других авторов. Известно, что инициация постлучевого гастроинтестинального синдрома происходит вследствие повреждения клеток кишечных крипт и сопровождается отеком, гиперемией, слущиванием эпителия, изъязвлениями, стриктурами и некрозом стенки кишки [3]. Ионизирующее излучение вызывает повреждение клеток и субклеточных структур. Аберрации ДНК приводят к нарушению сигнальных внутриклеточных путей, ответственных за нормальное функционирование жизненного цикла, инициацию апоптоза и репарацию молекул генетической информации [4-5].
Активация апоптоза происходит, как в условиях клеточного и тканевого гомеостаза, так и при разных патологических состояниях, таких как ишемия, неврологические нарушения, неоплазии и различные инфекции, а также при повреждениях ДНК [4]. В настоящий момент известны два механизма, которые активируют апоптоз в клетках. Внутренний путь, регулируемый митохондриями и внешний, индуцированный лигандами клеточной гибели. Эти лиганды способны индуцировать инициаторные протеазы, такие как каспаза-9, что приводит к активации терминальной протеазы - каспазы-3 [6]. В немногочисленных исследованиях было показано, что каспаза-3 является ключевой молекулой при активации апоптоза в эпителиоцитах толстой кишки после воздействия облучения. После повреждения ДНК запускается внутренний путь апоптоза, приводящий к высвобождению проапоптотических молекул и увеличению проницаемости митохондрий, что в свою очередь запускает активность терминальных молекул, таких как каспаза-7 и -3 [7-8].
В современной морфологии и радиологии отсутствует информация о воздействии электронов на слизистую оболочку толстой кишки, несмотря на перспективность и активное внедрение этого вида излучения для терапевтической практики в онкологии. Данные о воздействии других видов облучения на толстую кишку, в основном используемых в лучевой терапии, - противоречивы [2, 9-10]. В этом смысле морфологическое и молекулярно-биологическое исследования эффектов облучения электронами является актуальным, так как установлено, что оно обладает меньшим повреждающим эффектом на ткани [11]. В то же время при изучении влияния облучения электронами на эпителий толстой кишки важно оценить не только степень и глубину повреждений, но и пролиферативную активность эпителиоцитов, то есть их регенеративный потенциал.
Цель исследования: иммуногистохимическая оценка пролиферации и апоптоза эпителия толстой кишки после локального облучения электронами в дозе 8 Гр в эксперименте.
Материалы и методы исследования. В эксперименте использованы половозрелые крысы-самцы линии Вистар (n=30), которые были поделены на две группы: I - контрольная (n=10); II - опытная группа (n=20). Локальное однократное облучение электронами в дозе 2 Гр тазовоабдоминальной области производили на линейном ускорителе NOVAC-11 при мощности дозы 1 Гр/мин, энергии 10 МэВ и частоте 9 Гц, с диаметром поля облучения 100 мм. Животных каждой группы выводили из эксперимента на 1 и 3 сутки. Все манипуляции выполняли согласно «Международным рекомендациям по проведению медико-биологических исследований с использованием животных» (ЕЭС, Страсбург, 1985) и Хельсинской декларации (1985).
Фрагменты толстой (ободочной) кишки фиксировали в забуференом формалине, заливали в парафиновые блоки, гистологические срезы нарезали на микротоме толщиной 3 мкм, окрашивали гематоксилином и эозином. Микроскопический анализ выполняли с помощью систе- мы видеомикроскопии микроскопа Leica DM2000 (Германия), видеокамерой Leica ICC50 HD. Ключевые периоды жизненного цикла эпителия толстой кишки изучены с помощью маркеров терминации апоптоза (каспазы-3) и пролиферации (Ki-67). Иммуногистохимическое исследование проводили по стандартному протоколу в автоматическом режиме в иммуногистостейнере Bond-Max («Leica», Германия). Первичные антитела: к каспазе-3 (Invitrogen/Thermo Fisher Scientific; 74T2, 1:50) и Ki-67 (Abcam; ab15580, 1:100); вторичные – универсальные антитела (HiDef Detection™ HRP Polymer system, «Cell Marque», США). Количество иммунопози-тивных клеток подсчитывали в 10 полях зрения, при увеличении х400. Полученные данные были представлены в виде относительного числа позитивных клеток в %, как среднее значение доли (P) и ошибки средней доли (pm). Значимыми считали различия между показателями при p≤0,05.
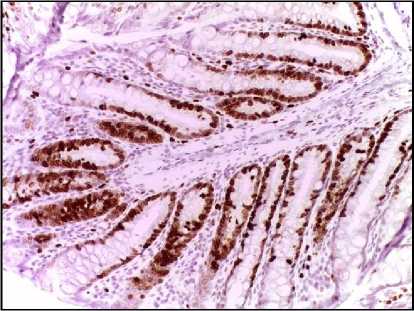
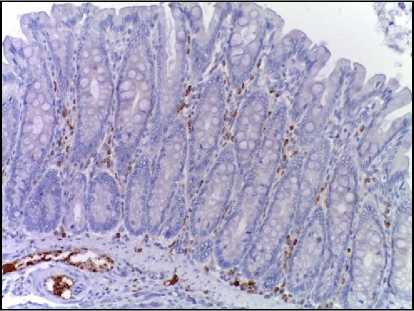
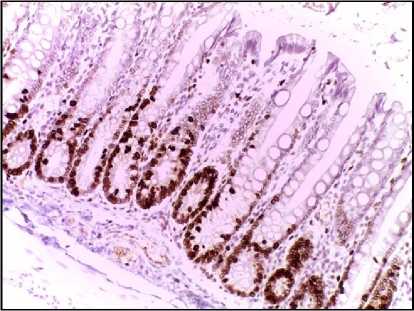
Результаты исследования и обсуждение. Во всех гистологических препаратах толстой кишки животных через сутки после локального облучения электронами в дозе 8 Гр наблюдали типичную морфологическую картину постлучевого колита, которая проявлялась в дезорганизации однослойного цилиндрического эпителия с апоптотическими тельцами и воспалительной инфильтрации в подслизистой основе, слабом интерстициальном отеке. Количество бокаловидных клеток было снижено, а сами кишечные крипты расширены. На 3-и сутки эксперимента отмечали восстановление гистоархитектоники эпителия слизистой оболочки толстой кишки, расположение и строение кишечных крипт, количество бокаловидных клеток приблизилось к контрольным значениям. При иммуногистохимическом исследовании через сутки после локального облучения электронами выявили преобладание апоптотических процессов. Количество каспаза-3-позитивных клеток было увеличено в 1,56 раза в опытной группе по сравнению с контрольной с до 33,5% до 52,5% (табл. 1). Количество Ki-67-позитивных клеток, напротив, было после облучения снижено в 1,54 раза с 49% до 31,2%. На 3-и сутки после облучения элек- тронами в эпителии толстой кишки количество иммунопозитивных клеток статистически не отличалось от контрольных значений (табл. 1, рис. 1).
Таблица 1
Доля позитивно окрашенных к антигенам энтероцитов в гистологических препаратах толстой кишки контрольной и опытных групп крыс в % (P±p m )
|
Маркер |
Группа II (облучение) |
Группа I (контроль) |
|
|
1 сутки |
3 сутки |
||
|
Сaspase-3 |
52,4715,13 ' |
39,6113,27 |
33,4812,35 |
|
Ki-67 |
31,212,97 ; |
43,6214,73 |
49,2714,53 |
Примечание: ↑ - статистически значимое увеличение и ↓ -уменьшение по сравнению с контрольной группой
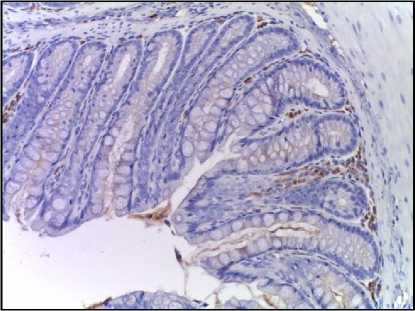
Электронотерапия является перспективным методом, обладающим терапевтическим эффектом при кратковременном облучении в высоких дозах, что значительно сокращает число осложнений по сравнению с лечением традиционными видами излучения. Значительная частота заболеваемости колоректальным раком и отсутствие данных об эффективности его лечения электронным излучением, как потенциальной альтернативы другим видам радиотерапии, стимулируют его экспериментальные исследования [11-12]. В проведенном эксперименте установлено, что эпителий толстой кишки обладает высокой радиочувствительностью, о чем свидетельствует морфологическая картина постлучевого колита, обнаруженная уже на первые сутки после облучения тазовоабдоминальной зоны крыс. Это явление подтверждает ранее проведенные исследования по аналогичным эффектам других видов ионизирующего излучения [1315]. В эксперименте было обнаружено, что уже на первые сутки после облучения электронами в эпителии значительно возрастает количество каспаза-3-позитивных клеток. Можно полагать, что результатом прямого воздействия электронов на энте-роциты толстой кишки является фрагментация ДНК и клеточных мембран, запуск апоптоза, завершающийся активацией каспазы-3 [7, 16]. Увеличение количества активированной каспазы-3 приводит к прекращению жизненного цикла энтеро-цитов. Наиболее интенсивно окрашенными на каспазу-3 были клетки, располагающиеся в области дна крип, являющиеся стволовыми для кишечного эпителия и обладающие, как известно, высокой митотической активностью (рис. 1).
Иммуногистохимические маркеры
Сaspase-3
8 Гр 1-е сутки
Ki-67
8 Гр 3-и сутки
контроль
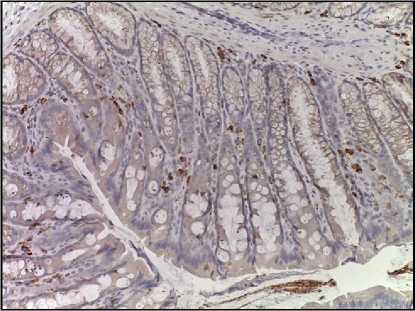
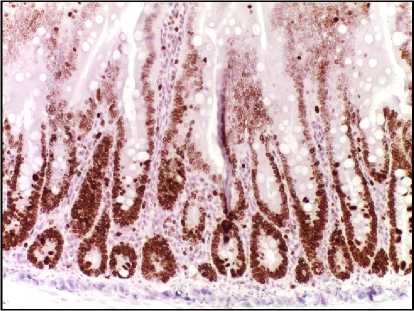
Рис. 1. Микрофото гистологических препаратов толстой кишки крыс после локального однократного облучения электронами в дозе 8 Гр. Окр.: иммуногистохимическая (см. в тексте) с докраской ядер гематоксилином. Ув.: ×200
Известно, что при вступлении в апоптоз энтероциты толстой кишки способны выделять молекулы, которые стимулируют сохранные стволовые клетки к ускоренной пролиферации [17-18]. Поэтому, наряду с указанным выше на первые сутки эксперимента эффектом облучения электронами, отмечали снижение количества Ki-67-позитивно окрашенных клеток в области дна кишечных крипт.
Однако уже на 3 сутки показатели пролиферации в опытной группе приблизились к значениям контрольной группы. Для восстановления пула эпителиоцитов кишечных крипт в такие кратчайшие сроки, очевидно вполне достаточно сохранившегося количества интактных стволовых клеток.
Заключение. Таким образом, при локальном однократном облучении элек- тронами тазово-абдоминальной области крыс Вистар в дозе 8 Гр через сутки отмечается снижение количества стволовых эпителиальных клеток кишечных крипт в толстой (ободочной) кишке, что подтверждается сдвигом пролиферативно-апоп-тотического баланса в сторону гибели клеток, оцененного соотношением каспа- зы-3 и Ki-67. В динамике, на третьи сутки эксперимента, наблюдается увеличение пула стволовых клеток с последующим восстановлением кишечных крипт.
Список литературы Особенности пролиферации и апоптоза эпителиоцитов толстой кишки крыс после облучения в дозе 8 гр
- Zhang L, Yu J. Role of apoptosis in colon cancer biology, therapy, and prevention. Curr Colorectal Cancer Rep. 2013;9(4):10.1007/s11888-013-0188-z. D0I:m1007/s11888-013-0188-z
- Booth C, Tudor G, Tudor J, et al. The Acute Gastrointestinal Syndrome in High-Dose Irradiated Mice. Health Phys 2012;103:383-399
- Akpolat M, Oz ZS, Gulle K, et al. X irradiation induced colonic mucosal injury and the detection of apoptosis through PARP-1/p53 regulatory pathway. Biomedicine & Pharmacotherapy 2020;127:110134. D0I:10.1016/j.biopha.2020.110134
- Hauer-Jensen M, Denham JW, Andreyev HJN. Radiation enteropathy — pathogenesis, treatment and prevention. Nat Rev Gastroenterol Hepatol 2014;11:470-479. D0I:10.1038/nrgastro.2014.46
- Araujo IK, Munoz-Guglielmetti D, Molla M. Radiation-induced damage in the lower gastrointestinal tract: Clinical presentation, diagnostic tests and treatment options. Best Pract Res Clin Gastroenterol 2020;48-49:101707. D0I:10.1016/j.bpg.2020.101707.
- Negroni A, Cucchiara S, Stronati L. Apoptosis, Necrosis, and Necroptosis in the Gut and Intestinal Homeostasis. Mediators Inflamm 2015;2015:250762. DOI: 10.1155Д015/250762
- McIntosh A, Meikle LM, Ormsby MJ, et al. SipA Activation of Caspase-3 Is a Decisive Mediator of Host Cell Survival at Early Stages of Salmonella enterica Serovar Typhimurium Infection. Infection and Immunity 2017;85:e00393-17. DOI: 10.1128/IAI.00393-17
- Beroske L, Van den Wyngaert T, Stroobants S, et al. Molecular Imaging of Apoptosis: The Case of Caspase-3 Radiotracers. IJMS 2021;22:3948. DOI: 10.3390/ijms22083948
- Rubio CA, Jalnäs M. Dose-time-dependent histological changes following irradiation of the small intestine of rats. Digest Dis Sci 1996;41:392-401. DOI:10.1007/BF02093834
- Otsuka K, Suzuki K. Differences in Radiation Dose Response between Small and Large Intestinal Crypts. Radiation Research 2016;186:302-314. DOI: 10.1667/RR14455.1
- Schüler E, Acharya M, Montay-Gruel P, et al. Ultra-high dose rate electron beams and the FLASH effect: From preclinical evidence to a new radiotherapy paradigm. Medical Physics 2022;49:2082-2095. DOI:10.1002/mp.15442
- Tam SY, Wu VWC. A Review on the Special Radiotherapy Techniques of Colorectal Cancer. Frontiers in Oncology 2019;9:208. DOI: 10.3389/fonc.2019.00208
- Muschel RJ, Hammond EM, Dewhirst MW. A New Assay to Measure Intestinal Crypt Survival after Irradiation: Challenges and Opportunities. Cancer Research 2020;80:927-928. DOI:10.1158/0008-5472.CAN-19-4045
- Moussa L, Usunier B, Demarquay C, et al. Bowel Radiation Injury: Complexity of the Pathophysiology and Promises of Cell and Tissue Engineering. Cell Transplant 2016;25:1723-1746. DOI:10.3727/096368916X691664
- Weiber S, Bjelkengren Gör, et al. Radiation Effects in the Colon: An Experimental Study in the Rat. Acta Oncologica 1993;32:565-569. DOI:10.3109/02841869309096119
- Pejchal J, Novotny J, Mafäk V, et al. Activation of p38 MAPK and expression of TGF-ß1 in rat colon enterocytes after whole body y-irradiation. International Journal of Radiation Biology 2012;88:348-358. DOI:10.3109/09553002.2012.654044
- Karmakar S, Deng L, He XC, Li L. Intestinal epithelial regeneration: active versus reserve stem cells and plasticity mechanisms. American Journal of Physiology-Gastrointestinal and Liver Physiology 2020;318:G796-802. DOI:10.1152/ajpgi.00126.2019
- Rees WD, Tandun R, Yau E, et al. Regenerative Intestinal Stem Cells Induced by Acute and Chronic Injury: The Saving Grace of the Epithelium? Front. Cell Dev. Biol. 2020;8:583919. DOI:10.3389/fcell.2020.583919


