Особенности протеома сыворотки крови больных плоскоклеточными карциномами головы и шеи
Автор: Какурина Гелена Валерьевна, Кондакова Ирина Викторовна, Чойнзонов Евгений Лхамацыренович, Шишкин Дмитрий Александрович, Черемисина Ольга Владимировна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 (56), 2013 года.
Бесплатный доступ
Представлены результаты сравнительной оценки протеома сыворотки крови в группах больных ПКГШ с метастазами, без метастазов и здоровых волонтеров с помощью комбинации методов 1D-SDS PAGE градиентного гель-электрофореза и массспектрометрического анализа. Предложенный дизайн исследования показал, что протеом сыворотки крови в группах здоровых волонтеров и больных ПКГШ с метастазами и без клинического проявления прогрессирования заболевания различен. В сывороточном протеоме больных ПКГШ представлены белки, участвующие в различных клеточных процессах, которые могут быть предложены для дальнейшего изучения в качестве потенциальных маркеров опухолевой прогрессии.
Протеомика, плоскоклеточные карциномы головы и шеи, маркеры
Короткий адрес: https://sciup.org/14056321
IDR: 14056321 | УДК: 617.51/.53-006.61:577.112:612.398.12
Текст научной статьи Особенности протеома сыворотки крови больных плоскоклеточными карциномами головы и шеи
Плоскоклеточные карциномы головы и шеи (ПКГШ) являются основным морфологическим типом опухолей головы и шеи (около 90 %), составляя около 5 % всех злокачественных новообразований. Клиническое течение ПКГШ отличается крайней агрессивностью и долгим бессимптомным течением [3]. Местные рецидивы и метастазы в лимфоузлы шеи сокращают 5-летнюю выживаемость пациентов вдвое [2, 4]. Имеющиеся на сегодняшний день методы обнаружения метастазов на ранних этапах прогрессии опухоли до их клинического проявления недостаточно эффективны и надежны. Несмотря на активный поиск молекулярных маркеров прогрессии данного заболевания, до сих пор не предложен ни один вариант диагностической панели, включающей белковые маркеры, отра- жающие биологическое поведение опухоли и ее реакцию на терапевтические воздействия, которая была бы достаточна для проведения стандартного клинического исследования [1].
С развитием протеомных технологий появилась возможность проводить полномасштабные исследования изменений белкового спектра тканей и биологических жидкостей организма больного, что открывает новые подходы к ранней диагностике, прогнозу и таргетной терапии ПКГШ. Основной массив исследований последних лет в основном связан со сравнительным анализом протеома злокачественных и соответствующих нормальных клеточных культур или злокачественных и нормальных тканей. При этом используются оборудование с большой производительностью и вы- сокотехнологичные, дорогостоящие и трудоемкие методы (3–4 дня), которые имеют свои недостатки. Альтернативой может стать использование одномерного денатурирующего гель-электрофореза (в градиентном ПААГ) (1D-SDS PAGE) в сочетании с масс-спектрометрическими методами анализа протеома сыворотки крови больных. Одномерный гель-электрофорез, обладая известными преимуществами перед двумерным электрофорезом, позволяет не упустить из сравнительного анализа высокозаряженные и гидрофобные мембранные белки [15, 16].
В настоящем исследовании проведен сравнительный анализ протеома сыворотки крови здоровых лиц и больных с верифицированным диагнозом плоскоклеточная карцинома головы и шеи, что позволило идентифицировать несколько белков, определение содержания которых может быть информативным в плане прогноза заболевания.
Целью исследования явилось проведение сравнительной оценки протеома сыворотки крови в группах больных ПКГШ с метастазами, без метастазов и здоровых волонтеров и определение возможности применения 1D-SDS PAGE денатурирующего градиентного гель-электрофореза в сочетании с масс-спектрометрическим анализом для выявления возможных биомаркеров ПКГШ и прогрессии этого заболевания.
Материал и методы
В исследование включены здоровые волонтеры и больные ПКГШ, получавшие лечение в отделении опухолей головы и шеи ФГБУ «НИИ онкологии» СО РАМН (г. Томск). Работа проведена с соблюдением принципов добровольности и конфиденциальности в соответствии с «Основами законодательства РФ об охране здоровья граждан» (Указ Президента РФ 39 от 24.12.93 № 2288), получено разрешение этического комитета института. Материалом для исследования явилась сыворотка крови 19 первичных больных ПКГШ с гистологически верифицированным диагнозом и 10 здоровых волонтеров. Группа больных с ПКГШ с метастазами составила 9 (Т2–4N1–2M0), без метастазов 10 человек (T1–2N0M0). Средний возраст обследованных больных составил 53 ± 5,3 года.
не идентифицированного программой Biotools 3.2, проводили с помощью программы «секвенирование De Novo». Достоверность предлагаемых программой последовательностей проверяли путем сравнения экспериментально полученных молекулярных масс фрагментов с теоретически рассчитанными при помощи функции Sequence Editor.
Результаты и обсуждение
Сравнительный анализ электрофореграмм, полученных с помощью одномерного градиентного 7–16 % гель-электрофореза сыворотки крови здоровых волонтеров и обследованных групп больных с ПКГШ, включающих подгруппы с регионарными метастазами и без метастазов, позволил обнаружить различия в интенсивности белковых полос в диапазоне масс от 10 кДа до 150 кДа. Сравнение электрофореграмм сыворотки крови больных с ПКГШ без метастазов и здоровых лиц показало отличие в интенсивности окраски полос, содержащих белки массой 10кДа, 25 кДа, 50 кДа и 75 кДа. У всех больных, имеющих регионарные метастазы, обнаружены белковые полосы в районе масс 10 кДа, 12кДа, 15 кДа, 18 кДа, 40 кДа, 100 кДа, интенсивность которых была выше по сравнению с группой здоровых и группой пациентов с ПКГШ без метастазов. Методами масс- спектрометрического анализа в выделенных бендах упомянутые выше белки были идентифицированы как: аполипопротеины А1 и А2, транстирретин, се-ротрансферрин, протеинфосфатаза 1В, комплемент С3, субъединицы гемоглобина α и β, матриксный экстрацеллюлярный фосфогликопротеин (MEPE), сывороточный амилоид А (таблица).
У 2 больных, имеющих метастазы, идентификация спектров выделенных белковых полос с молекулярной массой 110 кДа и 150 кДа выявила наличие нескольких белков в одном бенде, причем состав их был различен. В сыворотке крови больного со стадией процесса T3N1M0 (умершего через 7 мес после постановки диагноза) в области белковой полосы массой около 20–22 кДа была идентифицирована транкированная форма аполипоротеина А1, в отличие от остальных исследуемых лиц, где идентифицировалась полноразмерная форма апо-липоротеина (рис. 1).
Увеличение уровня аполипоротеина А1-2, транстирретина, серотрансферрина, сывороточного амилоида А и комплемента С3 при опухолях различной локализации подтверждается литературными данными и отражает реакцию организма на развитие патологического процесса [9]. Различия в составе обнаруженных нами белков, вероятно,
Таблица
Идентифицированные белки, полученные из выделенных белковых полос при разделении белков сыворотки крови в исследуемых группах.
|
Идентифицированные белки |
ID |
Mr |
Score |
Sequence Coverag |
|
Apolipoprotein A-I |
APOA1_HUMAN |
30759 |
200 |
68 % |
|
Apolipoprotein A-II |
APOA2_HUMAN |
11282 |
81 |
58 % |
|
Hemoglobin subunit alpha |
HBA_HUMAN |
15305 |
68 |
49 % |
|
Hemoglobin subunit beta |
HBB_HUMAN |
16102 |
149 |
85 % |
|
Serum amyloid A protein |
SAA_HUMAN |
13524 |
89 |
71 % |
|
Adenylyl cyclase-associated protein 1 |
CAP1_HUMAN |
51823 |
73 |
30 % |
|
Alpha-2-macroglobulin |
A2MG_HUMAN |
163189 |
70 |
20 % |
|
Myosin-15 |
MYH15_HUMAN |
224479 |
69 |
27 % |
|
Ashwin |
ASHWN_HUMAN |
25843 |
68 |
36 % |
|
Matrix extracellular phosphoglycoprotein |
MEPE_HUMAN |
58384 |
60 |
26 % |
|
Serotransferrin |
TRFE_HUMAN |
79280 |
60 |
32 % |
|
Protein phosphatase 1B |
PPM1B_HUMAN |
52609 |
63 |
39 % |
|
Complement C3 |
CO3_HUMAN |
188569 |
64 |
26 % |
Примечание: ID – аббревиатура названия белков в соответствии с базами данных NCBI; Mr – молекулярная масса белков; Score = -10×lgP, где P – вероятность того, что белок, который был сопоставлен масс-спектру из баз данных, является неверным. Все результаты поиска белков со значением Score больше 50 являются достоверными; Sequence Coverag – процент покрытия аминокислотной последовательности белка по базам данных. Достоверным считается показатель от 15 до 90 %.
связаны с наличием сопутствующих заболеваний. Однако некоторые авторы утверждают, что, например, более агрессивный тип ПКГШ связан с дифференциальной экспрессией некоторых белков, в том числе и некоторых форм аполипопротеина (преАро1, Аро1). По их мнению, аполипопротеины могут как служить носителем, так и косвенно способствовать развитию опухоли через активацию киназ [10]. Более того, результаты исследований, проведенных на животных, показали, что продукты протеолитического расщепления плазминогена, аполипопротеина(а) и других белков, содержащих домены типа kringle, имеют антиангиогенные и антиопухолевые свойства как in vitro, так и in vivo [17, 18]. Сывороточный амилоид А известен как маркер повреждения ткани или воспаления, относится к белкам острой фазы и предлагается как индивидуально, так и в комбинации с гаптоглобином и комплементом С3, для дифференциальной диагностики рака различных локализаций [7]. Обнаруженный в данной работе белок MEPE участвует в минерализации костей и является членом семейства белков SIBLING. SIBLING – растворимые, секретирующиеся белки, которые могут модулировать адгезию клетки путем взаимодействия их с поверхностными рецепторами клетки, такими как интегрины. Показана роль остеопонтина в прогрессии рака, который является одним из членов семейства SIBLING. Кроме того, накапливаются новые данные о возможной роли в неопластических процессах других членов семейства SIBLING [5]. Так, некоторые члены семейства SIBLING участвуют в регуляции активности металлопротеиназ ММП 2, 3, 9, что коррелирует с плохим прогнозом заболевания [8]. Роль МЕРЕ в качестве маркера прогноза заболевания ПКГШ до сих пор не обсуждалась. Высокая экспрессия МЕРЕ наблюдается в опухолях (чаще мезенхимального происхождения), которые вызывают онкогенную остеомаляцию [6, 12]. Причастность белков SIBLING ко многим звеньям прогрессии опухолевого процесса делает их потенциально ценными кандидатами в качестве эффективных биомаркеров.
Известно, что протеинфосфатаза 1В (PPM1B, PP2CB) участвует в МАРК-киназном сигнальном пути регуляции многих клеточных процессов, включающих регуляцию пролиферации (TAK1→NFkB путь), транскрипции и апоптоза (WNT-сигнальный путь) . TAK1 (TGF-β активи-
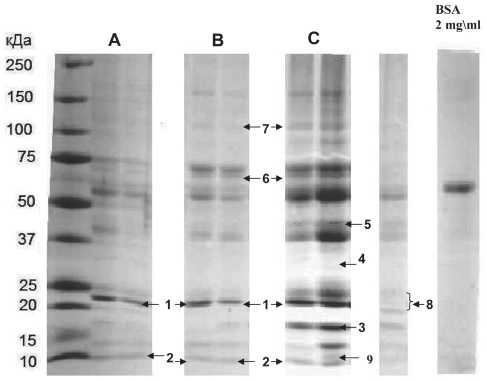
Рис. 1. Различие в белковых полосах электрофореграмм, полученных при разделении белков сыворотки крови здоровых доноров (A), больных ПКГШ без метастазов (B) и больных ПКГШ с метастазами (С).
Примечание: 1 – апоА1; 2 – апоА2; 3 – неидентифицирован;
4 – транстирретин; 5 – протеинфосфатаза 1В; 6 – комплемент С3; 7 –матриксный экстрацеллюлярный фосфогликопротеин (MEPE);
8 – усеченная форма апоА1; 9 – сывороточный амилоид А рованная киназа-1) предлагается B. Honorato et al. в качестве предиктора рецидивирования у пациентов с ПКГШ [11].
Полученные результаты показали, что протеом сыворотки крови в группах здоровых волонтеров и больных ПКГШ с метастазами и без клинического проявления прогрессирования заболевания различен. В сывороточном протеоме больных ПКГШ представлены белки, участвующие в различных клеточных процессах, которые могут быть предложены для дальнейшего изучения в качестве потенциальных маркеров опухолевой прогрессии. И так как в настоящее время нет данных о характере изменения протеома во взаимосвязи с клинико-морфологическими характеристиками опухолевого процесса при ПКГШ, это направление исследований является одним их актуальных в онкопротеомике.
Проведение протеомного анализа возможных биомаркеров с использованием денатурирующего одномерного гель-электрофореза в градиенте концентраций ПААГ и масс-спектрометрических методов анализа протеома, на наш взгляд, обеспечит наиболее возможную чистоту результатов исследования и может использоваться в плане выявления мажорных различий в исследуемых группах пациентов.


