Особенности разработки методов высокоэффективной жидкостной хроматографии количественного определения различных производных гамма-аминомасляной кислоты
Автор: Смирнова Л.А., Тюренков И.Н., Перфилова В.Н., Рябуха А.Ф., Сучков Е.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология токсикология
Статья в выпуске: 3 (39), 2013 года.
Бесплатный доступ
Проведен анализ существующих хроматографических методов анализа производных ГАМК в биологических пробах. Определены особенности подбора условий экстракции и хроматографирования, обеспечивающие оптимальные валидационные характеристики.
Вэжх, количественное определение, производные гамк
Короткий адрес: https://sciup.org/142149050
IDR: 142149050 | УДК: 651:547.466.3
Текст научной статьи Особенности разработки методов высокоэффективной жидкостной хроматографии количественного определения различных производных гамма-аминомасляной кислоты
ЦЕЛЬ РАБОТЫ
Найти и внедрить в практику новые биологически активные соединения – является одной из актуальных проблем современной медицины. Одним из важнейших этапов при работе по данной проблематике является проведение фармакокинетических исследований. Полученные при этом данные позволят объективно оценить и рекомендовать оптимальный путь введения, определить диапазон эффективных концентраций, обусловливающих желаемый эффект соединения, выявить фармакокинетические детерминанты действия препарата [1–3].
Для проведения фармакокинетических исследований необходимы адекватные методы количественного определения исследуемых соединений в биологическом материале. Избранный метод должен иметь высокую чувствительность, возможность работы с малыми объемами проб, большую специфичность и избирательность, надежность, воспроизводимость и универсальность. Данным требованиям отвечает метод высокоэффективной жидкостной хроматографии (ВЭЖХ), являющийся одним из основных аналитических методов при проведении фармакокинетических исследований.
МЕТОДИКА ИССЛЕДОВАНИЯ
Количественное определение изучаемых веществ в биологическом материале проводили методом ВЭЖХ на жидкостном хроматографе Shimadzu (Япония) с диодноматричным ультрафиолетовым и флуоресцентным детекторами, колонка SUPELCOSIL LC-18 (5 мкм; 100 мм х 4,6 мм).
Для приготовления мобильной фазы использовали ацетонитрил (УФ210) (Россия) и буферную систему, состоящую из однозамещенного фосфата калия 50 mМоль (Россия). Для увеличения коэффициента емкости фенибута и цитрокарда в элюент вводили 0,12 % ион-парного реагента – натриевой соли гептансульфоновой кислоты [4]. Соотношение водной и органической фазы для фенибута и цитрокарда составило 88 : 12 % v/v, для глутарона 90 : 10 % v/v. Скорость потока элюента – 1 мл/мин. Температура хроматографирования - 30 ° С.
Извлечение изучаемых веществ, а также одновременное осаждение белков производили из цитратной плазмы крыс 10%-м ТХУ в соотношении 1 : 0,5. Образцы встряхивали в течение десяти минут в ультразвуковой ванне для преципитации белков и центрифугировали в течение 15 минут при 3 тыс. об./мин на центрифуге Eppendorf, после чего надосадочную жидкость отбирали и вводили в инжектор с объемом петли 20 мкл.
Статистическую обработку результатов осуществляли при помощи компьютерной программы Microsoft Exel [5].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯИ ИХ ОБСУЖДЕНИЕ
Производные ГАМК фенибут, цитрокард и глутарон обладают достаточно сходными хроматографическими свойствами, поэтому параметры метода ВЭЖХ количественного определения для них будут весьма близки.
Однако в силу большего отличия по структуре для глутарона была разработана методика с флуоресцентной детекцией. А для фенибута и цитрокарда – метод ион-парной хроматографии с ультрафиолетовым детектором.
Идентификацию изучаемых веществ и расчет концентрации проводили по методу абсолютных стандартов. Время удерживания для фенибута и цитрокарда составило 9–11 мин, для глутарона – 5,5–6,5 мин.
Для количественного определения веществ использовали метод абсолютной калибровки. Зависимость площадей пиков от концентрации анализировалась методом регрессионного анализа в диапазоне концентраций от 0,5 до 200 мкг/мл. В результате было установлено, что калибровочные кривые носят линейный характер, с коэффициентом регрессии (R2) равным 0,999 – 1 (рис. 1–3).
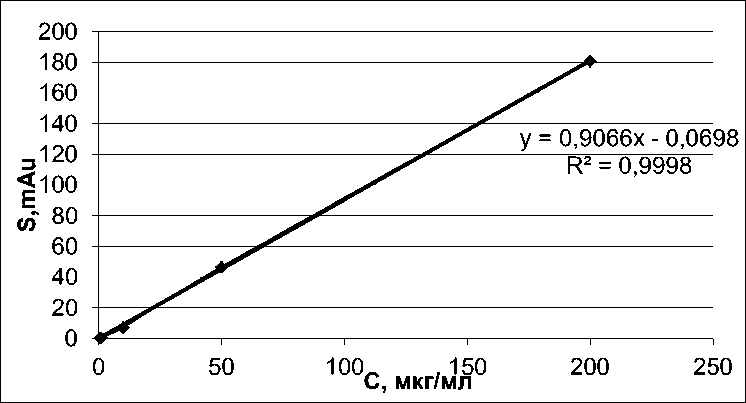
Рис. 1. Зависимость площади под хроматографическим пиком от концентрации фенибута:
* S - площадь под хроматографическим пиком, mAU х мин; * с — концентрация цитрокарда, мкг/мл
у = 0,4434х - 0,0751
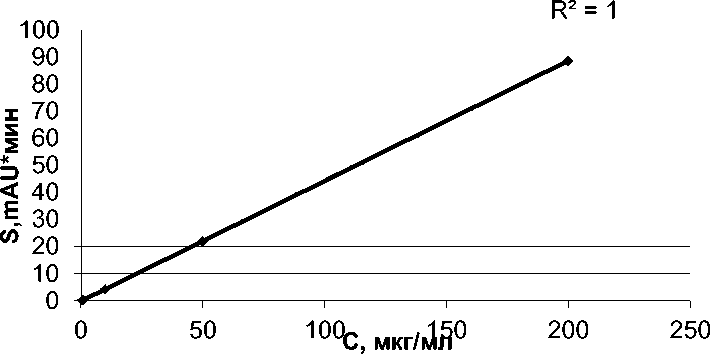
Рис. 2. Зависимость площади под хроматографическим пиком от концентрации цитрокарда:
* S - площадь под хроматографическим пиком, mAU х мин; * с — концентрация цитрокарда, мкг/мл
Далее были определены внутридневные процентные колебания (повторяемость метода), которые не превышали 14 % в изучаемых диапазонах концентраций. Междневные процентные колебания (воспроизводимость метода) для изучаемого соединения не превы- шали в среднем 10 %. Точность 96 %. Чувствительность метода (предел количественного обнаружения) для изучаемого соединения составляет 1 мкг/мл. Предел обнаружения – 200 нг/мл. Средняя ошибка измерения не превышает 10 % (табл.).
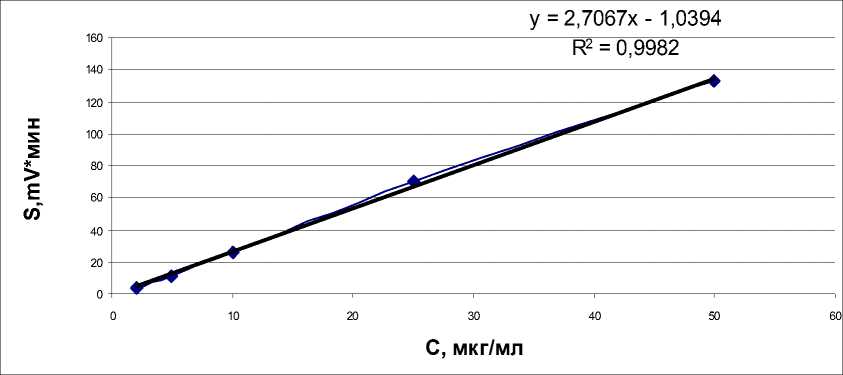
Рис. 3. Зависимость площади под хроматографическим пиком от концентрации глутарона:
* S - площадь под хроматографическим пиком, mAU х мин; * с — концентрация цитрокарда, мкг/мл
Основные аналитические параметры метода ВЭЖХ количественного определения фенибута, цитрокарда и глутарона
|
Параметр |
Фенибут |
Цитрокард |
Глутарон |
|
Внутридневные колебания (повторяемость), % |
15 |
14 |
14 |
|
Междневные колебания (воспроизводимость), % |
10 |
10 |
10 |
|
Точность, % |
94 |
93 |
96 |
|
Чувствительность, мкг/мл |
1 |
1 |
1 |
|
Предел обнаружения, нг/мл |
500 |
500 |
100 |
|
Средняя ошибка измерения, % |
9 |
9 |
8 |
При повторном проведении анализа, после 72 часов хранения стандартных растворов соединения при комнатной температуре, средние абсолютные процентные колебания находились в тех же пределах, показывая стабильность исследуемого вещества. При изучении влияния процессов замораживания и таяния, было обнаружено, что средние абсолютные процентные колебания для VMA-99-82 находились в тех же пределах, что определяет стабильность вещества под влиянием данных факторов.
ЗАКЛЮЧЕНИЕ
Таким образом, для количественного определения изучаемых соединений разработан метод высокоэффективной жидкостной хроматографии на обращеннофазной колонке С18 с флуоресцентным и УФ-детектированием.
Способ извлечения подобран оптимально и практически не влияет на среднюю ошибку измерения хроматографического метода количественного определения.
Разработанный метод количественного определения является высокоселективным и высокочувствительным, что позволяет эффективно использовать его для проведения фармакокинетических исследований различных производных ГАМК и их возможных метаболитов.


