Особенности развития радиационно-индуцированного оксидативного стресса в раковых клетках мутантных по гену ТР53
Автор: Саенко Юрий Владимирович, Шутов Александр Михайлович, Напалкова Светлана Михайловна, Семенова Марина Анатольевна, Цыганова Наталья Александровна, Кузнецова Татьяна Ивановна, Глущенко Евгения Сергеевна, Крючков Евгений Александрович, Белозеров Дмитрий Александрович, Манышкина Наталия Сергеевна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Физика и электроника
Статья в выпуске: 4-4 т.14, 2012 года.
Бесплатный доступ
В настоящей работе предпринята попытка изучить кинетику накопления активных форм кислорода и азота, внутриклеточной концентрации восстановленного глутатиона одновременно с исследованием кинетики повреждения ДНК в раковых клетках миелогенной лейкимии К562, с дефектным геном ТР53, после радиационного облучения. Исследование выполнено с использованием клеточной культуры. Внутриклеточная концентрация активных форм кислорода, азота, восстановленного глутатиона и повреждение ДНК анализировались через 5, 15, 30 минут и через 1, 4, 8, 12, 24, 48 часов после облучения ренгеновским излучением в дозе 4 и 12 Гр. Радиационно-индуцированная генерация АФК в клетках К562 имеет два временных максимума, первый максимум зафиксирован через 30 минут и второй через 24 часа после облучения. Динамика повреждения ДНК состоит из трёх фаз. Первая фаза характеризуется значительным увеличением количества разрывов ДНК и зафиксирована через 5 минут после облучения. Во время второй фазы в период времени 1 – 8 часов происходит постепенное снижение показателей повреждения ДНК и во время третей фазы 12 – 48 часов после облучения повреждение ДНК увеличивается. Повреждение ДНК не связано с процессами клеточной гибели. Динамика повреждения ДНК совпадает с динамикой развития оксидативного стресса. Повреждение ДНК в третьей фазе может также осуществляться оксидом азота, увеличение концентрации которого наблюдается в период времени 8 – 48 часов после облучения. Таким образом, радиационное облучение индуцирует в клетках линии К562, несущих дефектный ген ТР53, генетическую нестабильность и перманентный оксидативный стресс.
Оксидативный стресс, ген тр53, повреждение днк, рентгеновское излучение, глутатион, оксид азота, активные формы кислорода
Короткий адрес: https://sciup.org/148201341
IDR: 148201341 | УДК: 577.34-
Текст научной статьи Особенности развития радиационно-индуцированного оксидативного стресса в раковых клетках мутантных по гену ТР53
Крючков Евгений Александрович, младший научный сотрудник.
Белозеров Дмитрий Александрович, студент.
Манышкина Наталия Сергеевна, студентка.
трансформацию, возникновение геномной нестабильности и клеточную смерть [7]. Возникновение этих эффектов может быть отсрочено во времени и проявляться даже через несколько поколений после момента облучения [8]. Одним из таких отсроченных эффектов является нестабильность генома, которая является причиной возникновений мутаций и злокачественного перерождения [2]. Аналогичная картина наблюдается и у раковых клеток. После радиационного облучения злокачественные клетки могут подвергаться дальнейшим мутациям в результате приобретённой генетической нестабильности и утрачивать радиочувствительность [4]. Считается, что причиной генетической нестабильности может являться оксидативный стресс, возникающий в результате радиационного воздействия [5]. Также продемонстрировано, что генетически нестабильные клетки демонстрируют повышенный уровень внутриклеточных активных форм кислорода [10].
Активные формы кислорода (АФК) возникают в результате радиолиза воды и являются продуктом непосредственного взаимодействия фотонов высокой энергии с водой [6]. К ним относят короткоживущие радикалы - гидроксильный радикал и супероксид анион радикал, а также пероксид водорода. Из трех вышеперечисленных пред- ставителей АФК, только гидроксильный радикал является непосредственным продуктом радиолиза воды. Супероксид анион радикал и пероксиды называют вторичными АФК. Они генерируются в результате протекания цепных радикальных реакций инициируемых гидроксильным радикалом [6]. Важным участником подобного рода реакций являются сулфгидрильные соединения – цистеин и глутатион, с участием которых могут образовываться в процессе воздействия ионизирующего облучения супероксиданионрадикал, пероксиды и активные тиильные радикалы [11]. Одним из последствий радиационного воздействия является образование разрывов цепей ДНК, которые происходят в результате гидролитического разрыва фосфодиэфирной связи после переноса свободного радикала с основания на рибозный остаток [14]. Процессы свободно-радикального повреждения ДНК, несомненно, служат причиной мутаций и генетической нестабильности, но они хорошо описаны только для первых моментов времени после радиационного воздействия, охватывающих период от миллисекунд до минут [14]. Генетическая нестабильность и все связанные с ней неблагоприятные последствия проявляются во втором и последующих клеточных поколениях, когда кажется, что все последствия облучения должны быть исправлены [7]. Поэтому необходимо найти связь между первичным радиационным воздействием на клетку и последующими событиями, приводящими к возникновению генетической нестабильности. Теоретические расчёты продемонстрировали, что количество вторичных радикалов, возникающих после радиационного воздействия, соответствует количеству АФК, генерируемых в процессе нормального метаболизма клетки [15]. Вторичные АФК могут генерироваться в результате ряда внутриклеточных процессов, среди которых процессы дыхания, НАДФ-оксидаза, ксантиноксидаза и ряд других процессов [15]. Образовавшиеся вторичные радикалы способны также вызывать повреждение ДНК и инициировать процессы, приводящие к возникновению нестабильности генома.
В настоящей работе нами предпринята попытка изучить кинетику накопления активных форм кислорода и азота, внутриклеточной концентрации восстановленного глутатиона одновременно с исследованием кинетики повреждения ДНК в культуре клеток миелогенной лейки-мии К562, дефектных по гену ТР53, после радиационного облучения.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
В экспериментах использовали клеточную линию миелогенной лейкемии человека К562.
Клетки культивировали при 37оС, во влажной атмосфере, содержащей 5% СО2. Для культивирования использовали среду RPMI-1649, содержащую L-глутамин, 15% фетальной коровьей сыворотки и 0,04% гентамицина. Клетки облучали рентгеновским излучением, генерируемым терапевтическим акселератором Cliniac 600 при комнатной температуре в дозах 4 и 12 Грэй одноразово. Мощность дозы составляла 0,03 Гр/с при фокусном расстоянии 104 см. Высота водяного столба над клетками составляла 1см. Клетки облучались в 24 луночных планшетах (объём лунки 2,5 мл.). Параметры оксидативного стресса и повреждения ДНК анализировались через 5, 15, 30 минут и через 1, 4, 8, 12, 24, 48 часов.
Внутриклеточную концентрацию активных форм кислорода определяли с использованием 22 ,72 —дихлородигидрофлуоресцеин диацетата (DCFH-DA). Это вещество быстро проникает в цитоплазму и, взаимодействуя с АФК, окисляется до флуоресцирующего дихлорофлуоресцеина [1]. DCFH-DA добавляли в среду с клетками в конечной концентрации 30 мкМ за 30 мин до анализа и держали в СО2-инкубаторе при 37оС в темноте. После инкубации среду удаляли, добавляли равный объём фосфатного буферного раствора рН 7,4 и оставляли на льду на 15 минут в темноте. Интенсивность флуоресценции дихлорофлуоресцеина измеряли с использованием проточного цитометра Becton Dickinson FACS Canto (лазер 488 нм., LP зеркало – 503, BP фильтр – 530/30).
Концентрацию оксида азота (NO) внутри клеток определяли с использованием флуоресцентного красителя 4-Амино-5-метиламино-22 ,72 -дифлуоресцеин диацетата (DAF-FM) [12]. DAF-FM добавляли в среду с клетками в конечной концентрации 5 мкМ за 30 мин. до анализа и держали в СО2-инкубаторе при 37оС. После инкубации среду удаляли, добавляли равный объём фосфатного буферного раствора рН 7,4 и оставляли на льду на 15 минут в темноте. Интенсивность флуоресценции образовавшегося 4-Амино-5-метиламино-дифлуоресцеина измеряли с использованием проточного цитометра Becton Dickinson FACS Canto (лазер 488 нм., LP зеркало – 503, BP фильтр – 530/30).
Внутриклеточную концентрацию восстановленного глутатиона изучали с использованием флуоресцентного красителя монохлоробимана [9]. В инкубационную среду с клетками добавлялся монохлоробимане в конечной концентрации 5 мкМ и оставляли в СО2-инкубаторе при 37оС течение 10 минут. Затем 10 мкл клеточной суспензии переносили на предметное стекло и оценивали величину флуоресценции с использованием флуоресцентного микроскопа при Xex~ 390 нм и Л ~480нм.
Количество клеток с признаками апоптоза и некроза оценивали с использованием проточной цитометрии и набора реагентов для определения апоптоза V-FITC Apoptosis Kit (Invitrogen). Через определённые моменты времени после облучения клетки собирались, отмывались единожды фосфатным буфером (рН=7,4), затем ресус-пензировались в аннексин-V окрашивающем буфере, куда добавлялись аннексин-V-FITC (AnV) и пропидиум иодид (PI), и инкубировались при 370 С в темноте. Аннексин-V положительные и PI отрицательные клетки (AnV+PI-) нами считались как клетки с признаками апоптоза. AnV и PI положительные клетки (AnV+PI+) считались нами как клетки с признаками апоптоза и некроза [3].
Повреждение ДНК оценивали методом щелочного электрофореза клеток в агарозном геле [8]. В качестве характеристики повреждения ДНК использовали параметр – момент хвоста кометы (Тайл момент, ТМ), который рассчитывали как произведение процентного содержания ДНК вне клетки после проведения электрофореза на длину шлейфа ДНК и выражали в условных единицах.
Все эксперименты и определения параметров были выполнены как минимум с трёхкратных повторением. Результаты выражались как среднее значение со стандартным отклонением (М±SD). Результаты обработаны статистичес- ки с использованием критерия t Стьюдента для парных переменных. Различия между группами считали статистически значимыми при р<0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Радиационно-индуцированная генерация АФК (ROS) в клетках К562 имеет два временных максимума.
На рис. 1 представлены данные по внутриклеточной концентрации АФК в клетках К562 после облучения в дозах 4 и 12 Грэй. Концентрация АФК имеет два максимума.
Первый максимум наблюдается через 30 минут после облучения и превосходит концентрацию АФК контрольных клеток в 1,35 и 1,67 раза при облучении клеток дозами 4 и 12 Грей соответственно. При определении концентрации АФК через 4 после облучения, оказалось, что она практически не отличается от таковой в контрольных клетках. Через 8 часов концентрация АФК в клетках, подвергшихся облучению, была в 1,1 и 1,21 раза больше, но статистически незначимо (р>0,05) отличалась от таковой в контрольных клетках. Далее наблюдался рост концентрации АФК. Через 24 часа после облучения отмечался второй максимум внутриклеточной концентрации АФК, который превосходил по своим значениям первый максимум, наблюдавшейся через 30 минут после облу-
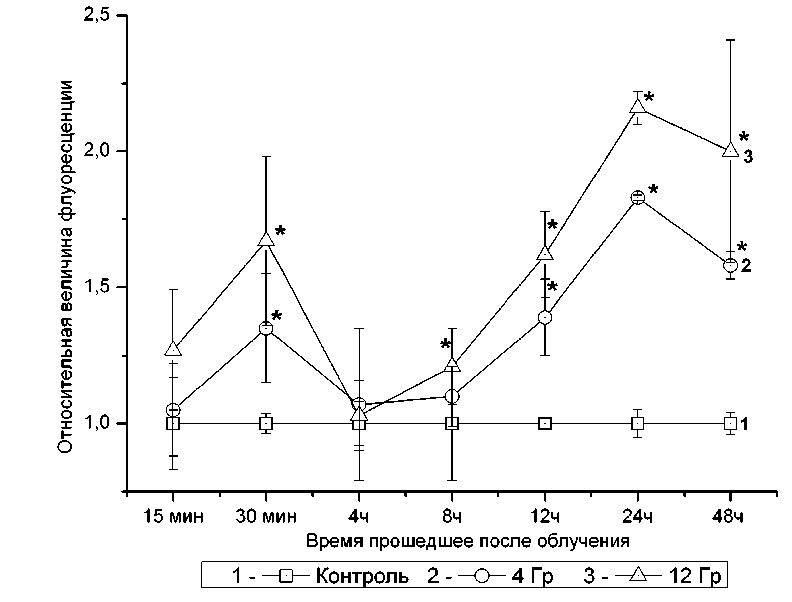
Рис. 1. Динамика изменения активных форм кислорода после облучения клеток линии К562 рентгеновским излучением в дозе 4 и 12 Грэй. Данные представлены как отношение величины флуоресценции DCFH-DA в клетках подвергшихся рентгеновскому облучению к контрольной группе. (* - p<0,05 в сравнении с контрольной группой)
чения. При облучении клеток дозой в 4 Гр концентрация АФК в 1,83 раза превосходила аналогичный параметр в контрольной группе, и в 2,16 раза, если клетки подвергались облучению в дозе 12 Гр. Через 48 часов после облучения, происходило некоторое снижение внутриклеточной концентрации АФК. Дальнейший мониторинг концентрации АФК в культурах клеток, подвергшихся облучению, нами был признан нецелесообразным в связи со старением среды и накоплением большого количества погибших клеток, что препятствовало точному определению концентрации АФК в клеточных культурах старше 48 часов. Таким образом, нами было установлено, что после облучения в дозах 4 и 12 Гр в клетках К562 активный формы кислорода генерируются циклически с двумя максимумами через 30 минут и 24 часа после облучения.
Концентрация оксида азота в клетках К562 растёт после облучения.
На рис. 2 представлена динамика изменения внутриклеточной концентрации оксида азота после облучения клеток К562 дозами 4 и 12 Грэй. Как видно из рисунка о прошествии 8 часов после облучения нами не было выявлено отличий во внутриклеточной концентрации азота между контрольными и облученными клетками. Через 12 часов концентрация оксида азота в облучен- ных клетках дозами 4 и 12 Гр. была в 1,25 и 1,32 раза соответственно выше, чем в контроле. В дальнейшем мы наблюдали постоянный рост внутриклеточной концентрации оксида азота. Так через 24 часа концентрация NO в случае облучения дозой 4 Гр. была в 1,35 раза выше, а в случае облучения дозой 12 Гр. - в 1,64 раза выше, чем в контроле. Спустя 48 часов после облучения концентрация оксида азота в клеточной культуре К562 подвергшейся облучению 12 Гр продолжала увеличиваться, превышая таковую в контрольной группе в 2,04 раза. В случае облучения дозой 4 Гр указанный параметр стабилизировался на уровне, наблюдаемом в 24 часа. На основании этих данных мы сделали вывод, что радиационное излучение стимулирует отсроченную продукцию оксида азота в клетках линии К562.
Уровень восстановленного глутатиона после облучения возрастает, а затем снижается.
Внутриклеточная концентрация восстановленного глутатиона (GSH) служит одной из характеристик тяжести внутриклеточного оксида-тивного стресса, считается, что при снижении концентрации GSH развивается оксидативный стресс [11]. В наших экспериментах концентрация GSH в облученных клетках была выше практически на всём протяжении эксперимента. На рисунке 3 видно, что при первом определении GSH через 1 час после начала эксперимента его
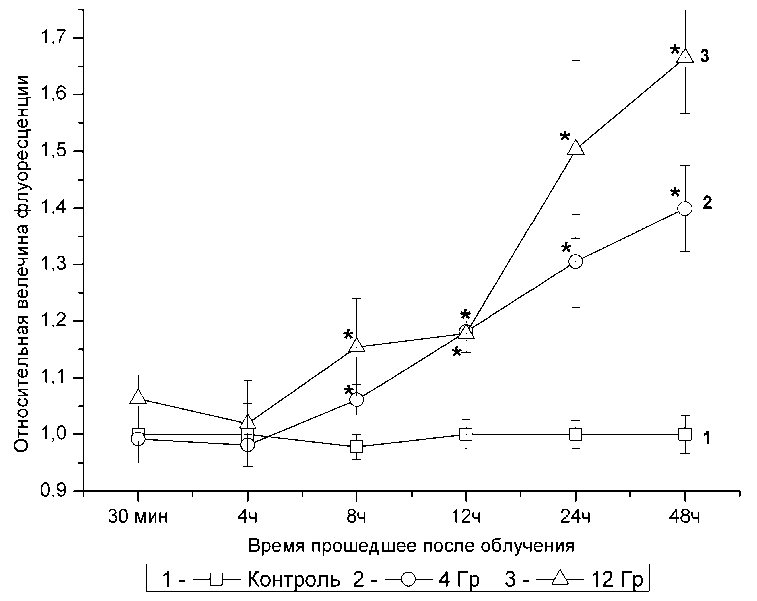
Рис. 2. Динамика изменения оксида азота после облучения клеток линии К562 рентгеновским излучением в дозе 4 и 12 Грэй. Данные представлены как отношение величины флуоресценции DAF-FM в клетках подвергшихся рентгеновскому облучению к аналогичному показателю клеток контрольной группы (*- p<0,05 в сравнении с контрольной группой)
концентрация в облученных клетках в дозе 4Гр на 50% выше, чем в контрольной группе клеток. Максимальное различие в концентрации GSH между контрольными и облученными клетками мы наблюдали через 12 часов после начала эксперимента. В группе клеток облученных в дозе 12 Гр через 12 часов концентрация GSH была в 2,2 раза выше, чем в контрольной группе, а в группе 4 Гр - в 1,7 раза (рис. 3). В дальнейшем мы наблюдали снижение внутриклеточной концентрации GSH. К 48 часу с момента начала эксперимента концентрация GSH в группе 12 Гр была всего в 1,3 раза выше, чем в контрольной группе. В группе клеток облучённых в дозе 4 Гр концентрация GSH была ниже, чем в контрольной группе. Исходя из наших наблюдений, мы сделали заключение, что облучение клеточной линии К562 рентгеновским излучением в дозах 4 и 12 Гр вызывает увеличение концентрации восстановленного глутатиона с максимумом в районе 12 часов с дальнейшим снижением до уровней GSH контрольных клеток и ниже.
Радиационно-индуцированное повреждение ДНК имеет волнообразную динамику.
О степени повреждения ДНК мы судили по образованию одноцепочечных разрывов, определяемых методом электрофореза клеток в агарозном геле. На рис. 4 представлен график, отражающий динамику образования одно- и двухцепо- чечных разрывов цепей ДНК через различные промежутки времени, прошедших после облучения. Через 5 – 30 минут после облучения нами отмечено зависимое от дозы увеличение количества разрывов ДНК. При облучении в дозе 4 Гр на 5 минуте нами зафиксированное более чем 7 кратное увеличение ТМ, а при облучении в дозе 12 Гр ТМ увеличивался в сравнении с контрольной группой в 15,1 раза. В дальнейшем тайл-момент облученных клеток снижался и в группе клеток подвергшихся облучению в дозе 4 Гр уже к первому часу составлял 4,58 против 2,47 усл. ед. в контрольной группе. Аналогичная динамика наблюдалась и в группе клеток, облученных в дозе 12 Гр. Через 8 часов после облучения ТМ в контрольной группе был 2,5±0,78 усл. ед., в группах 4 Гр и 12 Гр тайл-момент составлял 4,42±0,1 и 5,28±0,01 усл. ед. соответственно. По прошествии 12 часов с начала эксперимента и далее вплоть до окончания мониторинга изменений повреждения ДНК мы наблюдали второй этап роста значений ТМ в облученных клетках. Через 24 часа после начало эксперимента ТМ составлял 4,17±1,89, 15,12±2,82 и 25,52±7,89 усл. ед. в группах контроль, 4 и 12 Гр соответственно. Через 48 часов ТМ у облученных клеток незначительно снижался. Таким образом, из графика 4 видна сложная динамика изменения количества разрывов ДНК, которую можно разделить на 3 этапа: 1 этап заключается в росте повреждения
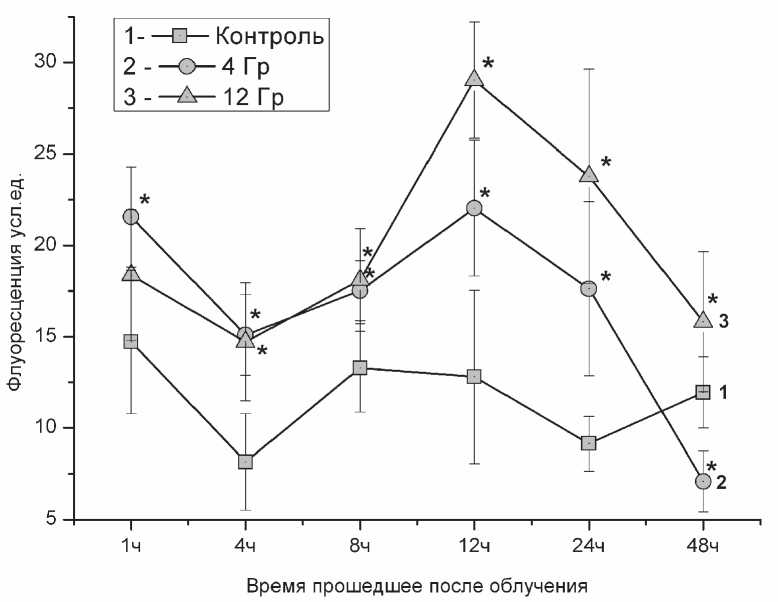
Рис. 3. Изменение внутриклеточной концентрации восстановленного глутатиона после облучения клеток линии К562 рентгеновским излучением в дозе 4 и 12 Грэй. Внутриклеточная флуоресценция монохлоробимана оценивалась через условные единицы ( * - p<0,05 в сравнении с контрольной группой)
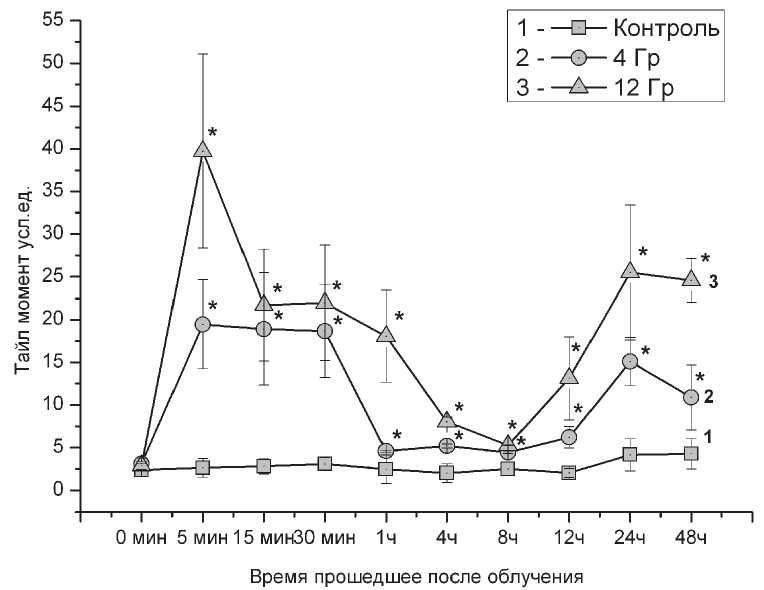
Рис. 4. Динамика изменения повреждения ДНК после облучения клеток линии К562 рентгеновским излучением в дозе 4 и 12 Грэй выраженная через тайл-момент ( * - р<0,05 в сравнении с контрольной группой)
ДНК в первый час после облучения; 2 этап характеризуется снижением тайл-момента до значений характерных для контрольной группы; и 3 этап характеризуется повышением тайл-момен-та облученных клеток.
Количество клеток с признаками апоптоза и некроза остается постоянным в период времени 12-48 часов после облучения.
Радиационное облучение клеток в дозе 4 и 12 Гр вызывало увеличение процента клеток в культуре с признаками апоптоза и некроза (рис. 5). Через 12 часов после облучение количество клеток с признаками апоптоза (AnV+PI-) в группе клеток облученных в дозе 4 Гр составляло 6,2±1,31 % против 3,1±0,67 в контрольной группе и в дальнейшем немного увеличилось и в 48 часов состав-
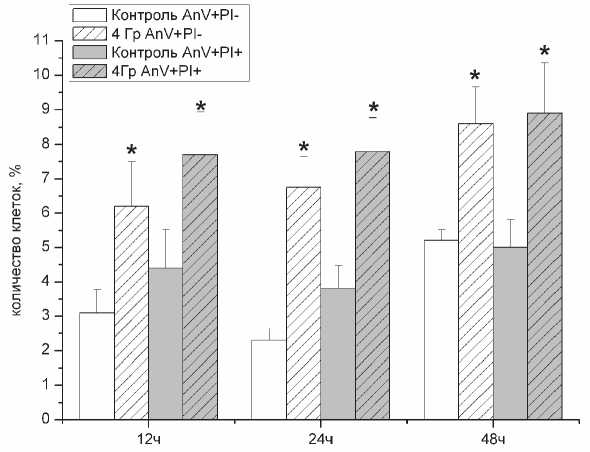
Время прошедшее после облучения
Рис. 5. Динамика изменения количества клеток К562 с признаками апоптоза и некроза после облучения в дозе 4 Гр (AnV+PI- - аннексин-V положительные клетки и пропидиум иодид
отрицательные; AnV+PI+ - аннексин-V и пропидиум иодид положительные клетки ( * - p<0,05 в сравнении с контрольной группой)
ляло 8,6±1,07 % от общего числа клеток. Количество клеток с признаками как апоптоза, так и некроза (AnV+PI+) через 12 часов составляло 7,7 ± 1,23 после облучения в дозе 4 Гр, а через 48 часов 8,9±1,46. Данная серия экспериментов позволила нам сделать вывод, что количество клеток с признаками апоптоза и некроза остается практически постоянным в период времени 12-48 часов.
ОБСУЖДЕНИЕ
Наиболее чувствительной биомолекулой к ионизирующему излучению является ДНК. Облучение клеток радиацией ведёт к разнообразным повреждения ДНК, к которым относятся: повреждение азотистых оснований, одно-и двуцепочечные разрывы цепей ДНК, образование ковалентных сшивок между азотистыми основаниями ДНК и между ДНК и белками [8]. Наиболее мутагенными и неблагоприятными являются одно – и двуцепочечные разрывы ДНК [14], которые в данной работе оценивались по значения тайл-момента. Возникновение разрывов цепей ДНК инициирует появление генетической нестабильности клеток [4, 8] Генетически нестабильные клоны раковых клеток характеризуются большей агрессивностью и проявляют большую устойчивость в отношении радио- и лекарственной терапии [2]. Образование радиационно-индуцированных разрывов цепей ДНК является многостадийным процессом. На первом этапе происходит взаимодействие гидроксильного радикала с азотистым основанием, далее, через образование пероксиль-ного радикала происходит перенос радикала с основания на рибозный остаток цепи ДНК, что и служит причиной разрыва цепи ДНК [8, 14]. Нами в данной работе продемонстрировано, что радиационное облучение клеточной культуры линии К562 вызывает увеличение ТМ на двух временных участках (рис. 4). Причиной появления второй фазы роста ТМ может быть увеличение числа некротических и апоптотических клеток [3]. Для оценки вклада апоптоза и некроза в обнаруженную нами фрагментацию ДНК в период времени 12-48 часов мы определили количество клеток с признаками апоптоза и некроза в это период. Из рисунка 5 видно, что разница в количестве клеток с признаками апоптоза и некроза возрастает между 12 и 24 часами и составляет в среднем 1-2% к 48 часу (рис. 5), тогда как разница в ТМ между 12 и 24 часом составляет 200-300% (рис.4). Основываясь на сопоставлении данных этих экспериментах, мы пришли к выводу, что увеличение ТМ в период времени 8-48 часов после облучения нельзя связывать только с гибелью клеток в результате апоптоза.
Наиболее вероятным механизмом повреждения ДНК после рентгеновского облучения кле- ток линии К562, с нашей точки зрения, является возникновение оксидативного стресса. Из результатов наших экспериментов видно, что внутриклеточная концентрация АФК после однократного облучения дозами 4 и 12 Гр имеет в обоих случаях два максимума (рис. 1). Увеличение внутриклеточной концентрации АФК, сразу после облучения, может быть связано с радиационно-индуцированными свободно-радикальными реакциями в воде и биологических молекулах [10]. DCFH-DA может реагировать с пероксиль-ными радикалами азотистых оснований ДНК[1], или с супероксид анион радикалом. Наибольшее количество супероксид анион радикала сразу после облучения образуется в результате не ферментативной реакции GSH с пероксильными радикалами [14]. Второй период роста концентрации АФК, начинающийся через 12 часов после облучения, нельзя напрямую связывать с радиационно-индуцированным образованием свободных радикалов и АФК, но, естественно, что причиной второго пика является повреждение клеточных систем радиацией. Источником АФК при нормальных условиях могут быть различные клеточные процессы, к которым можно отнести побочные продукты деятельности дыхательной цепи, НАДФН оксидазы, ксантин оксидазы и оксигеназы арахидоновой кислоты [11]. Однако, по мнению многих исследователей, более значительным источником АФК, чем радиационно-индуцированные цепные радикальные реакции, является митохондриальная дыхательная цепь [5]. Количество АФК образующееся в процессе нормального клеточного метаболизма сопоставимо или даже превосходит количество радиаци-онно-генерируемых АФК [11, 15].
Изменение концентрации оксида азота отличалось от динамики изменения АФК на первых этапах после облучения. Оксид азота, химически реагируя с АФК, генерирует пероксинитрит, который обладает большой способностью к модификации белков, липидов и ДНК. Наибольшее повреждение пероксинитрит наносит митохондриальной и ядерной ДНК [11]. Увеличение внутриклеточной концентрации NO одновременно с ростом концентрации АФК в период времени 1248 часов и одновременный рост ТМ в этот же период времени позволяет сделать вывод о возможности участия NO, а точнее пероксинитрита, в процессах радиационно-индуцированного повреждения ДНК в 3 фазе.
Динамика изменения внутриклеточной концентрации GSH демонстрирует противоположную тенденцию в сравнении с динамикой изменения внутриклеточной концентрации АФК и ТМ (рис. 1, 3, 4). Снижение концентрации GSH в период 12-48 часов можно объяснить его исполь- зование в реакциях утилизации пероксида водорода, катализируемых глутатион пероксидазой [2, 14, 15]. Другая причина снижения концентрации GSH связана с его использованием в реакциях коньюгации с электрофильными группами биомолекул, катализируемых глутатион-S-трансферазой, которые возникают в результате взаимодействия с АФК и свободными радикалами. Увеличение концентрации GSH в период времени до 12 часов после облучения, вероятно, связано с радиационно-индуцированной задержкой клеточного цикла G2/M фазе, поскольку именно в этой фазе наблюдается наиболее высокая концентрация восстановленного глутатиона [11]. Снижение концентрации GSH с увеличением концентрации АФК и NO свидетельствует о возникновении оксидативного стресса, который принимает непосредственное участие в механизмах повреждения ДНК и возможно, механизмах возникновения феномена нестабильности генома.
Таким образом, можно сделать заключение, что радиационно-индуцированная генерация АФК в клетках К562 имеет два временных максимума и совпадает с динамикой повреждение ДНК, которая также имеет два максимума и состоит из трёх фаз. Первая фаза характеризуется значительным увеличением количества разрывов ДНК и начинается сразу после облучения. Во время второй фазы происходит постепенное снижение тайл-момента. Во время третей фазы тайл-момент опять увеличивается. Снижение концентрации GSH, увеличение концентрации АФК и тайл-момента в период времени 12-48 часов после облучения свидетельствует о возникновении внутриклеточного оксидативного стресса, который может служить причиной повреждения ДНК. Повреждение ДНК в период времени 12-48 часов после облучения может также осуществляться оксидом азота, увеличение концентрации которого наблюдается в период времени 8 – 48 часов радиационного воздействия. Радиационное облучение индуцирует в клетках линии К562 с дефектным геном ТР53 генетическую нестабильность и перманентный оксидативный стресс.
Работа выполнена при поддержке федеральной целевой программы «Научные и научно-педагогические кадры инновационной России» грант №14.B37.21.0558.
Список литературы Особенности развития радиационно-индуцированного оксидативного стресса в раковых клетках мутантных по гену ТР53
- Characterization of 2',7'-dichlorofluorescin fluorescence in dissociated mammalian brain neurons: estimation on intracellular content of hydrogen peroxide/Y. Oyama, A. Hayashi, T. Ueha, K. Maekawa//Brain Res. 1994. Vol. 635. № 1-2. P. 113-117.
- Coleman W.B., Tsongalis G.J. The role of genomic instability in human carcinogenesis/W.B. Coleman, G.J. Tsongalis//1999. Anticancer Res. Vol. 19. P. 4645-64.
- Early detection of staurosporine-induced apoptosis by comet and annexin V assays/T. Godard, E. Deslandes, P. Lebailly, C. Vigreux, F. Sichel, J.M. Poul, Gauduchon P//Histochem. Cell Biol. 1999. Vol. 112. P. 155-161.
- Radiation-induced genomic instability and its implications for radiation carcinogenesis/L. Huang, A.R. Snyder, W.F. Morgan//Oncogene. 2003. Vol. 22. № 37. P. 5848-5854.
- Mitochondrial dysfunction, persistently elevated levels of reactive oxygen species and radiation-induced genomic instability: a review/J. Kim, G.K. Chandrasekaran, W.F. Morgan//Mutagenesis. 2006. Vol. 21. № 6. P. 361-367.
- Le Caer S. Water Radiolysis: Influence of Oxide Surfaces on H2 Production under Ionizing Radiation/S. Le Caer//Water. 2011. Vol. 3. P. 235-253.
- Wright E.G. Radiation-induced genomic instability and bystander effects: inter-related nontargeted effects of exposure to ionizing radiation/S.A. Lorimore, P.J. Coates, E.G. Wright//Oncogene. 2003. Vol.22. P. 7058-7069.
- Morgan W.F. Non-targeted and delayed effects of exposure to ionizing radiation: I. Radiation-induced genomic instability and bystander effects in vitro//Radiat. Res. 2003. Vol. 159. P. 567-580.
- Flow cytometric monitoring of glutathione content and anthracycline retention in tumor cells/S. Nair, S.V. Singh, A. Krishan//Cytometry. 1991. Vol. 12, № 4. P. 336-42.
- Persistent Oxidative Stress in Chromosomally Unstable Cells/C.L. Limoli, E. Giedzinski, W.F. Morgan, S.G. Swarts, D.D. Jones, W. Hyun//Cancer Research. 2003. Vol. 63. № 12. P. 3107-3111.
- Schafer F.Q., Buettner G.R. Redox environment of the cell as viewed through the redox state of the glutathione disulfide/glutathione//Free Radical Biology and Medicine. 2001. Vol. 30. №11. P. 1191-1212.
- Sheng J.Z., Wang D., Braun A.P. DAF-FM (4-Amino-5-methylamino-2,7-difluorofluorescein) diacetate detects impairment of agonist-stimulated nitric oxide synthesis by elevated glucose in human vascular endothelial cells: reversal by vitamin C and L-sepiapterin//J. Pharmacol. Exp. Ther. 2005. Vol. 315. P. 931-940.
- Starkov A.A., Fiskum G. Regulation of brain mitochondrial H2O2 production by membrane potential and NAD(P)H redox state//J. Neurochem. 2003. Vol. 86. P. 1101-1107.
- Wardman P. The importance of radiation chemistry to radiation and freeradical biology//The British Journal of Radiology. 2009. Vol. 82. P. 89-104.
- Mitochondrial ROS-induced ROS release: an update and review/D.B. Zorov, M. Juhaszova, S.J. Sollott//Biochim. Biophys. Acta. 2006. Vol. 1757. P. 509-517.


