Особенности реагирования антиоксидантных ферментов в органах крыс на нарушение циркадианных ритмов на разных этапах онтогенеза
Автор: Хижкин Евгений Александрович, Илюха Виктор Александрович, Лотош Татьяна Анатольевна, Виноградова Ирина Анатольевна, Анисимов Владимир Николаевич
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 4 (109), 2010 года.
Бесплатный доступ
Постоянное освещение, антиоксидантные ферменты, продолжительность жизни
Короткий адрес: https://sciup.org/14749719
IDR: 14749719
Текст статьи Особенности реагирования антиоксидантных ферментов в органах крыс на нарушение циркадианных ритмов на разных этапах онтогенеза
Чередование дня и ночи является важнейшим регулятором временнόй организации физиологических функций организма. Реакция организма на изменение световых режимов обусловлена работой эпифиза (шишковидного тела) [2], который является железой, запускающей процесс старения. Показано, что пересадка эпифиза старых мышей молодым является причиной ускоренного старения последних [12], а его удаление может приводить как к преждевременному старению, так и к продлению жизни. Было установлено, что эпифизэктомия в 14-месячном возрасте, в отличие от более ранних или более поздних возрастов, приводит к увеличению продолжительности жизни млекопитающих [13].
Наряду с удалением железы для изменения деятельности эпифиза используют постоянное освещение. Согласно гипотезе «циркадианной деструкции», воздействие света в ночные часы, как и удлинение светового дня, нарушают эндогенный суточный ритм организма, что приводит к изменению адаптационных реакций, отражается на состоянии здоровья и продолжительности жизни животных [7], [15].
Свободнорадикальная теория старения предполагает, что свободные радикалы, к которым относятся и некоторые активные формы кислорода (АФК), вызывают повреждение макромолекул, что в конечном счете приводит к старению [10]. Обнаружено, что продолжительность жизни животных отрицательно коррелирует с уровнем основного метаболизма и аутоокисляемостью тканей [1], [14]. Одним из способов защиты клеток от действия АФК является повышение (восстановление) ак-
тивности антиоксидантных ферментов (АОФ), в том числе и в результате их синтеза de novo [9].
Целью нашего исследования было изучение влияния постоянного освещения, воздействие которого начиналось в возрасте 1 и 14 месяцев, на активность АОФ – супероксиддисмутазы (СОД) и каталазы, а также продолжительность жизни крыс.
МЕТОДИКА ИССЛЕДОВАНИЯ
Опыт проводили на самцах и самках крыс, содержавшихся на стандартном рационе вивария со свободным доступом к воде. Были сформированы 3 группы животных: первая содержалась в стандартных условиях освещения в течение всей жизни (12 часов свет / 12 часов темнота; LD) и являлась контрольной, вторая и третья – при постоянном освещении с возраста 1 месяца (LL-1) и 14 месяцев (LL-14) соответственно. Группы LD и LL-1 состояли из 5 животных (соотношение самцов и самок 2:3), в группе LL-14 было 6 крыс (3:3).
У крыс первых двух групп (LD и LL-1) образцы тканей печени, почек, сердца, легких, селезенки и скелетной мышцы отбирали после декапитации в 6, 12, 18 и 24 месяца, у животных третьей группы (LL-14) – в 15, 18, 24 и 30 месяцев. Определение активности ферментов проводили спектрофотометрически: СОД по модифицированной адренохромной методике [11], каталазы – по количеству разложенной перекиси водорода [8]. Оценивали различные показатели, характеризующие продолжительность жизни в каждой из групп: среднюю продолжительность жизни (СПЖ), СПЖ последних 10 % крыс и максимальную продолжительность жизни (МПЖ) животных. Полученные данные обрабатывали общепринятыми методами вариационной статистики. Сравнение показателей у крыс одного возраста проводили попарно (LD – LL-1, LD – LL-14 и LL-1 – LL-14) с применением непараметрического критерия Вилкоксона – Манна – Уитни [5]. Работа выполнена с соблюдением международных принципов Хельсинкской декларации о гуманном отношении к животным, принципов гуманности, изложенных в директиве Европейского сообщества (86/609/ЕС), «Правил проведения работ с использованием экспериментальных животных», «Биоэтических правил проведения исследований на человеке и животных».
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Ранее нами было показано, что у крыс, которые с месячного возраста содержались в условиях постоянного освещения, активность АОФ возрастала до определенного уровня, а затем постепенно или резко, в зависимости от органа, снижалась – происходило «старение» ферментативного компонента антиоксидантной системы [3], [4]. Особенно отчетливо эти изменения проявлялись в сердце, почках и скелетной мышечной ткани.
В настоящем исследовании установлено, что с возрастом происходит в разной степени выражен- ное рассогласование в работе ферментов антиоксидантной системы у крыс первых двух групп. В печени и почках отмечено снижение активности СОД к 12 месяцам с последующим увеличением к 18-месячному возрасту, тогда как активность каталазы, наоборот, повышалась у 12-месячных крыс и снижалась к 18 месяцам. Активность СОД в этих органах у 12-месячных крыс имела минимальное значение, а каталазы – максимальное (рис. 1, 2). В отличие от этого, у крыс, содержавшихся при постоянном освещении с 14 месяцев, отмечены синхронные изменения активности ферментов – при увеличении активности СОД увеличивалась и активность каталазы. Активность СОД и каталазы печени и почек у этой группы животных по сравнению с крысами первых двух групп повышалась к 24-месячному возрасту и затем снижалась к 30 месяцам (рис. 1, 2).
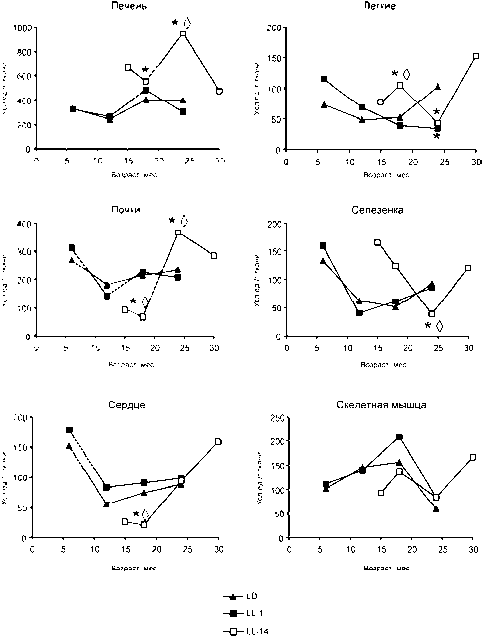
Рис. 1. Возрастные изменения активности СОД в органах крыс, содержавшихся в различных режимах освещения: LD – стандартное освещение, LL-1 – постоянное освещение с месячного возраста, LL-14 – постоянное освещение с 14 меся-цев; * – различия достоверны по сравнению с животными, содержавшимися при LD, ◊ – различия достоверны по сравнению с животными, содержавшимися при LL-1
В сердечной мышце крыс, содержавшихся в условиях стандартного и постоянного освещения с месячного возраста, активность СОД снижалась уже к 12-месячному возрасту и сохранялась на одном уровне в течение дальнейшей жизни. У крыс, находившихся в группе LL-14, активность этого фермента, начиная с 18 месяцев,
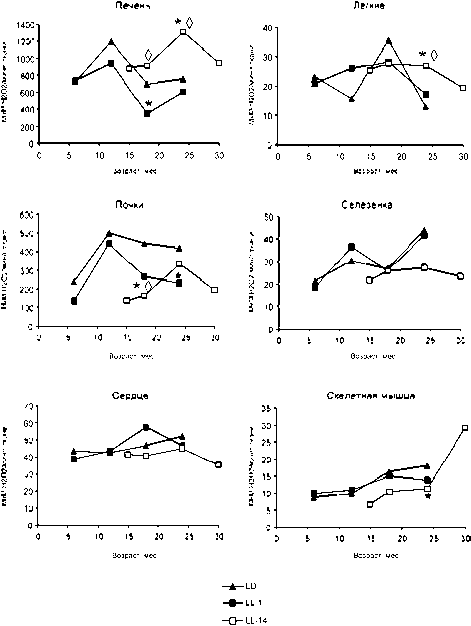
Рис. 2. Возрастные изменения активности каталазы в органах крыс, содержавшихся в различных режимах освещения: Условные обозначения, как на рис. 1
резко увеличивалась, и среднее ее значение к 30 месяцам более чем в 7 раз превышало таковое у 15-месячных животных (рис. 1). Активность каталазы в сердце крыс группы LL-1 несколько увеличивалась к 18 месяцам, тогда как активность этого фермента у крыс группы LL-14 повышалась к 24 месяцам (рис. 2).
У крыс, находившихся с месячного возраста при постоянном освещении, снижение активности СОД в селезенке происходило уже к 12 месяцам, а в легких – к 18 месяцам. Изменение активности этого фермента в легких и селезенке у животных, с 14 месяцев находившихся при постоянном освещении, имело V-образный характер с минимумом в 24 месяца (рис. 1). Активность каталазы в легких у 30-месячных крыс, подвергавшихся воздействию постоянного освещения с 14 месяцев, находилась на уровне 24-месячных животных, с месячного возраста содержавшихся при постоянном освещении. Отмечено, что сезонные изменения активности каталазы (повышение в весенний период и снижение осенью) в селезенке, характерные для крыс в группах LD и LL-1, исчезают при содержании крыс в условиях постоянного освещения с 14 месяцев (рис. 2).
Активность СОД в скелетной мышце крыс, содержавшихся в стандартных световых условиях и при постоянном освещении с месячного возраста, постепенно увеличивалась до 18 месяцев, а затем резко снижалась к 24-месячному возрасту (рис. 1).
В скелетных мышцах крыс в группе LL-14 были отмечены сезонные колебания активности СОД с повышением в 18 и 30 месяцев. Активность каталазы в разных группах практически не различалась, но у крыс третьей группы отмечалось усиление активности в 30-месячном возрасте (рис. 2).
Полученные данные по активности ферментов хорошо согласуются с показателями продолжительности жизни экспериментальных животных. Установлено, что выживаемость как самцов, так и самок крыс, находившихся в группе LL-1, была значительно ниже (на графиках кривые их выживаемости смещены влево), чем у крыс в группах LD и LL-14 (рис. 3). Кроме того, указанные животные характеризовались более низкой средней (самки – на 22,1 %, самцы – на 3 %) и максимальной продолжительностью жизни (самки – на 18 %, самцы – на 4 %) по сравнению с крысами, находившимися при стандартном освещении (см. таблицу).
Кривые выживаемости самцов и самок в группе LL-14 сходны с таковыми у крыс в группе LD (рис. 3). СПЖ самок, с 14 месяцев находившихся при постоянном освещении, на 4 % ниже, а МПЖ на месяц больше, чем у самок крыс при стандартном освещении. У самцов в группе LL-14 показатели продолжительности жизни были выше по сравнению с животными, находившимися в стандартных световых условиях. Показатели продолжительности жизни как самцов, так и самок в группе LL-14 превышают таковые у крыс, содержавшихся при постоянном освещении с месячного возраста (см. таблицу).
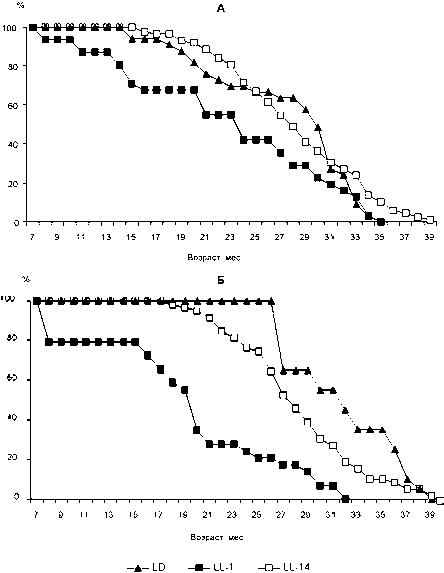
Рис. 3. Выживаемость самцов (А) и самок (Б) крыс, содержавшихся в различных режимах освещения. Условные обозначения, как на рис. 1
Влияние различных режимов освещения на продолжительность жизни самцов и самок крыс
|
Показатели |
Световой режим |
|||
|
Стандартное освещение (LD) |
Постоянное освещение (LL-1) |
Постоянное освещение (LL-14) |
||
|
3 и |
Количество крыс |
57 |
50 |
88 |
|
СПЖ, сут. |
766 ± 25,3 |
744 ± 28,0 |
818 ± 18,0 |
|
|
МПЖ, сут. |
1045 |
1005 |
1198 |
|
|
СПЖ последних 10 % крыс, сут. |
994 ± 9,2 |
1002 ± 1,8 |
1087 ± 8,3* |
|
|
S 2 сЗ и |
Количество крыс |
40 |
54 |
59 |
|
СПЖ, сут. |
844 ± 33,6 |
658 ± 22,8* |
811 ± 20,0 |
|
|
МПЖ, сут. |
1167 |
956 |
1198 |
|
|
СПЖ последних 10 % крыс, сут. |
1129 ± 18,9 |
921 ± 19,7 |
1113 ± 24,9 |
|
Примечание. * – различия достоверны по сравнению с животными в группе LD (p < 0,01).
ОБСУЖДЕНИЕ
Таким образом, снижение активности АОФ, свидетельствующее о «старении» системы в органах крыс, с 14 месяцев содержавшихся в условиях постоянного освещения, происходило позже (в 24 месяца), чем у животных, которые находились при стандартном и постоянном освещении с месячного возраста. Активность как СОД, так и каталазы в большинстве органов 24месячных крыс группы LL-1 была ниже по сравнению с животными того же возраста группы LL-14. Изменение активности АОФ в период постнатального развития, которое наблюдалось у крыс, содержавшихся при постоянном освещении с 14 месячного возраста, согласуется с увеличением их продолжительности жизни. Полученные результаты позволяют утверждать, что воздействие постоянного освещения может приводить не только к сокращению продолжительности жизни крыс, как это было показано в работе И. А. Виноградовой и коллег [16], но и спо- собствовать увеличению выживаемости животных. Фактором, обусловливающим эти различия, как и в ранее проведенных экспериментах на мышах [13], является срок начала экспериментальных воздействий. Так, при удалении эпифиза на разных этапах постнатального онтогенеза (3, 5, 7, 9, 14 и 18 месяцев) отмечалось либо сокращение, либо удлинение продолжительности жизни животных [13]. Эпифизэктомия в 14месячном возрасте приводила к значительному увеличению выживаемости мышей и поддержанию их гормонального и метаболического статуса на уровне 5-месячных животных. Авторы считают, что именно в этом возрасте эпифиз запускает «программу» старения организма. Воздействие постоянного освещения с 14 месяцев у крыс и эпифизэктомия в этом возрасте у мышей [13] оказывают сходное влияние на продолжительность жизни животных. Нами установлено, что у самок крыс, находившихся в группе LL-14, СПЖ, МПЖ и СПЖ последних 10 % животных и МПЖ самцов этой группы достоверно выше, чем у крыс, содержавшихся при стандартном и постоянном освещении с возраста 1 месяца. СПЖ и МПЖ крыс, содержавшихся при постоянном освещении с месячного возраста, были значительно ниже по сравнению с животными других групп.
Проведенное исследование является еще одним подтверждением свободнорадикальной теории старения, выдвинутой Д. Харманом [10] и Н. М. Эмануэлем [6] более полувека назад. Воздействие подавляющего функциональную активность эпифиза постоянного освещения с 14месячного возраста способно приводить к более позднему «старению» ферментативного компонента антиоксидантной системы крыс, что, возможно, является одной из причин продления жизни животных, а также подтверждением предположения Уолтера Пиерпаоли о ключевой роли эпифиза в запуске «программы» старения организма [13].
Работа выполнена при финансовой поддержке РФФИ (грант № 07-04-00546) и Гранта Президента РФ НШ–3731.2010.4.
Список литературы Особенности реагирования антиоксидантных ферментов в органах крыс на нарушение циркадианных ритмов на разных этапах онтогенеза
- Алтухов Ю. П. Гетерозиготность генома, интенсивность метаболизма и продолжительность жизни//Доклады АН. 1999. Т. 369. № 5. С. 704-707.
- Анисимов В. Н. Молекулярные и физиологические механизмы старения: В 2 т. 2-е изд., перераб. и доп. СПб.: Наука, 2008. Т. 1. 481 с.
- Виноградова И. А., Илюха В. А., Федорова А. С., Хижкин Е. А., Унжаков А. Р., Юнаш В. Д. Возрастные изменения физической работоспособности и некоторых биохимических показателей мышц крыс под влиянием световых режимов и препаратов эпифиза//Успехи геронтологии. 2007. Т. 20. № 1. С. 66-73.
- Ильина Т. Н., Виноградова И. А., Илюха В. А., Хижкин Е. А., Анисимов В. Н. Хавинсон В. Х. Влияние геропротекторов на возрастные изменения антиоксидантной системы печени крыс при различных световых режимах//Успехи геронтологии. 2008. Т. 21. № 3. С. 386-393. 5.
- Коросов А. В., Горбач В. В. Компьютерная обработка биологических данных: Метод. пособие. Петрозаводск: Изд-во ПетрГУ, 2007. 76 с.
- Эмануэль Н. М. Некоторые молекулярные механизмы и перспективы профилактики старения//Изв. АН СССР. Сер. биол. 1975. № 4. С. 785-794.
- Anisimov V. N. Light pollution, reproductive function and cancer risk//Neuro Endocrinol. Lett. 2006. Vol. 27. № 1-2. P. 35-52.
- Bears R. F., Sizer I. N. A spectral method for measuring the breakdown of hydrogen peroxide by catalase//J. Biol. Chem. 1952. Vol. 195. № 1. P. 133-140.
- Gutteridge J. M. C. Lipid peroxidation and antioxidants as biomarkers of tissue damage//Clinical Chemistry. 1995. Vol. 41. № 12. P. 1819-1828.
- Harman D. Aging: a theory based on free radical and radiation chemistry//J. Gerontol. 1956. Vol. 11. № 2. P. 298-300.
- Misra H. H., Fridovich I. The role of superoxide anion in the autoxidation of epinephrine and a simple assay for superoxide dismutase//J. Biol. Chem. 1972. Vol. 247. P. 3170-3175.
- Pierpaoli W., Bulian D. The pineal aging and death program. I. Grafting of old pineals in young mice accelerates their aging//J. Anti-Aging. Med. 2001. Vol. 4. № 1. P. 31-37.
- Pierpaoli W., Bulian D. The pineal aging and death program. II. Life prolongation in pre-aging pinealectomized mice//Ann. N. Y. Acad. Sci. 2005. Vol. 10
- Stevens R. G. Circadian disruption and breast cancer: from melatonin to clock genes//Epidemiology. 2005. Vol. 16. № 5. P. 254-258.
- Vinogradova I. A., Anisimov V. N., Bukalev A. V., Semenchenko A. V., Zabezhinski M. A. Circadian disruption induced by light-at-night accelerates aging and promotes tumorigenesis in rat//Aging. 2009. Vol. 1. № 10. P. 855-865.


