Особенности ремоделирования новообразованной сосудистой ткани на базе биодеградируемых сосудистых протезов, имплантированных в сонную артерию овец: морфогенетический анализ
Автор: Е.О. Кривкина, А.В. Миронов, А.Р. Шабаев, Е.А. Великанова, М.Ю. Ханова, А.В. Синицкая, Л.В. Антонова, Л.С. Барбараш
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Экспериментальные исследования
Статья в выпуске: 1 т.38, 2023 года.
Бесплатный доступ
Тканеинженерные сосудистые протезы, разрабатываемые для протезирования артерий малого диаметра, помимо высокой биосовместимости и сохранения своей проходимости после имплантации в сосудистое русло, должны также обладать пригодностью для формирования на своей основе новообразованной ткани, максимально соответствующей нативной сосудистой ткани. Цель: оценка результатов долгосрочной проходимости биодеградируемых сосудистых протезов с атромбогенным лекарственным покрытием на модели крупных лабораторных животных. Материал и методы. Сосудистые протезы диаметром 4 мм были изготовлены методом электроспиннинга из поли- мерной композиции 5% полигидросибутирата/валериата (PHBV) и 10% поликапролактона (PCL) и комплекса проангиогенных факторов (GFmix): сосудистого эндотелиального фактора роста (VEGF), основного фактора роста фибробластов (bFGF) и хемоаттрактантной молекулы (SDF-1α). Для повышения тромборезистентных свойств графтов была проведена атромбогенная модификация поверхности части изготовленных протезов гепарином и илопростом. Модифицированные протезы были имплантированы в сонную артерию овец сроком на 12 мес. Группа с аутоартериальной имплантацией выступила в качестве контроля. Результаты. Спустя 12 мес. имплантации проходимость аутоартериальных трансплантатов составила 87,5%. Проходимость PHBV/PCL/GFmix с гепарином и илопростом по окончании срока имплантации достигла 50%. Биодеградируемый каркас модифицированных протезов практически полностью резорбировался с образованием аневризм на всем протяжении. В модифицированных протезах обнаружено наличие основных элементов новообразованной сосудистой ткани и отмечено отсутствие кальция в стенках протезов. Заключение. Полученные результаты показали, что биодеградируемые сосудистые протезы PHBV/PCL/GFmixHep/Ilo обладают высокой долгосрочной проходимостью, что позволяет считать их пригодными для формирования на их основе новообразованной сосудистой ткани. Однако в связи с наличием факта аневризмообразования требуется проведение дополнительного укрепления каркаса протеза и повышения атромбогенных свойств внутренней поверхности.
Сосудистые протезы, гемосовместимость, электроспиннинг, гепарин, илопрост, проангиогенные факторы
Короткий адрес: https://sciup.org/149141593
IDR: 149141593 | УДК: 616.1-77-089.844:544.777:547.995.17:577.11]-092.9 | DOI: 10.29001/2073-8552-2023-38-1-151-159
Текст научной статьи Особенности ремоделирования новообразованной сосудистой ткани на базе биодеградируемых сосудистых протезов, имплантированных в сонную артерию овец: морфогенетический анализ
В связи с постоянным ростом частоты развития атеросклероза во всем мире возрастает также и количество хирургических вмешательств по восстановлению эффективного кровотока в поврежденных кровеносных сосудах посредством их протезирования или наложения шунтов [1]. Нехватка аутологичных кровеносных сосудов ведет к поиску альтернатив для лечения сердечно-сосудистых заболеваний.
Сосудистая тканевая инженерия является перспективным направлением для создания новых эффективных сосудистых протезов [2–4]. Все подходы сосудистой тканевой инженерии направлены на создание высокопористого сосудистого протеза, обеспечивающего формирование ткани, идентичной нативным кровеносным сосудам человека. Высокая пористость стенки протеза и является важной характеристикой сосудистого протеза, обеспечивающей свободную миграцию клеток из кровотока и окру- жающих тканей, а также поддерживающей прикрепление, пролиферацию и дифференцировку клеток в сосудистом направлении. Проангиогенные факторы и хемоаттрактантные молекулы, инкорпорированные в состав протеза в процессе его изготовления, способны стимулировать формирование полноценной новообразованной сосудистой ткани на месте имплантации сосудистого протеза [5]. Однако протез с такой конструкцией может вызвать тромбоз, поэтому для предотвращения тромбообразования поверхность тканеинженерного высокопористого сосудистого протеза можно модифицировать антитромботиче-скими и антибактериальными препаратами [6].
Модифицирование тканеинженерных протезов проан-гиогенными факторами и дополнительная модификация их поверхности лекарственными препаратами с антиагрегантной и антикоагулянтной активностью позволяет повысить долгосрочную проходимость и качество ремоделирования [5, 6]. Таким образом, альтернативой сосудистого аналога артерий и вен малого диаметра может стать функционально активный биодеградируемый сосудистый протез, обладающий пролонгированной резорбцией и способный замещаться во времени собственными клетками и тканями пациента, формируя на месте каркаса новый сосуд [7–10].
Материал и методы
Изготовление тканеинженерных сосудистых протезов
Тканеинженерные сосудистые каркасы диаметром 4 мм изготавливали методом двухфазного электроспиннинга на аппарате Nanon-01A (MECC, Япония) из композиции полимеров 5% поли(3-гидроксибутирата-ко-3-гидрокси-валерата) (poly (3-hydroxybutyrate-co-3-hydroxyvalerate; PHBV; Sigma-Aldrich, США) и 10% поли (ε-капролактоно-на) (poly-ε-caprolactone; PCL; Sigma-Aldrich, США) в хлороформе, с включением в состав биологически активных молекул (GFmix), а именно: фактор роста эндотелия сосудов (VEGF; Sigma-Aldrich, США) включенный в 1/3 внутренней стенки протеза, основной фактор роста фибробластов (bFGF; Sigma-Aldrich, США) и хемоаттрактантная молекула (SDF-1α; Sigma-Aldrich, США) – во внешние 2/3 стенки протеза.
Модификация поверхности сосудистых протезов антикоагулянтами и антиагрегантами
Для увеличения тромборезистентности поверхности изготовленных сосудистых протезов была проведена дополнительная поверхностная антитромботическия модификация по собственной оригинальной методике [11]. В качестве антитромботических лекарственных средств использовались антиагрегант илопрост (Ilo) и антикоагулянт нефракционированный гепарин (Hep).
В итоге были получены опытные образцы биодеградируемых сосудистых протезов PHBV/PCL/GFmixHep/Ilo.
Имплантация сосудистых протезов
Изготовленные сосудистые протезы PHBV/PCL/ GFmixHep/Ilo длиной 40 мм диаметром 4 мм были имплантированы в сонную артерию восьми овец эдильбаевской породы по методике «конец в конец» по схеме: 1 животное – 1 протез. Срок имплантации – 12 мес.
Для оценки проходимости имплантированных трансплантантов было проведено ультразвуковое исследование с функцией допплера на аппарате M7 Premium (Mindray, Китай): 1 и 5 сут, 1, 3, 6, 9 и 12 мес. после имплантации – для проходимых сосудистых протезов; 1 и 5 сут – для тромбированных протезов.
Послеоперационное медикаментозное ведение: ан-тибиотикотерапия (аксетин (цефуроксим) 1,5 г – в/м 2 р/сут + эноксапарин натрия подкожно 4000 антиХа МЕ/0,4 мл в течение 5 дней. При доказанной проходимости биодеградируемых протезов: клопидогрел 75 мг перорально 1 р/сут + гепарин натрия 5000 ЕД подкожно 2 р/сут) – в течение 1 мес.
Гистологическое исследование
Эксплантированные образцы сосудистых протезов были окрашены на гематоксилин-эозин и по Ван-Гизону. Новообразованную ткань, сформированную на основе сосудистых протезов, окрашенных на гематоксилин-эозин и по Ван-Гизону, оценивали в сравнении с эксплан-тированными контратеральными интактными сонными артериями.
Эксплантированные образцы фиксировали в 10% за-буференном формалине в течение суток, после для удаления излишков фиксирующего раствора промывали в проточной воде, затем обезвоживали в 6 порциях IsoPrep (BioVitrum, Россия). Пропитывали образцы парафином (3 порции) при 56 °C в течение 60 мин в каждой порции. Пропитанные образцы заливали в тугоплавкий парафин ГИСТОМИКС (БиоВитрум, Россия). Из полученных образцов изготавливали срезы толщиной 8 мкм с помощью микротома HM 325 (Thermo Scientific, США). Изготовленные образцы подсушивали в термостате в течение ночи при 37 °C. Затем образцы депарафинизировали в 3 порциях о-ксилоле в течение 1–2 мин в каждой и дегидратировали в 3 порциях 96% спирта по 1–2 мин. Далее депарафинированные срезы окрашивали в соответствии с протоколом исследования. Образцы исследовали с помощью световой и флуоресцентной микроскопии на микроскопе AXIO Imager A1 (Carl Zeiss, Германия) с увеличением объектива ×50, ×100 и ×200.
Иммунофлуоресцентное исследование
Эксплантированные участки сосудистых протезов и контралатеральных интактных сонных артерий овец замораживали при температуре –120 °C. Замороженные образцы фиксировали в криосреде Tissue-Tek (Sakura, Япония) и изготавливали срезы толщиной 8 мкм на криостате CryoStar NX50 (Thermo Scientific, США). Затем проводили непрямое флуоресцентное окрашивание изготовленных срезов на CD31, vWF (von Willebrand factor), α-actin, collagen I, III, IV типа (Abcam, Англия). Ядра клеток контрастировали DAPI (Sigma, США). Контрольные образцы готовили аналогично опытным, но вместо первичных антител использовали 1% BSA. Готовые стекла заключали в ProLong (Life Technologies, США) под покровное стекло. Изготовленные препараты анализировали с помощью лазерного сканирующего микроскопа LSM 700 (Zeiss, Германия).
Анализ уровня мРНК
Для выделения РНК были отобраны образцы сосудистых протезов и интактных сонных артерий, экспланти-рованных из экспериментальных животных. Пробопод-готовку проводили по ранее описанной методике [12]. Выделение общей РНК осуществляли при помощи коммерческого набора RNeasy Plus Universal Mini Kit (Qiagen, Германия) в соответствии с протоколом производителя. Качество и количество выделенной РНК оценивали на приборе Qubit 4 Fluorometer (Invitrogen, США). Оцен- ку экспрессии генов (IL1B, IL6, VEGFА, CXCL8, CXCR4, NR2F2, SNAI2, ICAM1, YAP1, KDR, FGF2, MMP2) проводили методом кПЦР с обратной транскрипцией. В качестве референсных использовали гены ACTB, GAPDH, B2M. Уровень генов интереса рассчитывали по методу ΔCt и 2-ΔΔСt, значения выражали в условных единицах (у.е.).
Результаты и обсуждение
Результаты ультразвукового исследования с функцией допплера
По результатам ультразвукового исследования с функцией допплера проходимость сосудистых протезов PHBV/PCL/GFmixHep/Ilo через 1 сут после имплантации в сонную артерию овец составила 62,5% (5 из 8) (рис. 1). По окончании срока имплантации (12 мес.) проходимыми оставались 50,0% имплантированных протезов (4 из 8). Однако во всех проходимых протезах уже через 1,5 мес. имплантации обнаружена тенденция к увеличению диаметра с четкими признаками формирования аневризматического расширения по всей длине протеза через 6 мес. наблюдения. Вследствие аневризмообра-зования диаметр протезов спустя 12 мес. имплантации увеличился до 2,4 см (см. рис. 1).
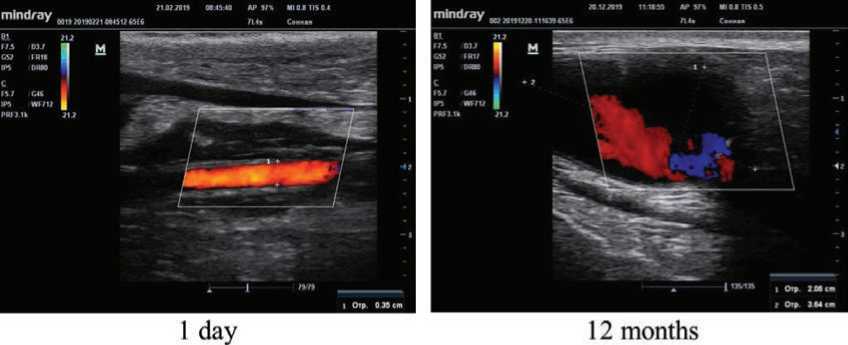
Рис. 1. Результаты ультразвукового исследования с функцией допплера проходимости протезов PHBV/PCL/GFmixHep/Ilo
Fig. 1. The results of an ultrasound examination with the Doppler function of the patency of the PHBV/PCL/GFmixHep/Ilo prostheses
Результаты гистологическогои иммунофлуоресцентного исследований
Результаты гистологического и иммунофлуоресцент-ного исследований эксплантированных образцов протезов и контралатеральных сонных артерий выявили, что биодеградируемый каркас PHBV/PCL/GFmixHep/Ilo практически полностью резорбировался с образованием аневризм на всем протяжении протеза (рис. 2). На его месте выявлено формирование трехслойного новообразованного сосуда, схожего по своему строению с нативной сонной артерией овцы. На внутренней стороне неоинтимы новообразованного сосуда визуализировался слой эндо-телиоподобных клеток (см. рис. 2).
Медиа представлена клетками, по морфологии схожими с гладкомышечными. За гладкомышечным слоем следовал слой соединительной ткани и адвентиция, тол- ща которой содержала в себе фибробластоподобные и гигантские многоядерные клетки, большое количество новообразованных сосудов, лимфатические фоликулы, а также небольшое количество периваскулярной жировой ткани. Однако новообразованная сосудистая ткань отличалась от интактной сонной артерии овцы отсутствием эластических волокон и четкой вытянутости цитоплазмы гладкомышечных клеток. Также в эндотелиальных клетках новообразованного эндотелиального монослоя на внутренней поверхности PHBV/PCL/GFmix с лекарственным покрытием выявлены признаки эндотелиально-мезенхимального перехода (одновременная экспрессия эндотелиальными клетками CD31, vWF и α-актина) (см. рис. 2).
Базальная мембрана содержала коллаген I и IV типа. Коллаген III типа также обнаружен в стенке ремоделиро-ванного протеза (рис. 3).
Hematoxyl in-eosin CD31. a-actin
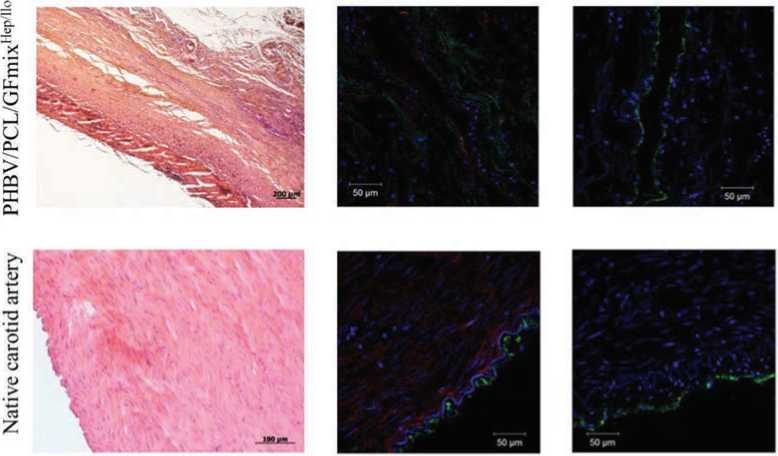
Рис. 2. Сравнение результатов гистологического и иммунофлуоресцентного исследований протезов PHBV/PCL/GFmixHep/Ilo и интактной сонной артерии овцы. Окраска гематоксилином и эозином, ×50. Окраска на CD31 (зеленое свечение), α-actin (красное свечение), vWF (зеленое свечение), ×200
Fig. 2. Comparison of the results of histological and immunoflu rescence studies of PHBV/PCL/GFmixHep/Ilo prostheses and intact sheep carotid artery. Hematoxylin-eosin staining, ×50. Staining for CD31 (green glow), α-actin (red glow) and vWF (green glow), ×200
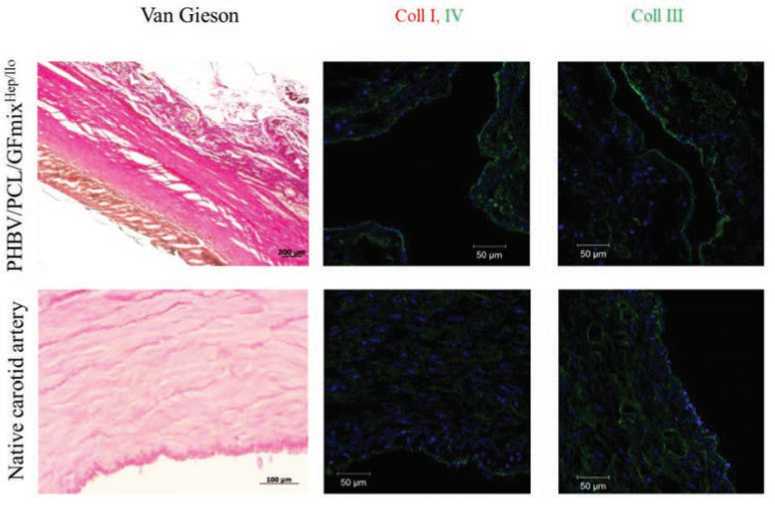
Рис. 3. Сравнение результатов гистологического и иммунофлуоресцентного исследований протезов PHBV/PCL/GFmixHep/Ilo и нативной артерии овцы. Окраска по Ван-Гизону, ×50. Окраска на Collagen I, III, IV (зеленое свечение), ×200
Fig. 3. Comparison of the results of histological and immunoflu rescent studies of prostheses and native sheep arteries. Coloring according to Van-Gieson, ×50. Coloring for Collagen I, III, IV (green glow), ×200
Результаты оценки профиля экспрессии генов
Сравнительный анализ профиля генной экспрессии в гомогентах ткани, полученных из ремоделированного сосудистого протеза, характеризовался обилием транскриптов, связанных с воспалением (IL1B, IL6 и CXCL8), ремоделированием экстрацеллюлярного матрикса (MMP2) и эндотелиально-мезенхимальным переходом (SNAI2), чего не наблюдали в контралатеральной сонной артерии овцы. Эндотелиальный лизат был обогащен воспалительными транскриптами (IL1B, IL6 и ICAM1) и признаками репрограммирования эндотелия (венозный транскрипт NR2F2 и маркер эндотелиально-мезенхимального перехода SNAI2) (табл. 1, 2). В связи с этим можно предположить, что молекулярный ландшафт сосудистой ткани, формирующейся на месте биодеградируе- мого сосудистого протеза, может отличаться от соответствующих кровеносных сосудов даже при регенерации артерий в долгосрочной перспективе (12 мес. после имплантации).
Таблица 1. Транскрипционный профиль регенерированных на месте сосудистых протезов PHBV/PCL/GFmixHep/Ilo и интактных контралатеральных сонных артерий через 12 мес. после имплантации: уровень экспрессии в условных единицах m ± SD
Table 1. Transcriptional profile of in situ regenerated vascular prostheses PHBV/PCL/GFmixHep/Ilo and intact contralateral carotid arteries 12 months after implantation: expression level in conventional m ± SD units
|
Ген Gene |
Интактная сонная артерия (гомогенат) Intact carotid artery (homogenate) |
Графт (гомогенат) Graft (homogenate) |
Интактная сонная артерия (смыв) Intact carotid artery (flush) |
Графт (смыв) Graft (flush) |
|
IL1B |
0,000186 ± 0,000055 |
0,000594 ± 0,000713 |
0,000579 ± 0,000073 |
0,005530 ± 0,001007 |
|
IL6 |
0,001678 ± 0,000702 |
0,001533 ± 0,000900 |
0,001058 ± 0,000170 |
0,003976 ± 0,000091 |
|
CXCL8 |
0,000689 ± 0,000332 |
0,001904 ± 0,000379 |
0,001928 ± 0,002761 |
0,004351 ± 0,000618 |
|
IL10 |
- |
- |
- |
- |
|
IL12A |
- |
- |
- |
- |
|
IL12B |
- |
- |
- |
- |
|
TNF |
- |
- |
- |
- |
|
IFNG |
- |
- |
- |
- |
|
CXCR4 |
0,017592 ± 0,005557 |
0,025238 ± 0,018372 |
0,062432 ± 0,002754 |
0,047241 ± 0,012453 |
|
NOS3 |
- |
- |
- |
- |
|
VEGFA |
0,023848 ± 0,009059 |
0,019827 ± 0,011576 |
0,006904 ± 0,003760 |
0,006484 ± 0,001813 |
|
FGF2 |
0,070019 ± 0,016891 |
0,013054 ± 0,003294 |
0,015252 ± 0,006000 |
0,012227 ± 0,003214 |
|
TGFB |
- |
- |
- |
- |
|
ICAM1 |
0,020364 ± 0,018289 |
0,006392 ± 0,001281 |
0,005075 ± 0,001121 |
0,004993 ± 0,001278 |
|
MMP2 |
0,084705 ± 0,034208 |
1,134578 ± 1,216459 |
0,006230 ± 0,004468 |
0,051311 ± 0,002237 |
|
KDR |
0,057268 ± 0,052768 |
0,017468 ± 0,005699 |
0,002294 ± 0,000830 |
- |
|
YAP1 |
0,173951 ± 0,063811 |
0,032772 ± 0,032010 |
0,012259 ± 0,003241 |
0,007270 ± 0,001915 |
|
NR2F2 |
0,012703 ± 0,010607 |
0,007789 ± 0,002543 |
0,000684 ± 0,001160 |
0,000958 ± 0,000214 |
|
SNAI2 |
0,156352 ± 0,072169 |
0,176597 ± 0,172171 |
0,001378 ± 0,000674 |
0,014902 ± 0,003125 |
Таблица 2. Транскрипционный профиль регенерированных на месте сосудистых протезов PHBV/PCL/GFmixHep/Ilo и интактных контралатеральных сонных артерий через 12 мес. после имплантации: относительный уровень экспрессии (кратность изменения относительно контроля)
Table 2. Transcriptional profile of in situ regenerated PHBV/PCL/GFmixHep/Ilo vascular prostheses and intact contralateral carotid arteries 12 months after implantation: relative expression level (fold change relative to control)
|
Ген Gene |
Интактная сонная артерия (гомогенат) Intact carotid artery (homogenate) |
Графт (гомогенат) Graft (homogenate) |
Интактная сонная артерия (смыв) Intact carotid artery (flush) |
Графт (смыв) Graft (flush) |
|
IL1B |
1 |
3,19 |
1 |
9,55 |
|
IL6 |
1 |
0,91 |
1 |
3,76 |
|
CXCL8 |
1 |
2,76 |
1 |
2,26 |
|
IL10 |
- |
- |
- |
- |
|
IL12A |
- |
- |
- |
- |
|
IL12B |
- |
- |
- |
- |
|
TNF |
- |
- |
- |
- |
|
IFNG |
- |
- |
- |
- |
|
CXCR 4 |
1 |
1,43 |
1 |
0,76 |
|
NOS3 |
- |
- |
- |
- |
|
VEGFA |
1 |
0,83 |
1 |
0,94 |
|
FGF2 |
1 |
0,19 |
1 |
0,80 |
|
TGFB |
- |
- |
- |
- |
|
ICAM1 |
1 |
0,31 |
1 |
0,98 |
|
MMP2 |
1 |
13,39 |
1 |
8,24 |
|
KDR |
1 |
0,31 |
1 |
- |
|
YAP1 |
1 |
0,19 |
1 |
0,59 |
|
NR2F2 |
1 |
0,61 |
1 |
1,40 |
|
SNAI2 |
1 |
1,13 |
1 |
10,81 |
Обсуждение
Несмотря на активные усилия по разработке биодеградируемого сосудистого протеза малого диаметра, обладающего биосовместимостью, прочностью, способностью к адаптивному росту и устойчивостью к развитию кальцификации, текущие достижения в этой области ограничены экспериментальными прототипами, демонстрирующими в лучшем случае 50% первичную проходимость в долгосрочном периоде (например, через 1 год после имплантации) [13, 14].
Одним из популярных подходов создания тканеинженерных сосудистых протезов является выращивание нового здорового сосуда на базе функционально активного каркаса, способного задавать привлекаемым клеткам вектор развития в сторону формирования новообразованной сосудистой ткани. При этом каркас протеза в идеале может полностью рассасываться во времени. При этом для эффективной биофункционализации сосудистых протезов очень важно понимать синергизм взаимодействия биологически активных компонент, которые вводятся в состав протеза.
В НИИ КПССЗ был разработан и протестирован в условиях in vitro и в экспериментах in vivo на мелких лабораторных животных сосудистый протез диаметром 1,5 мм, изготовленный из биодеградируемых полимеров полигидроксибутирата/валерата (PHBV) и поликапролактона (PCL) и содержащий в своем составе проан-гиогенные факторы: VEGF, bFG и SDGF-1a, послойно инкорпорированных в стенку протеза в процессе электроспиннинга. VEGF был призван активировать и поддерживать миграцию, пролиферацию, выживание и дифференцировку эндотелиальных клеток, увеличивать продукцию оксида азота и усиливать сосудистую проницаемость. bFGF ответственен за миграцию, пролиферацию и выживание эндотелиальных и гладкомышечных клеток, обеспечение созревания кровеносных сосудов. SDF-1a является хемоаттрактантом, поэтому способен усиливать миграцию мезенхимальных стволовых клеток костного мозга, которые могут дифференцироваться в гладкомышечном направлении внутри сосудистой стенки. Проходимость разработанных протезов спустя 12 мес. имплантации в аорту крысы близилась к 100%. Заселение клетками пористой стенки биодеградируемого протеза после его имплантации в сосудистое русло происходило благодаря естественным процессам ремоделирования имплантата с формированием трехслойной новообразованной сосудистой ткани, схожей со строением стенки нативного сосуда. Было доказано образование устойчивого эндотелиального монослоя, что является критичным моментом для обеспечения долгосрочной эффективности протезов после их имплантации в сосудистое русло [15].
Данные обнадеживающие результаты сподвигли на проведение преклинических испытаний разработанных сосудистых протезов на модели крупных лабораторных животных. В качестве модели выбраны овцы, которые обладают схожей с человеком физиологией сердечно-сосудистой системы, особенно механизмов гемостаза. Считается, что овцы пригодны для «моделирования наихудшего случая» вследствие повышенной склонности их сосудов к тромбозу и кальцификации, что позволяет провести максимально строгое тестирование сосудистых протезов [16]. Плюс на модели, приближенной к человеку, гораздо эффективнее выявлять весь спектр возможных рисков несостоятельности разрабатываемого изделия; в нашем случае как минимум потому, что в сосудистое русло овцы можно вшить гораздо более длинный протез, который не сможет так же быстро эндотелизироваться, как на модели крыс. В итоге на двух животных моделях получены настолько разные и неожиданные результаты, что в дальнейшем пришлось значимо менять технологию изготовления протеза.
Так, в пилотных исследованиях на овцах в 100% случаев в раннем послеоперационном периоде получен тромбоз биодеградируемых сосудистых протезов PHBV/ PCL/GFmix, не содержащих лекарственного покрытия. Запуск тромбообразования, по-видимому, был спровоцирован пористостью внутренней поверхности протеза [17]. Исходя из этого, нами был разработан подход поверхностного модифицирования протезов антикоагулянтом нефракционированным гепарином и антиагрегантом ило-простом с целью повышения гемосовместимых свойств протезов [11], что повысило проходимость протезов с 0 до 50%.
Также ранее нами было определено, что само оперативное вмешательство на столь агрессивной в плане тромбообразования животной модели способно внести свою лепту в итоговую проходимость оперированного сосуда. С этой целью была выполнена аутоартериальная имплантация с выводом животных из эксперимента через год. Выявлено, что полную проходимость реоперирован-ные сонные артерии сохраняли только в 87,5% случаев [17]. Таким образом, оперативное вмешательство способно дополнительно снижать процент проходимости оперированных сосудов в 12,5% случаев.
Вторая неожиданная находка заключалась в крайне быстрой резорбции полимерного каркаса сосудистого протеза, что привело к аневризмообразованию всех проходимых протезов PHBV/PCL/GFmixHep/Ilo с лекарственным покрытием. Начало формирования аневризм зафиксировано спустя 1,5 мес. имплантации. Апогей аневризмо-образования пришелся на период 6 мес. имплантации с последующей стабильной картиной в последующие 6 мес. наблюдения за имплантированными сосудистыми протезами. В литературе имеются сообщения об ускоренной деградации полимерных каркасов у овец по сравнению с крысами или другими животными моделями [18]. Мы получили аналогичные результаты на модели овцы, хотя в наших собственных предшествующих экспериментах на модели крысы даже спустя 12 мес. имплантации аналогичные протезы сохраняли свою начальную геометрию, а скорость биорезорбции полимеров, полученная нами в экспериментах in vivo , соответствовала литературным данным [5, 19.]
Таким образом, несмотря на то, что биодеградируемый сосудистый протез PHBV/PCL/GFmixHep/Ilo показал высокую биосовместимость и пригодность для замещения новообразованной сосудистой тканью без инициации процессов воспаления и кальцификации, разработанная конструкция требует укрепления внешнего каркаса и дополнительного повышения атромбогенных свойств внутренней поверхности с целью достижения 100% проходимости в долгосрочной перспективе.
Заключение
Результаты проведенного исследования продемонстрировали хорошую пригодность сосудистых протезов PHBV/PCL/GFmixHep/Ilo с лекарственным покрытием для формирования на его основе новообразованной сосудистой ткани, которая оказалась очень схожей по морфологии с протезируемой сонной артерией овцы. Однако в связи с наличием факта аневризмообразования требуется проведение дополнительного укрепления каркаса протеза и повышения атромбогенных свойств внутренней поверхности.
Список литературы Особенности ремоделирования новообразованной сосудистой ткани на базе биодеградируемых сосудистых протезов, имплантированных в сонную артерию овец: морфогенетический анализ
- Husain M.J., Datta B.K., Kostova D., Joseph K.T., Asma S., Richter P. et al. Access to cardiovascular disease and hypertension medicines in developing countries: an analysis of essential medicine lists, price, availability, and aff ordability. J. Am. Heart Assoc. 2020;9(9):e015302. DOI: 10.1161/JAHA.119.015302.
- Naegeli K.M., Kural M.H., Li Y., Wang J., Hugentobler E.A., Niklason L.E. Bioengineering human tissues and the future of vascular replacement. Circ. Res. 2022;131:109−126. DOI: 10.1161/CIRCRESAHA.121.319984.
- Iwaki R., Shoji T., Matsuzaki Y., Ulziibayar A., Shinoka T. Current status of developing tissue engineering vascular technologies. Expert Opin. Biol. Ther. 2022;22:433−440. DOI: 10.1080/14712598.2021.1960976.
- Wei Y., Wang F., Guo Z., Zhao Q. Tissue-engineered vascular grafts and regeneration mechanisms. J. Mol. Cell. Cardiol. 2022;165:40−53. DOI: 10.1016/j.yjmcc.2021.12.010.
- Antonova L.V, Sevostyanova V.V., Mironov A.V., Krivkina E.O., Velikanova E.A., Matveeva V.G. et al. In situ vascular tissue remodeling using biodegradable tubular scaff olds with incorporated growth factors and chemoattractant molecules. Complex Issues of Cardiovascular Diseases. 2018;7(2):25–36. DOI: 10.15825/1995-1191-2020-1-86-96.
- Matsuzaki Y., Ulziibayar A., Shoji T., Shinoka T. Heparin-eluting tissue- engineered bioabsorbable vascular grafts. Appl. Sci. 2021;11:4563. DOI: 10.3390/app11104563.
- Stowell C.E.T., Li X., Matsunaga M.H., Cockreham C.B., Kelly K.M., Cheetham J. et.al. Resorbable vascular grafts show rapid cellularization and degradation in the ovine carotid. J. Tissue Eng. Regen. Med. 2020;14(11):1673–1684. DOI: 10.1002/term.3128.
- L’Heureux N., McAllister T.N., de la Fuente L.M. Tissue-engineered blood vessel for adult arterial revascularization. N. Engl. J. Med. 2007;357(14):1451–1453. DOI: 10.1056/NEJMc071536.
- Matsuzaki Y., Miyamoto S., Miyachi H., Iwaki R., Shoji T., Blum K. et.al. Improvement of a novel small-diameter tissue-engineered arterial graft with heparin conjugation. Ann. Thorac. Surg. 2021;111:1234−1241. DOI: 10.1016/j.athoracsur.2020.06.112.
- Zhu T., Gu H., Ma W., Qilu Z., Du J., Chen S. et al. A fabric reinforced small diameter tubular graft for rabbits’ carotid artery defect. Composites. Part B: Engineering. 2021;225:109274. DOI: 10.1016/j.compositesb.2021.109274.
- Антонова Л.В., Севостьянова В.В., Резвова М.А., Кривкина Е.О., Кудрявцева Ю.А., Барбараш О.Л. и др. Технология изготовления функционально активных биодеградируемых сосудистых протезов малого диаметра с лекарственным покрытием: пат. 2702239. Заявитель и патентообладатель – Федеральное государственное бюджетное научное учреждение «Научно-исследовательский институт комплексных проблем сердечно-сосудистых заболеваний» (НИИ КПССЗ) (RU); № 2019119912; заявл. 25.06.2019; опубл. 07.10.2019, Бюл. № 28. [Antonova L.V., Sevostyanova V.V., Rezvova M.A., Krivkina E.O., Kudryavtseva Yu.A., Barbarash O.L. et al. Manufacturing technology of functionally active biodegradable vascular prostheses of small diameter with drug coating: Pat. 2702239. Applicant and patent holder Federal State Budgetary Scientifi c Institution “Research Institute for Complex Problems of Cardiovascular Diseases” (NII KPSSZ) (RU); No. 2019119912; dec. 06/25/2019; publ. 07.10.2019, Bull. No. 28. (In Russ.)].
- Антонова Л.В., Кривкина Е.О., Ханова М.Ю., Великанова Е.А., Матвеева В.Г., Миронов А.В. и др. Результаты преклинических испытаний биодеградируемых сосудистых протезов малого диаметра на модели овцы. Вестник трансплантологии и искусственных органов. 2022;24(3):80–93. [Antonova L.V., Krivkina E.O., Khanova M.Yu., Velikanova E.A., Matveeva V.G., Mironov А.V. et al. Results of preclinical trials in a sheep model of biodegradable small-diameter vascular grafts. Russian Journal of Transplantology and Artifi cial Organs. 2022;24(3):80–93. (In Russ.)]. DOI: 10.15825/1995-1191-2022-3-80-93.
- Fang S., Ellman D.G., Andersen D.C. Review: Tissue engineering of small-diameter vascular grafts and their in vivo evaluation in large animals and humans. Cells. 2021;10:713. DOI: 10.3390/cells10030713.
- Durán-Rey D., Crisóstomo V., Sánchez-Margallo J.A., Sánchez-Margallo F.M. Systematic review of tissue-engineered vascular grafts. Front. Bioeng. Biotechnol. 2021;9:771400. DOI: 10.3389/fbioe.2021.771400.
- Antonova L., Kutikhin A., Sevostianova V., Velikanova E., Matveeva V., Glushkova T. et al. bFGF and SDF-1α improve in vivo performance of VEGF-incorporating small-diameter vascular grafts. Pharmaceuticals. 2021;14:302. DOI: 10.3390/ph14040302.
- Koch S.E., de Kort B.J., Holshuijsen N., Brouwer H.F.M., van der Valk D.C., Dankers P.Y.W. et al. Animal studies for the evaluation of in situ tissue-engineered vascular grafts – a systematic review, evidence map, and meta-analysis. NPJ Regen. Med. 2022;7:17. DOI: 10.1038/s41536-022-00211-0.
- Antonova L.V., Mironov A.V., Yuzhalin A.E., Krivkina E.O., Shabaev A.R., Rezvova M.A. et al. A brief report on an implantation of small-caliber biodegradable vascular grafts in a carotid artery of the sheep. Pharmaceuticals. 2020;13:101. DOI: 10.3390/ph13050101.
- Fukunishi T., Ong C.S., Yesantharao P., Best C.A., Yi T., Zhang H. et al. Diff erent degradation rates of nanofi ber vascular grafts in small and large animal models. J. Tissue Eng. Regen. Med. 2020;14:203−214. DOI: 10.1002/term.2977.
- Насонова М.В., Шишкова Д.К., Антонова Л.В., Севостьянова В.В., Кудрявцева Ю.А., Барбараш О.Л. и др. Результаты субкутанной имплантации полимерных матриксов на основе поликапролактона и полигидроксибутировалерата, модифицированных ростовыми факторами. Соврем. технол. мед. 2017;2:7–18. [Nasonova M.V., Shishkova D.K., Antonova L.V., Sevostyanova V.V., Kudryavtseva Yu.A., Barbarash O.L. et al. Results of subcutaneous implantation of polymer matrices based on polycaprolactone and polyhydroxybutyrovalerate modifi ed by growth factors. Sovremennye tehnologii v medicine. 2017;2:7–18. (In Russ.)]. DOI: 10.17691/stm2017.9.2.01.


