Особенности ремоделирования сосудистого сплетения IV желудочка головного мозга и мозжечка крыс в зависимости от рациона кормления
Автор: Шувалова М.С., Шидаков Ю.Х.М., Жанузаков Д.З., Балыкин М.В.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Биологические науки
Статья в выпуске: 1, 2024 года.
Бесплатный доступ
Цель оценить особенности ремоделирования сосудистого сплетения IV желудочка и ангиоархитектоники мозжечка крыс, содержащихся на исключительно белковом и жировом рационах кормления.
Крысы, головной мозг, сосудистое сплетение, рацион питания
Короткий адрес: https://sciup.org/14129934
IDR: 14129934 | УДК: 612.824.1+612.827:612.392.83 | DOI: 10.34014/2227-1848-2024-1-172-183
Текст научной статьи Особенности ремоделирования сосудистого сплетения IV желудочка головного мозга и мозжечка крыс в зависимости от рациона кормления
Введение. В последние годы нейробиоло-гические исследования вскрыли ряд схожих физиологических функций сосудистых сплетений головного мозга (ССГМ) и мозжечка. Так, установлено, что ССГМ и клетки Пуркинье (КП) коры мозжечка экспрессируют мор- фоген Sonic hedgehog (Shh), активно участвующий в эмбриональном развитии головного мозга и церебрального сосудистого русла [1, 2]. Shh наряду с другими факторами роста способствует развитию и росту нервных стволовых клеток и кортикальных эксплантов [3].
Сосудистое сплетение IV желудочка головного мозга является производным эпителиальной инвагинации однослойной кровельной пластинки заднего мозга [4]. У взрослого человека и крысы сосудистое сплетение IV желудочка состоит из многоярусной капиллярной сети, расположенной в выростах соединительной ткани, покрытых одним слоем кубического эпителия – ворсинок (рис. 1).
Мозжечок, как и сосудистое сплетение IV желудочка, является производным заднего мозга. В процессе гистогенеза наружный слой мозжечка формируется путем миграции матричных клеток эпендимного слоя нервной трубки по отросткам радиальных глиоцитов. От наружного слоя клетки мигрируют в обратном направлении, по пути дифференцируясь в нейробласты и встречаясь с нейробластами следующей волны миграции из эпендимного слоя. Миграция двух потоков нейробластов по мере созревания приводит к формированию молекулярного, ганглионарного и зернистого слоев коры мозжечка и образованию внутренних межнейрональных связей (рис. 2).
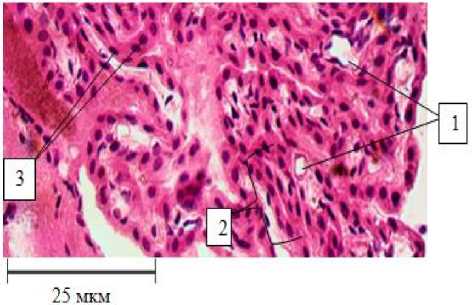
25 мкм
Рис. 1. Сосудистое сплетение IV желудочка головного мозга интактной крысы: 1 – капилляры сосудистого сплетения;
2 – ворсинка;
3 – кубический эпителий ворсин.
Окраска гематоксилин-эозином, ув. 400
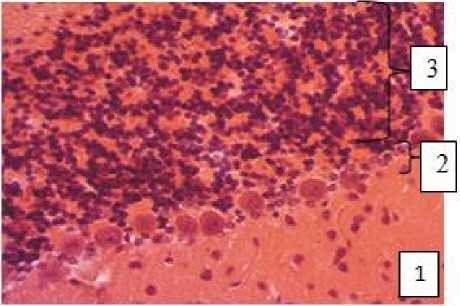
Рис. 2. Мозжечок интактной крысы:
1 – молекулярный слой;
2 – ганглионарный слой;
3 – зернистый слой.
Окраска гематоксилин-зозином, ув. 400
Fig. 1. Choroid plexus of the fourth ventricle of rat cerebrum:
-
1 – choroid plexus capillaries;
-
2 – villus;
-
3 – cuboidal villi epithelium.
Hematoxylin-eosin staining, magnification 400×
Fig. 2. Cerebellum of an intact rat:
-
1 – molecular layer;
-
2 – ganglion layer;
-
3 – granular layer.
Hematoxylin-eosin staining, magnification 400×
Сосудистое сплетение IV желудочка и мозжечок имеют не только общие источники происхождения, но и общее кровоснабжение и иннервацию. Так, сосудистое сплетение IV желудочка состоит из средней, косо-продольной и продольной частей, которые образованы передними и задними ветвями IV желудочка, отходящими от передней и задней нижних мозжечковых артерий. Общность иннервации заключается в том, что сосудистое сплетение IV желудочка, как и кровеносные сосуды мозжечка, иннервируются симпатиче- скими волокнами верхнего шейного и звездчатого узлов симпатического ствола и парасимпатическими – блуждающего нерва. Чувствительная иннервация осуществляется ветвями тройничного нерва [5].
Сосудистое сплетение IV желудочка из крови, притекающей по ветвям артерий мозжечка, вырабатывает цереброспинальную жидкость (ЦСЖ), лишенную видовой и тканевой специфичности и наделенную широким спектром функций. Вопрос о механизмах продукции ЦСЖ интригует ученых в течение сто- летий и по настоящее время окончательно не решен. Однако точно установлен факт переноса Na+, HCO3-, Cl- и H2O из крови в ЦСЖ и K+ в обратном направлении. В этом процессе принимает участие широкий спектр транспортеров, экспрессируемых на базальной (Na+-K+ATF, ряд котранспортеров) и апикальной (Kv- и Kir-каналы) мембранах эпителия сосудистого сплетения [6].
Ранее ЦСЖ рассматривалась как среда, обеспечивающая механическую поддержку мозга, способствующая удалению продуктов метаболизма, доставляющая отдельные нутриенты, а также служащая каналом связи внутри центральной нервной системы (ЦНС). В настоящее время доказано, что факторы-резиденты ЦСЖ влияют на широкий спектр поведения, включая сон и аппетит, а также на циркадные ритмы и связанную с ними двигательную активность животных [7].
Не менее интересны новые данные, полученные относительно физиологии мозжечка. Традиционно мозжечок рассматривался как орган приспособления организма к преодолению основных свойств массы тела – тяжести и инерции [8]. В настоящее время установлена роль мозжечка в регуляции сенсорной обратной связи моторных команд [5–9]. При этом кора мозжечка кодирует сенсомоторную адаптацию во время целенаправленного осознанного двигательного поведения, хотя точная взаимосвязь между симпатической передачей информации и поведением не ясна [5]. Мозжечок координирует точное движение глаз [10–12], а КП принимают участие в активном акте моргания [13, 14]. Мозжечок моделирует рефлекс мочеиспускания и участвует в обработке сенсорной информации мочевого пузыря [15]. В последние годы показана важная роль мозжечка в обучении [16], обработке звуков, т.е. в различении высоты тона и тембра [17]. С нарушением функции мозжечка связаны трудности в обучении у большинства детей с аутизмом [18].
Важнейшей составляющей жизнедеятельности человека и животных является питание. От количества и качества потребляемой пищи зависит физическое, психическое и социальное здоровье индивида. Существует масса разнообразных диетических подходов в профилактике и лечении заболеваний: кетодиета, детокс-диета, кремлевская диета, раздельное питание и т.п. Однако нельзя отрицать, что организм нуждается в ежедневном усвоении полного арсенала биологических соединений: белков, жиров, углеводов, витаминов и минеральных веществ. И выпадение каких-либо биомолекул из рациона питания может привести к определенным структурным и физиологическим изменениям в организме. Так называемое белое вещество головного мозга, или миелин, до 70 % состоит из липидов (фосфолипидов и холестерина), которые передают импульсы изолированно, организуя выполнение точных, координированных движений; 30 % миелиновой оболочки приходится на белки, которые в свою очередь выполняют каркасную функцию, а также участвуют в транспорте глюкозы, витаминов, минералов.
Однообразный рацион питания может отразиться на функционировании структур головного мозга и реологических свойствах крови в системе микроциркуляторного русла мозга.
Цель исследования. Оценить особенности ремоделирования сосудистого сплетения IV желудочка и ангиоархитектоники мозжечка крыс, содержащихся на исключительно белковом и жировом рационах кормления.
Материалы и методы. Работа выполнена на 15 белых беспородных крысах-самцах массой 200–250 г с соблюдением правил лабораторной практики, утвержденных приказом Министерства здравоохранения и социального развития РФ от 23 августа 2010 г. № 708 Н «Об утверждении правил лабораторной практики». Протокол исследований одобрен локальным этическим комитетом при НПО «Профилактическая медицина» МЗ КР (протокол № 1 от 5.10.2020).
Перед экспериментом животных разделили на 3 группы: 1-ю группу (n=5) составили интактные крысы, содержащиеся на стандартном корме; во 2-ю (n=5) вошли животные, потреблявшие исключительно жир (курдючное сало); 3-ю группу (n=5) составили крысы, которых кормили куриным яичным белком. На 15-й и 30-й дни опыта животных выводили из эксперимента путем передозировки хлороформа с последующей декапитацией. Производили забор крови из полостей сердца для последующей оценки уровней холестерина, глюкозы, общего белка и альбумина в сыворотке крови. Определение биохимических показателей производили энзиматическим колориметрическим методом с использованием тест-систем Vital (Россия).
Голову животного, освобожденную от мягких тканей, погружали на 3 дня в 10 % нейтральный раствор формалина. Затем головной мозг с мозжечком изымали из черепа, обезвоживали в спиртах возрастающей концентрации, заливали в парафин. Материалом исследования стали сосудистое сплетение IV желу- дочка головного мозга и мозжечок. Из парафиновых блоков готовили фронтальные серийные срезы толщиной 5–7 мкм, которые окрашивали гематоксилин-эозином и по Ван-Гизону. Готовые гистологические препараты изучали под микроскопом Olympus Bх40 (Япония) с одновременным фотографированием с помощью цветового фотоаппарата Levenhuk C130 NG (КНР) и протоколированием. Полученные результаты обрабатывали в программе SPSS 16.0, достоверность различий определяли по критерию Стьюдента при p<0,05.
Результаты и обсуждение. Содержание холестерина, глюкозы, общего белка и альбумина в сыворотке крови животных всех трех групп представлено в табл. 1.
Таблица 1
Table 1
|
Показатели Parameter |
1-я группа (интактные) Group 1 (intact) |
2-я группа (жировая диета) Group 2 (high-fat diet) |
3-я группа (белковая диета) Group 3 (high-protein diet) |
|
Холестерин, ммоль/л Cholesterol, mmol/l |
1,16±0,04 |
4,78±0,03* |
2,06±0,12 |
|
Глюкоза, г/л Glucose, g/l |
1,67±0,04 |
2,02±0,04* |
1,9±0,13 |
|
Общий белок, г/л Total protein, g/l |
61,16±4,94 |
55,6±0,50 |
103,9±12,9* |
|
Альбумин, г/л Albumin, g/l |
24,9±3,1 |
48,3±13,3* |
36,6±3,17* |
Примечание. * – достоверные отличия между группой контроля и сравниваемыми группами (p<0,05).
Note. * – the difference is significant compared with the control group (p<0.05).
Биохимические показатели сыворотки крови крыс Biochemical parameters of blood serum in rats
Как следует из табл. 1, при исключительно жировой диете, по сравнению с группой контроля, в сыворотке крови крыс уровень общего холестерина увеличился в 4,7 раза, на 20 % возрос уровень глюкозы и в 2 раза повысился уровень альбумина (p<0,05). У животных, находящихся на исключительно белковой диете, уровень общего белка сыворотки крови возрос на 69 %, при этом уровень альбумина увеличился на 46 % (p<0,05).
Механизм поставки жирных кислот в клетку включает в себя три этапа. Первый – это диссоциация жирных кислот с белковым компонентом, второй – транспорт через плазматическую мембрану, третий – связывание их с внутриклеточными белками и/или этерификация [19]. Вполне возможно, что гипе-ральбуминемия у крыс, содержащихся на жировом рационе, детерминирована первым этапом поставки жирных кислот в клетку. Диссоциация жирных кислот с альбуминовым комплексом вполне способна вызвать гиперальбу-минемию. Отсутствие углеводов в рационе кормления крыс сопровождается уменьше- нием запаса гликогена в печени, что вызывает усиленное поступление жирных кислот в нее. Развивается жировая дистрофия печени [20]. На этом фоне снижается глюконеогенез и содержание глюкозы в крови нарастает.
Высокие концентрации в крови холестерина, глюкозы и альбумина отражаются на гемореологии и микрогемоциркуляции в сосудистом сплетении IV желудочка. Независимо от сроков эксперимента отмечается спазм сосудов ворсинок сосудистого сплетения IV желудочка. Капилляры сосудистого сплетения IV желудочка включают в себя фенестрированный эпителий, базальную мембрану, перициты и рядом залегающие гладкомышечные клетки. Данное обстоятельство свидетельствует о возможности регуляции кровотока через сосуды ворсин при помощи воздействия на гладкомышечные клетки [21]. Следовательно, под действием нейрогуморальных факторов сосуды ворсин вполне могут подвергнуться спазму [22]. Однако вопрос о физиологическом значении спазма сосудов ворсин сосудистого сплетения IV желудочка остается открытым независимо от сроков эксперимента.
У животных, содержащихся на исключительно жировой диете, стенка капилляров ворсин на 15-й день опыта характеризуется утолщением базальной мембраны, просветлением цитоплазмы, набуханием ядер, что дополнительно уменьшает просвет сосудов. Содержание капилляров изменчиво: одни сосуды содержат эритроциты, другие – плазму, третьи – пустые.
На 30-й день отмечается нарушение целостности капиллярной стенки и кровоизлияние в просвет IV желудочка головного мозга (рис. 3).
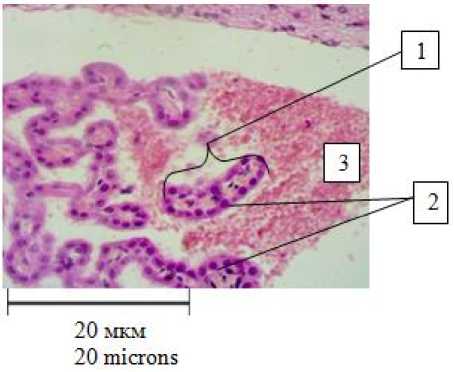
Рис. 3. Кровоизлияние в полость IV желудочка головного мозга крысы, находящейся на исключительно жировой диете (30-е сут): 1 – ворсинка сосудистого сплетения
IV желудочка головного мозга;
2 – эпендимоциты;
3 – участок кровоизлияния.
Окраска гематоксилин-эозином, ув. 400
Fig. 3. Hemorrhage into the fourth ventricle of rat cerebrum, 30-day high-fat diet:
-
1 – choroid plexus villi of the fourth ventricle of cerebrum;
-
2 – ependymocytes;
-
3 – hemorrhage area.
Hematoxylin-eosin staining, magnification 400×
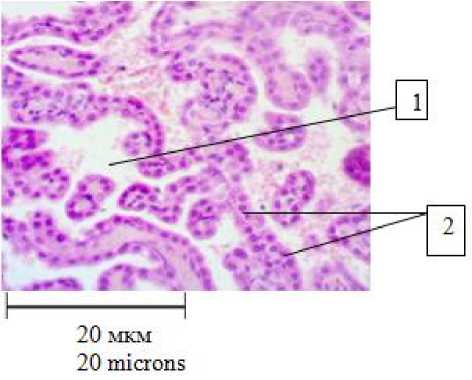
Рис. 4. Сосудистое сплетение IV желудочка крысы с признаками мутного набухания эпендимоцитов (жировая диета, 30-е сут):
1 – полость IV желудочка головного мозга;
2 – эпендимоциты.
Окраска гематоксилин-эозином, ув. 400
Fig. 4. Choroid plexus of the fourth ventricle of rat cerebrum with cloudy ependymocyte swelling (30-day high-fat diet):
-
1 – the fourth ventricle of cerebrum;
-
2 – ependymocytes.
Hematoxylin-eosin staining, magnification 400×
Нежная, рыхлая, состоящая из коллагеновых и в небольшом количестве эластических волокон соединительная ткань у экспериментальных животных уплотняется и грубеет. Это приводит к стиранию границ между соседними ворсинками сосудистого сплетения IV желудочка уже начиная с 15-го дня эксперимента. На 30-й день в отдельных случаях из-за отека соединительнотканная основа сосудистого сплетения IV желудочка становится оптически менее плотной и расстояние между ворсинками выглядит расширенным (рис. 4).
Эпендимоциты – структурно-функциональные единицы ворсинок сосудистого сплетения IV желудочка, выполняющие барьерную (гематоликворную и секреторную) функцию [23]. На 15-е сут кормления жиром эпен-димоциты становятся более плоскими, складчатость на базолатеральной поверхности сглаживается, расстояние между ними и капиллярами сокращается, площадь соприкосновения увеличивается. Надо полагать, что это компенсаторная реакция, направленная на облегчение секреции СМЖ на фоне спазма сосудов. На 30-е сут отмечается мутное набухание эпендимоцитов, что свидетельствует о деструкции крист [22]. В отдельных экземплярах отмечается просветление нуклеоплазмы, кариолема приобретает волнистые очертания. Описанные изменения могут выступать в качестве структурных эквивалентов нарушения секреторной функции эпендимоцитов.
Артерии и вены, проходящие по гребням извилин мозжечка, в большинстве случаев полнокровные, без признаков гемореологических нарушений. Редко встречаются экземпляры, содержащие гравитационно расслоенную на форменные элементы и плазму кровь. Со стороны сосудистой стенки наблюдается вакуолизация медии, повышенная извитость внутренней эластической мембраны. От сосудов в направлении основания извилин спускаются артериальные ветви, а в обратном направлении поднимаются венозные притоки. Между сосудами, расположенными по обеим поверхностям извилин, визуализируются анастомозы. Благодаря последним обеспечиваются окольное кровоснабжение и перемежающаяся активность отдельных звеньев микрогемоциркуляции. При выраженном спазме и закупорке одних отмечается полнокровие других сосудов. Так как корковое вещество располагается на периферии извилин, то кора по сравнению с белым веществом находится в привилегированном положении. Однако, несмотря на это, со стороны клеток разных слоев коры встречаются как приспособительные, так и патологические реакции.
В молекулярном слое концентрация корзинчатых и звездчатых нейронов снижается. Надо полагать, что их тормозящее влияние на клетки Пуркинье усилено. Последние увеличиваются в размерах, часто имеют зернистую протоплазму с признаками хроматолиза в ядрах. В зернистом слое концентрация клеток-зерен и клеток Гольджи не подвергается заметным изменениям. Изложенная картина дополняется большим количеством клубочков мозжечка, наличием светлых промежутков между телами и дендритными клетками Пуркинье. Возможно, активация клубочков мозжечка свидетельствует о повышении возбуждающего действия клеток-зерен в противоположность тормозящему влиянию клеток Гольджи на клетки Пуркинье. В результате этого клетки Пуркинье ожидаемо находятся в состоянии гиперфункции и подвергаются гипертрофии.
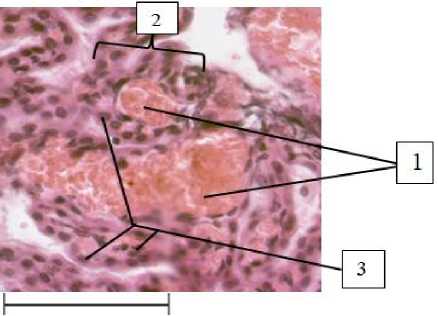
Сосудистое сплетение IV желудочка у крыс, которых кормили исключительно куриным яичным белком (рис. 5), находится в состоянии гиперемии, что является ярким отличием от группы контроля, а также животных, которые употребляли в пищу исключительно жир. Капилляры ССГМ у животных 3-й группы дилатированы, полнокровные, хорошо визуализируются в поле зрения микроскопа. Эпендимоциты, окружающие капилляры, увеличены в размерах, их патологические изменения обнаружить не удается.
20 мкм
20 µm
Рис. 5. Сосудистое сплетение IV желудочка головного мозга крысы, находящейся на исключительно белковом рационе кормления (30-е сут):
1 – дилатированные, гиперемированные капилляры ворсинок сосудистого сплетения головного мозга;
2 – ворсинка сосудистого сплетения головного мозга;
3 – эпендимоциты.
Окраска гематоксилин-эозином, ув. 400
Fig. 5. Choroid plexus of the fourth ventricle of rat cerebrum, 30-day high-protein diet: 1 – dilated, hyperemic capillaries of the villi of the cerebrum blood vessel plexus;
-
2 – villus of the cerebrum blood vessel plexus;
-
3 – ependymocytes.
Hematoxylin-eosin staining, magnification 400×
25 мкм
25 µm
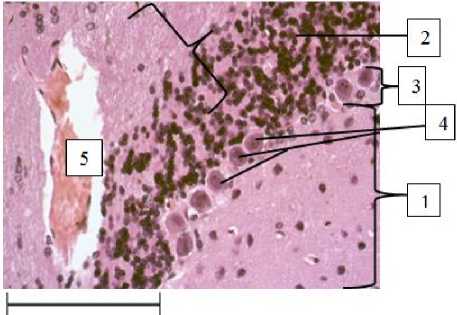
Рис. 6. Мозжечок крысы, находящейся на исключительно белковом рационе питания (30-е сут):
1 – молекулярный слой мозжечка;
2 – зернистый слой мозжечка;
3 – ганглионарный слой мозжечка;
4 – клетки Пуркинье;
5 – полнокровие сосудов мозжечка.
Окраска гематоксилин-эозином, ув. 400
Fig. 6. Rat cerebellum, 30-day high-protein diet: 1 – molecular cerebellum layer;
-
2 – granular cerebellum layer;
-
3 – ganglion cerebellum layer;
-
4 – Purkinje cells;
-
5 – congestion of cerebellar vessels.
Hematoxylin-eosin staining, magnification 400×
Корзинчатые клетки молекулярного слоя мозжечка эктопируются в сторону ганглионарного слоя и отличаются более светлой окраской, чем в группе контроля. Количество звездчатых клеток в поле зрения микроскопа уменьшается. Клетки Пуркинье подвергаются гипертрофии и гиперплазии, о чем свидетельствует 2–3-рядная топография и расположение между рядами клеток глии и зернистого слоя.
Ремоделирование сосудистого сплетения IV желудочка и мозжечка в ответ на диету как один из ключевых факторов экспозома обусловлено взаимодействием звеньев оси «нейрон – астроцит – кровеносный сосуд», которое вовлекается в регулирование локального кровотока в зависимости от активности конкретной области головного мозга [22], в нашем случае сосудистого сплетения IV желудочка и мозжечка. По данным литературы, величина соот- ношения между глиальными и нервными клетками отражает динамику развития нервной ткани и может быть использована для оценки уровня морфологических изменений. Авторы установили, что увеличение количества глиальных клеток при интоксикации свинцом и черепно-мозговой травме является приспособительной реакцией, направленной на поддержание жизнеспособности нейронов [23].
В наших опытах белковая и жировая диеты вызывают увеличение размеров и количества астроцитов во всех слоях коры и белом веществе мозжечка. В отдельных случаях наблюдается образование так называемых бочонков отростками астроцитов вокруг нейритов нейронов и капилляров. Универсальный ответ астроцитов на кормление животных белком и жиром может быть связан с тем, что обе диеты относятся к кетогенным. Иначе го- воря, ремоделирование астроцитов выступает структурным проявлением, реакцией напряжения их на кетогенную диету как один из ключевых факторов экспозома.
Это отличается от реакции кровеносного русла как одного из звеньев оси экспозома «нейрон – кровеносный сосуд – астроцит», когда при белковой диете отмечается гиперемия, а при жировой – признаки ишемии мозжечка и сосудистого сплетения IV желудочка. На этом фоне клетки Пуркинье при жировой диете подвергаются гипертрофии, при белковой – гиперплазии и гипертрофии. Отмеченные особенности ремоделирования клеток сосудистой стенки, астроцитов и нейронов мозжечка, скорее всего, связаны со своеобразием их метаболизма.
Заключение. Концентрация холестерина, глюкозы и альбумина в сыворотке крови крыс, содержащихся на жировом рационе кормления, выше, чем при белковом и стандартном питании. Исключительно жировой рацион питания приводит к ремоделированию базальной мембраны, просветлению цитоплазмы, набуханию ядер, спазму стенки капилляров сосудистого сплетения IV желудочка с явлениями кровоизлияний к 30-му дню эксперимента, а также хроматолизу ядер клеток Пуркинье. Исключительно белковый рацион питания характеризуется гиперемией сосудистого сплетения IV желудочка головного мозга и мозжечка, а также гипертрофией и гиперплазией клеток Пуркинье. Таким образом, жировой рацион кормления вызывает более выраженные изменения сосудистого сплетения IV желудочка головного мозга и коры мозжечка, чем белковый.
Список литературы Особенности ремоделирования сосудистого сплетения IV желудочка головного мозга и мозжечка крыс в зависимости от рациона кормления
- Liddelow S.A. Fluids and barriers of the CNS: a historical viewpoint. Fluids Barriers CNS. 2011; 8 (1): 2.
- Woollam D.H. The historical significance of the cerebrospinal fluid. Med Hist. 1957; 1 (2): 91-114.
- Dohrmann G.J. The choroid plexus: a historical review. Brain Res. 1970; 18 (2): 197-218.
- Chodobski A., Szmydynger-Chodobska J. Choroid plexus: target for polypeptides and site of their synthesis. Microsc Res Tech. 2001; 52 (1): 65-82.
- Lun M.P., Monuki E.S., Lehtinen M.K. Development and functions of the choroid plexus-cerebrospinal fluid system. Nat Rev Neurosci. 2015; 16 (8): 445-457.
- Brown P.D., Davies S.L., Speake T., Millar I.D. Molecular mechanisms of cerebrospinal fluid production. Neuroscience. 2004; 129 (4): 957-970.
- Zappaterra M.W., Lehtinen M.K. The cerebrospinal fluid: regulator of neurogenesis, behavior, and beyond. Cell Mol Life Sci. 2012; 69 (17): 2863-2878.
- Wolburg H., Paulus W. Choroid plexus: biology and pathology. Acta Neuropathol. 2010; 119: 75-88.
- Aguilar A., Meunier A., Strehl L., Martinovic J., Bonniere M., Attie-Bitach T., Encha-Razavi F., Spassky N. Analysis of human samples reveals impaired SHH-dependent cerebellar development in Joubert syndrome / Meckel syndrome. Proc Natl Acad Sci USA. 2012; 109 (42): 16951-16956.
- Roostaei T., Nazeri A., Sahraian M.A., Minagar A. The human cerebellum: a review of physiologic neuroanatomy. Neurol Clin. 2014; 32 (4): 859-869.
- Witter L., De Zeeuw C.I. Regional functionality of the cerebellum. Curr Opin Neurobiol. 2015; 33: 150-155.
- Manto M., Bower J.M., Conforto A.B., Delgado-García J.M., da Guarda S.N., Gerwig M., Habas C., Hagura N., Ivry R.B., Mariën P., Molinari M., Naito E., Nowak D.A., Oulad Ben Taib N., Pelisson D., Tesche C.D., Tilikete C., Timmann D. Consensus paper: roles of the cerebellum in motor control - the diversity of ideas on cerebellar involvement in movement. Cerebellum. 2012; 11 (2): 457-487.
- Yang Y., Lisberger S.G. Purkinje-cell plasticity and cerebellar motor learning are graded by complex-spike duration. Nature. 2014; 510 (7506): 529-532.
- Van Essen D.C., Donahue C.J., Glasser M.F. Development and Evolution of Cerebral and Cerebellar Cortex. Brain Behav Evol. 2018; 91 (3): 158-169.
- Akakin A., Peris-Celda M., Kilic T., Seker A., Gutierrez-Martin A., Rhoton A.Jr. The dentate nucleus and its projection system in the human cerebellum: the dentate nucleus microsurgical anatomical study. Neurosurgery. 2014; 74 (4): 401-424.
- Baumann O., Borra R.J., Bower J.M., Cullen K.E., Habas C., Ivry R.B., Leggio M., Mattingley J.B., Molinari M., Moulton E.A., Paulin M.G., PavlovaM.A., Schmahmann J.D., Sokolov A.A. Consensus paper: the role of the cerebellum in perceptual processes. Cerebellum. 2015; 14 (2): 197-220.
- Javalkar V., Khan M., Davis D.E. Clinical manifestations of cerebellar disease. Neurol Clin. 2014; 32 (4): 871-879.
- MantoM. Cerebellar motor syndrome from children to the elderly. Handb Clin Neurol. 2018; 154: 151-166.
- Довжикова И.В., Луценко М. Т. Мембранный транспорт жирных кислот (обзор). Бюллетень физиологии и патологии дыхания. 2013; 50: 130-138.
- Шидаков Ю.Х.-М., Шарова Е.В., Абдумаликова И.А., Мешанко Т.Р. Влияние рациона питания крыс на биохимический профиль крови и морфологию печени. Бюллетень науки и практики. 2020; 6 (2): 60-66.
- Новикова Л.Н. Ультраструктура гематолитического барьера в сосудистом сплетении боковых желудочков головного мозга кролика при острой ишемии. Журнал ГрГМУ. 2009; 2: 76-78.
- Коржевский Д.Е., Отеллин В.А. Структурные основы формирования гематоликворного барьера у человека. Успехи физиол. наук. 2002; 33 (4): 43-52.
- BillB.R., Korzh V. Choroid plexus in developmental and evolutionary perspective. Front. Neurosci. 2014; 8: 363.


