Особенности роста и содержания фотосинтетических пигментов в водорослей Acutodesmus dimorphus (Tupin) P.M. Царенко под давлением соли и ацетата
Автор: Романенко К.О., Романенко П.О., Бабенко Л.М., Косакивская И.В.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 2 т.13, 2017 года.
Бесплатный доступ
Целью этого исследования было исследование влияния напряжений соли (NaCl) и ацетата (NaC2H3O2) на картину накопления биомассы и содержания фотосинтетических пигментов в культуре водорослей пресноводной зеленой водоросли Acutodesmus dimorphus (Turpin) P.M. Царенко IBASU-A 251. Мы продемонстрировали, что хлорид натрия, введенный в культуральную среду в различных концентрациях, вызвал постепенное снижение микромагной биомассы, максимум которой регистрировался при концентрации соли 1,5%. Добавление ацетата натрия в тех же концентрациях привело, напротив, к резкому (более чем в два раза) снижению биомассы A. dimorphus. На 18-й день культивирования в условиях солевого стресса содержание хлорофилла а уменьшилось в 1,5-2,5 раза, содержание хлорофилла b - в 1,3-1,7 раза, а количество каротиноидов увеличилось в 1,2-1,6 раза. В условиях ацетатного стресса содержание хлорофилла а снижалось в 2-3 раза, а хлорофилла б - 1,7 - 1,8 раза, тогда как количество каротиноидов увеличивалось в пределах 1,4-1,8 раза. Увеличение концентраций химических стрессоров связано с некоторым уменьшением отношения хлорофиллов а / б и общего содержания хлорофиллов а + b, и в то же время увеличилось отношение каротиноидов / a + b. Ацетат натрия, по-видимому, был более мощным индуктором каротиногенеза, чем хлорид натрия. Наибольшее количество каротиноидов регистрировалось при концентрации 1% и 1,5% NaC2H3O2 в культуральной среде и 0,75% концентрации NaCl. Полученные результаты позволяют рассматривать Acutodesmus dimorphus (Turpin) P.M. Царенко IBASU-A 251 как активный производитель каротиноидов, который позднее будет применен в исследованиях гиперсинтеза отдельных классов этого пигмента.
Короткий адрес: https://sciup.org/14324013
IDR: 14324013
Текст научной статьи Особенности роста и содержания фотосинтетических пигментов в водорослей Acutodesmus dimorphus (Tupin) P.M. Царенко под давлением соли и ацетата
Acutodesmus dimorphus (Turpin) P.M. Tsarenko – пресноводная ценобиальная зеленая водоросль (Chlorophyta) из семейства Scenedesmaceae, представители которого, благодаря способности накапливать значительное количество липидов и углеводов в стрессовых условиях, рассматриваются как перспективные продуценты для производства биотоплива (Chokshi et al., 2015; La et al., 2016). Выявлено, что вид способен к интенсивному росту в различных типах сточных вод (Doria et al., 2012; Mata et al., 2012). Применение клеточного экстракта и биомассы A. dimorphus в качестве биоудобрения положительно влияло на прорастание семян томата (Garcia-Gonzalez, Sommerfeld, 2016). Полученные на сегодня данные свидетельствуют о значительном биотехнологическом потенциале микроводоросли (Tsarenko, Borisova, 2014). Известно, что водоросли под воздействием неблагоприятных факторов окружающей среды формируют клеточные и молекулярные механизмы адаптации, включающие, среди прочего, синтез физиологически активных веществ (каротиноидов, витаминов, фитогормонов), ценных для промышленной биотехнологии (Hu, 2004; Cardozo et al., 2007; Romanenko et al , 2015, 2016). Лабильность химического состава водорослей позволяет осуществлять управляемый биосинтез таких ценных соединений, как каротиноиды. На сегодняшний день, производство каротиноидов принадлежит к перспективным направлениям современной биотехнологии. Каротиноиды используются в качестве кормовых добавок при выращивании лососевых рыб, они являются провитаминами и эффективными антиоксидантами, препятствуют возникновению и развитию возрастных дегенеративных и онкологических заболеваний Nishino et al., 2009). Сообщалось, что такие химические соединения, как перекись водорода (Ma, Chen, 2001; Ip, Chen, 2005), хлориды аммония и натрия (Solovchenko, 2013; Masojídek et al., 2000; Ranga Rao et al., 2010; Sibi, 2015; Zhang et al., 1997), а также ацетат натрия (Kobayashi et al., 1993; Orosa et al., 2001; Pirastru et al., 2012) способны индуцировать синтез каротиноидов у микроводорослей. В связи с вышеизложенным, целью данной работы было выявить влияние хлорида натрия (NaCl) и ацетата натрия (NaC2H3O2, далее в тексте AcNa) на способность A. dimorphus к накоплению каротиноидов, определить характер действия различных концентраций химических стрессоров на содержание и соотношение фотосинтетических пигментов в альгокультуре A. dimorphus.
MATERIALS AND METHODS
Исследования проводились с альгологически чистой культурой Acutodesmus dimorphus (Turpin) P.M. Tsarenko, штамм IBASU-A 251, который в 2011 году был отнесен к перспективным продуцентам биомассы (Tsarenko et al. , 2011). Штамм характеризуется устойчивостью к контаминации другими видами и способностью к накоплению липидов (Tsarenko, Borisova, 2014). Для определения воздействия NaCl и AcNa на аккумуляцию фотосинтетических пигментов был применен метод двустадийной накопительной культуры (Kobayashi et al. , 1991). Первоначально культивирование осуществляли при максимально благоприятных для деления клеток и накопления биомассы условиях, после чего в среду культивирования вносили NaCl и AcNa различной концентрации. Было установлено, что при полном минеральном обеспечении переход в стационарную фазу у штамма IBASU-A 251 происходил на 28-32 сутки. Продолжительность первого этапа составила 14 суток и соответствовала стадии активного роста, тогда как второй этап пребывания культуры под влиянием стрессоров NaCl и AcNa занял 18 суток и был использован для данного исследования.
Водоросли выращивали в конических колбах объемом 1000 мл на среде Буррелли (Borysova et al., 2014). Объем культивируемой среды составлял 500 мл, начальная численность клеток 1,8-2,3·105/мл. Культивирование проводили при температуре +25-26°С, двустороннем освещении (2 клк) с чередованием фотопериода 16:8 (день: ночь). Осуществлялась постоянная продувка культуры стерильным воздухом. На 15 сутки культивирования культуру (численность клеток 2,7-2,9·106/мл) подвергали воздействию химических стрессоров. В колбы с плотной биомассой вносили растворы NaCl и AcNa пяти различных концентраций (0,25%; 0,5%; 0,75%; 1%; 1,5%), после чего альгокультуру переводили на круглосуточное освещение, которое использовали в качестве дополнительного фактора для стимуляции каротиногенеза (Masojídek et al., 2000; Solovchenko, 2013). Контроль роста численности клеток в культуре производили путем подсчета в камере Горяева, биомассу определяли по накоплению сухого вещества (Metody, 1975).
Содержание фотосинтетических пигментов в биомассе определяли на 18 сутки после внесения в среду культивирования различных концентраций химических стрессоров. Биомассу отделяли от питательной среды, отмывали дистиллированной водой от остатков солей и концентрировали центрифугированием в течение 20 мин. при 3000 об/мин. Для анализа фотосинтетических пигментов биомассу фиксировали в жидком азоте и хранили при температуре -40°С. Фотосинтетические пигменты экстрагировали ацетоном и определяли по методу (Wellburn, 1994). Измерение экстинции растворов осуществляли на спектрофотометре Shimadzu UV-1800 (Япония). Опыты проводили в двукратной биологической и трехкратной аналитической повторности. Полученные результаты статистически обрабатывали в программе Excel стандартного пакета Microsoft Office 2013. Достоверность различий оценивали по t-критерию Стьюдента, используя 5% уровень значимости (р ≤ 0,05). На графиках и таблице представлены средние арифметические и их стандартные ошибки.
RESULTS AND DISCUSSION
Нами был выявлен значительный потенциал микроводоросли к накоплению каротиноидов под действием химических стрессоров. Внесение NaCl и AcNa в культуральную среду на стадии активного роста биомассы A. dimorphus оказало существенное влияние на содержание и соотношение фотосинтетических пигментов. Показателем реакции фотосинтетического аппарата на воздействие неблагоприятных факторов является содержание и соотношение хлорофиллов а и b и каротиноидов (Babenko et al. , 2014; Fu, Bell, 2003; Haubner et al. ,
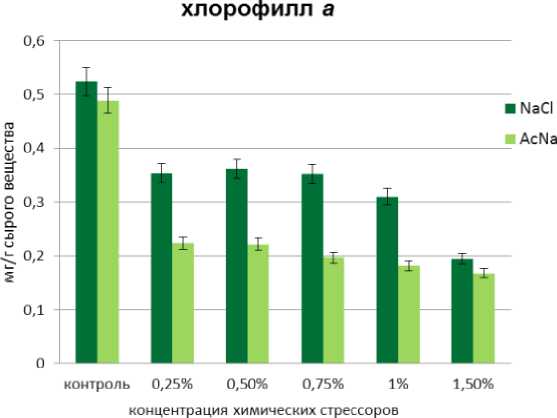
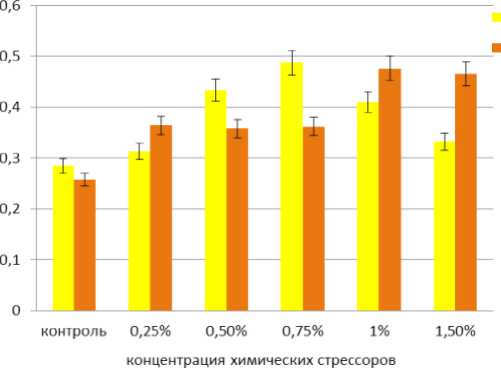
2014; Liang et al., 2014; Sudhir, Murthy, 2004; Vonshak, Torzillo, 2004). Проведенные нами исследования показали, что на восемнадцатые сутки культивирования A. dimorphus в условиях солевого стресса происходило постепенное уменьшение содержания хлорофиллов a и b, интенсивность которого зависела от концентрации NaCl (Рис. 1, а, б). Так, содержание хлорофилла a с увеличением концентрации NaCl в среде культивирования уменьшилось в 1,5-2,5 раза, содержание хлорофилла b в 1,3-1,7 раза. При этом количество каротиноидов возросло в 1,2-1,6 раза. При концентрации хлорида натрия 0,75% количество каротиноидов увеличилось вдвое и достигло максимума (Рис. 1, в). Увеличения синтеза каротиноидов под действием солевого стресса отмечено также у других микроводорослей. Так, при 30% концентрации NaCl, дефиците азота и избыточном освещении наблюдалось накопление ß-каротина в клетках Dunaliella salina (El Baz et. al., 2002). У Haematococcus pluvialis накоплению каротиноидов, главным образом, астаксантина, способствовало внесение в среду 2% NaCl (Boussiba et. al., 1992). Увеличение общего содержания каротиноидов отмечалось у Chlorella zofingiensis при внесении в культуральную среду 0,2 М NaCl, при этом основным каротиноидом был астаксантин. Увеличение концентрации NaCl в среде до 0,4 М ингибировало рост и уменьшало количество фотосинтетических пигментов (Del Campo et al., 2004). В условиях высокой инсоляции и в присутствии 2% NaCl в среде содержание астаксантина у Ch. zofingiensis возрастало вдвое по сравнению с кантаксантином, тогда как при низком освещении и той же концентрации соли, содержание этих двух каротиноидов было иным: кантаксантина синтезировалось в 8 раз больше, чем астаксантина (Pelah et al., 2004). Дефицит азота, повышенная соленость (0,3 М NaCl) и избыток света ингибировали фотосинтетическую активность у Chlorococcum sp., одновременно стимулируя накопление каротиноидов. Показано, что в первые сутки стресса в клетках Chlorococcum sp. накапливался лютеин, тогда как на третьи и четвертые сутки происходило увеличение содержания кантаксантина и астаксантина, а уровень лютеина существенно снижался (Masojídek et al., 2000). Добавление в среду культивирования 0,1% NaCl способствовало аккумуляции лютеина в клетках Botryococcus braunii, тогда как содержание других каротиноидов – астаксантина, виолаксантина, зеаксантина, ß-каротина – было незначительным (Ranga Rao et al., 2010). Внесение в среду культивирования Scenedesmus sp. 2% NaCl в сочетании с отходами от производства лимонной кислоты приводило к полной деградации хлорофиллов и аккумуляции каротиноидов (El-Sayed, 2010).
В условиях ацетатного стресса наблюдалась резкая деградация обоих хлорофиллов. Содержание хлорофилла а уменьшилось в 2-3 раза (Рис.1, а), хлорофилла b - в 1,7-1,8 раза (Рис. 1, б), тогда как содержание каротиноидов увеличилось в 1,4-1,8 раза (Рис. 1, в), при этом наибольшие значения зафиксированы для концентраций 1% и 1,5% AcNa. В работах других исследователей сообщалось, что под действием ацетата натрия в культуре Haematococcus pluvialis (Orosa et al. , 2001), Scenedesmus sp. (Pirastru et al. , 2012), Вracteacoccus minor (Minyuk et al. , 2015) содержание хлорофиллов а и b уменьшилось более чем в 10 раз, тогда как количество каротиноидов возросло более чем в 9 раз. Так, внесение AcNa в среду культивирования Haematococcus pluvialis способствовала значительному увеличению образования астаксантина, в меньшей степени – кантаксантина и β-каротина (Orosa et al. , 2001). При культивировании Scenedesmus sp. с внесением повышенных концентраций AcNa (60 мМ и 120 мМ) отмечено увеличение содержания астаксантина и кантаксантина, тогда как низкие концентрации AcNa (4,5 мМ) этому не способствовали (Pirastru et al. , 2012). У Вracteacoccus minor отмечено высокое содержание интермедиантов астаксантина, который запасался в форме диацильных эфиров (Minyuk et al. , 2015)
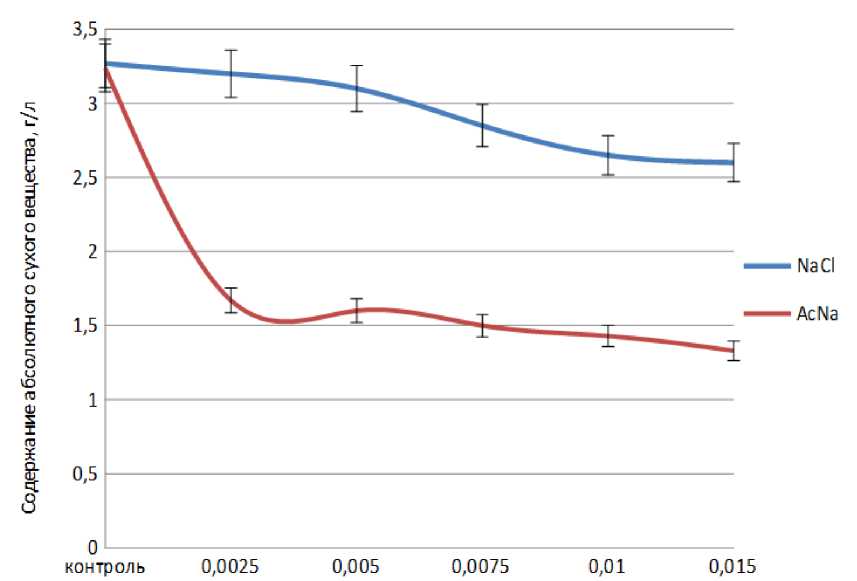
В ходе эксперимента нами было зафиксировано снижение темпов образования биомассы в зависимости от увеличения концентрации NaCl и AcNa (Рис. 2). Следует отметить, что все концентрации ацетата натрия более чем в два раза сократили образование биомассы водоросли (Рис. 2, красная линия), тогда как в опыте с хлоридом натрия наблюдалось постепенное снижение биомассы, максимум которого зафиксирован при концентрации 1,5 % (Рис. 2, синяя линия). Значительные потери биомассы при внесении AcNa в питательную среду были также зафиксированы при двустадийном выращивании Haematococcus pluvialis (Dantsyuk, 2010). Для таксономически близких к A. dimorphus водорослей A. obliquus и Scenedesmus almeriensis (Sánchez et al., 2008; Kaewkannetra et al., 2012) показано, что низкие концентрации NaCl (0,5%) в среде культивирования не тормозят увеличение биомассы, тогда как с повышением концетрации NaCl (до 3%) накопление биомассы сокращается более чем в 2 раза.
В ацетатной альгокультуре нами отмечена агрегация клеток с образованием хлопьев, тогда как в солевом эксперименте это не наблюдалось. С повышением концентрации AcNa увеличивалось количества мертвых бесцветных клеток, особенно массово они были отмечены при концентрациях равных 1% и 1,5 %. В солевом опыте, вне зависимости от концентрации NaCl в среде, мертвые клетки нами не обнаружены. Ранее сообщалось, что ацетат (0,05 М) в сочетании с NaCl (0,17 М) вызывал массовое отмирание молодых клеток В. minor (Chubchikova et al. , 2011).
С увеличением концентрации NaCl и AcNa соотношение хлорофиллов а/b , а также сумма хлорофиллов а+b уменьшались, что косвенно свидетельствует о снижении фотохимической активности в клетках микроводоросли. В то же время происходил рост соотношения каротиноиды/ a+b . Показатель соотношения каротиноиды/ а+b в опыте с AcNa был значительно выше, чем в опыте с NaCl При концентрации NaCl равной 0,75% и концентрациях AcNa равных 1% и 1,5% зафиксированы самые высокие показатели в образовании каротиноидов в культуре A. dimorphus IBASU-A-251: для хлорида натрия – 0,487 мг/г сырого веса и для ацетата натрия – 0,476 мг/г и 0, 465 мг/г сырого веса (табл. 1).
хлорофилл b
мг/г сырого вещества м г/г сырого вещества
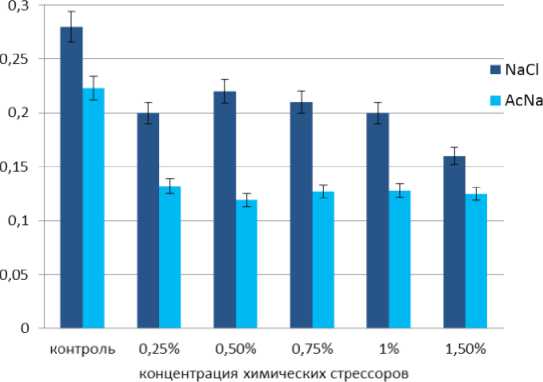
Figure 1. Содержание фотосинтетических пигментов (а – хлорофилл а; б – хлорофилл b; в – каротиноиды) в альгокультуре A. dimorphus под воздействием NaCl и AcNa различной концентрации.
каротиноиды
концентрация химических стрессоров
Figure 2
Влияние хлорида натрия и ацетата натрия различной концентрации на накопление
биомассы A. dimorphus
Table 1. Влияние хлорида натрия и ацетата натрия на соотношение фотосинтетических пигментов в альгокультуре A. dimorphus .
|
Концентрация химического стрессора, % |
Хлорофиллы a/b |
Хлорофиллы a+b , мг/г сырого вещества |
Каротиноиды / хлорофиллы a+b |
|||
|
NaCl |
AcNa |
NaCl |
AcNa |
NaCl |
AcNa |
|
|
контроль |
1,87 |
2,19 |
0,804±0,03 |
0,712±0,01 |
0,35 |
0,36 |
|
0,25% |
1,76 |
1,69 |
0,553±0,05 |
0,356±0,04 |
0,57 |
1,02 |
|
0,50% |
1,64 |
1,68 |
0,582±0,02 |
0,354±0,03 |
0,74 |
1,01 |
|
0,75% |
1,67 |
1,55 |
0,562±0,03 |
0,324±0,04 |
0,87 |
1,12 |
|
1% |
1,55 |
1,42 |
0,510±0,04 |
0,310±0,05 |
0,83 |
1,55 |
|
1,50% |
1,22 |
1,34 |
0,355±0,03 |
0,293±0,02 |
0,81 |
1,59 |

а

б
Figure 3. Внешний вид культуры A. dimorphus IBASU-A-251 на 18 сутки культивирования в условиях действия химических стрессоров различной концентрации: а - ацетат натрия, б - хлорид натрия.
С момента начала стрессового этапа эксперимента цвет культивируемой водоросли постепенно менялся. На 18 сутки действия химических стрессоров контрольный вариант имел зеленую окраску, что объясняется высоким содержанием зеленых пигментов - хлорофиллов. Под влиянием ацетата различной концентрации альгокультура приобрела яркий оранжевый цвет (рис. 3 а), тогда как при воздействии хлорида натрия цвет водоросли менялся от буро-зеленого до оранжевого и ярко-оранжевого (рис. 3, б).
CONCLUSION
Внесение в среду культивирования микроводоросли A. dimorphus IBASU-A 251 в фазу ее активного роста химических стрессоров хлорида натрия и ацетата натрия снижали темпы накопления биомассы. Добавление соли вызывало постепенное уменьшение биомассы микроводоросли, тогда как ацетат приводил к резкому сокращению биомассы. Увеличение концентрации химических стрессоров сопровождалось ростом количества каротиноидов и уменьшением – хлорофиллов a и b. Максимальный уровень каротиноидов наблюдался при концентрации в среде культивирования NaCl равной 0,75%, и концентрации AcNa равной 1% и 1,5%. Показано, что ацетат натрия является более агрессивным индуктором каротиногенеза. Наименьшие концентрации AcNa вызывали резкую деградацию хлорофиллов. Полученные результаты позволяют рассматривать Acutodesmus dimorphus (Turpin) P.M. Tsarenko IBASU-A 251 как активный продуцент каротиноидов, перспективный для последующих исследований на предмет гиперсинтеза отдельных классов этих пигментов.
Список литературы Особенности роста и содержания фотосинтетических пигментов в водорослей Acutodesmus dimorphus (Tupin) P.M. Царенко под давлением соли и ацетата
- Babenko L.М., Kosakivska I.V., Akimov Yu.A., Klymchuk D.O., Skaternya T.D. (2014). Еffect of temperature stresses on pigment content, lipoxygenase activity and cell ultrastructure of winter wheat seedlings. Genet. Plant Physiol., 4(1-2), 117-125
- Borysova O.V., Tsarenko P.M., Konishchuk M.O. (2014). Microalgae culture collection IBASU-A. Kyiv, 110 p
- Boussiba S., Fan L., Vonshak A. (1992). Enhancement and determination of astaxanthin accumulation in green alga Haematococcus pluvialis. Methods Enzymol. Part A: Carotenoids, 213, 386-391
- Cardozo K.H., Guaratini T., Barros M.P., Falcão V.R., Tonon A.P., Lopes N.P., Campos., Torres M.A., Souza A.O., Colepicolo P., Pinto E. (2007). Metabolites from algae with economical impact. Comp. Biochem. Physiol. C Toxicol. Pharmacol., 146(1-2), 60-78
- Chokshi K., Pancha I., Trivedi K., George B., Maurya R., Ghosh A., Mishra S. (2015). Biofuel potential of the newly isolated microalgae Acutodesmus dimorphus under temperature induced oxidative stress conditions. Bioresour. Technol., 180, 162-171
- Chubchikova I.N., Drobetskaya I.V., Minyuk G.S., Dantsyuk N.V., Chelebiyeva E.S. (2011). Screening of green microalgae as a potential source of natural ketocarotenoids 2. Features of growth and secondary carotenogenesis in the representatives of the genus Bacteacoccus (Clorophyceae). Mor. ekol. zhurn., 10(1), 91-97.
- Dantsyuk N.V. (2010). Effect of sodium acetate on intensity of secondary carotenogenesis of green microalgae Haematococcus pluvialis. Ekol. morya, 80, 44-50.
- Del Campo J.A., Rodríguez H., Moreno J., Vargas M.Á., Rivas J., Guerrero M.G. (2004). Accumulation of astaxanthin and lutein in Chlorella zofingiensis (Chlorophyta). Appl. Microbiol. Biotechnol., 64, 848-854
- El Baz F.K., Aboul-Enein A.M., El-Baroty G.S., Youssef A.M., Abdel-Baky H.H. (2002). Accumulation of antioxidant vitamins in Dunaliella salina. J. Biol. Sci., 2(4), 220-223
- El-Sayed A.B. (2010). Carotenoids accumulation in the green alga Scenedesmus sp. incubated with industrial citrate waste and different induction stresses. Nature Sci., 8(10), 34-40
- Fu F.-X., Bell P.R.F. (2003). Effect of salinity on growth, pigmentation, N2 fixation and alkaline phosphatase activity of cultured Trichodesmium sp. Mar. Ecol. Prog. Ser., 257, 69-76
- Garcia-Gonzalez J., Sommerfeld M. (2016). Biofertilizer and biostimulant properties of the microalga Acutodesmus dimorphus. J. Appl. Phycol., 28(2), 1051-1061
- Haubner N., Sylvander P., Vuori K., Snoeijs P. (2014). Abiotic stress modified the synthesis of alphatocopherol and beta-carotene in phytoplankton species. J. Phycol., 50, 753-759
- Hu Q. (2004). Environmental Effects on Cell Composition. In: Handbook of Microalgal Culture: Biotechnology and Applied Phycology. Ed. by A. Richmond, Blackwell Science Ltd.: Oxford, UK, 83-93
- Ip P.-F., Chen F. (2005). Employment of reactive oxygen species to enhance astaxanthin formation in Chlorella zofingiensis in heterotrophic culture. Process Biochem., 40, 3491-3496
- Kaewkannetra P., Enmak P., Chiu T.Y. (2012). The effect of CO2 and salinity on the cultivation of Scenedesmus obliquus for biodiesel production. Biotechnol. Bioprocess Eng., 17, 591-597
- Kobayashi M., Kakizono T., Nagai S. (1991). Astaxanthin production by a green alga Haematococcus pluvialis accompanied with morphological changes in acetate media. J. Ferment. Bioeng., 71(5), 335-339
- Kobayashi M., Kakizono T., Nagai S. (1993). Enhanced carotenoid biosynthesis by oxidative stress in acetate-induced cyst cells of a green unicellular alga, Haematococcus pluvialis. Appl. Environ. Microbiol., 59(3), 867-873
- La H.-J., Choi G.-G., Cho C., Seo S.-H., Srivastava A., Jo B.-H., Lee J.-Y., Jin Y.-S., Oh H.-M. (2016). Increased lipid productivity of Acutodesmus dimorphus using optimized pulsed electric field. J. Appl. Phycol., 28(2), 931-938
- Liang Y., Cao C., Tian C., Sun M. (2014). Changes in cell density and chlorophyll fluorescence with salinity stress in two Isochrysis galbana strains (Prymnesiophyceae). Algol. Stud., 145-146, 81-98
- Ma R. Y-N., Chen F. (2001). Induction of astaxanthin formation by reactive oxygen species in mixotrophic culture of Chlorococcum sp. Biotechnol. Lett., 23(7), 519-523
- Masojídek J., Torzillo G., Kopecký J., Koblížek M., Nidiaci L., Komenda J., Lukavská A., Sacchi A. (2000). Changes in chlorophyll fluorescence quenching and pigment composition in the green alga Chlorococcum sp. grown under nitrogen deficiency and salinity stress. J. Appl. Phycol., 12, 417-426
- Mata T.M., Melo A.C., Simões M., Caetano N.S. (2012). Parametric study of a brewery effluent treatment by microalgae Scenedesmus obliquus. Bioresour Technol., 107, 151-158
- Metody fiziologo-biokhimicheskogo issledovaniya vodorosley v gidrobiologicheskoy praktike. (1975). Otv. red. Topachevskiy A.V. Kyiv: Naukova dumka, 247 s.
- Minyuk G.S., Chelebieva E.S., Chubchikova I.N. (2015). Secondary carotenogenesis of the green microalga Bracteacoccus minor (Chlorophyta) in a two-stage culture. Algologia, 25(1), 21-34.
- Nishino H., Murakoshi M., Tokuda H., Satomi Y. (2009). Cancer Prevention by Carotenoids. Arch. Biochem. Biophys., 483, 165-168
- Orosa M., Franqueira D., Cid A., Abalde J. (2001). Carotenoid accumulation in Haematococcus pluvialis in mixotrophic growth. Biotech. Lett., 23, 373-378
- Pelah D., Sintov A., Cohen E. (2004). The effect of salt stress on the production of canthaxanthin and astaxanthin. World J. Microbiol. Biotechnol., 20, 483-486
- Pirastru L., Darwish M., Chu F. L., Perreault F., Sirois L., Sleno L., Popovic R. (2012). Carotenoid production and change of photosynthetic functions in Scenedesmus sp. exposed to nitrogen limitation and acetate treatment. J. Appl. Phycol., 24, 117-124
- Ranga Rao A., Sarada R., Ravishankar G.A. (2010). Enhancement of carotenoids in green alga Botryococcus braunii in various autotrophic media under stress conditions. Int. J. Biomed. Pharma Sci., 4(2), 87-92
- Romanenko E.A., Kosakovskaya I.V., Romanenko P.A. (2015). Phytohormones of Microalgae: Biological Role and Involvement in the Regulation of Physiological Processes. Pt I. Auxins, Abscisic Acid, Ethylene. IJA., 17(3), 275-289
- Romanenko K.O., Kosakovskaya I.V., Romanenko P.O. (2016). Phytohormones of Microalgae: Biological Role and Involvement in the Regulation of Physiological Processes. IJA., 18(2), 179-201
- Sánchez J.F., Fernández J.M., Acién F.G., Rueda A., Pérez-Parra J., Molina E. (2008). Influence of culture conditions on the productivity and lutein content of the new strain Scenedesmus almeriensis. Process Biochem., 43, 398-405
- Sibi G., Shetty V., Mokashi K. (2015). Enhanced lipid productivity approaches in microalgae as an alternate for fossil fuels-A review. J. Energy Inst., 89(3), 330-334
- Solovchenko А.Е. (2013). Physiology and Adaptive Significance of Secondary Carotenogenesis in Green Microalgae. Russ. J. Plant Physiol., 60(1), 3-16
- Sudhir P., Murthy S.D.S. (2004). Effects of salt stress on basic processes of photosynthesis. Photosynthetica, 42(4), 481-486
- Tsarenko P.M., Borisova E.V. (2014). Microalgal Culture Collection IBASU-A -a potential resource of feedstock for biodiesel production. Algologia, 24(3), 409-412.
- Tsarenko P., Borysova O., Blium Ya. (2011). Microalgae as bioenergetics object IBASU-A collection species -perspective producers of biomass as the source of raw stuff for biofuel. Visn. NAN Ukraine, 5, 49-54. (in Ukraine)
- Vonshak A., Torzillo G. (2004). Environmental Stress Physiology. In: Handbook of Microalgal Culture: Biotechnology and Applied Phycology. Ed. by A. Richmond, Blackwell Science Ltd.: Oxford, UK, 57-82
- Wellburn A. (1994). The spectral determination of chlorophyll a and chlorophyll b, as well as total carotenoids, using various solvents with spectrophotometers of different resolution. J. Plant Physiol., 144, 307-313
- Zhang D. H., Lee Y.K., Ng M.L., Phang S. M. (1997). Composition and accumulation of secondary carotenoids in Chlorococcum sp. J. Appl. Phycol., 9, 147-155


