Особенности семенного размножения Hedysarum grandiflorum Pall. ex situ и in vitro
Автор: Супрун Н.А., Малаева Е.В., Шумихин С.А.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Ботаника
Статья в выпуске: 4, 2020 года.
Бесплатный доступ
В условиях ex situ и in vitro изучены особенности семенного размножения Hedysarum grandiflorum из 7 природных популяций Волгоградской, Самарской и Луганской обл. Выявлена оптимальная температура прорастания семян и зависимость всхожести и энергии их прорастания от срока хранения. Максимальная всхожесть наблюдалась у скарифицированных семян H grandiflorum 2018 г сбора и составила 70%. Установлено, что всхожесть и энергия прорастания семян невысокие и быстро снижаются с годами хранения, при этом их скарификация позволяет увеличить эти показатели. Экспериментально был подобран оптимальный режим стерилизации семян H. grandiflorum -10% раствор Лизоформин 3000 в течении 5 минут. При этом процент стерильных проростков составил 60%.
Hedysarum grandiflorum, семенное размножение, in vitro, Волгоградская обл.
Короткий адрес: https://sciup.org/147229664
IDR: 147229664 | УДК: 58.084.1 | DOI: 10.17072/1994-9952-2020-4-286-293
Текст научной статьи Особенности семенного размножения Hedysarum grandiflorum Pall. ex situ и in vitro
Одним из вариантов сохранения редких видов и увеличения их численности, наравне с созданием природных заповедных территорий (сети ООПТ) в естественных местообитаниях (in situ), является интродукция растений и их культивирование (сохранение биоразнообразия ex situ). Выращивание в ботанических садах позволяет проводить углубленные стационарные исследования по биологии, экологии и систематике редких видов, организовать изучение их семенного и вегетативного размножения [Белолипов, 1974; Прилипко, 1980; Davy, Jefferies, 1981; Скворцов, 1983; Тихомиров, 1986; Луконина, 2005; Супрун, 2014; Малаева, Супрун, 2018]. Коллекции интродуцированных дикорастущих растений «позволяют застраховать вид от полного исчезновения в природе, дают материал для реинтродукции, размножения рас- тений и их сберегающего использования, так же как и для использования в исследовательских и образовательных целях» [Стратегия ..., 2003].
В настоящее время для сохранения редких видов растений широкое применение получил метод культуры in vitrо . Многие исследователи указывают на важнейшее значение использования биотехнологического метода как дополнительного варианта сохранения видов ex situ, выступающего в качестве их страхового фонда [Андреев, Горбунов, 2000; Benson at al, 2000; Малаева, 2019].
Следует отметить, что исследования в области культуры ткани для решения проблем сохранения генофонда растений имеют свои особенности [Ве-чернина, 2006]. Довольно часто они связаны с отсутствием возможности свободного выбора объек-
та, а также дефицитом исходного материала нужного растения. В связи с этим, при введении в культуру in vitro редких видов, в качестве исходного материала предпочтительно использовать семена из природных популяций, поскольку таким образом обеспечивается генетическое разнообразие [Молканова, 2017].
Одним из главных направлений работы ГБУ ВО «Волгоградский региональный ботанический сад» (далее ВРБС) является интродукция растений природной флоры Волгоградской обл. с целью их сохранения и увеличения численности. Особый интерес для интродукции представляет своеобразная флора меловых обнажений, выходы которых приурочены к долинам некоторых рек юга России. Сложная история формирования данной флоры обусловила наличие особых растительных группировок и высокую степень эндемизма кальцефильных растений. Резко выраженный своеобразный химизм и механический состав почвы, температурные условия и световой режим, связанный с большим альбедо меловых местообитаний, представляет комплекс факторов, обусловливающих развитие особых адаптационных приспособлений у растений-кальцефилов, имеющих немалый научный интерес.
Особый интерес для нашей работы представляет Hedysarum grandiflorum Pall., который включен в Красную книгу Волгоградской области и Красную книгу Российской Федерации, что подчеркивает важность его введения в культуру [Красная книга…, 2017]. Семенной способ размножения является приоритетным для H. grandiflorum и является основным путем поддержания и увеличения численности [Супрун, 2014].
Ряд авторов изучали семенное размножение копеечника крупноцветкового [Кузнецова, 2008; Ильина, 2013; Лаврентьев, 2016]. Однако в работах недостаточно сведений по семенному размножению H. grandiflorum , связанных с особенностями местообитания данного вида в условиях ex situ и in vitro .
В связи с этим, цель исследования – изучение особенностей семенного размножения H. grandi-florum в условиях ex situ и in vitro .
Объекты и методы исследования
Исследования проводились в 2017–2019 гг. на базе ВРБС (г. Волгоград).
Измерения плодов и семян осуществлялись штангенциркулем. Для определения массы семян и члеников плодов (далее везде – плодов) проводилось взвешивание 100 образцов в 5-кратной повторности из каждой популяции.
Проводилось морфологическое описание внешних покровов плодов и семян. Для анализа биометрических данных (Д – длина; Ш – ширина) се- мян и плодов выборка составляла 50 шт. образцов (данные обрабатывались с помощью компьютерной программы STATISTICA 6.0 – различия достоверны по плодам и семенам) [STATISTICA, 2001].
Для изучения семенного размножения семена H. grandiflorum Pall. были собраны из семи различных природных популяций. Для сравнения величины плодов и семян растений из разных популяций брали по 100 плодов и семян; масса плодов определялась взвешиванием 100 шт. в 3-кратной повторности. Лабораторное проращивание семян проводили в чашках Петри на подложке из фильтровальной бумаги по 100 семян в чашке в 3-кратной повторности. Скарификация проводилась непосредственно перед посевом, так как прошедшие такую обработку семена плохо хранятся вследствие нарушения структуры оболочки. Энергия прорастания семян исследованного вида учитывалась за первые 7 дней. Абсолютная всхожесть выявлялась в течение 30 дней. Для определения грунтовой всхожести семена высеивали в рассадные ящики. Поскольку цветение и созревание плодов у копеечника крупноцветкового происходит не одновременно, то в образцах присутствовали как зрелые, так и незрелые плоды, и семена. Для лабораторных и полевых опытов отбирали только зрелые плоды и семена [Николаева, 1985].
Методика биотехнологических исследований базировалась на общепринятых классических приемах с культурами изолированных тканей и органов растений [Бутенко, 1999].
Семена предварительно обрабатывали 95%-ным этиловым спиртом в течение 50‒60 сек. В качестве стерилизатора использовали различные концентрации Белизны и «Лизоформина 3000» (действующее вещество – глутаровый альдегид, глиоксаль и дидецилдиметиламмоний хлорид) с различной временной экспозицией. Методика по применению стерилизующего вещества – «Лизо-формин 3000» ‒ устанавливалась опытным путем сотрудниками лаборатории биотехнологии ВРБС.
После многократного промывания в стерильной дистиллированной воде семена высаживали на безгормональную питательную среду с минеральной основой по прописи Мурасиге-Скуга [Murashige, Skoog, 1962]. При оценке оптимального режима стерилизации учитывали количество заросших и количество проросших семян.
Проростки делили на фрагменты и пересаживали на модифицированные питательные среды для получения пролиферирующей культуры.
В условиях in vitro растения культивировали в чашках Петри и биологических пробирках при освещении с интенсивностью 3‒5 клк, при 16часовом фотопериоде, температуре 24ºС и относительной влажности воздуха 70%. Все опыты про- водили трижды, повторность в каждом варианте 10-кратная.
Статистическая обработка результатов исследования проводилась общепринятыми методами с применением интегрированной системы «Statis-tica» версии 6.0, Microsoft Office Excel 2013 и Past 6.1.
Результаты и их обсуждение
Плод H. grandiflorum – членистый боб. Членики его почти округлые, сильно сдавленные лате-рально, сетчато-ребристые, беловойлочные, покрыты шипами с крючковатой верхушкой. Такое строение члеников при разделении способствует анемохории, реже зоохории. Кроме того, явным признаком анемохории является не распадающий-

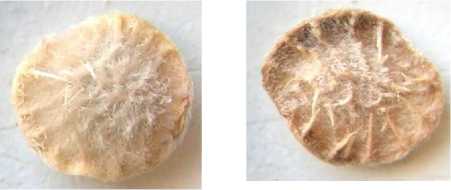
ся после отцветания околоцветник. В среднем в одном бобе закладывается 4 членика, при этом среднее количество развитых семян равно 4. Размеры и масса семян и плодов (члеников бобов) варьируют в зависимости от места произрастания вида. Семена имеют плоско-выпуклую почковидную форму и окрашены в коричневый или темнокоричневый цвет. Поверхность семян блестящая, имеет гладкую скульптуру, без опушения. Рубчиковый след округлой формы, беловатого цвета, в среднем около 0.15 мм в диаметре. Длина плодов в среднем составляет 3.37±0.02 мм, ширина – 3.59±0.02 мм; масса плодов (100 шт.) – 0.459±0.005 г, масса семян (100 шт.) – 0.336 ±0.007 г. (рис. 1, табл. 1, 2).
Масштаб |__| ‒ 1 мм
Рис. 1 . Структура плодов Hedysarum grandiflorum
Таблица 1
Размеры плодов Hedysarum grandiflorum из разных географических популяций
|
Место сбора |
Измерение |
M±m, мм |
σ |
V |
Масса, г |
|
Sm |
Длина |
4.11±0.07 |
0.24 |
5.84 |
0.503 |
|
Ширина |
4.37±0.04 |
0.38 |
8.69 |
||
|
Lk |
Длина |
3.77±0.04 |
0.39 |
10.34 |
0.423 |
|
Ширина |
3.81±0.03 |
0.30 |
7.87 |
||
|
LA |
Длина |
3.40±0.06 |
0.43 |
12.64 |
0.398 |
|
Ширина |
3.58±0.06 |
0.42 |
11.73 |
||
|
KK |
Длина |
3.45±0.07 |
0.18 |
5.22 |
0.465 |
|
Ширина |
3.56±0.04 |
0.28 |
7.86 |
||
|
KI |
Длина |
3.32±0.06 |
0.32 |
9.64 |
0.430 |
|
Ширина |
3.70±0.05 |
0.26 |
7.03 |
Примечание. В этой и следующей таблице: Sm – Самарская обл., Кинельский р-н, окр. пос. Усть-Кинелький; Lk – Луганская обл., окр. с. Камышное, степные балки по р. Дерлуп; LA – Луганская обл., юго-западнее г. Луганска, окр. пос. Александровка и пос. Бахлут; KK – Волгоградская обл., Камышинский р-н, балка Кривцовская; КI – Волгоградская обл., Иловлинский р-н, хут. Александровка.
Таблица 2
Размеры семян Hedysarum grandiflorum из разных географических популяций
|
Место сбора |
Измерение |
M±m, мм |
σ |
V |
Масса, г |
|
Sm |
Длина |
2.20±0.06 |
0.32 |
14.54 |
0.313 |
|
Ширина |
2.52±0.06 |
0.31 |
12.30 |
||
|
Lk |
Длина |
2.15±0.03 |
0.15 |
6.98 |
0.378 |
|
Ширина |
2.49±0.03 |
0.16 |
6.42 |
||
|
LA |
Длина |
2.20±0.03 |
0.22 |
10 |
0.301 |
|
Ширина |
2.51±0.05 |
0.29 |
11.55 |
||
|
KK |
Длина |
1.90±0.05 |
0.16 |
8.42 |
0.321 |
|
Ширина |
2.28±0.09 |
0.18 |
7.89 |
||
|
KI |
Длина |
1.90±0.05 |
0.21 |
11.05 |
0.378 |
|
Ширина |
2.14±0.07 |
0.25 |
11.68 |
Исследования биометрических показателей плодов в различных популяциях, показали, что коэффициент вариации длины и ширины ниже среднего (V = 5‒13%), что говорит о небольшом варьировании этих признаков. Таким образом, высокие значения длины и ширины наблюдаются у популяций, собранных в Луганской обл., юго-западнее г. Луганска, в окрестностях пос. Александровка и пос. Бахлут; низкие значения вариации длины плодов обнаружены в Самарской обл., в Кинельском р-не, в окрестностях пос. Усть-Кинелький и в Волгоградской обл., Камышинском р-не, в балке Кривцовская.
Биометрический анализ семян показал, что их размеры тесно связаны с географическим расположением популяций. По индексу длина – ширина все популяции достоверно различаются между собой (табл. 2).
Исследуя биометрические показатели семян в различных популяциях, обнаружили, что коэффициент вариации по длине и ширине незначителен (V = 6‒15%), следовательно, это свидетельствует о стабильности данного признака. Максимальные значения длины составляют 2.20 мм, ширины – 2.52 мм, минимальные – соответственно 1.90 и
-
2.14 мм.
По внешним признакам плоды копеечника крупноцветкового из популяций различного географического расположения отличяются по следующим показателям:
-
• плоды имеют цвет: светло-желтый, желтооранжевый и серо-коричневый. Окраска плодов каждой отдельной популяции имеет свой цвет, но есть присутствие других цветов;
-
• опушение на плодах присутствует всегда. Степень его может быть различным: густым или редким;
-
• выраженность сетчатости на поверхности плодов зависит от высоты, расположения ребер и расстояния между ними;
-
• длина шипиков у плодов отличается. Для некоторых плодов характерно наличие разной длины шипиков на окаймлении, а на других по всей поверхности плода, но с разной степенью выраженности.
В условиях ВРБС нами проведена серия опытов по определению всхожести семян H. grandiflorum различного срока хранения (сборы 2017 – 2019 гг.) (табл. 3‒5).
Таблица 3
Влияние различных способов предпосевной обработки на прорастание семян H. grandiflorum (сбор 2017 г.)
|
Условия прорастания |
Всхожесть (%) |
||||||||
|
7 дней |
15 дней |
30 дней |
|||||||
|
1 |
2 |
3 |
1 |
2 |
3 |
1 |
2 |
3 |
|
|
Скарификация (наждачная бумага) |
25 |
27 |
31 |
30 |
36 |
38 |
46 |
54 |
58 |
|
Обработка горячей водой (3 мин.) |
2 |
6 |
4 |
4 |
9 |
5 |
4.1 |
23 |
10 |
|
Стратификация (холодильник t = 0…+5ºC) |
0 |
0 |
0 |
8 |
8 |
6 |
26 |
29 |
25 |
|
Обработка этиловым спиртом |
39 |
41 |
24 |
44 |
48 |
29 |
54 |
57 |
41 |
|
Контроль |
13 |
23 |
18 |
16 |
26 |
21 |
20 |
31 |
28 |
Таблица 4
Влияние различных способов предпосевной обработки на прорастание семян H. grandiflorum (сбор 2018 г.)
|
Условия прорастания |
Всхожесть (%) |
||||||||
|
7 дней |
15 дней |
30 дней |
|||||||
|
1 |
2 |
3 |
1 |
2 |
3 |
1 |
2 |
3 |
|
|
Скарификация (наждачная бумага) |
39 |
27 |
40 |
60 |
81 |
67 |
69 |
82 |
70 |
|
Обработка горячей водой (3 мин.) |
2 |
6 |
5 |
3 |
6 |
10 |
5 |
12 |
10 |
|
Стратификация (холодильник t = 0…+5ºC) |
6 |
0 |
4 |
14 |
11 |
12 |
21 |
28 |
25 |
|
Обработка этиловым спиртом |
39 |
41 |
24 |
44 |
48 |
29 |
54 |
57 |
41 |
|
Контроль |
25 |
34 |
41 |
49 |
58 |
76 |
76 |
66 |
79 |
Таблица 5
Влияние различных способов предпосевной обработки на прорастание семян H. grandiflorum (сбор 2019 г., на момент проведения опыта свежесобранный материал)
|
Условия прорастания |
Всхожесть (%) |
||||||||
|
7 дней |
15 дней |
30 дней |
|||||||
|
1 |
2 |
3 |
1 |
2 |
3 |
1 |
2 |
3 |
|
|
Скарификация (наждачная бумага) |
20 |
21 |
18 |
51 |
28 |
41 |
72 |
60 |
65 |
|
Обработка горячей водой (3 мин.) |
8 |
6 |
2 |
11 |
10 |
3 |
12 |
20 |
12 |
|
Стратификация (холодильник t = 0…+5ºC) |
1 |
6 |
0 |
6 |
9 |
10 |
18 |
25 |
29 |
|
Обработка этиловым спиртом |
30 |
24 |
23 |
45 |
47 |
29 |
54 |
59 |
56 |
|
Контроль |
10 |
16 |
20 |
13 |
24 |
45 |
27 |
39 |
48 |
H. grandiflorum не размножается вегетативным путем, в связи с чем способ размножения только семенной. Семенное размножение вида затруднено, так как для вида характерна твердосемянность, которую можно нарушить механическим, температурным и химическим воздействием [Попцов, 1976; Николаева, 1985]. У видов, обладающих твердосемянностью и гетерокарпией, лишь часть семян прорастают относительно быстро. Семена различных видов копеечников способны длительное время храниться в почве. Всходы появляются периодически за счет семян нового урожая и запаса их в почве.
Из полученных данных видно, что семена H. grandiflorum обладают различной энергией прорастания. Абсолютная всхожесть определялась на 30-й день.
При стратификации отдельные семена копеечника крупноцветкового начинают прорастать уже на 7-й день. Обработка этиловым спиртом и наждачной бумагой увеличивает число проросших семян. Обработка кипятком в течение 3 мин. оказалась губительной для семян H. grandiflorum , вероятно, температурный предел для них ниже, чем предполагалось, или такая обработка вызвала более глубокий физиологический покой семян. Спирт играет роль не растворителя каких-либо веществ, а промокашки, т.е. лишь смачивает стенки пор, мельчайших канальцев, что способствует проникновению в них воды.
Опыты показали, что семена копеечника крупноцветкового прорастают в широком температурном диапазоне – от +5 до +28ºС. Однако интервал постоянных температур, в пределах которого наблюдается достаточно высокая всхожесть, составляет +20…+25ºС. При этих температурах максимальная всхожесть сочетается с максимальной скоростью прорастания.
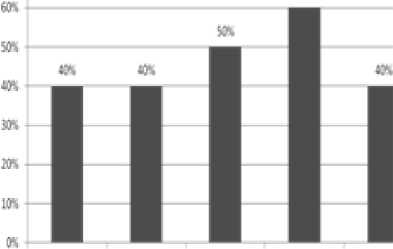
В условиях лаборатории биотехнологии эмпирическим путем определяли время поверхностной стерилизации, которое зависело от процента жизнеспособных регенерантов. Использование препарата «Лизоформин 3000» позволило получить максимальный выход стерильных эксплантов H. gran-diflorum. Оптимальным режимом стерилизации является 10%-ный раствор «Лизоформин 3000» в течение 5 мин. В данном случае был получен самый большой процент стерильных эксплантов – 60% (рис. 2).
1Л-- ж
1 2 3 4 5
Рис. 2. Выход жизнеспособных эксплантов H. grandiflorum в зависимости от режима стерилизации:
-
1 – контроль, дистилированная вода; 2 – Белизна 20%-ная, 5 мин.; 3 – Белизна 20%-ная, 7 мин.; 4
– «Лизоформин 3000» 10%-ный, 5 мин.; 5 – «Лизоформин 3000» 10%-ный, 7 мин.
При увеличении времени стерилизации увеличивался процент стерильных, но повышался процент непрорастающих семян и растягивались сроки прорастания.
Также были исследованы всхожесть и динамика прорастания в зависимости от состава питательной среды.
Для изучения семенного размножения копеечника крупноцветкового был заложен эксперимент по проращиванию семян на питательной среде (рис. 3).
Семена на жидкой питательной среде начали прорастать на 9-й день после введения в культуру in vitro, тогда как на агаризованной ‒ на 10-й день. Кроме того, динамика прорастания семян H. gran-diflorum на жидкой и агаризованной питательных средах отличались. Так, на 12-й день на жидкой питательной среде – 4 проростка, на агаризован-ной – 2; на 14-й – 5 и 3 проростка соответственно. Следует отметить, что на жидкой питательной сре- де развивались проростки нормальной морфологии, тогда как на агаризованной среде некоторые из них имели уродства. Стерильные проростки в дальнейшем делили на фрагменты и использовали в качестве вторичных эксплантов на следующих этапах культивирования in vitro.
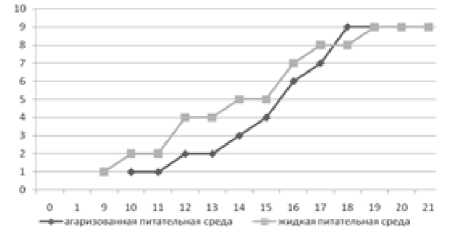
Рис. 3 . Динамика прорастания семян H. grandiflorum на агаризированной и жидкой питательных средах МС
Таким образом, использование жидких питательных сред для проращивания семян редких видов растений, в том числе и H. grandiflorum , весьма перспективно.
Заключение
В результате проведенных исследований по изменчивости семян копеечника крупноцветкового исследуемых популяций, обнаружено небольшое варьирование по индексу длина-ширина, что свидетельствует о стабильности данного признака. Наличие изменчивости морфологических признаков плодов вида свидетельствует о влиянии широкого диапазона различных факторов внешней среды (район произрастания, сообщество, субстрат, антропогенные воздействия и т. д.).
Для интродукционных исследований рекомендуется использовать только семенной материал, так как в условиях культивирования H. grandiflo-rum проходит неполный онтогенез (нет постгенеративного периода): вегетирует, цветет, плодоносит и отмирает на генеративной стадии развития, как правило, уже в конце первого года. Посев следует производить в осенний период для прохождения семенами естественной стратификации.
В результате исследований по стерилизации семян при введении в культуру in vitro установлено влияние режимов стерилизации на сроки прорастания. Так, при увеличении времени стерилизации увеличивался процент стерильных семян, но повышался процент непрорастающих и растягивались сроки прорастания. Экспериментально был подобран оптимальный режим стерилизации семян копеечника крупноцветкового – 10%-ный раствор «Лизоформин 3000» в течение 5 мин., процент стерильных эксплантов достигал 60%.
Разработанные приемы получения растений-регенерантов в культуре изолированных тканей могут быть использованы для сохранения генофонда редких видов копеечников в коллекциях in vitro .
Список литературы Особенности семенного размножения Hedysarum grandiflorum Pall. ex situ и in vitro
- Андреев Л.Н., Горбунов Ю.Н. Сохранение редких и исчезающих растений ex situ: достижения и проблемы // Изучение и охрана разнообразия фауны, флоры и основных экосистем Евразии: материалы междунар. конф. М., 2000. С. 19-23.
- Белолипов И.В. О сохранении и размножении редких, реликтовых, эндемичных видов растений природной флоры Средней Азии на примере интродукционных работ ботанического сада АН УзССР // Узбекский биологический журнал. 1974. № 1. С. 34-37.
- Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнологии на их основе: учеб. пособие. М.: ФБК-Пресс, 1999. 160 с.
- Вечернина Н.А. Сохранение биологического разнообразия редких, исчезающих видов, уникальных форм и сортов растений методами биотехнологии: автореф. дис. ... д-ра биол. наук. Барнаул, 2006. 33 с.
- Ильина В.Н. Перспективы интродукции некоторых видов семейства бобовые в связи с особенностями начальных периодов онтогенеза // Самарский научный вестник. 2013. № 3 (4). С. 44-47.
- Красная книга Волгоградской области. Воронеж: Издат-Принт, 2017. Т. 2. Растения и другие организмы. 268 с.
- Кузнецова М.Н. Семенное воспроизведение копеечника крупноцветкового (Hedysarum grandiflorum Pall.) // Современные проблемы морфологии и репродуктивной биологии семенных растений: материалы междунар. конф. Ульяновск, 2008. С. 76-84.
- Лаврентьев М.В. Характеристика репродуктивных особенностей Hedysarum grandiflorum (Faba-ceae) в южной части приволжской возвышенности // Бюллетень Ботанического сада Саратовского государственного университета. 2016. Т. 14, вып. 2. С. 35-43.
- Луконина А.В. Растительный покров Волгоградской области как источник растений для интродукции: автореф. дис. ... канд. биол. наук. М., 2005. 24 с.
- Малаева Е.В. Сохранение редких видов растений в коллекции in vitro Волгоградского регионального ботанического сада // Проблемы ботаники Южной Сибири и Монголии. 2019. № 18. С. 606-610.
- Малаева Е.В., Супрун Н.А. Изучение и сохранение редких видов растений в Волгоградском региональном ботаническом саду // Ботаника в современном мире: тр. XIV Съезда РБО. Махачкала: Алеф, 2018. Т. 2. С. 283-285.
- Молканова О.И. Использование биотехнологических методов для размножения и сохранения редких видов растений // Бюллетень Главного ботанического сада. 2017. № 1(203). С. 42-48.
- Николаева М.Г., Разумова М.В., Гладкова В.Н. Справочник по проращиванию покоящихся семян. Л.: Наука, 1985. 348 с.
- Попцов А.В. Биология твердосемянности. М.: Наука, 1976. 157 с.
- Прилипко Л.И. Задачи ботанических садов в сохранении редких и исчезающих видов растений местной природной флоры // Бюллетень Главного ботанического сада. 1980. Вып. 118. С. 3-8.
- Скворцов А.К. Перспективы и задачи изучения и культивирования редких и исчезающих видов природной флоры СССР // Редкие и исчезающие виды природной флоры СССР, культивируемые в ботанических садах и других интродукционных центрах страны. М.: Наука, 1983. С. 15-21.
- Стратегия ботанических садов России по сохранению биологического разнообразия растений. М.: Красная Звезда, 2003. 32 с.
- Супрун Н.А. Копеечники (Hedysarum L.) Нижнего Поволжья (изменчивость и систематика): авто-реф. дис. ... канд. биол. наук. М., 2014. 22 с.
- Тихомиров В.Н. Культивирование редких и исчезающих видов растений в ботанических садах как один из методов охраны генофонда флоры // Особенности развития редких растений при культивировании в центре европейской части СССР. М., 1986. С. 4-7.
- Benson E.E. et al. In vitro micropropagation of Primula scotica: a rare Scotish plant // Biodiversity and conservation. 2000. Vol. 9. P. 711-726.
- Davy A.J., Jefferies R.L. Approaches to the monitoring of rare plant populations // Biol. aspects rare plant conserv. Proc. Intern. Conf. Cambridge, 1981. P. 219-232.
- Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue cultures // Phsiol. plant. 1962. Vol. 15, № 3. P. 473-497.


