Особенности сезонного накопления суммы окисляемых веществ в растениях коровяка обыкновенного {Verbascum thapsus L.)
Автор: Ягонцева Т.А.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Ботаника
Статья в выпуске: 6, 2005 года.
Бесплатный доступ
Проведен количественный анализ суммарного содержания окисляемых веществ в траве коровяка обыкновенного. Максимальное накопление окисляемых веществ отмечено в фазу бутонизации и остается на достаточно высоком уровне в период цветения и плодоношения. В результате хроматографического анализа извлечений из травы к. обьгсновенного выявлено 7 веществ, отнесенных к фенолкарбоновым кислотам. Идентифицированы хлорогеновая и кофейная кислоты
Короткий адрес: https://sciup.org/147204381
IDR: 147204381 | УДК: 581.9
Текст научной статьи Особенности сезонного накопления суммы окисляемых веществ в растениях коровяка обыкновенного {Verbascum thapsus L.)
Пермский государственный университет, 614990, Пермь, ул. Букирева, 15
Проведен количественный анализ суммарного содержания окисляемых веществ в траве коровяка обыкновенного. Максимальное накопление окисляемых веществ отмечено в фазу бутонизации и остается на достаточно высоком уровне в период цветения и плодоношения. В результате хроматографического анализа извлечений из травы к. обыкновенного выявлено 7 веществ, отнесенных к фенолкарбоновым кислотам. Идентифицированы хлорогеновая и кофейная кислоты.
Комплексное использование всех частей растения в качестве лекарственных средств в медицине или ветеринарии - основа рационального использования лекарственных ресурсов. Лекарственным сырьем некоторых видов Verbascum L. - коровяк (сем. норичниковые - Scrophulariaceae) являются только венчики цветков (Государственный..., 2001), а большая часть растительного сырья не используется. Поэтому целесообразно проведение фитохимических и фармакологических исследований для наиболее рационального применения всех частей растения.
Одной из групп биологически активных веществ являются фенолокислоты. Они играют важную роль в биосинтезе таких соединений, как флавоноиды и кумарины, обладающие многообразным терапевтическим действием. Производные фенолкарбоновых кислот, наряду с другими полифенольными соединениями, проявляют антиоксидантную активность (Дроздова, Бубенчиков, 2004). Данные по составу фенолокислот у видов р. Verbascum L. достаточно ограниченны. В плодах V. thapsus L. обнаружена вератровая кислота (De Pascual, Diaz, Grande, 1978), в цветках V. phlomoides L. и V. thapsiforme Schrad. выявлено присутствие 3,4-дигидроксикоричной, протокатеховой, п-оксибензойной, n-кумаровой, ванилиновой и феруловой кислот (Swiatek, Kurowska, Rotkiewicz, 1984), кроме того, в семенах V. lychnitis L. и V. phoeniceum L. отмечено преобладание в комплексе оксикоричных кислот хлорогеновой кислоты (Доля, Литвиненко, 1996).
Целью нашей работы было изучение качественного состава фенолокислот и количественное содержание комплекса полифенольных веществ в ор ганах коровяка обыкновенного (V. thapsus), произрастающего в условиях Западного Урала.
Образцы для анализа собирались в период цветения во второй половине июля 2004 г. Образец дикорастущих растений собран на насыпи железнодорожного полотна около 30-го км горнозаводского направления (Пермский район). Для исследования качественного состава фенолкарбоновых кислот применяли метод двумерной бумажной хроматографии. Воздушно-сухое сырье экстрагировали 70% спиртом этиловым в соотношении 1:10. Разделение компонентов проводили на хроматографической бумаге "Ленинградская средняя" в следующих системах: н-бутанол - кислота уксусная ледяная - вода (4:1:2) - первое направление; 2% уксусная кислота -второе направление. В качестве хромогенных реактивов для обнаружения фенолокислот применяли пары гидроксида аммония и реактив Гепфнера (За-прометов, 1974; Бандюкова, 1983). Для идентификации веществ использовали аутентичные образцы. Количественный анализ суммы полифенольных веществ проводили перманганатометрическим методом (Государственная..., 1987) в трехкратной повторности. Для анализа использовали сырье культивируемого коровяка в разных фазах развития одного года сбора (июнь-сентябрь 2004 г.), выращенного в питомнике лекарственных растений ПГФА.
Результаты хроматографического анализа представлены в табл. 1 и на рис. 1. Выявлено 7 веществ группы фенолкарбоновых кислот. В УФ-свете пятна флюоресцируют голубым цветом, после обработки парами аммиака окраска усиливается, пятна начинают светиться, приобретая оттенки от яркоголубого до желто-зеленого. После обработки
Особенности сезонного накопления суммы окисляемых веществ ...
хроматограмм реактивом Гепфнера вещества окрашиваются в желто-коричневый цвет. Это доказывает, что данные вещества относятся к фенолкарбоновым кислотам. Вещества 3, 5 и 7 присутствуют не во всех образцах, а наиболее стабильно встречаются вещества 1, 2, 4 и 6. В результате сравнения опытных образцов с аутентичными образцами было определено вещество 1 (Rf 0.57) как хлорогеновая кислота и вещество 3 (Rf 0.20) как кофейная кислота.
СНзСООН, 2%
Рис. 1. Схема двумерной хроматограммы фенолокислот травы V. thapsus
Фенолкарбоновые кислоты наряду с дубильными веществами, окисляемыми фенольными соединениями, аскорбиновой и аминокислотами относят к группе полифенольных веществ. Исследована се зонная динамика накопления суммы окисляемых веществ в образцах, заготовленных в различные фенологические фазы (табл. 2).
Таблица 1
Хроматографическая характеристика фенолокислот V. thapsus
|
№ вещества |
Значение Rf* |
Окраска пятен |
|||
|
БУВ (4:1:2) |
СНзСООН, 2% |
УФ |
УФ+ИНз |
Реактив Гепфнера |
|
|
1 |
0.47 |
0.57 |
Голубой |
Желто-зеленый |
Желто-коричневый |
|
2 |
0.50 |
0.71 |
Голубой |
Желто-зеленый |
Желто-коричневый |
|
3 |
0.59 |
0.20 |
Бледно-голубой |
Ярко-голубой |
Желто-коричневый |
|
4 |
0.59 |
0.68 |
Голубой |
Желто-зеленый |
Желто-коричневый |
|
5 |
0.59 |
0.81 |
Голубой |
Ярко-синий |
Ярко-синий |
|
6 |
0.70 |
0.70 |
Бледно-голубой |
Ярко-голубой |
Ярко-голубой |
|
7 |
0.82 |
0.71 |
Голубой |
Сине-голубой |
Сине-голубой |
|
Хлорогеновая кислота |
- |
0.58 |
Голубой |
Желто-зеленый |
Желто-коричневый |
|
Кофейная кислота |
- |
0.23 |
Голубой |
Ярко-голубой |
Желто-коричневый |
|
Феруловая кислота |
- |
0.27 |
Голубой |
Темно-голубой |
Желто-коричневый |
’Среднее значение пяти измерений
Таблица 2
Содержание окисляемых веществ в органах V. thapsus в различные фазы развития, %
|
Органы растения |
Вегетация |
Бутонизация |
Цветение |
Плодоношение |
|
Корни |
3.4±0.3 |
3.2±0.3 |
2.6±0.3 |
2.7±0.3 |
|
Стебли |
1.9±О.З |
2.4±0.3 |
4.3±0.3 |
|
|
Листья |
2.5±0.3 |
5.2±0.3 |
5.1±0.3 |
4.0±0.3 |
|
Цветки ■ |
9.3±0.3 |
2.8±0.3 |
— |
|
|
Семена |
— |
— |
0.8±0.3 |
|
|
Трава |
— |
5.9±0.3 |
2.2±0.3 |
3.9±0.3 |
Анализ полученных результатов показал, что максимальное накопление суммы окисляемых веществ в органах и траве к. обыкновенного наступает в фазе бутонизации и уменьшается к фазе плодоношения. Выявлено, что в разных органах динамика содержания исследуемой группы веществ различна. Так, в корнях в фазу вегетации содержание этих веществ максимально, и оно уменьшается к фазе плодоношения, а в стеблях наоборот, идет увеличение их от фазы бутонизации к фазе плодоношения. Суммарное содержание окисляемых веществ в листьях максимально в фазу бутонизации и остается на достаточно высоком уровне вплоть до периода плодоношения. В генеративных органах содержание окисляемых веществ резко отличается, так, в бутонах отмечено наибольшее их количество - 9.3%, а в цветках - уже 2.8%, в семенах их содержание минимально (0.8%).

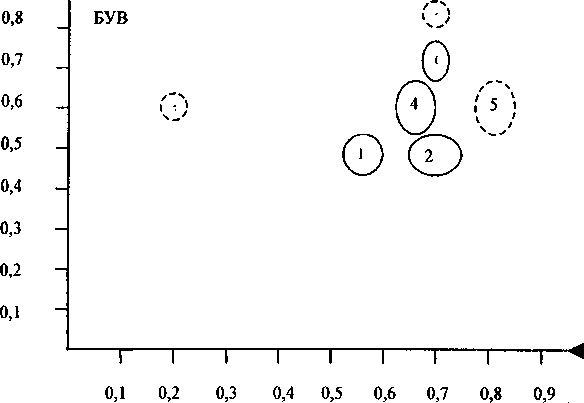
Рис. 2. Содержание окисляемых веществ в культивируемых (?) и дикорастущих (2) образцах V. thapsus
Нами проведен сравнительный анализ суммарного содержания окисляемых веществ в культивируемой и дикорастущей формах коровяка. Результаты представлены на рис. 2. Сумма окисляемых веществ в органах обеих форм к. обыкновенного в целом различается незначительно. Листья культивируемых растений характеризуются повышенным суммарным содержанием окисляемых веществ.
Выводы
В результате хроматографического анализа извлечений из травы V. thapsus выявлено 7 веществ, отнесенных по флюоресценции в УФ-свете и по реакциям на хромогенные реактивы к фенолкарбо новым кислотам. Два вещества при сравнении с аутентичными образцами определены как хлоро-геновая кислота (вещество 1) и кофейная кислота (вещество 3).
Исследование сезонной динамики суммы полифенольных веществ в подземных и надземных органах V. thapsus показало, что максимальное накопление окисляемых веществ наступает в фазе бутонизации и остается на достаточно высоком уровне до периода плодоношения. Наибольшее количество окисляемых веществ в фазу бутонизации содержится в генеративных органах, а в период цветения и плодоношения - в ассимилирующих частях растения, т.е. в листьях и стеблях.
Общий уровень накопления полифенольных веществ в дикорастущих и культивируемых формах V. thapsus примерно одинаков.
Автор благодарит к.х.н. В.М. Пертиченко за помощь в выполнении работы и подготовке статьи.
Список литературы Особенности сезонного накопления суммы окисляемых веществ в растениях коровяка обыкновенного {Verbascum thapsus L.)
- Баидюкова В.А. Фенолокислоты растений, их эфиры и гликозиды//Химия прир. соединений. 1983. №2. С. 263-273.
- Государственная фармакопея СССР. Вып. 1: Общие методы анализа. 11-е изд. М., 1987. Государственный реестр лекарственных средств. М.,2001. 1277 с.
- Доля B.C., Литвиненко О.В. Жирные масла семян некоторых видов сем. Scrophulariaceae и состав фенолов семян двух видов Verbascum L.//Раст. ресурсы. 1996. Т. 32, вып. 4. С. 44-52.
- Дроздова И.Л., Бубенчиков Р.А. Антиоксидантная активность полифенольных комплексов Viola odorata L. и Fragaria vesca L.//Раст. ресурсы. 2004. Т. 40, вып. 2. С. 92-96.
- Запрометов М.Н. Основы биохимии фенольных соединений. М.: Высшая школа, 1974. 214 с.
- De Pascual T.J., Diaz F., Grande M. Components del Verbascum thapsus L.//An quim. 1978. Vol. 74, № 2. P. 311-314; № 12, P. 1566-1567.
- Swiatek L, Kurowska A., Rotkiewicz D. Analiza kwas6w thjszczowych I fenolowych wystepujacych we fios verbasci II Herba pol. 1984. Vol. 30, Xs 3-t. P. 173-181.


