Особенности синтеза феррита кобальта на солнечной печи
Автор: Пайзуллаханов М.С.
Журнал: Журнал Сибирского федерального университета. Серия: Техника и технологии @technologies-sfu
Рубрика: Исследования. Проектирование. Опыт эксплуатации
Статья в выпуске: 4 т.18, 2025 года.
Бесплатный доступ
Методом синтеза из расплава на солнечной печи может быть получен материал СоFe2O4 со структурой шпинели Fd3m сингонии с параметром элементарной ячейки a = 8,39 Å. Показано, что такой материал проявляет стойкость к воздействию водяных паров, имеет низкое водопоглощение. Выявлено, что механизм электрической проводимости перовскитового материала состава СоFe2O4 является электронным и связан с прыжками поляронов. Сделано предположение о том, что CoFe2O4 может быть использован как катализатор при получении синтез-газа. В результате проделанной работы получена зависимость выхода синтез-газа от массы катализатора. При некаталитической газификации шелухи риса выход газообразных продуктов составил 34 %, а твердый остаток образовался в количестве 37 %. В случае каталитической газификации наблюдается увеличение выхода газовой фазы до 60 %. Также наблюдается ускорение процесса газификации.
Феррит кобальта, водород, катализатор, возобновляемая энергия, ресурс, эффективность, солнечная печь, шпинель, керамика, магнит
Короткий адрес: https://sciup.org/146283102
IDR: 146283102 | УДК: 669.112.228.1–044.962
Текст научной статьи Особенности синтеза феррита кобальта на солнечной печи
Сегодня потребность в топливе и электроэнергии в нашей стране возрастает, а это требует эффективного и целенаправленного использования природных ресурсов. Поэтому поощряется широкое применение водорода и возобновляемых источников энергии для потребления и производства населением. Водород рассматривают в качестве топлива будущего, поскольку он является экологически чистым энергоносителем и играет важную роль в быстро развивающейся технологии различных топливных элементов.
При электро- или фотохимическом расщеплении воды образуются водород и кислород, процессы разложения воды могут служить для получения возобновляемой энергии, однако, как правило, выделение кислорода ускоряет один катализатор, а выделение водорода – другой. Необходимость использования двух катализаторов является существенной проблемой для упрощения процесса – поскольку каждому катализатору требуется свой собственный подход к оптимизации, их интеграцию в единое устройство не всегда просто обеспечить.
Свойства материала, такие как размер частиц, структура, микроструктура и удельная поверхность, фазовая стабильность, определяются методом его получения. Основными методами синтеза являются твердофазные реакции, термическое разложение, гидротермальные и соль-– 489 – вотермальные методы, совместное осаждение, золь-гель и микроволновая обработка. При этом каждый метод имеет свои преимущества и недостатки, и нет оптимального способа получения высококачественных ферритовых материалов из шпинели. Поэтому изучение структуры и свойств феррита кобальта СоFe2O4, синтезированного из расплава смеси Fe2O3 + СоO на солнечной печи, является актуальным.
Материалы со структурой шпинели MFe 2 O 4 (М – двухвалентный катион) представляют собой многофункциональную керамику и привлекают большое внимание исследователей. Например, шпинели на основе феррита кобальта (II) CoFe 2 O 4 относятся к магнитным материалам [1, 2]. В то же время феррит кобальта может быть использован как электрод литий-ионных источников тока [3], топливных элементов [4]. Предполагается, наблюдаемые свойства могут быть регулированы варьированием микроструктуры керамического материала. Следовательно, изучение феррита кобальта со структурой шпинели, синтезированного из расплава на солнечной печи, представляется актуальным.
В данной работе был исследован катализатор CoFe 2 O 4 , синтезированный в потоке солнечного излучения плотностью 200 Вт/см2 в однозеркальной солнечной печи.
Методология
Солнечные технологии, в отличие от традиционных, характеризуются высокой скоростью нагрева, позволяют получить мелкодисперсный однородный материал высокой химической чистоты. В то же время в ферритовых материалах одновременно происходит процесс ферритизации. Такие особенности обуславливают возможности создания усовершенствованной керамики, композитов интерметаллических составов, функционально-градиентных материалов [5–8].
Стехиометрические количества сырья, рассчитанные в мольных процентах, сначала смешивали и измелчали мокрым способом на шаровой мельнице с корундовыми шарами в течение 8 часов. На базе готовой смеси формовались (50 кН) образцы диаметром 5 мм и длиной 140 мм, которые устанавливались на фокальную плоскость солнечной печи и расплавлялись под воздействием концентрированного солнечного излучения при плотности потока 200 Вт/см2. Расплавы охлаждались методом слива в воду, при которой скорость охлаждения составляла порядка 1000 град/с. Затем материал измельчали мокрым способом до размера 1–10 мкм [9–11].
Рентгенофазовый анализ образцов полученных материалов выполнен на дифрактометре Panalytical Empyrean с программным обеспечением в геометрии отражения Брэгга-Брентано с CuKα – излучения (λ = 1,5418 Å). Данные были получены между 10о и 64 о с шагом 0,5о.
Исследования морфологии и микроструктурных особенностей образцов материалов проводили методом сканирующей электронной микроскопии (СЭМ) Центра передовых технологий Министерства инновационного развития.
Термогравиметрические (ТГ) кривые были получены на приборе TG50 в воздушном потоке со скоростью нагрева 10 градусов Цельсия в минуту с использованием около 50 мг пробы.
Температурный коэффициент термического расширения измеряли на катетометре в интервале температур 300–1250 K. Электрическое сопротивление измеряли четырехконтактным методом в интервале температур 300–1300 K. На рис. 1 приведены кривые ДТА и ТГ образцов смеси оксидов кобальта и железа.
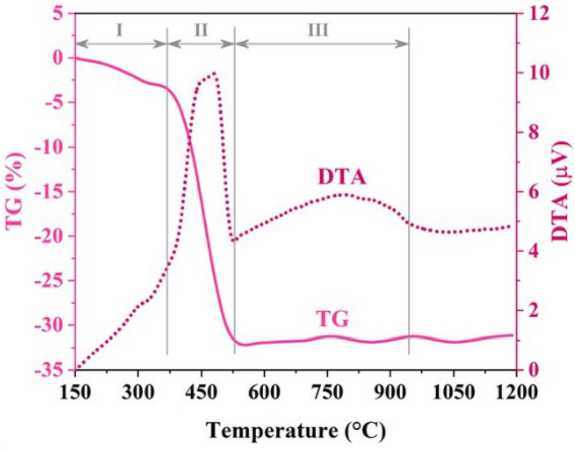
Рис. 1. ДТА и ТГ образцов смеси оксидов кобальта и железа
Fig. 1. DTA and TG of cobalt and iron oxide mixture samples
Анализ ДТА-ТГ проводится для исследования поведения предшественника CoFe 2 O 4 при прокаливании. Как видно на рис. 1, линии ДТА представляют собой два заметных экзотермических пика. Первый резкий приписывается к образованию ферритной фазы шпинели. При этом диапазоне температур остаточные компоненты разлагаются, и впоследствии в интервале 400–520 °C аморфный порошок кристаллизуется с образованием нанокристаллическо-го шпинель-феррита. Широкий пик с центром при ~ 800 °C представляет собой уплотнение CoFe2O4. Наночастицы CoFe2O4 агломерируются из-за их высокой поверхностной энергии и магнитных свойств, что приводит к выделению тепла, которое проявляется в широком пике.
Процент потери массы свежеприготовленного порошка, нагретого до 1200 °C, представлен на рис. 1. Первый этап потери массы прихватки происходит при температуре ~ 400 °C, что представляет собой испарение поглощенной воды и термическое разложение или сжигание других органических соединений. На этот этап приходится менее 5 % от общей потери массы. Вторая ступень имеет большую массу потери, связанной с образованием фазы феррита шпинели. Эта стадия соответствует резкому экзотермическому пику кривой ДТА. На графике ТГ больше не было обнаружено потери массы при температуре выше ~ 600 °C.
Как обсуждалось, первая стадия (150–375 °C) представляет собой удаление поглощенной воды и других органических соединений. Примечательно, что одновременное появление экзотермических и эндотермических реакций не позволяет обнаружить очевидный пик на кривых ДТА. На средней стадии, сравнивая кривые ДТА, видно, что образование CoFe2O4 сдвигается в сторону более высокого температурного диапазона.
Увеличение температуры на втором этапе потери массы будет объяснено аналогичным образом. Последний этап (до 1000 °C) содержит широкий экзотермический пик ДТА, что связано с уплотнением. Поэтому никакой потери массы на этом этапе не было получено.
Далее нами проведен синтез феррита кобальта на основе смеси оксидов кобальта и железа на солнечной печи. На рис. 2 показана рентгенограмма образца материала состава CoFe 2 O 4, полученного синтезом из расплава на солнечной печи.
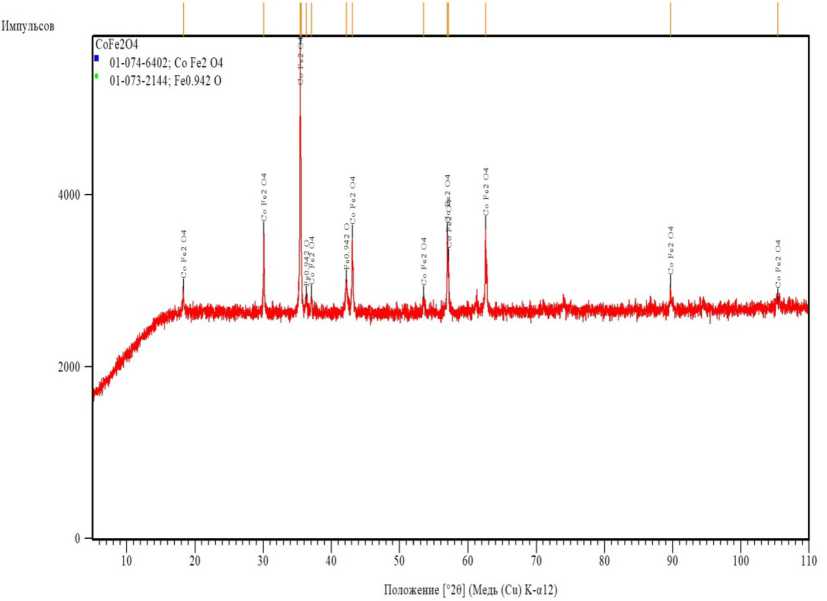
Рис. 2. Рентгенограмма образца материала, полученного синтезом из расплава на солнечной печи состава CoFe 2 O 4
Fig. 2. X-ray diffraction pattern of a sample of material obtained by synthesis from melt on solar furnace of Co-Fe2O4 composition
Анализ рентгенограмм показал, что полученный материал заданного состава имеет структуру шпинели сингонии F d3m с параметром решетки а = 8,39 Å
Рентгеновская плотность рассчитывалась по формуле:
_ 8M dx~~^N~A’ где а – параметр решетки, NA– число Авагадро, М – молярная масса. Как показывают расчеты, рентгеновская плотность составляет 5,28 г/см3
Для оценки степени кристалличности образцов воспользовались соотношением:
1 - х 100 % где Iфон – интенсивность фонового рассеяния рентгеновского излучения, I311 – интенсивность рентгеновского отражения на плоскости 311. Расчеты показали, что степень кристалличности составляет 88 %.
Вклад микронапряжений в кристаллической решетке со средним размером кристаллитов, приводящим к уширению пика, рассчитывали по методу Уильямсона-Холла.
pcosd = I— I + 4s sin6
где β – полная ширина на половине высоты (FWHM), θ – угол дифракции, K – коэффициент формы, λ – излучение длины волны, t – средний размер кристаллитов, ε – размер микронапряжения. Линейная аппроксимация графика зависимости βcosθ от 4sinθ дает ε как наклон и Kλ/ t как точка пересечения. Для образцов феррита кобальта, синтезированных на солнечной печи, получены следующие значения: t = 70 нм, ε = 0,03 %. На рис. 3 и 4 приведены зависимости усадки и кажущейся плотности материала от температуры спекания.
Как видно из рис. 3 и 4, при повышении температуры спекания керамики наблюдается увеличение усадки и кажущейся плотности. На рис. 5 и 6 приведены зависимости электрического сопротивления и водопоглощения образца материала от температуры спекания.
Как видно из рис. 5, с ростом температуры наблюдается возрастание электрического сопротивления, т.е. образцы материала демонстрируют полупроводниковый характер с электронным механизмом проводимости. В то время как из рис. 6 видно, что повышение температуры спекания керамики до 1200 °C вызывает уменьшение водопоглощения.
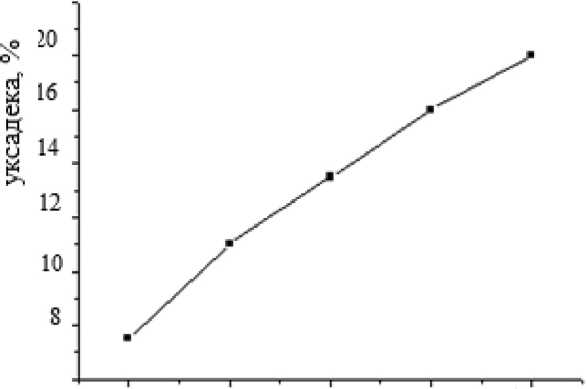
1000 1100 1150 1200 1250
температура спекания, °C
Рис. 3. Зависимость усадки от температуры
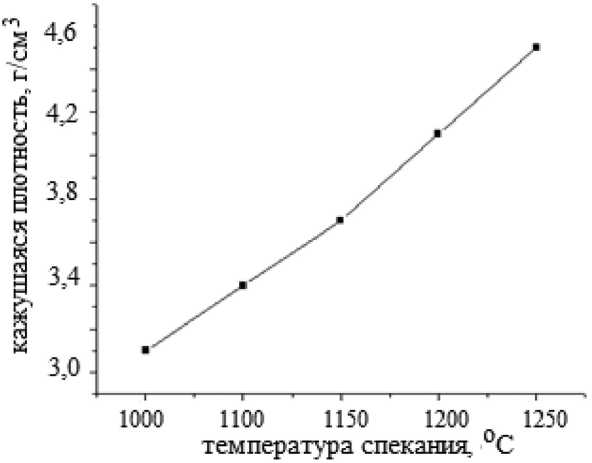
Рис. 4. Зависимость плотности от температуры спекания
спекания
-
Fig. 3. Dependence of shrinkage on sintering temperature
-
Fig. 4. Dependence of density on sintering temperature
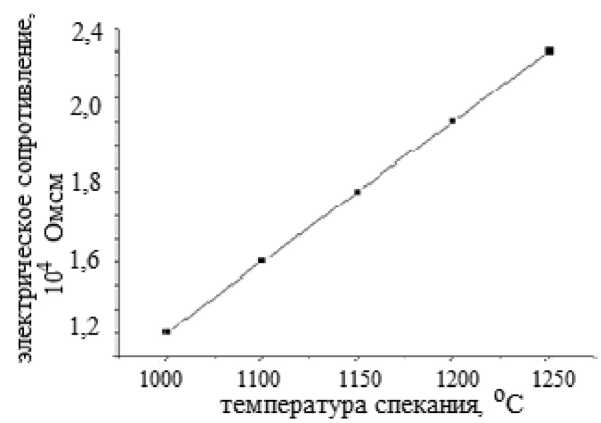
Рис. 5. Зависимость электрического сопротивления от температуры спекания
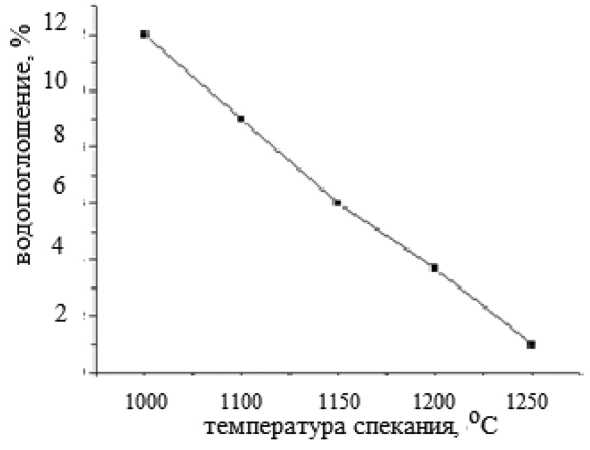
Рис. 6. Зависимость водопоглощения от температуры спекания
-
Fig. 5. Dependence of electrical resistance on sintering temperature
-
Fig. 6. Dependence of water absorption on sintering temperature

а)
б)
Рис. 7. Микроструктура образца материала состава CoFe2O4, спеченного при 1100 (а) и 1250 оС (б)
Fig. 7. Microstructure of a sample of CoFe2O4 material sintered at 1100 (a) and 1250 oC (б)
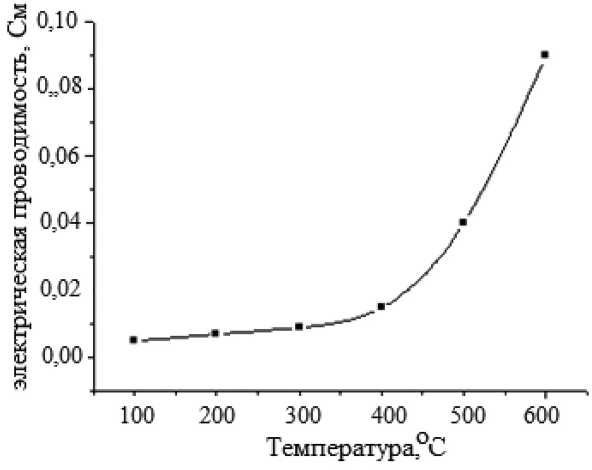
Рис. 8. Температурная зависимость электрической проводимости образца, спеченного при 1250 оС
Fig. 8. Temperature dependence of electrical conductivity of the sample sintered at 1250 oC
На рис. 7 приведена микроструктура образца материала, спеченного при 1100 и 1250 оС. Из рисунка видно, что средний размер кристаллитов зерен составляет 30–40 мкм. Причем зерна имеют форму преимущественно сферолитов и искривленных цилиндров.
На рис. 8 приведена температурная зависимость электрической проводимости образа материала, спеченного при 1250 оС. Как видно из рисунка, электрическая проводимость на постоянном токе увеличивается с повышением температуры. Можно предположить, что механизм электрической проводимости связан с прыжками поляронов. По-видимому, при достаточно большой тепловой энергии электроны пересекают барьер и участвуют в прыжках. С увеличением температуры скорость успешных прыжков увеличивается, что, в свою очередь, приводит к увеличению проводимости [12]. С другой стороны, повышение температуры также стимулирует увеличение количества вакансий, которые априори ответственны за увеличение проводимости по модели скачкообразной релаксации [13].
Согласно [12, 13], механизм электрической проводимости перовскитового материала состава CoFe 2 O 4 является электронным и связан с прыжками поляронов. Как показывает анализ данных [14], добавка водорода в топливные смеси способна существенно повысить КПД двигателей внутреннего сгорания, снизить химический недожог и уменьшить содержание вредных примесей в отходящих газах. В этом отношении перспективной технологией, позволяющей получать водородсодержащее топливо с высокой концентрацией водорода без примесей оксидов углерода, является каталитический пиролиз углеводородов.
CH 4 → 2H 2 + C.
Пиролиз проводят с использованием проточной каталитической установки Autoclave Engineers BTRS-Jn в трубчатом металлическом реакторе при температуре процесса 675 °C и давлениях 1 и 5 атм. Из вышеприведенной реакции видно, что помимо водорода в ходе данного процесса образуется также углерод. По всей видимости, получаемый при этом углерод представляет собой нановолокнистый продукт с уникальными физико-химическими свойствами [15]. Синтезированные материалы охарактеризованы методами рентгенофазового анализа, электронной микроскопии, низкотемпературной адсорбции азота, методами Дебая-Шеррера. Нами определено, что феррит кобальта имеет развитую поверхность, значение площади поверхности по методу составляет 16 м2/г, средний размер кристаллитов, определенный по уравнению Дебая-Шеррера, составляет 4,0 нм.
Таблица 1. Влияние катализатора на выход газовой смеси из шелухи риса
Table 1. Effect of catalyst on the yield of gas mixture from rice husk
|
Количество катализатора, масс. % |
5 |
10 |
15 |
|
Выход продукта – газовой смеси, % от массы |
40 |
54 |
60 |
Для исследования процесса газификации использовалась шелуха риса с влажностью 8 % и зольностью 22.5 %. Исследование процесса газификации проводилось в интервале температур 550–650 °C. Скорость подачи газа-носителя (воздуха) варьировалась в интервале от 0.6 до 0.9 л/мин. Масса навески шелухи риса составляла 2 г. В качестве катализаторов процесса газификации использовался феррит кобальта (CoFe2O4). Массовое содержание катализатора в составе пробы изменялось от 1 до 15 % масс. В табл. 1 приведены результаты газификации органического сырья – шелухи риса в присутствии феррита кобальта как катализатора.
Заключение
Технологический маршрут, включающий плавление на солнечной печи стехиометрической смеси оксида кобальта с оксидом железа, закалку расплава в воду, измельчение отливка и формование с последующим спеканием при 1300 К, позволяет получить материал на основе шпинель структуры феррита кобальта CoFe2O4 c развитой тонкой микроструктурой (со средним размером зерен 2–5 мкм).
Методом синтеза из расплава на солнечной печи может быть получен материал СоFe2O4 со структурой шпинели F d3m сингонии с параметром элементарной ячейки a = 8,39 Å.
Показано, что такой материал проявляет стойкость к воздействию водяных паров, имеет низкое водопоглощение.
Выявлено, что механизм электрической проводимости перовскитового материала состава СоFe 2 O 4 является электронным и связан с прыжками поляронов.
Сделано предположение, что CoFe2O4 может быть использован как катализатор при получении синтез-газа. В результате проделанной работы получена зависимость выхода синтез-газа от массы катализатора. При некаталитической газификации шелухи риса выход газообразных продуктов составил 34 %, а твердый остаток образовался в количестве 37 %. В случае каталитической газификации наблюдается увеличение выхода газовой фазы до 60 %. Также наблюдается ускорение процесса газификации.
Определены свойства полученных материалов, позволяющие использовать их в кислородных мембранах, катодных и анодных материалах, а также в системах хранения водорода.


