Особенности состава кишечной микробиоты у больных раком толстой кишки
Автор: Волков С.В., Лобанов С.Л., Добродеев А.Ю.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 5 т.21, 2022 года.
Бесплатный доступ
Цель исследования - изучить состав кишечной микробиоты и определить возможности ее использования для диагностики и прогнозирования течения рака толстой кишки (РТК). Материал и методы. В период с 2017 по 2021 г. на базе ФГБОУ ВО «Читинская государственная медицинская академия» проведено исследование, в которое было включено 75 больных РТК (i группа, основная) и 25 здоровых лиц (ii группа, контрольная). В основной группе проводились хирургическое лечение и адъювантная химиотерапия. Для определения состава кишечной микробиоты у больных основной группы забор биоптатов с опухолевой ткани и с визуально не измененной слизистой оболочки толстой кишки производился после завершения операции (из макропрепарата), а у здоровых лиц - с визуально не измененной слизистой оболочки толстой кишки во время видеоколоноскопии. Результаты. При анализе толстокишечной микробиоты у больных РТК установлено достоверное снижение количественного состава Bifidobacterium spp., E. coli (типичные) и увеличение Clostridium spр. относительно здоровых лиц. Выявлена значимая связь количества Lactobacillus spp., Bifidobacterium spp., Bacteroides spp., E. coli - с полом больного; Lactobacillus spp., Bifidobacterium spp., Staphylococcus spp. (CNS) - со степенью дифференцировки опухоли; условно-патогенной микрофлоры - с формой роста опухоли. Отдельные комбинации состава кишечной микробиоты у больных РТК являются факторами прогноза развития послеоперационных осложнений (Lactobacillus spp., Bacteroides spp., E. coli 3,0 КОЕ/г). Заключение. Исследование кишечной микробиоты позволяет дифференцировать больных РТК, а также прогнозировать риск развития послеоперационных осложнений и выживаемость больных.
Рак толстой кишки, кишечная микробиота, диагностика, прогноз
Короткий адрес: https://sciup.org/140296630
IDR: 140296630 | УДК: 616.345-006.6-008.87 | DOI: 10.21294/1814-4861-2022-21-5-102-108
Текст научной статьи Особенности состава кишечной микробиоты у больных раком толстой кишки
Рак толстой кишки (РТК) является одной из наиболее частых злокачественных опухолей среди населения нашей страны [1]. При первичном обращении у 70–80 % больных диагностируется РТК III–IV стадии [2]. Поздняя диагностика является одной из главных причин высокой летальности и низкой выживаемости [3]. Для уменьшения количества запущенных форм рака и снижения высокого уровня летальности необходимо выявление РТК на ранних стадиях. В связи с этим актуальным является поиск новых диагностических маркеров, позволяющих заподозрить данную патологию и предпринять детальное обследование больных.
В настоящее время активно исследуется влияние микробиоты на развитие и течение РТК [4, 5]. Кишечная микробиота ‒ достаточно многообразный, но уравновешенный и четко функционирующий биологический механизм. По данным литературы, опухолевый процесс сопровождается некоторыми качественными и количественными изменениями микробного мира [6]. Изучение характера кишечной микробиоты может не только углубить знания об особенностях РТК, но и внести вклад в фундаментальные вопросы канцерогенеза. При обобщении результатов исследований биопсийного материала у больных РТК выявлено, что имеются количественные и качественные различия среди ряда колоний ( Escherichia/Shi-gella, Bacteroides, Faecalibacterium, Prevotella, Corynebacterium,Oribacterium, Enterococcus, Neisseria, Porphyromonas и Akkermansia ) в опухолевой ткани и неизмененной слизистой оболочке толстой кишки [5, 7].
Целью исследования были изучение состава кишечной микробиоты и определение возможности ее использования для диагностики и прогнозирования течения РТК.
Материал и методы
Работа выполнена на кафедре факультетской хирургии с курсом урологии ФГБОУ ВО «Читинская государственная медицинская академия» в период с 2017 по 2021 г. В исследование включено 75 больных с морфологически верифицированным РТК (I группа, основная) и 25 здоровых лиц (II группа, контрольная). Диагноз у больных РТК устанавливался на основании видеоколоноскопии и гистологического исследования. Для исключения дополнительной патологии в сравниваемых группах проводились общеклинические анализы, рентгенография органов грудной клетки, УЗИ и мультиспиральная компьютерная томография органов брюшной полости, видеогастроскопия и видеоколоноскопия, ЭКГ и осмотр терапевта.
Характеристика по полу и возрасту представлена в табл. 1. Средний возраст в основной и контрольной группах составил 58,7 ± 13,8 и 56,4 ± 11,3 года соответственно, что отвечает статистическим данным о заболеваемости РТК. Соотношение мужчин и женщин в группах – 1:1.
У больных РТК чаще всего опухоль локализовалась в сигмовидном и ректосигмоидном отделах – по 18 (24 %) наблюдений соответственно (табл. 2). В большинстве случаев выявлен РТК II стадии – 56 (74,7 %), реже встречался РТК III стадии – 13 (17,3 %) больных, у которых отмечалось метастатическое поражение от 1 до 3 регионарных лимфоузлов. Наиболее часто регистрировались умереннодифференцированные ‒ 55 (73,3 %) и инфильтративно-язвенные ‒ 58 (77,3 %) опухоли.
Хирургическое лечение у всех больных РТК выполнено в радикальном объеме (R0), с учетом локализации и распространенности опухоли (табл. 3). В послеоперационном периоде у больных РТК по показаниям (при распространенности опухолевого процесса Т4 и/или N+) проводилось 6–10 курсов адъювантной химиотерапии по схеме FOLFOX или XELOX.
Для определения состава кишечной микробиоты у больных основной группы забор биоптатов с опухолевой ткани и с визуально не измененной слизистой оболочки толстой кишки производился после завершения операции (из макропрепарата), а у здоровых лиц – с визуально не измененной слизистой оболочки толстой кишки во время ви-
|
Характеристика по полу и возрасту characteristics by sex and age |
Таблица 1/table 1 |
|
|
Показатели/ Indices |
Основная группа/ Study group (n=75) |
Контрольная группа / Control group (n=25) |
|
Пол/Sex |
||
|
Мужчины/Men |
38 (50,7 %) |
13 (50,7 %) |
|
Женщины/Women |
37 (49,3 %) |
12 (49,3 %) |
|
Средний возраст, лет/Average age, years |
58,7 ± 13,8 |
56,4 ± 11,2 |
Таблица 2/table 2
Клинико-морфологическая характеристика РТКclinical and morphological characteristics of cRc
|
Показатели/ Indices |
Количество (n=75)/ Quantity (n=75) |
|
Локализация опухоли/Tumor localization |
|
|
Слепая кишка/Cecum |
9 (12,0 %) |
|
Восходящий отдел/Ascending colon |
12 (16,0 %) |
|
Поперечно-ободочная кишка/Transverse colon |
11 (14,7 %) |
|
Нисходящий отдел/Descending colon |
7 (9,3 %) |
|
Сигмовидная кишка/Sigmoid colon |
18 (24,0 %) |
|
Ректосигмоидный отдел/Rectosigmoid colon |
18 (24,0 %) |
|
Стадия опухоли/Stages of the tumor |
|
|
I (T1–2N0M0) |
6 (8,0 %) |
|
IIА (T3N0M0) |
5 (6,7 %) |
|
IIВ (T4аN0M0) |
39 (52,0 %) |
|
IIС (T4bN0M0) |
12 (16,0 %) |
|
IIIА (T1–2N1a-bM0) |
6 (8,0 %) |
|
IIIВ (T3–4аN1a-bM0) |
7 (9,3 %) |
|
Формы роста опухоли/Forms of tumor growth |
|
|
Экзофитная/Exophytic |
17 (22,7 %) |
|
Инфильтративно-язвенная/Infiltrative-ulcerative |
58 (77,3 %) |
|
Степень дифференцировки/Degree of differentiation |
|
|
Высокодифференцированная аденокарцинома/Well differentiated adenocarcinoma |
15 (20,0 %) |
|
Умереннодифференцированная аденокарцинома/ Moderately differentiated adenocarcinoma |
55 (73,3 %) |
|
Низкодифференцированная аденокарцинома/ Poorly differentiated adenocarcinoma |
5 (6,7 %) |
Таблица 3/table 3
Хирургическое лечение больных РТКsurgical treatment of patients with cRc
Полученные в ходе исследования данные обрабатывались в программе Statistica 10.0. Для количественных признаков производился расчет медиан (Ме) и стандартных отклонений (σ). Оценка нормальности распределения значений переменных проводилась с использованием критерия Шапиро–Уилка. Учитывая распределение признаков, отличное от нормального, полученные данные представлены в виде медианы, первого и третьего квартилей: Me (Q1; Q3). Для сравнения двух независимых групп по одному количественному признаку применялся критерий Манна–Уитни. При попарном сравнении применялась поправка Бонферрони. Во всех случаях р<0,05 считали статистически значимым. Кривые выживаемости больных РТК строились по методу Каплана–Мейера.
Результаты и обсуждение
При сравнительном бактериологическом анализе биопсийного материала толстой кишки в основной и контрольной группах установлены значимые изменения уровня Bifidobacterium spp., E. coli (типичные), Clostridium spр. по «схеме»: слизистая здорового человека → неизмененная слизистая больного РТК → опухолевая ткань (табл. 4).
В частности, в контрольной группе у здоровых добровольцев отмечалось значимо большее количество Bifidоbacterium spp . (7,6 КОЕ/г), E. сoli (типичные) (6,1 КОЕ/г) с одновременным низким значением, характеризующим Clostridium spp. (2,2 КОЕ/г), по сравнению с аналогичными показателями у больных раком толстой кишки ( Bifidоbacterium spp . – 5,6 КОЕ/г, E. сoli (типичные) – 4,6 КОЕ/г, Clostridium spp. – 3,7 КОЕ/г). Изменение состава отдельных компонентов микрофлоры может быть ассоциировано с аденокарциномой толстой кишки. Кроме того, отмечается зависимость уровней этих изменений от таких клинико-морфологических характеристик, как принадлежность пациентов по полу в сравниваемых группах, макроскопического типа опухоли и степени ее дифференцировки. В основной группе у мужчин, страдающих РТК, превалировал количественный состав Lactobacillus spp . (7,0 КОЕ/г), Bifidobacterium spp. (6,1 КОЕ/г), Bacteroides spp. (8,0 КОЕ/г), E. coli (типичные) (5,2 КОЕ/г) по сравнению с женщинами – Lactobacillus spp . (6,0 КОЕ/г), Bifidobacterium spp . (5,0 КОЕ/г), Bacteroides spp. (6,8 КОЕ/г), E. coli (типичные) (4,1 КОЕ/г) (р<0,05). Условно-патогенная микрофлора (УПМ) в большем количестве присутствует в опухолевой ткани при инфильтративно-язвенной форме роста опухоли (5,8 КОЕ/г), чем при экзофитном типе (3,2 КОЕ/г) (р=0,012). В неизмененной слизистой толстой кишки у больных РТК таких особенностей не выявлено.
Таблица 4/table 4
Состав кишечной микробиоты в сравниваемых группах (количество микроорганизмов в 1 г биоптата (lg=101 КОЕ/г)
the composition of the intestinal microbiota in the groups (number of microorganisms in 1 g of biopsy specimen (lg=101 cFu/g)
|
Микроорганизмы/ Microorganisms |
Основная группа/ Study group (n=75) |
Группа контроля (3)/ Control group (3) (n=25) |
p 1–2 |
p 1–3 |
p 2–3 |
|
|
Неизмененная слизистая оболочка (1)/ Unaltered mucosa (1) |
Опухоль (2)/ Tumor (2) |
|||||
|
Lactobacillus spp. |
6,6 [6,0–8,0] |
5,5 [5,0–6,0] |
8,2 [7,0–9,0] |
0,003 |
0,003 |
0,002 |
|
Bifidobacterium spp. |
6,9 [6,0–8,0] |
5,6 [5,0–7,0] |
7,6 [6,0–8,0] |
0,001 |
0,026 |
0,001 |
|
Clostridium spр. |
2,9 [2,0–3,0] |
3,7 [2,0–5,0] |
2,2 [2,0–3,0] |
0,004 |
0,001 |
0,001 |
|
Escherichia coli (типичные) |
5,4 [5,0-6,0] |
4,6 [3,0-6,0] |
6,1 [6,0–7,0] |
0,001 |
0,049 |
0,009 |
|
Escherichia coli (гемолитические) |
3,1 [3,0–4,0] |
3,3 [3,0–6,0] |
3,0 [3,0–3,0] |
0,003 |
˃0,05 |
0,042 |
|
Escherichia coli (лактозонегативные)/ |
3,3 [3,0–4,0] |
3,7 [3,0–4,0] |
3,1 [3,0–4,0] |
0,004 |
˃0,05 |
0,002 |
|
Enterobacteriaceae |
5,4 [4,0–6,0] |
5,8 [3,0–6,0] |
5,8 [5,0–6,0] |
0,001 |
0,001 |
0,029 |
|
Pseudomonas spp. |
3,0 [3,0–3,0] |
3,2 [3,0–4,0] |
3,0 [3,0–3,0] |
0,008 |
˃0,05 |
˃0,05 |
|
Staphylococcus spp. (CNS) |
3,0 [3,0–3,0] |
3,0 [3,0–3,0] |
3,3 [3,0–4,0] |
˃0,05 |
0,002 |
0,002 |
|
Candida spp. |
2,8 [2,0–3,0] |
3,2 [3,0–4,0] |
3,0 [3,0–4,0] |
0,002 |
<0,0001 |
0,002 |
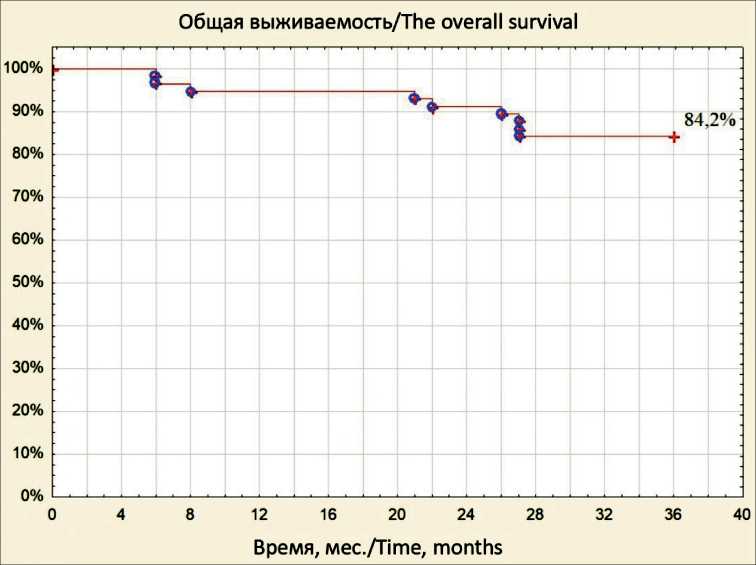
Рис. 1. Общая выживаемость больных РТК
Fig. 1. Overall survival of patients with CRC
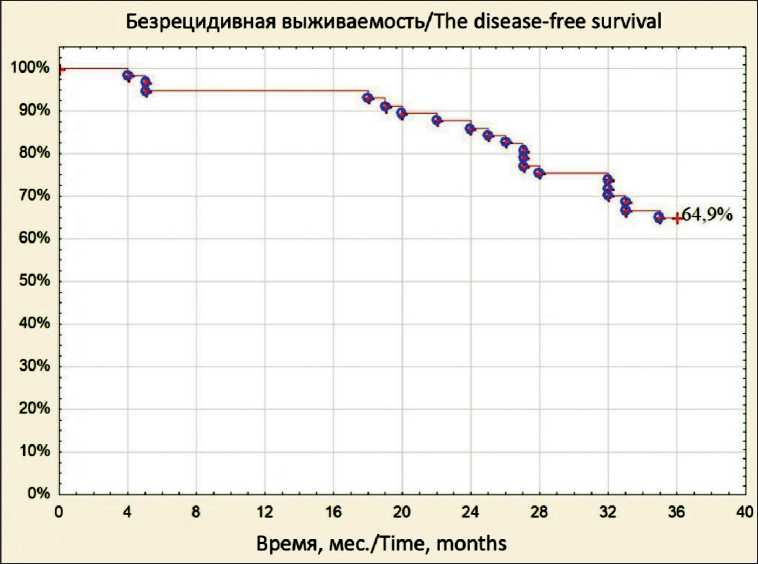
Рис. 2. Безрецидивная выживаемость больных РТК
Fig. 2. Relapse-free survival of patients with CRC
При сравнительном анализе количественного состава микробиоты в зависимости от степени дифференцировки опухоли установлено, что Lactobacillus spp. (6,2 КОЕ/г) , Bifidobacterium spp. (8,0 КОЕ/г) в большем, а Staphylococcus spp. (CNS) (3,2 КОЕ/г) в меньшем количестве присутствуют при высокодифференцированной по сравнению с умереннодифференцированной аденокарциномой толстой кишки Lactobacillus spp. (4,3 КОЕ/г) , Bifidobacterium spp. (6,9 КОЕ/г), Staphylococcus spp. (CNS) (2,8 КОЕ/г) (р<0,05).
Дополнительно проведена оценка прогностического потенциала кишечной микробиоты в развитии послеоперационных осложнений и прогрессировании заболевания при 3-летнем динамическом наблюдении.
Осложнения в виде несостоятельности анастомоза зафиксированы у 11 (15,5 %) больных. Следует отметить, что у больных с послеоперационными осложнениями выявлено изменение количества Lactobacillus spp., Bacteroides spp., Escherichia coli (менее 3,0 КОЕ/г).
Расчет 3-летней выживаемости проведен у 57 (76 %) больных РТК (рис. 1, 2), при этом 14 (18,7 %) пациентов из анализа были исключены, так как 4 (5,3 %) умерли в раннем послеоперационном периоде и 4 (5,3 %) ‒ от неонкологических заболеваний (COVID-19, сердечно-сосудистые заболевания и травмы), 6 (8 %) больных выбыло из-под наблюдения. По данным отдаленного мониторинга, из 57 больных РТК более 3 лет прожили 48 (84,2 %) пациентов. За анализируемый период рецидивы за- болевания возникли у 20 (35,1 %) больных, из них местные – в 6 (10,5 %), гематогенные метастазы – в 14 (24,6 %) наблюдениях, от прогрессирования РТК умерло 9 (15,8 %) пациентов, включенных в исследование.
При прогрессировании заболевания количественный состав Bifidоbacterium spp . (8,0 КОЕ/г), Lactobacillus spp . (7,9 КОЕ/г) в неизмененной слизистой оболочке толстой кишки, а E. сoli (6,0 КОЕ/г) в опухолевой ткани был больше, чем у больных без местных рецидивов и отдаленных метастазов, – Bifidоbacterium spp . (7,0 КОЕ/г), Lactobacillus spp . (6,8 КОЕ/г), E. сoli (5,2 КОЕ/г).
Адъювантная химиотерапия проведена у 44 (77,2 %) больных РТК, которые в зависимости от продолжительности жизни были разделены на 2 подгруппы: прожившие более 3 лет – 26 (45,6 %) и менее 3 лет – 18 (31,6 %) пациентов. Установлено, что у больных, переживших 3 года после лечения без признаков рецидива заболевания, количество Lactobacillus spp . (7,9 КОЕ/г), Bifidоbacterium spp . (8,0 КОЕ/г), Bacteroides (6,2 КОЕ/г) и E. coli
Список литературы Особенности состава кишечной микробиоты у больных раком толстой кишки
- Злокачественные новообразования в России в 2018 году (заболеваемость и смертность). М., 2019. 250 с.
- Майстренко Н.А., Хватов А.А., Сазонов А.А. Хирургическое лечение больных пожилого и старческого возраста с местно-распространенным раком толстой кишки. Вестник хирургии. 2016; 175(4): 24-31.
- Костромицкий Д.Н., Добродеев А.Ю., Афанасьев С.Г., Тарасова А.С. Комбинированное лечение больных с метастазами колоректального рака в печени. Анналы хирургической гепатологии. 2021; 26(2): 120-8.
- Sofi F., Dinu M., Pagliai G., Pierre F., Gueraud F., Bowman J., Gerard P., Longo V., Giovannelli L., Caderni G., de Filippo C. Fecal microbiome as determinant of the effect of diet on colorectal cancer risk: comparison of meat-based versus pesco-vegetarian diets (the MeaTIc study). Trials. 2019; 20(1): 688.
- Sheng Q.S., He K.X., Li J.J., Zhong Z.F., Wang F.X., Pan L.L., Lin J.J.Comparison of Gut Microbiome in Human Colorectal Cancer in Paired Tumor and Adjacent Normal Tissues. Onco Targets Ther. 2020; 13: 635-46.
- O'Keefe S.J. Diet, microorganisms and their metabolites, and colon cancer. Nat Rev Gastroenterol Hepatol. 2016; 13(12): 691-706.
- Zorron Cheng Tao Pu L., Yamamoto K., Honda T., Nakamura M., Yamamura T., Hattori S., Burt A.D., Singh R., Hirooka Y., Fujishiro M. Microbiota profile is different for early and invasive colorectal cancer and is consistent throughout the colon. J Gastroenterol Hepatol. 2020; 35(3): 433-7.


