Особенности состава кишечной микробиоты у онкологических больных
Автор: Агинова В.В., Григорьевская З.В., Петухова И.Н., Багирова Н.С., Терещенко И.В., Самойленко И.В., Кузьменко А.О., Кононец П.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 6 т.23, 2024 года.
Бесплатный доступ
Цель исследования - оценить и сравнить качественный и количественный состав микробиоты кишечника у пациентов с различными злокачественными новообразованиями. Материал и методы. В исследование включали пациентов, получавших различные виды лечения в ФГБУ «НМИЦ онкологии им. Н. Н. Блохина» Минздрава России в 2023 г. по поводу аденокарциномы желудка, включая кардиоэзофагеальный рак (группа 1, n=23), плоскоклеточного рака пищевода (группа 2, n=20) и метастатической или местнораспространенной меланомы кожи (группа 3, n=20). Все пациенты на момент включения должны были иметь морфологическую верификацию диагноза, возраст старше 18 лет, состояние по шкале ECOG ≤1 и не иметь признаков кишечной инфекции, а также не принимать антибиотики в течение 28 дней до начала исследования. Образцы кала собраны на этапе госпитализации больного в стационар. Проведена оценка количественного и качественного содержания микроорганизмов 17 таксономических групп. Культивирование микроорганизмов проведено по стандартным микробиологическим методикам с учетом условий роста той или иной группы микроорганизмов. Видовая идентификация микробных изолятов получена методом матрично-ассоциированной лазерной десорбции/ионизации - времяпролетной масс-спектрометрии (MALDI-TOF) и программного обеспечения MALDI Biotyper v.3.0 (Bruker Daltonics, Германия). Использованы методы описательной статистики из пакета программ SPSS Statistics, v.27. Для количественного описания видового разнообразия микробиоты кишечника проведены расчеты с использованием индексов видового разнообразия Маргалефа (d) и Шеннона (H). Критерий равномерности распределения видов микроорганизмов по их обилию в популяционном сообществе оценивали с помощью индекса Пиелу (E). Для проверки значимости различий между выборочными совокупностями значений индекса Шеннона и получения статистически корректных оценок различий использовали T-критерий Хатчисона. Различия считали достоверными при р≤0,05.
Рак желудка, рак пищевода, меланома кожи, кишечная микробиота, дисбиоз, инфекционные осложнения, иммунотерапия
Короткий адрес: https://sciup.org/140308737
IDR: 140308737 | УДК: 616.329/.33-006.6+616-006.81-06-093/-098:616.34-008.8:615.37 | DOI: 10.21294/1814-4861-2024-23-6-51-61
Текст научной статьи Особенности состава кишечной микробиоты у онкологических больных
Рак – полиэтиологическое заболевание, являющееся второй по значимости причиной смертности населения во всем мире. Канцерогенез – сложный патофизиологический механизм зарождения и развития рака, результат внутриклеточного накопления мутаций в ходе репликации ДНК или воздействия различных экзо- и эндогенных канцерогенов, инфекционных агентов, ультрафиолетового излучения, токсических веществ и пр. [1, 2]. В настоящее время широко обсуждается вопрос о роли микробиоты в онкогенезе, а также о возможности ее использования в качестве прогностического маркера и/или терапевтической мишени у пациентов онкологической клиники [3–6]. Микробиота может участвовать в процессе индукции онкогенеза или способствовать подавлению опухоли посредством различных молекулярных механизмов. Недавние исследования и клинические испытания показывают, что микробиота является мощным, но до конца не изученным потенциальным союзником в борьбе с онкологическими заболеваниями [7]. Кишечная микробиота состоит в основном из анаэробных бактерий [8], которые способствуют пищеварению. Функции микробиоты человека чрезвычайно многообразны. Микроорганизмы и их метаболиты вовлечены во все процессы обмена веществ человека. Одним из важных факторов для понимания роли микробиоты в онкогенезе является факт разнообразия ее количественного и качественного состава, включая α-разнообразие (видовое разнообразие микроорганизмов в конкретном локусе) и β-разнообразие (индекс видового разнообразия между микроорганизмами различных мест обитания). Доказано, что истощение микробиоты и развитие дисбиоза являются негативными факторами при развитии онкологических заболеваний [9]. Микроорганизмы могут способствовать возникновению и прогрессированию, например, колоректального рака (КРР), посредством индукции хронического воспалительного состояния, биосинтеза генотоксинов, токсичных метаболитов, непосредственно повреждающих ДНК [10].
Основными патогенами при КРР, по сообщениям Z. Dai et al. (2019), являются S. gallolyticus, E. coli , энтеротоксигенные B. fragilis (ETBF), E. faecalis и F. nucleatum. ДНК S. gallolyticus обнаружена примерно у 20–50 % пациентов, страдающих раком толстой кишки, при этом механизм индукции роста опухоли микроорганизмом может включать усиление воспалительных сигналов путем воздействия циклооксигеназы-2. E. coli индуцирует разрывы двухцепочечной ДНК через островок по-ликетидсинтазы ( pks ), содержащий токсин под названием колибактин. E. faecalis включает индукцию макрофагов слизистой оболочки для производства кластогенов, которые вызывают повреждение ДНК посредством эффекта «свидетеля». Кроме того, E. faecalis, продуцирующий супероксид, способен вызывать дистальный колит, повреждение ДНК и рак у гнотобиотических мышей [10]. На животных моделях установлен проканцерогенный эффект бактерий видов Fusobacterium (в частности, F. nucleatum ). Наличие F. nucleatum в новообразованиях кишечника может инициировать трансформацию аденомы в карциному, а при наличии опухоли – являться причиной формирования резистентности к химиотерапии. При этом высокая распространенность этой бактерии является предиктором рецидива заболевания [11].
Результаты проведенного в Японии крупномасштабного исследования подчеркивают, что сдвиги в качественном и количественном составе микробиоты кишечника происходят уже на самых ранних стадиях развития колоректального рака. В частности, численность бактерий Fusobacterium nucleatum и Solobacterium moorei повышена на начальных стадиях заболевания, что позволяет предположить их возможное участие в индукции онкогенеза или в прогрессировании заболевания. Также в индукции онкогенеза на начальном этапе принимают участие бактерии Atopobium parvum, которые в сочетании со стрептококками образуют ассоциацию бактерий, продуцирующих сероводород (H2S). Бактерии рода Bilophilia производят желчную кислоту дихлорацетат, воздействие которой приводит к повреждению ДНК. Избыток этих бактерий в толстой кишке приводит к воспалению слизистой оболочки и, соответственно, к повреждению клеточной ДНК. Ученые подчеркивают, что для выяснения точных механизмов, с помощью которых эти бактерии могут способствовать онкогенезу, необходимы дальнейшие исследования [12].
Большое количество исследований направлено на изучение возможной взаимосвязи состава микробиоты и эффективности иммунотерапии, в частности при меланоме кожи. Предполагается, что первичная устойчивость к иммунотерапии может быть связана с аномальным составом микробиоты кишечника. Высказано мнение, что предиктором ответа на терапию препаратами анти-PD-1 являются уровень разнообразия состава кишечной микробиоты кишечника и высокое содержание бактерий, относящихся к роду Faecalibacterium или порядку Bacteroidales [9]. На эффективность иммунотерапии и выживаемость больных без прогрессирования оказывают влияние α- и β-разнообразие микробиоты кишечника, а также количественное соотношение бактерий Clostridium spp ., Faecalibacterium prausnitzii, Bacteroides thetaiotaomicron, Holdemania filiformis, Dorea formicogenerans, Bifidobacterium longum, Collinsella aerofaciens и Enterococcus faecium и пр. [3, 16].
Нарушение состава нормальной микробиоты кишечника характеризуется снижением количества ее облигатных представителей и увеличением популяционного уровня в норме отсутствующих или встречающихся в ничтожно малых количествах условно-патогенных микроорганизмов. В итоге, обедненные микробные ассоциации не в состоянии обеспечить защитные и другие физиологические функции микробиоты, осуществляемые микробиоценозом кишечника. При снижении иммунологической реактивности и формировании вариабельного иммунодефицитного состояния возможно попадание в кровоток условно-патогенных энтеробактерий, псевдомонад и других грамо-трицательных бактерий, вырабатывающих эндотоксины, которые могут провоцировать развитие сепсиса у больного [17].
Взаимодействие между иммунной системой и комменсальной микробиотой может определять системный иммунный тонус, включая надзор за злокачественными клетками [18]. В ряде исследований показано, что короткоцепочечные жирные кислоты (КЦЖК), в синтезе которых участвуют различные бактерии кишечной микробиоты, повышают общий иммунитет и улучшают результаты иммунотерапии [19]. Полисахариды, вырабатываемые бактериями порядка Bacteroides , а именно B. uniformis, влияют на динамику состава микробного сообщества и на синтез бутирата [20], что может повышать эффективность иммунотерапии. Жирные кислоты средней и длинной цепи, вырабатываемые микробиотой, могут стимулировать противоопухолевый иммунитет путем связывания с рецепторами свободных жирных кислот [21].
Исследования микробиоты кишечника могут выявить наличие специфических микроорганизмов, связанных с конкретными результатами лечения, включая относительную численность этих организмов. Вместе с тем, можно измерить и другие характеристики кишечной микробиоты, например α-разнообразие, часто описываемое с помощью индекса разнообразия Шеннона. Было высказано предположение, что α-разнообразие, как суммирующая мера содержания микроорганизмов, может лучше коррелировать с результатами лечения рака, чем наличие или отсутствие определенного микроорганизма [22, 23], однако эта связь еще не доказана окончательно, и вполне вероятно, что оба фактора важны [24].
Таким образом, изучение видового и количественного состава микробиоты кишечника, определение функций ее метаболома, выявление дисбиоза, а также определение возможностей качественной и количественной коррекции микробиоты с терапевтической целью необходимо ввести в круг обязательных задач современных научных исследований в онкологии.
Цель исследования – оценить и сравнить качественный и количественный состав микробиоты кишечника у пациентов онкологической клиники с различными нозологическими формами.
Материал и методы
Образцы кала были собраны на этапе госпитализации больного в стационар для прохождения противоопухолевого лечения, в случае РЖ и РП – до начала хирургического лечения, при меланоме – до начала проведения иммунотерапии. Биологический материал собран и доставлен в бактериологическую лабораторию с соблюдением правил забора, хранения и транспортировки биологического материала в специальном одноразовом стерильном контейнере с завинчивающейся крышкой и лопаточкой для сбора пробы для посева.
Оценивали количественное и качественное содержание микроорганизмов 17 таксономических групп. Спектр оцениваемых таксонов определен согласно требованиям отраслевого стандарта [25] с расширением перечня исследуемых микроорганизмов, как наиболее часто встречающихся в результатах исследований, по данным современных научных публикаций.
После поступления биологического материала в лабораторию проводили подготовку проб к исследованию и осуществляли посев в жидкие, полужидкие и на плотные питательные среды (селенитовый бульон, тиогликолевая среда, среда Блаурокка, среда Плоскирева, 5 %-кровяной агар, висмут-сульфит агар, агар Эндо, маннит-солевой агар, агар Сабуро, среда Шедлера, томатный агар). Культивирование микроорганизмов осуществляли согласно стандартным микробиологическим методикам с учетом условий роста (требований к питательной среде, освещенности, аэрации, времени культивирования и пр.) той или иной группы микроорганизмов. Видовая идентификация микробных изолятов получена методом матричноассоциированной лазерной десорбции/ионизации – времяпролетной масс-спектрометрии (MALDI-TOF) и программного обеспечения MALDI Biotyper v.3.0 (Bruker Daltonics, Германия). Для этого суточную культуру тонким слоем наносили на подготовленную, согласно инструкции, MALDI мишень. После высыхания образца на мишень наносили 1 мкл 70 % раствора муравьиной кислоты, затем 1 мкл матрицы (α-циано-4-гидроксикоричная кислота) и, после подсушивания образцов, про- водили идентификацию на MALDI-TOF масс-спектрометре.
Использованы методы описательной статистики из пакета программ IBM SPSS Statistics, v.27. Для количественного описания видового разнообразия микробиоты кишечника проводили расчеты с использованием индексов видового разнообразия Маргалефа (d) (для расчета индекса использована абсолютная величина – численность, чем выше значение индекса, тем большим видовым богатством характеризуется микробное сообщество) и Шеннона (H) (диапазон значений: 0–4, чем выше значение индекса, тем более разнообразны виды в среде обитания). Критерий равномерности распределения видов микроорганизмов по их обилию в популяционном сообществе оценивали с помощью индекса Пиелу (E) (диапазон значений: 0–1), причем Е=1 при равном обилии всех видов. Для проверки значимости различий между выборочными совокупностями значений индекса Шеннона и получения статистически корректных оценок различий использовали T-критерий Хатчисона (модифицированная версия t-критерия Стьюдента) без учета поправки на множественные сравнения. Различия считали достоверными при р≤0,05.
Результаты
В исследование включены 63 пациента, демографические и клинические характеристики которых представлены в табл. 1. Суммарно исследовано 63 образца биологического материала (кал). В результате проведенных исследований биологического материала пациентов выделено и идентифицировано 129 видов микроорганизмов. Эти микроорганизмы объединены в таксономические группы, которые относятся к основной облигатной и транзиторной микробиоте кишечника человека, а именно: Bifidobacterium spp ., Lactobacillus spp ., E. сoli, Enterococcus spp ., Streptococcus spp ., дрожжеподобные микроскопические грибы , мицелиальные микроскопические грибы, S. aureus, коагулазонегативные стафилококки , Corynebacterium spp ., условно-патогенные энтеробактерии, неферментирующие грамотрицательные бактерии, Bacteroides spp ., Peptostreptococcus spp . , Veillonella spp ., Clostridium spp ., Eubacteria spp . и пр. Необходимо отметить, что патогенные энтеробактерии родов Shigella и Salmomella у пациентов, включенных в исследование, не обнаружены. Данные представлены на гистограмме (рис. 1) , где показатели по оси X – частота встречаемости видов микроорганизмов, по оси Y – основные таксономические группы выделенных микроорганизмов.
Необходимо отметить, что при сравнении результатов анализов пациентов 1 и 2-й группы, 1 и 3-й и 2 и 3-й групп не выявлено различий в микробном разнообразии бактериальных таксономических субъединиц, т.е. видовой состав выделяемых микроорганизмов в группах исследования был без
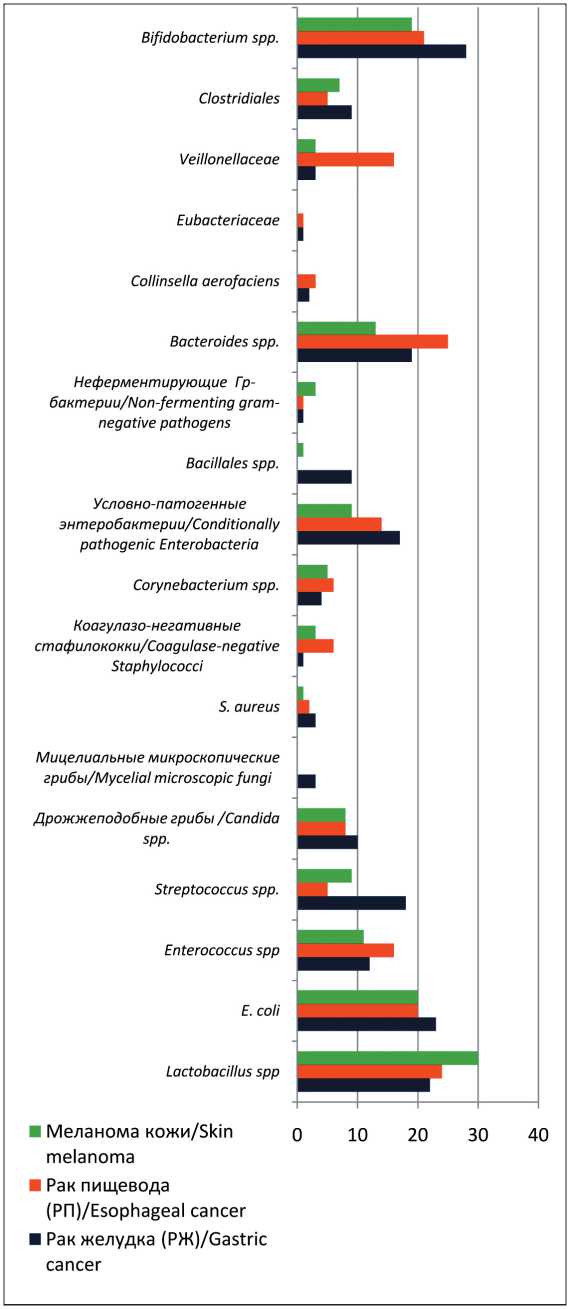
Fig. 1. Occurrence and spectrum of obligate microorganisms of human gut microbiota in gastric cancer, esophageal cancer and skin melanoma patients. Note: created by the authors
Таблица 1/table 1
Демографические и клинические показатели пациентов групп исследования demographic and clinical characteristics of patients in the study groups
Примечания: * – все пациенты с IIIB/C/D стадией или эквивалентом IIIB/C/D стадии, или олигометастатической резектабельной меланомой IV стадии с измеримыми очагами; таблица составлена авторами.
Notes: * – all patients with stage IIIB/C/D or equivalent stage IIIB/C/D or oligometastatic resectable stage lV resectable melanoma with measurable foci; created by the authors.
Таблица 2/table 2
Количество пациентов со сниженными показателями облигатных (строгих и аэротолерантных) анаэробных микроорганизмов
number of patients with reduced rates of obligate (strict and aerotolerant) anaerobic microorganisms
|
Bifidobacterium spp. |
108–109/109–1010 |
17 (73,9 %) |
15 (75,0 %) |
15 (75,0 %) |
74,6 % |
|
Lactobacillus spp. |
107–108/106–107 |
12 (52,2 %) |
9 (45,0 %) |
13 (65,0 %) |
54,0 % |
|
Bacteroides spp. |
109–1010/ 1010–1011 |
12 (80,0 %) (из n=15) |
10 (76,9 %) (из n=13) |
10 (100 %) (из n=10) |
66,7 % |
Список литературы Особенности состава кишечной микробиоты у онкологических больных
- Bagheri Z., Moeinzadeh L., Razmkhah M. Roles of Microbiota in Cancer: From Tumor Development to Treatment. J Oncol. 2022. https://doi.org/10.1155/2022/3845104.
- Kim J., Lee H.K. The Role of Gut Microbiota in Modulating Tumor Growth and Anticancer Agent Efficacy. Mol Cells. 2021; 44(5): 356-62. https://doi.org/10.14348/molcells.2021.0032.
- Grigor'evskaya Z.V., Petukhova I.N., Bagirova N.S., Aginova V.V., Kononets P.V. Rol' mikrobioty v onkogeneze. Sibirskii onkologicheskii zhurnal. 2023; 22(2): 129-42. https://doi.org/10.21294/1814-4861-2023-22-2-129-142.
- Bagirova N.S., Grigor'evskaya Z.V., Tereshchenko I.V., Petukhova I.N., Kazimov A.E., Vinnikova V.D., Vershinskaya V.A. Mikrobiologicheskaya i molekulyarnaya identifikatsiya anaerobnogo komponenta mikrobioty polosti rta u bol'nykh rakom orofaringeal'noi oblasti. Klinicheskaya laboratornaya diagnostika. 2022; 66(5): 301-8. https://doi.org/10.51620/0869-2084-2022-67-5-301-308.
- Bagirova N.S., Petukhova I.N., Grigor'evskaya Z.V., Sytov A.V., Slukin P.V., Goremykina E.A., Khokhlova O.E., Fursova N.K., Kazimov A.E. Mikrobiota polosti rta u bol'nykh rakom orofaringeal'noi oblasti s aktsentom na Candida spp. Opukholi golovy i shei. 2022; 12(3): 71-85. https://doi.org/10.17650/2222-1468-2022-12-3-71-85.
- Bhatt A.P., Redinbo M.R., Bultman S.J. The role of the microbiome in cancer development and therapy. CA Cancer J Clin. 2017; 67(4): 326-44. https://doi.org/10.3322/caac.21398.
- Fan X., Jin Y., Chen G., Ma X., Zhang L. Gut Microbiota Dysbiosis Drives the Development of Colorectal Cancer. Digestion. 2021; 102(4): 508-15. https://doi.org/10.1159/000508328.
- Collado M.C., Derrien M., Isolauri E., de Vos W.M., Salminen S. Intestinal integrity and Akkermansia muciniphila, a mucin-degrading member of the intestinal microbiota present in infants, adults, and the elderly. Appl Environ Microbiol. 2007; 73(23): 7767-70. https://doi.org/10.1128/AEM.01477-07.
- Grigor'evskaya Z.V., Petukhova I.N., Bagirova N.S., Aginova V.V., Kononets P.V. Rol' mikrobioty v onkogeneze. Sibirskii onkologicheskii zhurnal. 2023; 22(2): 129-42. https://doi.org/10.21294/1814-4861-2023-22-2-129-142.
- Dai Z., Zhang J., Wu Q., Chen J., Liu J., Wang L., Chen C., Xu J., Zhang H., Shi C., Li Z., Fang H., Lin C., Tang D., Wang D. The role of microbiota in the development of colorectal cancer. Int J Cancer. 2019; 145(8): 2032-41. https://doi.org/10.1002/ijc.32017.
- Yu T., Guo F., Yu Y., Sun T., Ma D., Han J., Qian Y., Kryczek I., Sun D., Nagarsheth N., Chen Y., Chen H., Hong J., Zou W., Fang J.Y. Fusobacterium nucleatum Promotes Chemoresistance to Colorectal Cancer by Modulating Autophagy. Cell. 2017; 170(3): 548-63. https://doi.org/10.1016/j.cell.2017.07.008.
- Yachida S., Mizutani S., Shiroma H., Shiba S., Nakajima T., Sakamoto T., Watanabe H., Masuda K., Nishimoto Y., Kubo M., Hosoda F., Rokutan H., Matsumoto M., Takamaru H., Yamada M., Matsuda T., Iwasaki M., Yamaji T., Yachida T., Soga T., Kurokawa K., Toyoda A., Ogura Y., Hayashi T., Hatakeyama M., Nakagama H., Saito Y., Fukuda S., Shibata T., Yamada T. Metagenomic and metabolomic analyses reveal distinct stage-specific phenotypes of the gut microbiota in colorectal cancer. Nat Med. 2019; 25(6): 968-76. https://doi.org/10.1038/s41591-019-0458-7.
- Liu S., Dai J., Lan X., Fan B., Dong T., Zhang Y., Han M. Intestinal bacteria are potential biomarkers and therapeutic targets for gastric cancer. Microb Pathog. 2021; 151. https://doi.org/10.1016/j.micpath.2021.104747.
- Sukhina M.A., Stavtsev M.G., Achkasov S.I., Yudin S.M. Osobennosti kishechnoi mikrobioty u patsientov s kolorektal'nym rakom. Koloproktologiya. 2023; 22(3): 94-103. https://doi.org/10.33878/2073-7556-2023-22-3-94-103.
- Vadhwana B., Tarazi M., Boshier P.R., Hanna G.B. Evaluation of the Oesophagogastric Cancer-Associated Microbiome: A Systematic Review and Quality Assessment. Cancers (Basel). 2023; 15(10): 2668. https://doi.org/10.3390/cancers15102668.
- Gopalakrishnan V., Helmink B.A., Spencer C.N., Reuben A., Wargo J.A. The Influence of the Gut Microbiome on Cancer, Immunity, and Cancer Immunotherapy. Cancer Cell. 2018; 33(4): 570-80. https://doi.org/10.1016/j.ccell.2018.03.015.
- Bondarenko V.M., Matsulevich T.V. Disbakterioz kishechnika kak kliniko-laboratornyi sindrom: sovremennoe sostoyanie problemy. M., 2007. 304 s.
- Chen D.S., Mellman I. Elements of cancer immunity and the cancer-immune set point. Nature. 2017; 541(7637): 321-30. https://doi.org/10.1038/nature21349.
- Lapébie P., Lombard V., Drula E., Terrapon N., Henrissat B. Bacteroidetes use thousands of enzyme combinations to break down glycans. Nat Commun. 2019; 10(1): 2043. https://doi.org/10.1038/s41467-019-10068-5.
- Feng J., Qian Y., Zhou Z., Ertmer S., Vivas E.I., Lan F., Hamilton J.J., Rey F.E., Anantharaman K., Venturelli O.S. Polysaccharide utilization loci in Bacteroides determine population fitness and community-level interactions. Cell Host Microbe. 2022; 30(2): 200-15. https://doi.org/10.1016/j.chom.2021.12.006.
- Olekhnovich E.I., Ivanov A.B., Babkina A.A., Sokolov A.A., Ulyantsev V.I., Fedorov D.E., Ilina E.N. Consistent Stool Metagenomic Biomarkers Associated with the Response To Melanoma Immunotherapy. mSystems. 2023; 8(2). https://doi.org/10.1128/msystems.01023-22.
- Bredin P., Naidoo J. The gut microbiome, immune check point inhibition and immune-related adverse events in non-small cell lung cancer. Cancer Metastasis Rev. 2022; 41(2): 347-66. https://doi.org/10.1007/s10555-022-10039-1. Erratum in: Cancer Metastasis Rev. 2024; 43(2): 865. https://doi.org/10.1007/s10555-022-10062-2.
- Zakharevich N.V., Morozov M.D., Kanaeva V.A., Filippov M.S., Zyubko T.I., Ivanov A.B., Ulyantsev V.I., Klimina K.M., Olekhnovich E.I. Systemic metabolic depletion of gut microbiome undermines responsiveness to melanoma immunotherapy. Life Sci Alliance. 2024; 7(5). https://doi.org/10.26508/lsa.202302480.
- Sitkin S.I., Vakhitov T.Ya., Dem'yanova E.V. Mikrobiom, disbioz tolstoi kishki i vospalitel'nye zabolevaniya kishechnika: kogda funktsiya vazhnee taksonomii. Al'manakh klinicheskoi meditsiny. 2018; 46(5): 396-425. https://doi.org/10.18786/2072-0505-2018-46-5-396-425.
- OST 91500.11.0004-2003. Otraslevoi standart. Protokol vedeniya bol'nykh. Disbakterioz kishechnika (utv. Prikazom Minzdrava Rossii ot 09.06.2003 № 231).
- Zheng Z., Hu Y., Tang J., Xu W., Zhu W., Zhang W. The implication of gut microbiota in recovery from gastrointestinal surgery. Front Cell Infect Microbiol. 2023; 13. https://doi.org/10.3389/fcimb.2023.1110787.
- Lederer A.K., Chikhladze S., Kohnert E., Huber R., Müller A. Current Insights: The Impact of Gut Microbiota on Postoperative Complications in Visceral Surgery-A Narrative Review. Diagnostics (Basel). 2021; 11(11): 2099. https://doi.org/10.3390/diagnostics11112099.
- Liu Y., He W., Yang J., He Y., Wang Z., Li K. The effects of preoperative intestinal dysbacteriosis on postoperative recovery in colorectal cancer surgery: a prospective cohort study. BMC Gastroenterol. 2021; 21(1): 446. https://doi.org/10.1186/s12876-021-02035-6.
- Zhao L., Cho W.C., Nicolls M.R. Colorectal Cancer-Associated Microbiome Patterns and Signatures. Front Genet. 2021; 12. https://doi.org/10.3389/fgene.2021.787176.
- Cheng W.T., Kantilal H.K., Davamani F. The Mechanism of Bacteroides fragilis Toxin Contributes to Colon Cancer Formation. Malays J Med Sci. 2020; 27(4): 9-21. https://doi.org/10.21315/mjms2020.27.4.2.
- Witt R.G., Cass S.H., Tran T., Damania A., Nelson E.E., Sirmans E., Burton E.M., Chelvanambi M., Johnson S., Tawbi H.A., Gershenwald J.E., Davies M.A., Spencer C., Mishra A., Wong M.C., Ajami N.J., Peterson C.B., Daniel C.R., Wargo J.A., McQuade J.L., Nelson K.C. Gut Microbiome in Patients With Early-Stage and Late-Stage Melanoma. JAMA Dermatol. 2023; 159(10): 1076-84. https://doi.org/10.1001/jamadermatol.2023.2955.
- Stoma I., Littmann E.R., Peled J.U., Giralt S., van den Brink M.R.M., Pamer E.G., Taur Y. Compositional Flux Within the Intestinal Microbiota and Risk for Bloodstream Infection With Gram-negative Bacteria. Clin Infect Dis. 2021; 73(11): 4627-35. https://doi.org/10.1093/cid/ciaa068.
- Stoma I.O., Uss M.A., Milanovich N.F., Stoma V.O., Gubanova T.N., Moduleva E.A. Monitoring sostava mikrobioma kishechnika pri transplantatsii gemopoeticheskikh stvolovykh kletok: primenenie v klinicheskoi praktike. Infektsionnye bolezni: novosti, mneniya, obuchenie. 2022; 11(2): 85-90. https://doi.org/10.33029/2305-3496-2022-11-2-85-90.
- Fonseca D.C., Marques Gomes da Rocha I., Depieri Balmant B., Callado L., Aguiar Prudêncio A.P., Tepedino Martins Alves J., Torrinhas R.S., da Rocha Fernandes G., Linetzky Waitzberg D. Evaluation of gut microbiota predictive potential associated with phenotypic characteristics to identify multifactorial diseases. Gut Microbes. 2024; 16(1). https://doi.org/10.1080/19490976.2023.2297815.


