Особенности совместного культивирования Pseudomonas chlororaphis и Saccharomyces cerevisiae для создания комплексного биопрепарата
Автор: Пронин А.С., Колмыкова Т.С., Лукаткин А.С.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Биостимуляторы, биопестициды
Статья в выпуске: 1 т.57, 2022 года.
Бесплатный доступ
В современном сельском хозяйстве наблюдается тенденция к увеличению использования биологических продуктов, в том числе средств защиты растений. Активно ведутся разработки по созданию и оптимизации технологий производства новых биопрепаратов, включающих линии бактерий (plant growth promoting bacteria, PGPB) или грибов (plant growth promoting fungi, PGPF). Грибы и бактерии совместно существуют в ризосфере, между ними происходит постоянное взаимодействие. В последние годы на рынок агрохимикатов и пестицидов выходят биопрепараты, в состав которых входят бактерии и грибы (инсектицид Биостоп, фунгицид Споробактерин). Трудности производства совместного бактериально-грибного биопрепарата связаны с особыми требованиями микроорганизмов к составу питательной среды, аэрации и режимам культивирования. В настоящей работе мы впервые установили положительное влияние Saccharomyces cerevisiae Y-4317 на рост Pseudomonas chlororaphis subsp . auerofaciens , а также выявили оптимальные режимы культивирования и состав питательной среды для совместного роста микроорганизмов различных таксономических категорий (PGPB и PGPF). Показана высокая эффективность использования свекловичной мелассы для совместного выращивания P. chlororaphis и S. cerevisiae . Выявлено стимулирующее влияние полученной культуральной жидкости (КЖ) на энергию прорастания и всхожесть семян культурных злаков. Цель работы - изучить возможность совместного куль-тивирования бактерии Pseudomonas chlororaphis subsp . auerofaciens B-5326 и дрожжей Saccharo-myces cerevisiae Y-4317 и оптимизировать параметры их выращивания для получения культуральной жидкости, стимулирующей прорастание семян и начальный рост злаковых растений. В качестве посадочного материала использовали штаммы бактерии Pseudomonas chlororaphis subsp. aureofaciens B-5326 и дрожжей Saccharomyces cerevisiae Y-4317. Штаммы микроорганизмов были получены в виде лиофилизата в ампулах из Всероссийской коллекции промышленных микроорганизмов НИЦ Курчатовский институт - ГосНИИгенетика (г. Москва). Растительные объекты - семена кукурузы ( Zea mays L.) гибрида Делитоп, пшеницы ( Triticum aestivum L.) сорта Мироновская 808, ячменя ( Нordeum vulgare L.) сорта Скипетр. После восстановления жизнеспособности микробиологических культур готовили посадочный материал, который объединяли и выращивали 48 ч, используя шейкер-инкубатор, в трех вариантах питательных сред, различающихся по источнику углерода (глюкоза, фруктоза, свекловичная меласса). При совместном культивировании в динамике (от 0 до 72 ч) с использованием шейкера-инкубатора SPH-2102 («BIORUS», Республика Беларусь) и в лабораторном ферментере BIORUS GJ («BIORUS», Республика Беларусь) оценивали жизнеспособность (колониеобразующие единицы, КОЕ) и биомассу микроорганизмов при разных температурах (от 20 до 32 °С) и скорости подачи воздуха (от 1 до 6 л/ч). Семена сельскохозяйственных растений опрыскивали полученной культуральной жидкостью в разных разведениях (от 1:200 до 1:25), спустя 12 ч семена помещали на воду в чашки Петри. Энергию прорастания и всхожесть определяли спустя соответственно 3 и 7 сут. Показано, что при совместном культивировании P. chlororaphis и S. cerevisiae свекольная меласса полностью удовле-творяет потребность микроорганизмов в основных питательных веществах: количество клеток не опускалось ниже 6½108 и 3½106 КОЕ/мл. Общая биомасса составила 20,4 г/л, что было на 17-22 % выше, чем на средах с глюкозой или фруктозой. Нами подобраны оптимальные условия совместного культивирования: температура 30 °С, режим аэрации 4 л/ч, продолжительность культивирования 24 ч. Продемонстрировано положительное влияние S. cerevisiae на жизнеспособность P. chlororaphis при длительном совместном культивирование (72 ч): количество жизнеспособных клеток P. chlororaphis в присутствии S. сerevisiae составило 1½106 КОЕ/мл против 5½104 при росте P. chlororaphis отдельно от дрожжей . Вероятно, продуцирование фитогормонов S. cerevisiae в КЖ при совместном культивировании обусловливало активный рост и высокую жизнеспособность P. сhlororaphis . Предварительные опыты по применению комплексного биопрепарата, разработанного на основе совместной культуры, для предпосевной обработки семян показали его стимулирующее действие на энергию прорастания и всхожесть семян ячменя, пшеницы и кукурузы. Четкую тенденцию к увеличению энергии прорастания и всхожести семян злаковых культур отмечали при всех разведениях. Наибольшую эффективность комплексный биопрепарат показал в отношении всхожести семян кукурузы. Максимальное повышение энергии прорастания и всхожести семян всех изучаемых культур было выявлено при разведении биопрепарата 1:200. Выполненное исследование позволило выявить ключевые параметры совместного культивирования PGPB P. chlor-oraphis и PGPF S. cerevisiae и тем самым создать предпосылки для последующего создания биопрепарата на основе сочетания микроорганизмов различных таксономических групп.
Pseudomonas chlororaphis, saccharomyces cerevisiae, биопрепарат, биомасса, режимы культивирования, ячмень, пшеница, кукуруза, всхожесть семян
Короткий адрес: https://sciup.org/142234463
IDR: 142234463 | УДК: 579.64:57.083.13
Текст научной статьи Особенности совместного культивирования Pseudomonas chlororaphis и Saccharomyces cerevisiae для создания комплексного биопрепарата
В последние годы в мировом сельском хозяйстве наблюдается тенденция к увеличению использования биологических препаратов, в том числе средств защиты растений (1). Активно оптимизируются технологий производства новых биопрепаратов. Для обеспечения высокой эффективности биопрепаратов при их создании используются стимулирующие рост растений штаммы бактерий (plant growth promoting bacteria, PGPB) и грибов (plant growth promoting fungi, PGPF) (2-4). Микробиологические препараты представляют собой живые клетки микроорганизмов, отселектированных по полезным свойствам и либо находящиеся в культуральной жидкости, либо адсорбированные на нейтральном носителе.
PGPB рода Pseudomonas синтезируют метаболиты, оказывающие ростостимулирующее и антифунгальное действие на растения (5-9). При использовании этих биопрепаратов показан прирост биологического и хозяйственного урожая ряда культур (7, 8). Интерес вызывают препараты, созданные на базе совместных культур двух и более PGPB, в частности микробиологический продукт на основе Pseudomonas aureofaciens и Azotobacter vine-landii (10-13). Указанные виды бактерий интенсивно используются в качестве регуляторов роста культурных растений, а также стимулируют их устойчивость к патогенам (14). Однако в условиях нестабильного климата и систематического негативного воздействия внешних факторов актуальной остается проблема снижения урожайности в результате стрессовых воздействий. В связи с этим принципиально важно искать новые подходы для создания биологических препаратов, обладающих также стресс-модулирую-щим эффектом.
Так, привлекает внимание возможность использовать при создании биопрепаратов представителей иной таксономической группы микроорганизмов — грибов. Немногочисленные исследования показали, что некоторые штаммы дрожжей продуцируют фитогормоны (15). Известно, что биологически активные вещества, обладающие гормональной активностью, могут не только регулировать рост и развитие растений, но и участвовать в защите от абиотических факторов (16-18). Тот факт, что у дрожжей обнаружена способность синтезировать фитогормоны, позволяет рассматривать их как потенциальный компонент биологических препаратов для практики растениеводства.
Грибы и бактерии совместно существуют в ризосфере, между ними происходит постоянное взаимодействие. Выделяемые в группы PGPF и PGPB микроорганизмы способны влиять на рост и развитие растений (1923). Однако в современной литературе нам не встречались сведения по их совместному действию на растения. Есть данные, что представители рода Pseudomonas улучшали рост базидиомицета Agaricus bisporus , но механизм такого взаимодействия не известен (24).
В последние годы на рынок агрохимикатов и пестицидов выходят биопрепараты, в состав которых входят бактерии и грибы (инсектицид Биостоп, фунгицид Споробактерин) (25). Основные трудности при производстве таких препаратов связаны с различной требовательностью компонентов к составу питательной среды, аэрации и режимам культивирования. У бактерий оптимальная температура роста ниже и продолжительность куль- тивирования короче по сравнению с грибами. Кроме того, грибам для биосинтеза необходим свободный аминный азот (26, 27). Изучение условий совместного культивировании PGPB и PGPF необходимо при разработке фундаментальных основ для последующего создания комплексных биопрепаратов, воздействующих на сельскохозяйственные культуры.
В настоящей работе мы впервые установили положительное влияние Saccharomyces cerevisiae Y-4317 на рост Pseudomonas chlororaphis subsp . auerofaciens , а также выявили оптимальные режимы культивирования и состав питательной среды для совместного роста микроорганизмов различных таксономических групп (PGPB и PGPF). Показана высокая эффективность использования свекловичной мелассы для совместного выращивания P. chlororaphis и S. cerevisiae . Выявлено стимулирующее влияние полученной культуральной жидкости (КЖ) на всхожесть и энергию прорастания семян культурных злаков.
Цель работы — изучить возможность совместного культивирования бактерии Pseudomonas chlororaphis subsp . auerofaciens B-5326 и дрожжей Saccharomyces cerevisiae Y-4317 и оптимизировать параметры их выращивания для получения культуральной жидкости, стимулирующей прорастание семян и начальный рост злаковых растений.
Методика. Штаммы бактерии Pseudomonas chlororaphis subsp. aureo-faciens B-5326 и дрожжей Saccharomyces cerevisiae Y-4317 были получены в виде лиофилизатов в ампулах из Всероссийской коллекции промышленных микроорганизмов НИЦ Курчатовский институт — ГосНИИгенетика (г. Москва). Штаммы не были генетически модифицированными.
Растительные объекты — семена кукурузы ( Zea mays L.) гибрида Де-литоп, пшеницы ( Triticum aestivum L.) сорта Мироновская 808, ячменя ( Hordeum vulgare L.) сорта Скипетр.
Для восстановления жизнеспособности культуры ампулу с высушенным штаммом микроорганизмов стерильно вскрывали и добавляли жидкую питательную среду (0,2-0,4 мл): для P. chlororaphis — DMEM/F12 Merck («Sigma-Aldrich», США), для S. cerevisiae — Malt extract («Pronadisa», Испания). После растворения лиофилизата содержимое стерильно переносили пастеровской пипеткой в чашки Петри на агаризованные питательные среды такого же состава. Далее штаммы выращивали раздельно 48 ч в термостате ТС-1/20 СПУ (ОАО «Смоленское СКТБ СПУ», Россия) при 28 ° С.
При подготовке инокулятов из каждой чашки отбирали по единичной колонии с характерной для штамма морфологией, переносили в колбы объемом 250 мл и культивировали на шейкере-инкубаторе SPH-2102 («BIORUS», Беларусь) при 28 ° С и 130 об/мин. Среда для выращивания P. chlororaphis содержала 10 г/л глюкозы и по 0,5 г/л NaNO 3 , (NH 4 ) 2 SO 4 , NH 4 NO 3 , КН 2 РО 4 . Среда для выращивания S. cerevisiae — синтетическая модифицированная среда Ридера: 10 г/л глюкозы, 0,5 г/л пептона, 1 г/л дрожжевого экстракта, по 0,5 г/л NaNO 3 , (NH 4 ) 2 SO 4 , NH 4 NO 3 , КН 2 РО 4 . Спустя 48 ч титры P. chlororaphis и S. cerevisiae составили соответственно 107 и 105 КОЕ/мл.
Для совместного культивирования двух штаммов микроорганизмов брали по 15 мл полученной стартовой культуры, переносили в колбы объемом 500 мл и выращивали 48 ч при 28 ° С и 130 об/мин на шейкере-инкубаторе SPH-2102. Состав среды для совместного культивирования микроорганизмов был следующим: 0,5 г/л пептона, 1 г/л дрожжевого экстракта, по 0,5 г/л NaNO 3 , (NH 4 ) 2 SO 4 , NH 4 NO 3 , КН 2 РО 4 , источник углерода варьировал.
Для выяснения наиболее приемлемого состава использовали три варианта питательных сред, различающихся по источнику углерода: 1 — глюкоза (10 г/л), 2 — фруктоза (10 г/л), 3 — свекловичная меласса (15 г/л). Рассматривали варианты с варьированием некоторых других компонентов питательных сред (существенных различий с основной прописью выявлено не было). В последующем определяли влияние температуры (от 20 до 32 ° C) на совместный рост P. chlororaphis и S. cerevisiae на шейкере-инкубаторе, а также оценивали численность жизнеспособных микроорганизмов (по числу колониеобразующих единиц, КОЕ) в динамике (от 0 до 48 ч и от 48 до 72 ч).
Совместное культивирование P. chlororaphis и S. cerevisiae осуществляли также в лабораторном ферментере BIORUS GJ («BIORUS», Республика Беларусь), в котором варьировали скорость подачи воздуха через фильтры (от 1 до 6 л/ч). Культивирование длилось 20 ч при 30 ° C. Среда была аналогичной использованной в предыдущем эксперименте, с мелассой в качестве основного источника углерода.
Количество полученной биомассы оценивали при высушивании фильтров до постоянной массы в сушильном шкафу UF75 («Memmert GmbH + Co. KG», Германия) в течение 1-2 ч при 105 ° C, отделении клеток микроорганизмов от культуральной жидкости (объем КЖ 10 мл, с 3-кратной промывкой дистиллированной водой), определении сухой массы на аналитических весах Analytical Balance ME54T/A00 («Mettler Toledo», США) до постоянного значения (±0,1 мг) (28).
Жизнеспособность клеток каждого исследуемого микроорганизма в культуральной жидкости определяли посевом на агаризованную универсальную среду, содержащую 10 г/л глюкозы, 0,5 г/л пептона, 1 г/л дрожжевого экстракта и по 0,5 г/л NaNO 3 , (NH 4 ) 2 SO 4 , NH 4 NO 3 , КН 2 РО 4 . Пробы культуральной жидкости отбирали микробиологической пипеткой объемом 5 мл. Численность микроорганизмов определяли методом серийных 10-кратных разведений, подсчитывая число колоний каждого вида, индикацию осуществляли по морфологическому описанию колоний дрожжей и бактерий исследуемых родов (29-31). Для визуализации микрообъектов использовали микроскоп с камерой захвата Fixed Microscope Adapter («Levenhuk», США).
Семена сельскохозяйственных растений обрабатывали опрыскиванием культуральной жидкостью в разных разведениях (1:200, 1:150, 1:100, 1:50, 1:25), спустя 12 ч семена проращивали на воде в чашках Петри (20 или 50 семян на чашку) при 25 ° С в термостате ТС-1/20 СПУ. Контролем служили семена, обработанные водой. Энергию прорастания и всхожесть определяли по общепринятым методам спустя соответственно 3 и 7 сут (32).
Все эксперименты были проведены не менее трех раз, каждый включал 5 колб или чашек Петри с одинаковым материалом, выращенным в однотипных условиях. При определении жизнеспособности клеток каждый вариант анализировали в 10 повторностях. Проращивание семян проводили в 5 повторностях (чашках Петри) для каждого варианта опыта.
Статистическую обработка результатов проводили по стандартным методикам (33) в программе Microsoft Excel 2007. Данные в таблицах и на графиках приведены в виде средних арифметических значений со стандартными ошибками ( M ±SEM). Оценку различий выборочных средних проводили по t -критерию Стьюдента при p < 0,05 с использованием программ Microsoft Excel 2007 и Statistica v.12 («StatSoft, Inc.», США).
Резуёьтаты. После 48-часового раздельного культивирования P. chlororaphis subsp. aureofaciens B-5326 и S. cerevisiae Y-4317 их численность до- стигла соответственно 2*108 и 7*106 КОЕ/мл. Далее мы изучили возможность совместного роста двух культур в жидкой питательной среде. Отметим, что в доступной литературе соответствующих данных о таком культивировании и его условиях мы не обнаружили.
Для оптимизации совместного культивирования двух штаммов микроорганизмов мы изучили влияние состава питательной среды на изменения их биомассы и численности. При этом в качестве основного источника углерода использовали глюкозу, альтернативных — фруктозу и свекловичную мелассу.
Питательная среда
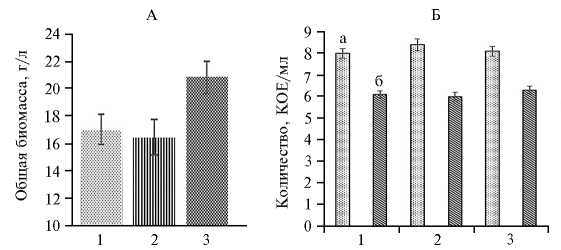
Рис. 1. Общая биомасса (А) и количество клеток (Б) при совместном культивировании Pseudomonas chlororaphis subsp. aureofaciens B-5326 (а) и дрожжей Saccharomyces cerevisiae Y-4317 (б) в зависимости от состава жидкой питательной среды: 1 — глюкоза (10 г/л), 2 — фруктоза (10 г/л), 3 — свекловичная меласса (15 г/л) ( N = 10, M ±SEM).
На средах с глюкозой и фруктозой наблюдалось относительно слабое накопление суммарной биомассы (рис. 1, А). Максимальное значение общей биомассы при совместном росте изучаемых штаммов зафиксировали на среде, содержащей мелассу, — 20,4 г/л, или на 17-22 % выше, чем на средах с глюкозой и фруктозой.
При совместном культивировании численность P. chlororaphis и S. cerevisiae не опускалось ниже соответственно 6*10 8 и 3*106 КОЕ/мл (см. рис. 1, Б). При этом на всех изученных средах величина КОЕ у S. cerevisiae и P. chlororaphis достоверно не менялась. Изучаемые штаммы были способны расти совместно на мелассе без существенного снижения жизнеспособности клеток (см. рис. 1, Б). Поэтому во всех последующих опытах использовали питательную среду, содержащую в качестве источника углерода мелассу.
Успешное использование свекловичной мелассы для совместного культивирования штаммов микроорганизмов можно объяснить тем, что в ее состав наряду с другими компонентами входит около 1 % раффинозы. С одной стороны, раффиноза способна ингибировать рост и образование биопленки бактерий группы псевдомонад (34), с другой — она также влияет на фенотипы бактерий, морфологию колоний, формирование матрикса и подвижность колоний (35). Использование свекловичной мелассы для совместного выращивания P. chlororaphis subsp. aureofaciens B-5326 и S. cerevisiae Y-4317 может снизить экономическую нагрузку при промышленном производстве создаваемого биологического препарата.
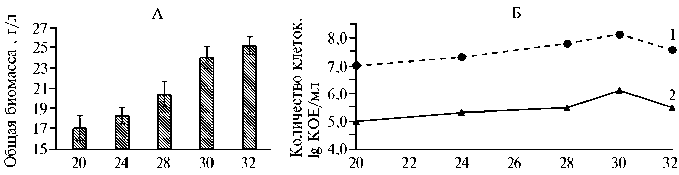
Температурный режим при совместном культивировании бактерий и дрожжей повлиял на изменение суммарной биомассы этих микроорганизмов (рис. 2, А). При температурах 20 и 24 ° С суммарная биомасса оказалась минимальной (статистически значимых различий между этими вариантами мы не зафиксировали). При температуре 28 ° С общая биомасса составила
20,5 г/л, при 30 ° C — 24,3 г/л. Дальнейшее повышение температуры (до 32 ° C) достоверно не увеличило суммарную биомассу бактерий и грибов по сравнению с таковой при 30 ° C.
Температура, °C
Рис. 2. Общая биомасса (А) и количество клеток (Б) при совместном культивировании Pseudomonas chlororaphis subsp. aureofaciens B-5326 (1) и дрожжей Saccharomyces cerevisiae Y-4317 (2) на среде с мелассой (15 г/л) в зависимости от температурного режима ( N = 5, M ±SEM).
Величина маркеров на рисунке Б отображает значение ±SEM.
Температурный режим также оказал влияние на жизнеспособность бактерий и грибов (см. рис. 2, Б). Начиная с температуры 20 ° C, величина КОЕ P. chlororaphis и S. cerevisiae увеличивалось, и максимум был зафиксирован при 30 ° C (соответственно 10 8 и 106 КОЕ/мл). При дальнейшем повышении температуры (до 32 ° C) число колоний значительно сократилось, составив 7,5*10 7 и 5,4*105 КОЕ/мл для P. chlororaphis и S. cerevisiae . Cледо-вательно, при совместном культивировании микроорганизмов различных таксономических групп оптимальна температура 30 ° C.
Дрожжи по типу питания относятся к факультативным анаэробам; присутствие кислорода подавляет спиртовое брожение, и они активно накапливают биомассу (36). Поэтому задачей следующего этапа исследования был подбор оптимального режима аэрации при совместном культивировании дрожжей и бактерий в биореакторе (табл. 1). Мы обнаружили, что оптимальный режим аэрации составляет 4 л/ч. Cтоит отметить, что присутствие кислорода в среде в большей степени влияло на жизнеспособность дрожжей, поскольку количество жизнеспособных клеток P. chlororaphis при всех режимах аэрации не опускалось ниже 2*10 8 КОЕ/мл. Полученные на этом этапе данные сопоставимы с результатами предыдущих экспериментов, когда культивирование осуществляли на шейкер-инкубаторе в колбах с ватно-марлевыми пробками. Из этого можно сделать вывод, что изученные микроорганизмы не очень требовательны к режимам аэрации и явной конкуренции между ними не наблюдается.
1. Количество жизнеспособных клеток (КОЕ/мл) Pseudomonas chlororaphis subsp. aureofaciens B-5326 и Saccharomyces cerevisiae Y-4317 при совместном культивировании в биореакторе BIORUS GJ («BIORUS», Республика Беларусь) на среде с мелассой (15 г/л) в зависимости от режима аэрации ( N = 5, M ±SEM)
|
Режим аэрации, л/ч |
P. chlororaphis , *108 |
S. cerevisiae , *106 |
|
1 |
4,2±0,31 |
0,8±0,05 |
|
2 |
2,1±0,18 |
2,4±0,09 |
|
3 |
3,6±0,24 |
3,6±0,18 |
|
4 |
5,9±0,36 |
5,9±0,12 |
|
5 |
3,2±0,17 |
2,1±0,26 |
|
6 |
2,4±0,08 |
4,2±0,16 |
В дельнейшем мы изучили динамику изменения титров культур (по величине КОЕ) при совместном выращивании P. chlororaphis и S. cerevisiae на среде с мелассой при температуре 30 °C (рис. 3). В первые 8 ч после начала культивирования величина КОЕ у дрожжей возрастала гораздо быстрее и значительнее, чем у бактерий, и титры P. chlororaphis и S. cerevisiae составили соответственно 6*104 и 3,8*104 КОЕ/мл. Очевидно, рост во время логарифмической фазы в первые часы культивирования у дрожжей происходил интенсивнее, чем у псевдомонад. Спустя 12 ч культивирования кривая роста S. cerevisiae вышла на стационарную фазу, после этого численность дрожжей слегка возрастала и после 24 ч культивирования начала снижаться. Псевдомонады показали наиболее активный рост в период с 8 до 24 ч культивирования, что коррелирует с данными литературы (37). Максимальное количество клеток P. chlororaphis зафиксировали через 24 ч совместного культивирования с дрожжами (8,4*108 КОЕ/мл). В период от 36 до 48 ч численность бактериальных клеток постепенно снижалась и титр P. chlororaphis уменьшился почти в 100 раз (до 8,8*106 КОЕ/мл). Наблюдаемое при совместном культивировании дрожжей и бактерий удлинение логарифмической фазы роста P. chlororaphis можно объяснить включением в состав субстрата мелассы, содержащей сложные углеводы, использование которых увеличивает продолжительность экспоненциального роста клеток. Последующее торможение роста, возможно, объясняется конкуренцией за источники питания (38).
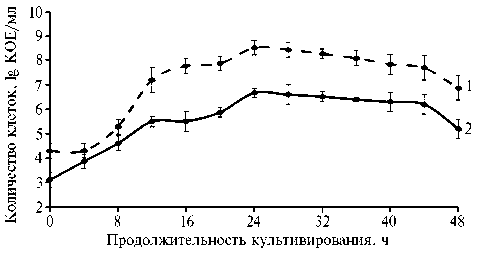
Рис. 3. Численность Pseudomonas chlororaphis subsp. aureofaciens B-5326 (1) и Saccharomyces cerevisiae Y-4317 (2) при совместном культивировании на среде с мелассой (15 г/л) при температуре 30 ° С ( N = 5, M ±SEM) .
Для того чтобы проверить высказанное предположение, мы продлили совместное культивирование микроорганизмов до 72 ч, одновременно учитывая рост P. chlororaphis в чистой культуре (рис. 4). При это парадоксальным образом оказалось, что в смешанной культуре с дрожжами S. cerevisiae дальнейшего снижения титра бактерий не происходило, тогда как в чистой культуре псевдомонад спустя 72 ч титр жизнеспособных клеток снижался до предельного минимума (5*104 КОЕ/мл.
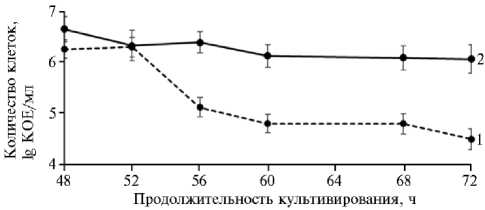
Рис. 4. Динамика роста Pseudomonas chlororaphis subsp. aureo-faciens B-5326 при раздельном (1) и совместном культивировании с Saccharomyces cerevisiae Y-4317 (2) в течение 72 ч на среде с мелассой (15 г/л) при температуре 30 ° С ( N = 5, M ±SEM) .
Таким образом, бы ло показано положитель ное влияние S. cerevisiae на жизнеспособность P. chlororaphis, поскольку через 72 ч совместного культивирования титр бактерий составил 1*106 КОЕ/мл, что примерно на два порядка выше, чем в чистой культуре бактерий. Сходное влияние метаболитов грибов на жизнеспособность бактерий при взаимодействии Pseudomonas и Saccharomyces описана в работе J.D. Romano с соавт. (39).
Известно, что в основе механизма взаимодействия бактерий и гри- бов лежит способность дрожжей синтезировать из глюкозы глюконат. Глюконат, в свою очередь, повышает жизнеспособность бактерий рода Pseudomonus (40). Этим отчасти можно объяснить выявленное положительное влияние S. cerevisiae на рост P. chlororaphis. Кроме того, в последние годы появились данные, что дрожжи служат активными продуцентами ауксина индолил-3-уксусной кислоты (возможно, и других фитогормонов). Примерно 90 % из всех известных видов дрожжей способны к синтезу ауксинов: дрожжи рода Cyberlindnera, Rhodotorula graminis, Rhodosporidium fluviale, Rhodosporidium paludigenum, Aureobasidium pullulans, Saccharomyces cerevisiae (41-43). При этом по активности синтеза гормональных соединений дрожжи практически не уступают бактериям и водорослям. Показано, что культуральная жидкость дрожжей способна влиять на рост и развитие растений (44). Можно предположить, что именно продуцирование фитогормонов дрожжами S. cerevisiae при совместном культивировании обусловливало активный рост и высокую жизнеспособности P. chlororaphis.
Мы предварительно оценили эффективность комплексного биопрепарата, определив всхожесть семян злаковых растений (ячменя, пшеницы, кукурузы) после обработки культуральной жидкостью, полученной при совместном выращивании дрожжей и псевдомонад, в четырех разведениях (от 1:200 до 1:25) (табл. 2). В контрольных вариантах энергия прорастания и всхожесть семян были довольно высокими и составили от 79 до 89 %.
2. Энергия прорастания и всхожесть (%) обработанных семян злаковых культур при разных разведениях культуральной жидкости, полученной при совместном выращивании Pseudomonas chlororaphis subsp. aureofaciens B-5326 и Saccharo-myces cerevisiae Y-4317 ( M ±SEM)
|
Показатель |
Разведение |
Контроль (вода) |
||||
|
1:200 |
1:150 |
| 1:100 | |
1:50 |
1:25 |
||
Ячмень ( ^ordeum vulgare L.), сорт Скипетр
|
Энергия прорастания |
90±2,1 |
88±2,5 91±3,1 |
89±2,8 87±2,5 |
85±2,4 |
|
Всхожесть |
96±2,9* |
92±3,4 95±3,8 |
92±2,2 89±3,2 |
87±3,0 |
|
Пшеница ( Triticum aestivum L.), сорт |
Мироновская 808 |
|||
|
Энергия прорастания |
93±3,2 |
91±2,9 95±3,7 |
89±2,6 85±2,8 |
86±3,2 |
|
Всхожесть |
94±3,6 Кукуруза |
95±3,1 96±4,1 92±2,8 90±3,1 ( Zea mays L.), гибрид Делитоп |
89±2,7 |
|
|
Энергия прорастания |
89±2,9* |
87±3,6 86±4,1 |
80±3,8 81±2,9 |
79±3,1 |
|
Всхожесть * Различия с контролем |
96±4,6* 89±3,6 90±2,8 статистически значимы при р < 0,05. |
85±3,0 88±3,3 |
83±3,4 |
|
Предпосевная обработка биопрепаратом стимулировала прорастание семян всех исследованных злаковых культур. При этом эффективность обработки зависела от концентрации (разведения) культуральной жидкости. У семян ячменя всхожесть статистически значимо (р = 0,05) увеличилась на 9 % по сравнению с контролем при использовании КЖ в разведении 1:200. Четкая тенденция к увеличению энергии прорастания и всхожести семян ячменя отмечалась при всех разведениях (различия с контролем недостоверны). Схожие зависимости были выявлены для пшеницы, где самые высокие значения всхожести наблюдались для разведений 1:200-1:100, однако различия с контролем оказались недостоверными.
В опыте с семенами кукурузы также самыми эффективными оказались самые низкие концентрации биопрепарата. При использовании разведения 1:200 энергия прорастания достоверно (р = 0,05) увеличилась на 10 %, а всхожесть — на 13 % по сравнению с контролем. Разведения 1:150 и 1:100 показали тенденцию к стимулированию прорастания семян (различия с контролем недостоверны). Более высокие дозы биопрепарата (разведения 1:50 и 1:25) незначительно повышали энергию прорастания и всхожесть.
Повышение энергии прорастания и высокая всхожесть семян контролируются фитогормонами, которые активируют деление и растяжение клеток, повышают стрессоустойчивость (16, 17).
Итак, нами показана возможность совместного культивирования бактерии Pseudomonas chlororaphis subsp. aureofaciens B-5326 и дрожжей Saccharomyces cerevisiae Y-431, что позволит создать биопрепарат на основе микроорганизмов разных таксономических групп. Свекловичная меласса (отход сахарного производства) вполне удовлетворяет потребности исследуемых микроорганизмов в основных питательных веществах. Были подобраны оптимальные условия совместного культивирования: температура 30 ° С, режим аэрации 4 л/ч, продолжительность культивирования 24 ч. Выявлено положительное влияние S. cerevisiae на жизнеспособность P. chlororaphis при длительном (72 ч) совместном культивировании. Так, в присутствии S. cerevisiae титр P. chlororaphis составил 106 КОЕ/мл, в чистой культуре — 104 КОЕ/мл. Предпосевная обработка семян препаратом, полученным при совместном культивировании указанных микроорганизмов, стимулировала энергию прорастания и всхожесть у ячменя, пшеницы и кукурузы. Наиболее высокую эффективность комплексный препарат показал в отношении семян кукурузы. Максимальное повышение энергии прорастания и всхожести семян всех изучаемых культур выявлено при разведении препарата 1:200.
Список литературы Особенности совместного культивирования Pseudomonas chlororaphis и Saccharomyces cerevisiae для создания комплексного биопрепарата
- Kocira S., Hara P., Szparaga A., Czerwiñska E., Beloev H., Findura P., Bajus P. Evaluation of the effectiveness of the use of biopreparations as seed dressings. Agriculture, 2020, 10(4): 90 (doi: 10.3390/agriculture10040090).
- Yadav A.N., Verma P., Singh B., Chauhan V.S., Suman A., Saxena A.K. Plant growth promoting bacteria: Biodiversity and multifunctional attributes for sustainable agriculture. Advances in Biotechnology & Microbiology, 2017, 5(5): 555671 (doi: 10.19080/AIBM.2017.05.5556671).
- El-Maraghy S.S., Tohamy A.T., Hussein K.A. Plant protection properties of the plant growth-promoting fungi (PGPF): Mechanisms and potentiality. Current Research in Environmental & Applied Mycology (Journal of Fungal Biology), 2021, 11: 391-415 (doi: 10.5943/cream/11/1/29).
- Kumar A., Singh S., Gaurav A.K., Srivastava S., Verma J.P. Plant growth-promoting bacteria: Biological tools for the mitigation of salinity stress in plants. Frontiers in Microbiology, 2020, 11: 1216 (doi: 10.3389/fmicb.2020.01216).
- Бурова Ю.А., Ибрагимова С.А., Ревин В.В. Действие культуральной жидкости бактерии Pseudomonas aureofaciens на развитие семян пшеницы и фитопатогенных грибов. Известия Тульского государственного университета. Естественные науки, 2012, 3: 198-206.
- Бабенко Л.М., Романенко Е.А., Юнгин, О.С., Косаковская И.В. Ацилгомосеринлактоны как регуляторы урожайности и стрессоустойчивости сельскохозяйственных культур (обзор). Сельскохозяйственная биология, 2021, 56(1): 3-19 (doi: 10.15389/agrobiology.2021.1.3rus).
- Bertani I., Zampieri E., Bez C., Volante A., Venturi V., Monaco S. Isolation and characterization of Pseudomonas chlororaphis strain ST9 and its potential as a bioinoculant for agriculture. BioRxiv, 2020, 10(7): 1466 (doi: 10.1101/2020.12.23.424151).
- Jiménez J.A, Novinscak A., Filion M. Inoculation with the plant-growth-promoting rhizo-bacte-rium Pseudomonas fluorescens LBUM677 impacts the rhizosphere microbiome of three oilseed crops. Frontiers in Microbiology, 2020, 11: 569366 (doi: 10.3389/fmicb.2020.569366).
- Zhang Y., Li T., Xu M., Guo J., Zhang C., Feng Z., Peng X., Li Z., Xing K., Qin S. Antifungal effect of volatile organic compounds produced by Pseudomonas chlororaphis subsp. aureofaciens SPS-41 on oxidative stress and mitochondrial dysfunction of Ceratocystis fimbriata. Pesticide Biochemistry and Physiology, 2021, 173: 104777 (doi: 10.1016/j.pestbp.2021.104777).
- Salim H.A., Aziz A.K., Mahdi M.H., Ali M.A.K., Salman M.H., Hussein M.M., Mohammed L.K., Ahmed M.S., Khalil A.Y., Hadi T.A. Effect of bio-fertilizers Azotobacter chroococcum and Pseudomonas fluorescens on growth of broccoli (Brassica oleracea L. var. italica). Journal of Advances in Biology, 2018, 11(01): 2236-2240 (doi: 10.24297/jab.v11i1.7590).
- Martínez-Carranza E., Ponce-Soto G.-Y., Servín-González L., Alcaraz L.D., Soberón-Chávez G. Evolution of bacteria seen through their essential genes: the case of Pseudomonas aeruginosa and Azotobacter vinelandii. Microbiology, 2019, 165(9): 976-984 (doi: 10.1099/mic.0.000833).
- Сидоренко М.Л., Слепцова Н.А., Быковская А.Н., Бережная В.В., Клыков А.Г. Прорастание семян злаков под влиянием композиций азотфиксирующих и фосфатмо-билизующих бактерий из почв, возделываемых в условиях Дальнего Востока. Сельскохозяйственная биология, 2021, 56(1): 146-157 (doi: 10.15389/agrobiology.2021.1.146rus).
- Naserzadeh Y., Nafchi A.M., Mahmoudi N., Nejad D.K., Gadzhikurbanov A.S. Effect of combined use of fertilizer and plant growth stimulating bacteria Rhizobium, Azospirillum, Azotobacter and Pseudomonas on the quality and components of corn forage in Iran. RUDN Journal of Agronomy and Animal Industries, 2019, 14(3): 209-224 (doi: 10.22363/2312-797x-2019-14-3-209-224).
- Ali S., Hameed S., Shahid M., Iqbal M., Lazarovits G., Imran A. Functional characterization of potential PGPR exhibiting broad-spectrum antifungal activity. Microbiological Research, 2020, 232: 126389 (doi: 10.1016/j.micres.2019.126389).
- Streletskii R.A., Kachalkin A.V., Glushakova A.M., Demin V.V., Chernov I.Y. Quantitative determination of indole-3-acetic acid in yeasts using high performance liquid chromatography— tandem mass spectrometry. Microbiology, 2016, 85: 727-736 (doi: 10.1134/S0026261716060187).
- Лукаткин А.С., Зауралов О.А. Экзогенные регуляторы роста как средство повышения холодоустойчивости теплолюбивых растений. Доклады Россельхозакадемии, 2009, 6: 20-22.
- Колмыкова Т.С., Лукаткин А.С. Эффективность регуляторов роста растений при действии абиотических стрессовых факторов. Агрохимия, 2012, 1: 83-94.
- Gruznova K.A., Bashmakov D.I., Miliauskiene J., Vastakaite V., Duchovskis P., Lukatkin A.S. The effеct of a growth regulator Ribav-Extra on winter wheat seedlings exposed to heavy metals Zemdirbyste-Agriculture, 2018, 105(3): 227-234 (doi: 10.13080/z-a.2018.105.029).
- Yamagiwa Y., Inagaki Y., Ichinose Y., Toyoda K., Hyakumachi M., Shiraishi T. Talaromyces wortmannii FS2 emits p-caryphyllene, which promotes plant growth and induces resistance. Journal of General Plant Pathology, 2011, 77(6): 336-341 (doi: 10.1007/s10327-011-0340-z).
- Bhattacharyya P.N., Jha D.K. Plant growth-promoting rhizobacteria (PGPR): emergence in agriculture. World Journal of Microbiology and Biotechnology, 2012, 28(4): 1327-1350 (doi: 10.1007/s11274-011-0979-9).
- Khan A.L., Waqas M., Lee I.-J. Resilience of Penicillium resedanum LK6 and exogenous gibber-ellin in improving Capsicum annuum growth under abiotic stresses. Journal of Plant Research, 2015, 128(2): 259-268 (doi: 10.1007/s10265-014-0688-1).
- Tian P., Razavi B.S., Zhang X., Wang Q., Blagodatskaya E. Microbial growth and enzyme kinetics in rhizosphere hotspots are modulated by soil organics and nutrient availability. Soil Biology and Biochemistry, 2020, 141: 107662 (doi: 10.1016/j.soilbio.2019.107662).
- Ozimek E., Hanaka A. Mortierella species as the plant growth-promoting fungi present in the agricultural soils. Agriculture, 2021, 11(1): 7 (doi: 10.3390/agriculture11010007).
- Taparia T., Krijger M., Haynes E., Elphinstone J.G., Noble R., van der Wolf J. Molecular characterization of Pseudomonas from Agaricus bisporus caps reveal novel blotch pathogens in Western Europe. BMC Genomics, 2020, 21(1): 505 (doi: 10.1186/s12864-020-06905-3).
- Справочник пестицидов и агрохимикатов, разрешенных к применению на территории Российской Федерации. М., 2011.
- Jacob F.F., Striegel L., Rychlik M., Hutzler M., Methner F.-J. Spent yeast from brewing processes: a biodiverse starting material for yeast extract production. Fermentation, 2019, 5(2): 51 (doi: 10.3390/fermentation5020051).
- Anderson A.J., Kim Y.C. Insights into plant-beneficial traits of probiotic Pseudomonas chlorora-phis isolates. Journal of Medical Microbiology, 2020, 69(3): 361-371 (doi: 10.1099/jmm.0.001157).
- Нетрусов А.И., Егорова М.А., Захарчук Л.М. Практикум по микробиологии /Под ред. А.И. Нетрусова. М., 2005.
- Casalone E., Barberio C., Cappellini L., Polsinelli M. Characterization of Saccharomyces cere-visiae natural populations for pseudohyphal growth and colony morphology. Research in Microbiology, 2005, 156(2): 191-200 (doi: 10.1016/j.resmic.2004.09.008).
- Kasana R.C., Sharma U.K., Sharma N., Sinha A.K. Isolation and identification of a novel strain of Pseudomonas chlororaphis capable of transforming isoeugenol to vanillin. Current Microbiology, 2007, 54(6): 457-461 (doi: 10.1007/s00284-006-0627-z).
- Jain R., Pandey A. A phenazine-1-carboxylic acid producing polyextremophilic Pseudomonas chlororaphis (MCC2693) strain, isolated from mountain ecosystem, possesses biocontrol and plant growth promotion abilities. Microbiological Research, 2016, 190: 63-71 (doi: 10.1016/j.mi-cres.2016.04.017).
- ГОСТ 12038-84. Семена сельскохозяйственных культур. Методы определения всхожести. М., 2004.
- Лакин Г.Ф. Биометрия. М., 1990.
- Saric L.C., Filipcev B.V., Simurina O.D., Plavsic D.V., Saric B.M., Lazarevic J.M., Mi-lovanovic I.L. Sugar beet molasses: properties and applications in osmotic dehydration of fruits and vegetables. Food and Feed Research, 2016, 43(2): 135-144 (doi: 10.5937/FFR1602135S).
- Kim H.-S., Cha E., Kim Y., Jeon Y.H., Olson B.H., Byun Y., Park H.-D. Raffinose, a plant galactoside, inhibits Pseudomonas aeruginosa biofilm formation via binding to LecA and decreasing cellular cyclic diguanylate levels. Scientific Reports, 2016, 6(1): 25318 (doi: 10.1038/srep25318).
- Kuriyama H., Kobayashi H. Effects of oxygen supply on yeast growth and metabolism in continuous fermentation. Journal of Fermentation and Bioengineering, 1993, 75(5): 364-367 (doi: 10.1016/0922-338X(93)90135-U).
- Shen X., Wang Z., Huang X., Hu H., Wang W., Zhang X. Developing genome-reduced Pseudomonas chlororaphis strains for the production of secondary metabolites. BMC Genomics, 2017, 18: 715 (doi: 10.1186/s12864-017-4127-2).
- Moreno-Avitia F., Utrilla J., Bolivar F., Nogales J., Escalante A. Metabolic reconstruction of Pseudomonas chlororaphis ATCC 9446 to understand its metabolic potential as a phenazine-1-carboxamide-producing strain. Applied Microbiology and Biotechnology, 2020, 104(23): 1011910132 (doi: 10.1007/s00253-020-10913-4).
- Romano J.D., Kolter R. Pseudomonas-Saccharomyces interactions: Influence of fungal metabolism on bacterial physiology and survival. Journal of Bacteriology, 2005, 187(3): 940-948 (doi: 10.1128/JB.187.3.940-948.2005).
- Schleissner C., Reglero A., Luengo J.M. Catabolism of D-glucose by Pseudomonas putida occurs via extracellular transformation into D-gluconic acid and induction of a specific gluconate transport system. Microbiology, 1997, 143(5): 1595-1603 (doi: 10.1099/00221287-143-5-1595).
- Limtong S., Koowadjanakul N. Yeasts from phylloplane and their capability to produce indole-3-acetic acid. World Journal of Microbiology and Biotechnology, 2012, 28(12): 3323-3335 (doi: 10.1007/s11274-012-1144-9).
- Nutaratat P., Srisuk N., Arunrattiyakorn P., Limtong S. Plant growth-promoting traits of epiphytic and endophytic yeasts isolated from rice and sugar cane leaves in Thailand. Fungal Biology, 2014, 118(8): 683-694 (doi: 10.1016/j.funbio.2014.04.010).
- Pirog T.P., Iutynska G.O., Leonova N.O., Beregova K.A., Shevchuk T.A. Microbial synthesis of phytohormones. Biotechnologia Acta, 2018, 11(1): 5-24 (doi: 10.15407/biotech11.01.005).
- Стрелецкий Р.А., Качалкин А.В., Федотов Г.Н. Влияние дрожжей-продуцентов фитогормонов на развитие проростков Lepidium sativum. Современные проблемы науки и образования, 2017, 1: 130.


