Особенности структурных и микроструктурных изменений в тимусе в «катаболической» фазе после воздействия экспериментальной гипертермии
Автор: Мичурина Светлана Викторовна, Васендин Дмитрий Викторович, Ищенко Ирина Юрьевна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Медицинские науки
Статья в выпуске: 2 (131), 2013 года.
Бесплатный доступ
Целью исследования явилось изучение клеточного состава тимуса 45 крыс Вистар после экспериментальной гипертермии. Животные нагревались однократно до стадии теплового удара. На разных сроках эксперимента (5 ч, 3 сут.) после экспериментальной гипертермии животных забивали под легким наркозом и забирали тимус для исследования. Гистологические препараты изготавливались по стандартным методикам. Во всех зонах тимуса дифференцировали иммунобласты, средние и малые лимфоциты, клетки с фигурами митозов, клетки с пикнотическими ядрами, эпителиальные клетки и макрофаги (увеличение 1000 раз, на стандартной площади 4500 мкм 2). Установлено, что воздействие на организм крыс Вистар экспериментальной гипертермии приводит к формированию акцидентальной инволюции тимуса. Инволюция органа соответствовала «катаболической» фазе постгипертермического периода (5 ч, 3 сут. после экспериментальной гипертермии), что выражалось в снижении относительного веса органа (на 25 %), уменьшении относительной площади коркового вещества (на 15 %) и плотности лимфоцитов (на 12 %). На тканевом уровне выявлено усиление деструктивных процессов, признаки периваскулярного отека, миграция клеточных элементов в лимфатические пространства и капилляры.
Тимус, гипертермия, крысы вистар, инволюция
Короткий адрес: https://sciup.org/14750379
IDR: 14750379 | УДК: 611.438:615.367
Текст научной статьи Особенности структурных и микроструктурных изменений в тимусе в «катаболической» фазе после воздействия экспериментальной гипертермии
В последние годы был проведен ряд исследований, посвященных выяснению причин и механизмов нарушений функций органов иммунной, или лимфоидной [10], системы, в частности тимуса, при воздействии на организм общей экспериментальной гипертермии (ЭГ) [2], [3], [4], [11], [12], [13], [15]. В настоящее время отсутствуют систематические литературные сведения, касающиеся состояния тимуса при воздействии на организм высокой внешней температуры. Вопросы морфологических (и функциональных) сдвигов в тимусе обсуждаются фрагментарно, да и то лишь в отношении функциональных иммунологических сдвигов. Но, как отмечает исследователь В. М. Успенский, любая функция решительно невозможна без структуры и любое функциональное нарушение имеет в своей основе морфологические изменения различных уровней: органного, тканевого, клеточного, субклеточного или молекулярного [17].
Изучение биологических эффектов действия на живой организм высокой внешней температу-
ры в эксперименте позволяет получить сведения о структурно-функциональных основах адаптации, дезадаптации и восстановления органов и их систем. Исследования биологических эффектов гипертермического воздействия, реализующихся через морфологическое и функциональное состояние структурно-клеточных элементов тимуса, не проводились, поэтому целью нашей работы явилось изучение особенностей структурных и микроструктурных изменений в тимусе в различные сроки после однократного воздействия высокой внешней температуры (ЭГ).
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования были проведены на 45 самцах крыс Вистар в возрасте 2,5–3 мес. с исходной массой тела 200–230 г. В качестве объекта исследования выбран тимус крыс.
Разогревание экспериментальных животных производилось в утренние часы в соответствии со «Способом экспериментального моделирования общей гипертермии у мелких лаборатор- ных животных» [5]. Животных разогревали в резервуаре стандартной термобани ТБ-110 при погружении в горячую воду до уровня шеи. Уровень гипертермии, при котором прекращали разогревание, определялся ректальной температурой 43,5 ºС (стадия теплового удара). Время разогревания каждой особи до уровня ректальной температуры 43,5 ºС было индивидуальным и составляло не более 17 мин. Темп повышения температуры тела животных составил более 1 ºС за 5 мин. Температурный режим нагрева горячей воды-теплоносителя подбирался экспериментально и составил 45 ºС. Данную температуру можно считать оптимальной при моделировании общей гипертермии, так как более высокие значения плохо переносятся животными и приводят в конечном итоге к возрастанию ректальной температуры до уровня гипертермии (40 ºС и выше), но медленнее, чем на 1 ºС за 5 мин. Измерение ректальной температуры проводилось на всех этапах эксперимента: до начала опыта, в течение всего периода разогревания и в постгипертермическом периоде в течение 30 мин.
Термометрия осуществлялась с помощью дифференциальной термопары (медь-констан-тан), подключенной к высокочувствительному микровольтметру-микроамперметру постоянного тока типа Ф 116/2, что позволяло с высокой точностью измерять даже небольшие перепады температур. Непрерывное в ходе всего опыта и точное (до десятых долей градуса) измерение ректальной температуры позволяло извлекать животных из термобани в критический момент – на высоте развития теплового удара, что обеспечило их стопроцентную выживаемость. По данным термометрии, ректальная температура крыс возвращалась к исходному уровню уже через 20 мин после прекращения разогревания.
Все животные нагревались однократно в полном соответствии с описанной методикой до стадии теплового удара (ректальная температура 43,5 ºС). На разных сроках эксперимента животных забивали под легким эфирным наркозом путем декапитации, по 15 животных из группы в каждую временную точку, и забирали гистологический материал для морфологических исследований.
Для светооптического исследования тимус фиксировали в растворе по Телесницкому, обезвоживали в серии спиртов возрастающей концентрации и заливали в смесь парафина с добавлением 5–6 % чистого воска. Срезы изготавливали на ротационном микротоме, окрашенные препараты заключали в канадский бальзам. Определение относительных площадей коркового и мозгового вещества, капсулы и междольковых перегородок проводили на срезах толщиной 10 мкм, окрашенных гематоксилином Майера и эозином, используя метод наложения точечных морфометрических сеток [1]. Срезы морфометрировали при увеличении в
16 раз, морфометрию железистых образований проводили на тех же срезах при увеличении в 200 раз. Клеточный состав тимуса изучали на срезах толщиной 5 мкм, окрашенных азуром II и эозином. При увеличении в 1000 раз (объектив 100, окуляр 10) подсчитывали абсолютное количество разных видов клеток на стандартной площади 4500 мкм². Дифференцировали следующие клеточные элементы: иммунобласты, средние и малые лимфоциты, клетки с фигурами митозов, клетки с пикнотическими ядрами, эпителиальные клетки и макрофаги. Подсчет клеток проводили в субкапсулярной и внутренней зонах коркового вещества и в мозговом веществе. Для всех морфологических данных вычисляли абсолютные и относительные показатели.
Для электронно-микроскопического исследования материал (по 5 кусочков тимуса от каждого животного, по 5 животных из каждой экспериментальной группы) фиксировали в 4 % параформальдегидном изотоническом 0,1 М фиксаторе на фосфатном буфере Миллонига (рh = 7,4) в течение 2 ч при t = 4 °С. Дофиксацию проводили в 1 % осмиевом фиксаторе на 0,2 М какодилатном буфере (рh = 7,4). После дегидратации образцов в серии спиртов возрастающей концентрации они заключались в эпон-812. Уль-тратонкие срезы толщиной 35–45 нм получали на ультратоме LKB-8800, контрастировали насыщенным водным раствором уранилацетата при 40 ºС в течение 40 мин, а затем цитратом свинца в течение 20 мин. После напыления углеродом в вакууме контрастированные срезы изучались в электронном микроскопе JEM-1010.
Статистическую обработку данных проводили методом вариационной статистики с применением t-критерия Стьюдента [8], [14]. Полученные результаты обработаны при помощи пакета программ Statistica 6.0. Различия сравниваемых показателей принимались как достоверные при p < 0,05. Результаты представлены как M ± m, где M – среднестатистическое значение, m – cтандартная ошибка от среднего.
Все экспериментальные работы выполнены в Центральной научно-исследовательской лаборатории Новосибирского государственного медицинского университета (заведующий – доктор медицинских наук профессор С. В. Мичурина) с соблюдением правил биоэтики, утвержденных Европейской конвенцией о защите позвоночных животных, используемых для лабораторных или иных целей.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Нами было установлено, что воздействие на организм крыс ЭГ приводит к выраженным изменениям на тканевом, клеточном и субклеточном уровнях организации тимуса, которые характерны для «катаболической» фазы развития постстрессорной реакции, соответствующей в нашем эксперименте острому (5 ч, 3 cут.) постгипертермическому периоду [13].
Воздействие на организм крыс высокой внешней температуры приводило к выраженным изменениям не только зонального [3], но и клеточного состава тимуса во всех его структурно-функциональных зонах.
Клеточный состав тимуса был изучен нами на светооптическом и электронно-микроскопическом уровнях. Субклеточное строение тех клеток, которые хорошо визуализировались на светооптическом уровне, мы сочли возможным не показывать, однако присутствие всех типов клеточных популяций подтверждено электронно-микроскопически. Некоторые типы клеток тимуса не идентифицировались при помощи светомикроскопического метода исследования, поэтому приводится подробное описание их ультраструктурной организации.
Цитологический профиль тимуса был представлен следующим образом. У контрольной группы животных (интактные крысы) в корковом веществе тимуса хорошо выражена субкапсулярная зона. Общая численность клеток на стандартной площади 4500 мкм2 составила 172,83 ± 6,18. При этом количество малых лимфоцитов было 119,0 ± 5,99, иммунобластов – 25,5 ± 2,2, средних лимфоцитов – 14,0 ± 2,0. Количество клеток с фигурами митозов составило 3,3 ± 0,61, а численность клеток с пикнотически-ми ядрами – 2,67 ± 0,37. Кроме того, в субкапсулярной зоне коркового вещества тимуса были хорошо представлены макрофаги (2,33 ± 0,23) с фагоцитированными остатками ядер погибших лимфоцитов. В субкапсулярном слое коры тимуса группы контрольных животных количество эпителиальных клеток на стандартной площади равнялось 6,0 ± 1,06.
Во внутренней зоне коркового вещества плотность клеточных элементов оказалась большей, чем в субкапсулярном и мозговом слоях. На стандартной площади 4500 мкм² содержалось в среднем 216,17 ± 7,61 клетки. Количество малых лимфоцитов составило 179,17 ± 6,56, иммунобластов – 8,33 ± 1,12, средних лимфоцитов – 15,33 ± 1,54. Фигуры митозов отмечались у 3,67 ± 0,61 клетки. Численность же макрофагов была 1,83 ± 1,19. Во внутренней коре эпителиальные клетки встречались несколько реже, чем в субкапсулярной. Их количество на стандартной площади составило 5,67 ± 1,19.
В мозговом веществе регистрировалась наименьшая плотность клеточных элементов, чем во всех изученных нами зонах тимуса, она составила 127,67 ± 9,18. При этом доминировала популяция малых лимфоцитов, в среднем она составила 83,67 ± 9,53 клетки; иммунобластов – 3,83 ± 0,59, а средних лимфоцитов – 15,67 ± 2,65. Содержание клеток с фигурами митозов также в мозговом слое тимуса меньше, чем в структурнофункциональных зонах коркового вещества.
Количество делящихся клеток на стандартной площади равнялось 0,17 ± 0,18. Численность макрофагов составила 2,0 ± 0,69. Обращает на себя внимание то, что в мозговом веществе органа значительно больше эпителиальных клеток, нежели в корковом слое. На стандартной площади среза их в среднем 21,0 ± 1,44.
В стромальном компартменте тимуса у интактных животных встречались различные типы клеточных популяций: лимфоциты, плазматические клетки, эозинофилы, макрофаги, обычно расположенные неправильно.
Распространенным типом клеточных элементов тимуса являются тучные клетки. Они расположены в основном в соединительнотканной строме, часто обнаруживаются рядом с кровеносными сосудами, а также диффузно разбросаны в капсуле и междольковых перегородках. Среди выявленных нами тучных клеток в строме тимуса встречались как дегранулирующие, так и недегранулирующие формы. Неде-гранулирующие клетки визуализировались как крупные, с высокой плотностью гранул, маскирующих ядро. Среди дегранулирующих тучных клеток преобладали клетки со слабой (I степень) степенью дегрануляции. Присутствие клеток с III степенью дегрануляции оказалось невелико.
У контрольной группы животных эпителиальный компонент тимуса был представлен диффузной сетью эпителиальных клеток, железистыми структурами и тельцами Гассаля. Место скопления телец Гассаля – мозговое вещество. У интактных животных они встречались редко и, как правило, в виде небольших одиночных образований. Мелкие тельца состояли из нескольких концентрически расположенных эпителиальных клеток, в более крупных тельцах эпителиальные клетки образовывали несколько слоев. Центральная часть таких телец была заполнена гомогенным блестящим ярко-розовым веществом.
Железистые структуры выглядели как тяжи и трубчатые образования. Стенка последних была сформирована одним слоем эпителиальных клеток, а в просвете обнаруживались лимфоциты и эпителиальные слущенные клетки.
Сосудистое русло в коре тимуса представлено кровеносными капиллярами. В зоне кортикомедуллярного соединения идентифицировались посткапиллярные венулы, имеющие более широкий просвет и хорошо выраженные периваскулярные пространства неравномерной ширины. В периваскулярных пространствах, окружающих артериолы и посткапиллярные венулы тимуса в зоне кортикомедуллярного соединения, мы встречали лимфатические капилляры. На светооптическом уровне лимфатические капилляры выглядели как слепо начинающиеся, неравномерно расширенные пространства, выстланные эндотелием и заполненные лимфоцитами.
«Катаболическая» фаза постгипертермического периода характеризовалась увеличением периваскулярных пространств в тимусе, особенно в области корковомедуллярного соединения и мозговой зоны. На светооптическом уровне отмечалось появление плазматических клеток на фоне большого числа лимфоидных клеток, заполняющих периваскулярные пространства. Ультраструктурно выявлено, что плазматические клетки очень активны: профили их гранулярного эндоплазматического ретикулума расширены, заполнены электронносветлым материалом и образуют с митохондриями мито-ГЭР-комплексы (рис. 1).
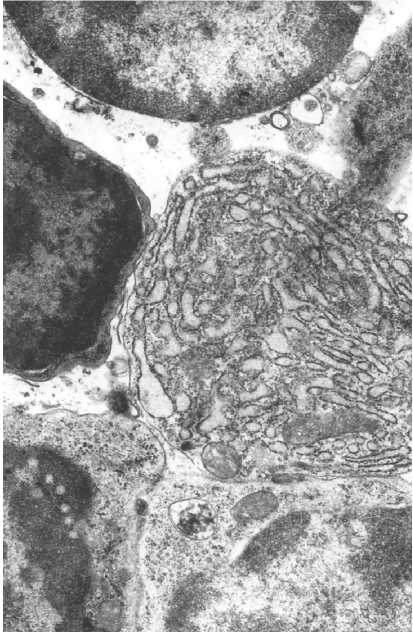
Рис. 1. Плазматическая клетка. Увеличение 8000
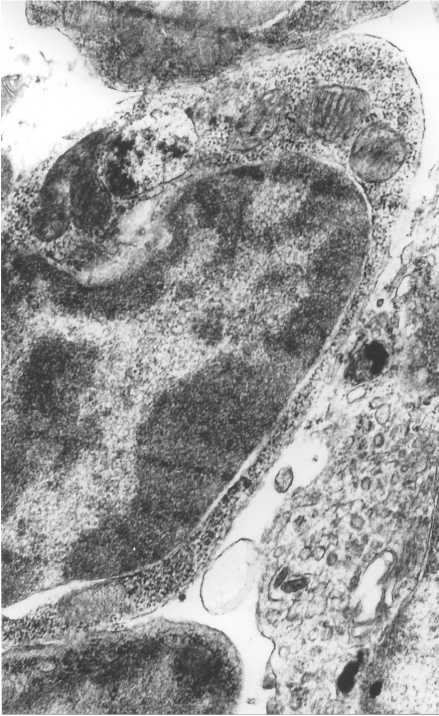
Рис. 2. Фрагмент эпителиальной клетки с вакуолью. Фрагмент эндотелиальной клетки с большим количеством пиноцитозных пузырьков. Увеличение 10 000
На ультраструктурном уровне обращало на себя внимание очень большое количество пино-цитозных везикул в эндотелиоцитах капилляров и венул, разволокнение базальных мембран, преимущественно со стороны периваскулярных эпителиальных клеток, наличие соединительнотканных фибрилл и детрита разрушенных эпителиальных клеток в периваскулярных пространствах (рис. 2).
Такие морфологические изменения свидетельствуют о нарушении гемато-тимического барьера и лимфодренажной функции, поскольку перивенулярные пространства рассматриваются исследователями в качестве прелимфатиче-ских структур [15]. Появление плазматических клеток может свидетельствовать о наличии антигена в паренхиме и строме тимуса [19]. На протяжении всей «катаболической» фазы после ЭГ на ультраструктурном уровне отмечалась дилатация и заполнение клеточным детритом интерстициальных пространств во всех зонах тимуса. Обнаружены значительные разрушения эпителиальных клеток (рис. 3).
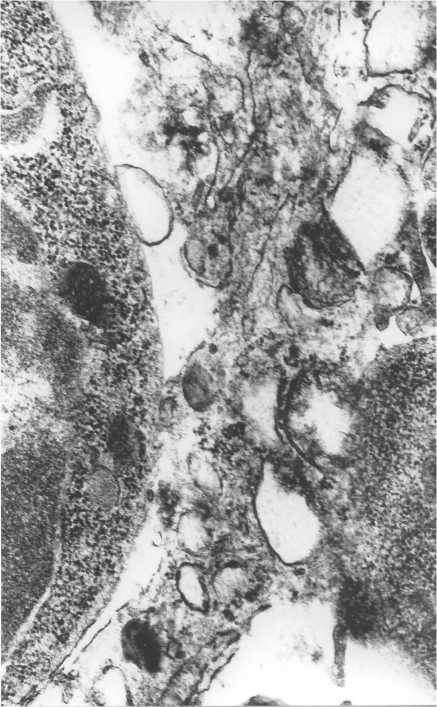
Рис. 3. Фрагмент разрушенной эпителиальной клетки. Увеличение 15 000
В них наблюдалось баллонообразное расширение профилей гранулярного эндоплазматического ретикулума, осыпание с его мембран рибосом, что, как известно, является признаком нарушения синтетических процессов. В митохондриях отмечено набухание митохондриального матрикса, дезорганизация и разрушение крист, что может свидетельствовать о нарушении энергообеспечения эпителиальных клеток тимуса [9]. Во многих случаях определялось разрушение цитоплазматической мембраны и выход остатков органелл в межклеточное пространство (рис. 4).
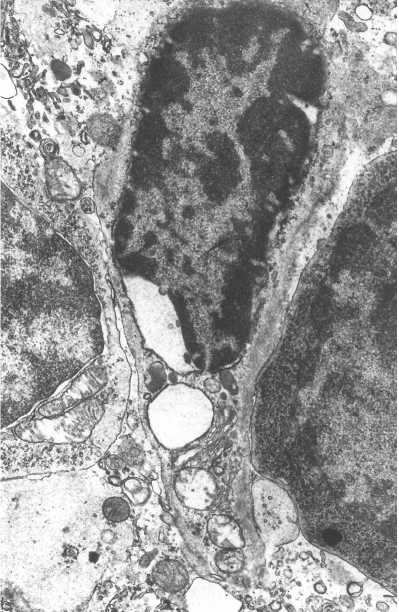
Рис. 4. Разрушающаяся эпителиальная клетка. Увеличение 10 000
На фоне выраженных деструктивных процессов в органе, затруднении дренажа интерстициальных пространств выявлены значительные изменения в лимфоидном компартменте тимуса. Общая плотность клеточных элементов, особенно во внутренней зоне коркового вещества тимуса, достоверно снижалась и через 5 ч после проведения ЭГ составила 177,8 ± 12,1 клетки. Основной вклад в эти изменения вносило уменьшение количества лимфоидных клеток, и в первую очередь в коре снижалось содержание именно малых лимфоцитов (для внутренней зоны коркового вещества – 120,4 ± 8,1). В мозговом веществе общая плотность клеточных элементов не менялась, но при этом обнаруживалось уменьшение числа зрелых лимфоцитов до 69,0 ± 6,41. По-видимому, значительный вклад в эти изменения вносит процесс миграции зрелых лимфоцитов из коры через венулы и лимфатиче- ские сосуды, что согласуется с данными ряда исследователей [7], [18]. Интересно, что при этом не снижалась интенсивность лимфопоэтической функции тимуса, так как неизменным оставалось количество иммунобластов и митотически делящихся клеток в субкапсулярной зоне, увеличивалось число иммунобластов во внутренней коре (16,0 ± 2,62) и росло содержание средних лимфоцитов в субкапсулярном слое и мозговом веществе (25,4 ± 1,52*; здесь и далее: * – отличия достоверны в сравнении с показателями интактных животных (контроль) при р < 0,05). По-видимому, эти данные свидетельствуют об усилении лимфоцитопоэтической функции и ускорении созревания имеющихся тимоцитов в соответствующих зонах, что рассматривается нами как компенсаторные процессы. Снижение количества зрелых лимфоцитов может объясняться и гибелью дифференцированных Т-лимфоцитов. В первые часы острого периода в тимусе отмечено усиление процесса гибели клеток. В субкапсулярной и внутренней зонах коры тимуса увеличивалось число клеток с пикноти-ческими ядрами (7,2 ± 1,75), была ярко выражена макрофагальная реакция (7,6 ± 1,04; количество макрофагов увеличилось более чем в 2 раза). Ультраструктурно в них отмечено содержание крупных вторичных лизосом разной электронной плотности, активный комплекс Гольджи, умеренное содержание митохондрий и профилей гранулярного эндоплазматического ретикулума. Следует отметить, что в условиях гипертермического стресса главная роль в усилении гибели лимфоидных клеток, причем осуществляющейся по типу апоптоза, отводится глюкокортикоидным гормонам надпочечников [7]. Определенный вклад в усиление процесса разрушения лимфоцитов в корковом веществе тимуса вносят тучные клетки. Появление в начале острого периода большого количества дегранулированных тучных клеток согласуется с имеющимися данными литературы о стереотипности ответной реакции этих клеток на внешние дестабилизирующие влияния [6]. Дегрануляция является обычной реакцией тучных клеток на повреждение тканей. Этот процесс сопровождается выбросом гепарина, гистамина, серотонина, ферментов в соединительную ткань, что ведет к повышению сосудистой проницаемости, изменению тонуса сосудов. К моменту окончания «катаболической» фазы постстрессорной реакции происходило восстановление долевых соотношений коркового и мозгового вещества органа до уровня контроля. Отмечалось дальнейшее снижение численной плотности всех клеточных элементов в исследованных зонах тимуса (155,0 ± 10,92; 167,0 ± 4,35*; 111,75 ± 5,57), а среди них – клеток лимфоидного ряда, особенно во внутренней коре (151,0 ± 3,83*). Во всех структурно-функциональных зонах выявлялся низкий уровень содержания зрелых лим- фоцитов по сравнению с контролем (92,5 ± 9,22*; 113,75 ± 4,8*; 52,5 ± 8,7*), во внутренней зоне коркового слоя тимуса поддерживался возросший уровень числа иммунобластов (16,0 ± 2,87*), а в мозговом веществе – высокое содержание средних лимфоцитов (30,0 ± 5,83). На 3-и сутки после ЭГ в тимусе снижалась интенсивность процесса гибели клеток, что подтверждалось восстановлением до контрольного уровня числа клеток с пикнотическими ядрами (3,0 ± 1,56; 1,75 ± 0,55#; 2,0 ± 0,82; здесь и далее: # – отличия достоверны в сравнении с показателями группы «ЭГ + 5 ч») и макрофагов (2,0 ± 0,82#; 2,75 ± 0,87#; 2,25 ± 0,55), фагоцитирующих погибшие лимфоциты, возрастала относительная площадь железистых образований, а в обеих зонах коркового вещества увеличивалось количество эпителиальных клеток (6,75 ± 0,73#; 7,5 ± 1,11), что, по-видимому, объясняется острой необходимостью усиления секреции тимических гормонов при экстремальных воздействиях [7], [15].
ЗАКЛЮЧЕНИЕ
-
1. Изменения лимфоидной популяции тимуса в «катаболической» фазе после воздействия ЭГ характеризуются:
-
• значительным снижением содержания малых лимфоцитов, особенно во внутренней зоне коркового вещества органа, увеличением количества клеток с пикнотическими ядрами, а также числа макрофагов, фагоцитирующих деструктурированные лимфоциты, что рассматривается нами как усиление двух процес-
- сов – миграции малых лимфоцитов из тимуса и гибели дифференцированных Т-лимфоцитов;
-
• постепенным нарастанием числа средних лимфоцитов в субкапсулярной зоне коры, что может свидетельствовать об усилении лимфопоэтической функции и ускорении созревания имеющихся тимоцитов в соответствующих зонах и рассматривается нами как компенсаторные процессы.
-
2. К концу «катаболической» фазы постстрес-сорной реакции (3-и сутки) результаты массоме-трии (снижение относительного веса тимуса), а также изменения структуры и клеточного состава органа (уменьшение плотности клеточных элементов, что в первую очередь определяется снижением численности малых лимфоцитов) свидетельствуют о наличии акцидентальной инволюции тимуса.
-
3. Состояние микроциркуляторного русла в «катаболической» фазе характеризуется отечностью периваскулярных пространств, постепенным увеличением количества плазматических клеток к 3-м суткам постгипертермического периода, что объясняется массивным внедрением антигенов вследствие повышенной проницаемости гемато-тимусного и капсулярно-тимического барьеров.
-
4. К концу «катаболической» фазы постгипертермической реакции значительно возрастает относительная площадь железистых образований, что, по-видимому, свидетельствует об усилении секреции тимических гормонов при данном экстремальном воздействии.
SPECIAL STRUCTURAL AND MICROSTRUCTURAL CHANGES IN THYMUS IN «CATABOLIC» PHASE AFTER EXPERIMENTAL HYPERTHERMIA
Список литературы Особенности структурных и микроструктурных изменений в тимусе в «катаболической» фазе после воздействия экспериментальной гипертермии
- Автандилов Г. Г. Медицинская морфометрия: Руководство. М.: Медицина, 1990. 384 c.
- Быкова Е. В. Патогенетические и клинические аспекты безопасности общей управляемой гипертермии высокого уровня (42,5-44,0 °С): Автореф. дис.. д-ра мед. наук. Новосибирск, 2006. 32 c.
- Васендин Д. В. Влияние вьюокой внешней температуры на микроанатомическую организацию тимуса крыс//Аспирантские и докторантские чтения. Дерзания нового времени -поиск инноваций: Материалы науч.-практ. конф. М., 2012. С. 44-46.
- Васендин Д. В., Мичурина С. В., Ищенко И. Ю. Структурные изменения в тимусе крыс в остром периоде после воздействия экспериментальной гипертермии//Вестник Ивановской медицинской академии. 2012. Т. 17. № 1. С. 20-24.
- Ефремов А. В., Пахомова Ю. В., Пахомов Е. А., Ибрагимов Р. Ш., Шорина Г. Н. Способ экспериментального моделирования общей гипертермии у мелких лабораторных животных. Патент РФ, № 2165105, 2001//Изобретения. Полезные модели. 2001. № 10. С. 43-45.
- Зерчанинова Е. И. О роли тучных клеток в регуляции кроветворения при действии на организм экстремальных факторов: Автореф. дис.. канд. мед. наук. Екатеринбург, 2000. 20 c.
- Кветной И. М., Ярилин А. А., Полякова В. О., Князькин И. В. Нейроиммуноэндокринология тимуса. СПб.: ДЕАН, 2005. 160 c.
- Лакин Г. Ф. Биометрия. М.: Высш. шк., 1990. 352 c.
- Лукьянова Л. Д. Биоэнергетическая гипоксия: понятие, механизмы и способы коррекции//Бюллетень экспериментальной биологии. 1997. T. 124. № 9. С. 244-254.
- Международная анатомическая терминология. М., 2003.
- Мичурина С. В., Васендин Д. В., Ищенко И. Ю., Жданов А. П. Структурные изменения в тимусе после воздействия экспериментальной гипертермии//Вестник Новосибирского государственного университета. Серия: Биология, клиническая медицина. 2010. Т. 8. № 1. С. 51-56.
- Пахомова Ю. В. Особенности гемолимфатических соотношений показателей белкового обмена при общей гипертермии: Автореф. дис. канд. мед. наук. Новосибирск, 2000. 19 c.
- Пахомова Ю. В. Системные механизмы метаболизма при общей управляемой гипертермии: Автореф. дис.. д-ра мед. наук. Новосибирск, 2006. 33 c.
- Плохинский Н. А. Биометрия. M.: Изд-во МГУ, 1970. 356 с.
- С елятицкая В. Г., Обухова Л. А. Эндокринно-лимфоидные отношения в динамике адаптивных процессов. Новосибирск: Изд-во СО РАМН, 2001. 168 c.
- С имакова И. Ю. Особенности эндокринно-метаболического статуса у крыс в динамике общей искусственной гипертермии: Автореф. дис. канд. мед. наук. Новосибирск, 2005. 20 c.
- Успенский В. М. Функциональная морфология слизистой оболочки желудка. Л.: Наука, 1986. 291 с.
- Ярилин А. А. Гомеостатические процессы в иммунной системе. Контроль численности лимфоцитов//Иммунология. 2004. № 5. C. 312-320.
- Saint-Marie G., Peng F.-S., Marcoux D. The stroma of the thymus of the rat: Morphologic and antigen diffusion, a reconsideration//Amer. J. Anat. 1996. Vol. 177. № 3. P. 333-352.


