Особенности течения артериальной гипертензии, связанные с распределением аллелей и генотипов полиморфного маркера C825t гена GNB3 среди больных, проживающих в Ростовской области
Автор: Арутюнян Л.В., Дроботя Н.В., Пироженко А.А., Торосян С.С., Калтыкова В.В.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.12, 2017 года.
Бесплатный доступ
Проанализированы клинические наблюдения и специально проведенные исследования у 47 больных с артериальной гипертензией (АГ), проживающих в Ростовской области. Среди обследованных мужчин было 21 (45%), женщин 26 (55%). Проведен анализ влияния полиморфизма гена гуанин связывающего белка (GNB3) на особенности течения АГ. При сравнении частот генотипов и аллелей гена GNB3, оказалось, что носительство генотипа C/T полиморфного маркера C825T гена GNB3 ассоциировано с отягощенным семейным анамнезом и ранним началом АГ. У больных АГ 3 степени оказалась достоверно ниже частота аллели С полиморфного маркера C825T гена GNB3. Носительство аллели T было ассоциировано с повышенной массой тела (ИМТ >325). Достоверной связи между изученным геном и стадией, а также с развитием осложнений АГ (инфаркт миокарда, нарушение мозгового кровообращения, хроническая сердечная недостаточностью), поражением органов мишеней в рамках данного исследования выявить не удалось.
Артериальная гипертензия, генетический полиморфизм, ген gnb3
Короткий адрес: https://sciup.org/140188641
IDR: 140188641 | УДК: 616.12-008.331.1:575.22
Текст научной статьи Особенности течения артериальной гипертензии, связанные с распределением аллелей и генотипов полиморфного маркера C825t гена GNB3 среди больных, проживающих в Ростовской области
В настоящее время в мире АГ страдает около 1 млрд человек. Несмотря на всеобщие усилия по профилактике и лечению АГ, она остается одним из ведущих факторов риска смертности населения от основных сердечно-сосудистых осложнений, таких как нарушение мозгового кровообращения и инфаркт миокарда, доля которых в структуре общей смертности составляет 20–50%.
Вклад АГ в смертность лиц среднего возраста от сердечно-сосудистых заболеваний составляет 40%, а в смертность от мозгового инсульта – 70–80% [2].
Растущая заинтересованность современных исследователей проблемой генетических полиморфизмов открывает широкие перспективы в переосмыслении и более глубоком понимании механизмов возникновения и прогрессирования большинства известных болезней. Не является исключением и АГ – многофакторное заболевание, при котором полиморфизмы в разных генах рассматривают в комплексе с экзогенными факторами [6].
В генетических исследованиях факторов развития АГ идентифицировано более 1500 генов, которые ассоциированы с повышением уровня АД [8].
Известно, что в большинстве случаев многофакторная природа АГ обусловлена генетическим полиморфизмом ренин-ангиотензин-альдостероновой (РААС) и брадикининовой систем [9]. Эти заключения основываются на многочисленных исследованиях по изучению ассоциации АГ с полиморфными вариантами соответствующих генов.
При исследовании связи генетических факторов АГ с особенностями ее течения, развитием осложнений и эффективностью терапии было показано, что наибольшее значение имели гены, кодирующие компоненты РААС [5].
С позиций современных представлений одним из патогенетических механизмов АГ является нарушение процессов передачи сигналов внутрь клеток. Как известно, в клетках организма присутствуют гуанин связывающие G-белки, представляющие собой ГТФ-азы – ферменты, которые связывают и гидролизуют гуанозинтрифосфат (ГТФ, GTP) и функционируют в качестве вторичных посредников во внутриклеточных сигнальных каскадах [3].
G-белки экспрессируются во всех клетках. G-белок, кодированный геном GNB3, опосредует передачу сигналов внутрь клеток, контролируя тонус сосудов и клеточную пролиферацию. Изменение активности синтезируемого G-белка может повлечь за собой нарушения в передаче внутриклеточных сигналов и привести к сужению сосудов, повышению артериального давления, гипертрофии левого желудочка, клеточной пролиферации и другим патологическим процессам. Многими работами подтверждена связь полиморфного маркера C825T гена GNB3 с развитием ожирения.
Раннее начало АГ ассоциировано с носительством генотипа Т/Т полиморфного маркера С825Т гена [4]. Некоторые исследования показывают, что генотип Т/Т предрасполагает к макрососудистым осложнениям, таким как инсульты и инфаркт миокарда, вне зависимости от уровня артериального давления и других факторов риска. Гомозиготы по Т аллели (генотип Т/Т) более предрасположены к повышению массы тела, чем носители аллели С.
На основании многочисленных исследований был определен круг генов-кандидатов, вовлеченных в формирование АГ [1, 7, 10, 12]. Однако, следует иметь в виду, что в разных популяциях вклад генов в развитие одного и того же заболевания может существенно различаться.
Соответственно, значительно различается в популяциях и уровень ассоциации одних и тех же маркеров. Например, аллель 825Т гена GNB3 достоверно ассоциирована с АГ в европейских популяциях, но не в восточно-азиатских. Вариабельность результатов генетикоэпидемиологических исследований может быть связана как с генетической гетерогенностью исследованных популяций, так и с патофизиологическими особенностями в патогенезе АГ у представителей разных этнических групп [11].
Исходя из вышеизложенного, цель исследования состояла в изучении ассоциации полиморфного маркера C825T гена GNB3 с особенностями течения АГ у больных, проживающих в Ростовской области.
Материалы и методы
В основу работы положены результаты комплексного клинического, инструментально и лабораторного исследования 47 больных АГ, проживающих в Ростовской области. Среди обследованных мужчин было 21 (45%), женщин 26 (55%). Средний возраст больных составил 53,9 ± 1,7 лет; продолжительность АГ – 5 лет и более. Диагноз АГ, степень, стадия и группа сердечно-сосудистого риска установлена на основании рекомендаций ВНОК по диагностике и лечению артериальной гипертонии. Критерием исключения являлась вторичная АГ.
Комплекс стандартного обследования больных включал электрокардиографию, ультразвуковое исследование сердца и почек (прибор «Acuson-128X» фирмы Acuson Cоrporation», США), суточное мониторирование артериального давления (прибор «Bplab», Россия), определение основных биохимических показателей крови.
Определение полиморфизма АГ осуществлялось на амплификаторе ДТ 96 (производство ДНК-технологии, Россия) на основании полимеразно-цепной реакции в режиме реального времени. В результате исследования определяли 9 вариантов однонуклеидных полиморфизмов генов (SNPs) – ADD1 (G1378T), AGT (T704C), AGT (C521T), AGTR1 (A1166C), AGTR2 (G1675A), CYP11B2 (C344T), GNB (C825T), NOS3 (T786C), NOS3 (G894T). Из генов-кандидатов, обуславливающих АГ, наиболее изучены гены, кодирующие ренин-ангиотензин-альдо-стероновую систему (РААС): AGT (T704C), AGT (C521T), AGTR1 (A1166C), AGTR2 (G1675A), CYP11B2 (C344T), в связи с чем в качестве гена кандидата особый интерес для нас представил один из менее изученных, ген GNB3 кодирующий бета-3-субъединицу G-белка.
Все пациенты участвовали в исследовании добровольно и были полностью информированы о его дизайне и целях. Протокол исследования был одобрен локальным этическим комитетом РостГМУ.
Математическая обработка полученных данных осуществлялась с использованием прикладных программ STATISTICA 10.
Результаты и обсуждение
Оценка семейного анамнеза больных АГ, включенных в исследование, с помощью стандартного опросника ВОЗ «Семейный анамнез» позволил установить, что подавляющее число пациентов (60%) имели отягощенный семейный анамнез по АГ.
При сравнении больных с отягощенным и неотяго-щенным семейным анамнезом оказалось, что больные с отягощенной по АГ наследственностью на момент обследования были сравнительно моложе (50 ± 2,25 лет и 59,8 ± 2,05 лет, соответственно, р = 0,003. Дебют гипертонии отмечался у данных больных в более молодом возрасте, чем у больных с неотягощенным анамнезом (40,8 ± 1,8 лет и 54,6 ± 2,3 лет, соответственно, р = 0,004). В группе больных с отягощенным семейным анамнезом была выше доля больных с АГ 3 степени тяжести (50% и 21%, соответственно, р = 0,037).
При анализе частоты встречаемости полиморфного маркера C8255T гена GNB3оказалось, что у больных АГ с отягощенным семейным анамнезом достоверно выше частота встречаемости данного гена (соответственно, 60,7% и 42,1%, p = 0,026 (рис. 1).
В табл. 1 представлена частота распределения аллелей и генотипов гена GNB3у больных с отягощенным и не-отягощенным семейным анамнезом.
При сравнении частот генотипов и аллелей изученного нами гена, оказалось, что носительство генотипа C/T полиморфного маркера C825T гена GNB3ассоциировано с отягощенным семейным анамнезом.
Нами также был проведен анализ частоты встречаемости гена GNB3 у больных с ранним началом и разной степенью тяжести АГ. Под «ранним» началом АГ понимали возникновение заболевания в возрасте менее 45 лет у
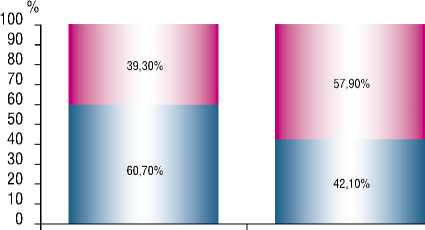
отягощенный анамнез не отягощенный анамнез
Табл. 1. Частота распределения аллелей и генотипов гена GNB3 у больных АГ с отягощенным и неотягощенным семейным анамнезом
|
Генотипы и аллели |
Отягощенный анамнез (n = 28) |
Не отягощенный анамнез (n = 19) |
P |
ОR |
Cl (95%) |
|
С/С |
11 (39,3%) |
11 (62,5%) |
НД |
– |
– |
|
C/T |
15 (53,6%) |
6 (31,6%) |
0,029 |
2,55 |
1,25–5,46 |
|
T/T |
2 (7,1%) |
2 (10,5%) |
НД |
– |
– |
|
T |
19 (25,7%) |
10 (26,3%) |
0,027 |
0,54 |
0,46–0,87 |
|
С |
37 (50%) |
28 (73,7%) |
НД |
– |
– |
■ ■ Ген GNB
I I Выборка
Рис. 1. Распределение частоты встречаемости гена GNB3 у больных АГ с отягощенным и неотягощенным семейным анамнезом мужчин и менее 55 лет у женщин. В обследованной группе было 28 больных с ранним началом АГ и 19 больных с поздним началом АГ (соответственно, 59,6% и 40,4%, р = 0,044).
Больные с ранним началом АГ имели достоверно большую длительность заболевания к моменту обследования (10,3 ± 1,76 лет и 5,2 ± 0,64 лет, р = 0,024), 32% больных этой группы имело АГ 3 степени тяжести. Эта группа больных чаще имела отягощенный семейный анамнез (75% и 21%, р = 0,013).
В табл. 2 представлена частота аллелей и генотипов гена GNB3, ассоциированных с ранним началом АГ.
При сравнении частот генотипов и аллелей изученного нами гена, оказалось, что раннее начало АГ ассоциировано с носительством генотипа C/T полиморфного маркера C825T гена GNB3 (рис. 2).
Для оценки ассоциации гена GNB3 с тяжестью АГ из числа обследованных мы сформировали 2 группы. В первую группу вошли больные АГ 1 и 2 ст., во вторую – больные АГ 3 ст. При сравнении групп выявлено, что среди больных АГ 3 ст. тяжести больше женщин (56% и 44%, p = 0,039). Длительность заболевания у них была больше (8,5 ± 1,2 лет и 7 ± 0,56 лет). По другим клиническим характеристикам группы достоверно не отличались.
В табл. 3 представлено сравнение частоты генотипов и аллелей гена GNB3 у больных АГ разной степени тяжести.
При анализе распределения частоты генотипов и аллелей оказалось, что у больных АГ3 степени тяжести достоверно меньше частота встречаемости аллели C полиморфного маркера C825T гена GNB3, т.е. носители аллели C имеют пониженный риск развития АГ 3 степени тяжести.
Учитывая то обстоятельство, что больные имели различные стадии АГ, нами была предпринята попытка установить ассоциацию полиморфного маркера C825T гена GNB3 со стадией заболевания.
Из числа обследованных I стадию заболевания имели 7 человек (15%), II стадию – 16 человек (34%), III стадию – 24 человек (51%). Больные с АГ различных
Табл. 2. Частота генотипов и аллелей гена GNB3 у больных АГ с ранним и поздним началом заболевания
|
Генотипы и аллели |
Раннее начало n = 28 |
Позднее начало n = 19 |
P |
ОR |
Cl (95%) |
|
C/C |
14 (50%) |
10 (52,6%) |
НД |
– |
– |
|
C/T |
14 (50%) |
6 (31,6%) |
0,039 |
1,46–4,57 |
1,23–5,43 |
|
T/T |
- (0%) |
3 (15,8%) |
НД |
– |
– |
|
T |
14 (25%) |
12 (31,6%) |
НД |
– |
– |
|
С |
42 (75%) |
26 (68,4%) |
НД |
– |
– |
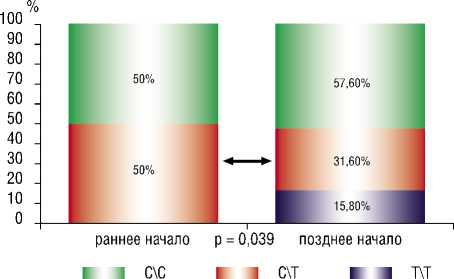
Рис. 2. Распределение частоты встречаемости генотипа C/T гена GNB3 у больных с ранним и поздним началом АГ
Табл. 3. Частота распределения генотипов и аллелей полиморфного маркера C825T гена GNB3 у больных АГ разной степени тяжести

Имеются многочисленные данные, свидетельствующие о том, что избыточная масса тела является фактором риска развития кардиальной патологии, поэтому можно предположить, что определение полиморфизма генов, ассоциированных с избыточной массой тела, требует особого внимания и представляется перспективным.
В обследованной группе больных 29 пациентов (61,7%) имели ИМТ ≥ 25 (повышенная масса тела), 18 пациентов (38,3%) – ИМТ < 25 (нормальная масса тела), р = 0,018. Больные с повышенной массой тела чаще характеризовались отягощенным семейным анамнезом (79% и 21%, р = 0,0067), длительность заболевания у них была больше, чем у больных с нормальной массой тела (10,2 ± 1,56 лет и 4,7 ± 0,64 лет, p = 0,01).
Частота распределения генотипов и аллелей гена GNB3 у больных АГс избыточной и нормальной массой тела представлена в табл. 4.
Приведенные в таблице данные свидетельствуют о том, что носительство аллели T полиморфного маркера C825T гена GNB3 ассоциировано с повышенной массой тела.
В рамках данного исследования нами не было установлено достоверной связи полиморфизма гена GNB с развитием осложнений АГ и поражением органов мишеней.
Выводы
-
1. Носительство генотипа C/T полиморфного маркера C/T гена GNB3 у больных АГ ассоциировано с отягощенным семейным анамнезом.
-
2. У больных АГ с отягощенным семейным анамнезом заболевание начинается в более молодом возрасте и характеризуется более высоким уровнем АД. Раннее начало АГ ассоциировано с носительством генотипа C/T полиморфного маркера C825T гена GNB.
-
3. У больных с АГ 3 степени тяжести оказалась достоверно меньшей частота аллели С полиморфного маркера C825T гена GNB, что может свидетельствовать о пониженном риске формирования АГ высокой степени тяжести у носителей аллели C.
-
4. Носительство аллели T полиморфного маркера C825T гена GNB3 ассоциировано с повышенной массой тела (ИМТ ≥ 25). Гомозиготы по T аллели (генотип T) более предрасположены к повышению массы тела, чем носители аллели С, следовательно, риск развития ожирения у людей с генотипом T/T выше по сравнению с C/C генотипом.
Табл. 4. Частота распределения генотипов и аллелей гена GNB3 у больных АГ с избыточной и нормальной массой тела
|
Генотипы и аллели |
ИМТ ≥ 25 |
ИМТ < 25 |
P |
ОR |
Cl (95%) |
|
C/C |
13 (44,8%) |
8 (44,4%) |
НД |
– |
– |
|
C/T |
13 (44,8%) |
9 (50%) |
НД |
– |
– |
|
T/T |
3 (10,3%) |
1 (5,6%) |
НД |
– |
– |
|
T |
19 (32,8%) |
11 (30,6%) |
0,04 |
1,08 |
0,98–2,25 |
|
С |
39 (67,2%) |
25 (69,4%) |
0,008 |
0,78 |
0,79–1,87 |
Список литературы Особенности течения артериальной гипертензии, связанные с распределением аллелей и генотипов полиморфного маркера C825t гена GNB3 среди больных, проживающих в Ростовской области
- Карпов Р.С. Полиморфные маркеры генов GNB3 (С825Т), AGTR1 (А1166) и АСЕ (A2350G и I/D) у больных артериальной гипертонией, сочетающейся с сахарным диабетом типа 2/Р.С. Карпов, К. В. Пузырев, О. А. Кошельская и др.//Терапевтический архив 2004. № 6. -С. 30-35.
- Кобалава Ж.Д. Артериальная гипертония. Ключи к диагностике и лечению/Ж.Д. Кобалава, Ю.В. Котовская, В.И. Моисеев. М.: ГЭОТАР-Медиа. 2009. -864 с.
- Люльман Х. Наглядная фармакология/Х. Люльман, К. Мор, Л. Хайн; Перевод с немецкого. -М.: Мир, 2008. -383 с.: ил. -(Наглядная медицина).
- Минушкина Л.О. Полиморфные маркеры гена ангиотензиногена у пациентов с артериальной гипертонией. Материалы Всероссийской научно-практической конференции «Современные возможности эффективной профилактики, диагностики и лечения артериальной гипертонии»/Л.О. Минушкина, Н.Б. Бабунова, А.А. Затейщикова, О.Ю. Кудряшова . -Москва, 2001. -С. 43.
- Минушкина Л.О. Генетические факторы при гипертонической болезни: связь с особенностями течения, развитием осложнений, эффективностью терапии: автореферат диссертации д.м.н./Минушкина Л.О-Москва, 2008.
- Сидоренкова М.Б. Изучение некоторых генетических полиморфизмов у пациентов европеоидной расы с артериальной гипертонией/М.Б. Сидоренкова, М.В.Терентьева, Г.И. Костюченко, А.В. Г ритчина, А.В. Манукян, М.А. Пляшешников//Биомедицина 2010, № 3. С. 138-140.
- Чистяков Д.А. Полиморфизм гена сосудистого рецептора ангиотензина II и сердечно-сосудистые заболевания/Д.А. Чистяков, Ж.Д. Кобалава, С.Н. Терещенко//Терапевтический архив, 2000. № 72. С. 27-30.
- Chiba S. Angiotensin II type 1 receptor gene polymorphism in patient with cardiac hypertrophy./S.Chiba,A. Ishanov, H. Okamoto, M. Watanabe//Japanese Heart Journal. 1998. Vol.39, № 1. P. 87-96.
- Naber C.K. Genetics of human arterial hypertension/C.K. Naber, W. Siffer//Minerva Med. 2004. Vol. 5, № 5. P. 346-356.
- O’Donnel С. J. The ACE Deletion Insertion Polymorphism and Hypertension: an Association Analysis in the Framingham Heart Study/C.J. O’Donnel, K. Lindpaintner, M. G. Larson.//European Heart Journal. 1997, P. 722-724.
- Ohmichi M. The genotype of the angiotensin-converting enzyme gene and global left ventricular dysfunction after myocardial infarction/M. Ohmichi, N. Ivai, Y.Nakamura//American Journal of Cardiology. 1995; 76: 326-329.
- Schunkert H. Polymorphism of the angiotensin-converting enzyme gene and cardiovascular disease/H. Schunkert//Journal of Molecular Medicine. 1997, Vol. 75, № 11-12. P. 876-875.


