Особенности течения и среднесрочные исходы имплантат-ассоциированной инфекции, вызванной ведущими грамотрицательными возбудителями
Автор: Туфанова О.С., Божкова С.А., Гордина Е.М., Артюх В.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.31, 2025 года.
Бесплатный доступ
Введение. Имплантат-ассоциированная инфекция (ИАИ), вызванная грамотрицательными патогенами, характеризуется более тяжелым, рецидивирующим течением и более высокой летальностью. Основной причиной этого является рост антибиотикорезистентности данных возбудителей и сложность выбора препаратов для стационарного и амбулаторного этапов лечения. Цель работы — оценить влияние различных факторов и сравнить особенности течения имплантатассоциированной инфекции, вызванной ведущими Гр(–) возбудителями (P. aeruginosa, K. pneumoniae, A. baumannii), у пациентов с благоприятными и неблагоприятными исходами лечения. Материалы и методы. Выполнен ретроспективный анализ историй болезни 172 пациентов, пролеченных по поводу имплантат-ассоциированной инфекции, вызванной P. aeruginosa, K. pneumoniae, A. baumannii. По результатам телефонного анкетирования или осмотра пациенты согласно критериям Делфи разделены на две группы: с благоприятным (n = 95) и неблагоприятным (n = 77) исходом лечения. В программе IBM SPSS STATISTICS (версия 26) выполнен статистический анализ влияния на исходы лечения различных факторов анамнеза, лабораторного и микробиологического исследований, особенностей хирургического вмешательства, антибактериальной терапии и течения раннего послеоперационного периода. Результаты. Среди исследуемых пациентов доля неблагоприятных исходов составила 45 %, летальный исход — 10 %. При проведении сравнительного исследования показано статистически значимое влияние на развитие неблагоприятного исхода послеоперационного уровня сывороточного альбумина (p = 0,002), чувствительности выделенного изолята к тестируемым антибактериальным препаратам (p = 0,011), выделение возбудителя из биоматериала пациентов в послеоперационном периоде (p = 0,001), более частой потребности в назначении внутривенного альбумина и железа (p = 0,003 и p = 0,056 соответственно) и необходимости в проведении повторного хирургического вмешательства в раннем послеоперационном периоде (p = 0,001). Обсуждение. ИАИ, обусловленная грамотрицательными бактериями, характеризуется длительным рецидивирующим течением и высокой летальностью, что связано, прежде всего, с растущей антибиотикорезистентностью возбудителей и требует индивидуального подхода к хирургическому и медикаментозному лечению, а также разработки новых тактических подходов к терапии. Заключение. Гипоальбуминемия и антибактериальная резистентность выделенных изолятов P. aeruginosa, K. pneumoniae, A. baumannii, выделение возбудителя в послеоперационном материале, а также потребность в хирургическом вмешательстве в раннем послеоперационном периоде, являются факторами риска неблагоприятного исхода.
Имплантат-ассоциированная инфекция, перипротезная инфекция, имплантат-ассоциированный остеомиелит, энтеробактерии, K. pneumoniae, P. aeruginosa, A. baumannii, антибактериальная терапия, фторхинолоны, ко-тримоксазол
Короткий адрес: https://sciup.org/142244809
IDR: 142244809 | УДК: [616.71-089.843-77-022.1:615.281.9]- 089.168 | DOI: 10.18019/1028-4427-2025-31-3-322-333
Текст научной статьи Особенности течения и среднесрочные исходы имплантат-ассоциированной инфекции, вызванной ведущими грамотрицательными возбудителями
По мере старения населения и роста заболеваемости остеоартритом прогнозируется увеличение количества операций по протезированию крупных суставов. К 2040 г. ожидается проведение 2,8 млн. операций по эндопротезированию (ЭП) тазобедренного сустава (ТБС) и 1 млн. операций — коленного сустава (КС) [1]. Несмотря на то, что данные хирургические вмешательства в большинстве случаев успешны, замена суставов может быть осложнена перипротезной инфекцией (ППИ) с частотой развития в течение двух лет 1,63 % для ТБС и 1,55 % для КС [2]. Встречаемость перелом-ассоциированной инфекции (ПАИ) колеблется от 1,8 % до 27 % и зависит от локализации и типа перелома [3].
В подавляющем большинстве случаев имплантат-ассоциированная инфекция (ИАИ) развивается в первые два года после хирургического вмешательства с установкой имплантата, но риск данного осложнения существует и в дальнейшем, а количество осложнений ежегодно увеличивается на 0,04–0,06 % [4]. Учитывая повсеместный рост первичных ЭП, частота ревизий, вызванных инфекционными осложнениями, также растет.
Несмотря на то, что ведущими возбудителями инфекции костей и суставов, в том числе ассоциированных с ортопедическими имплантатами, являются стафилококки, участие в этиологии Гр(–) возбудителей, включая K. pneumoniae, P. aeruginosa, A. Baumannii , является прогностически неблагоприятным признаком [5, 6]. Доля Гр(–) бактерий в структуре возбудителей ортопедической инфекции варьирует от 10 % до 23 % [5, 7], однако повсеместно растущие темпы выделения штаммов с устойчивостью к различным антибиотикам представляют особую сложность по причине ограничения выбора антибактериальных препаратов, как на стационарном, так и на амбулаторном этапах лечения. В этой связи многие авторы указывают участие в этиологии ИАИ Гр(–) бактерий как самостоятельный независимый фактор возможной неудачи лечения таких пациентов в 50 % случаев [8, 9].
В настоящее время опубликовано крайне мало научных работ (в основном зарубежных), посвященных изучению исходов лечения пациентов с ИАИ, вызванной Гр(–) бактериями. По мнению исследователей, к факторам риска при лечении таких пациентов относят, в первую очередь, неверный выбор вида хирургического вмешательства [10], причем ключевой ошибкой является вмешательство с сохранением инфицированной металлоконструкции (МК) [8, 11, 12]. При этом эффективность исключительно консервативной терапии составляет лишь 10 % [13]. Кроме того, к факторам неблагоприятного исхода относят женский пол, наличие в этиологии инфекции микробных ассоциаций, ожирение [11, 12], наличие неоднократных санирующих хирургических вмешательств в анамнезе [8, 14], антибиотикорези-стентность возбудителя инфекции [15] и другие.
В связи с относительно небольшим количеством публикаций по проблеме ИАИ, вызванной Гр(–) бактериями, и сложностью лечения пациентов с ИАИ данная проблема требует более детального изучения.
Цель работы — оценить влияние различных факторов и сравнить особенности течения имплантат-ассоциированной инфекции, вызванной ведущими Гр(–) возбудителями ( P. aeruginosa, K. pneumoniae, A. baumannii ), у пациентов с благоприятными и неблагоприятными исходами лечения.
МАТЕРИАЛЫ И МЕТОДЫ
В сплошное одноцентровое ретроспективное исследование включены пациенты с ИАИ, получившие лечение в отделении гнойной остеологии с 1 января 2017 года по 31 декабря 2022 года.
Критерии включения :
-
— наличие ИАИ конечностей;
-
— выполненное санирующее хирургическое вмешательство в очаге инфекции (индексная операция);
-
— выделение впервые штаммов P. aeruginosa, K. pneumoniae, A. baumannii (как изолированного штамма, так и в составе полимикробной ассоциации) из одного и более образцов при проведении микробиологического исследования (МБИ) до- и интраоперационного материала (тканевые биоптаты, удаленная металлоконструкция, синовиальная жидкость).
Критерии невключения :
-
— повторная операция с рецидивом ИАИ, вызванной P. aeruginosa, K. pneumoniae, A. baumannii ;
-
— локализация инфекции исключительно в пределах мягких тканей;
-
— ИАИ позвоночника;
-
— ампутация (экзартикуляция) конечности, выполненная в ходе санирующей операции,
Критерий исключения — отсутствие информации о двухлетнем исходе (в том числе отсутствие возможности для телефонной связи с пациентом).
Отбор пациентов в исследование проводили с использованием программы микробиологического мониторинга «Микроб-2» (2017–2020 гг.) и ЛИС «Акросс-Инжениринг» (2021–2022 гг.) на основании анализа результатов МБИ биоматериала пациентов, прооперированных в 2017–2022 гг. в отделении гнойной остеологии. Выделение клинических изолятов P. aeruginosa, K. pneumoniae, A. baumannii в лаборатории выполняли в соответствии с международными стандартами МБИ ( англ .: Standards for microbiology investigations, UK SMI). Видовую идентификацию осуществляли на панелях Microlatest с помощью iEMS Reader MF (2017–2020), с 2021 г. — методом MALDI-TOF-MS ( англ .: Matrix Assisted Laser Desorption Ionization Time of Flight Mass-Spectrometry) с использованием системы FlexControl. Оценку чувствительности выделенных культур Гр(–) бактерий к антибактериальным препаратам проводили в соответствии с критериями EUCAST (2017–2022 гг.).
После отбора историй болезни пациентов, соответствующих критериям включения ( n = 172), было проведено телефонное анкетирование, в ходе которого пациентам задавали стандартные вопросы относительно того, были ли у них в течение двух лет после проведения индексной операции клинические или лабораторные признаки рецидива инфекционного процесса, проведены ли повторные санирующие операции. В случае летального исхода беседу проводили с родственниками пациента. Все включенные пациенты были разделены на две группы в соответствии с исходами по критериям Делфи [16]: благоприятный исход (группа 1) и неблагоприятный исход (группа 2). Под благоприятным исходом понимали отсутствие клинико-лабораторных признаков рецидива инфекционного процесса и проведения санирующего хирургического вмешательства в течение двух лет с момента проведения индексной операции.
Согласно критериям включения и невключения в исследование включено 172 человека.
К группе 1 были отнесены 95 человек (55 %), из них 37 пациентам (22 %) впоследствии не проводили хирургических вмешательств либо по причине отсутствия показаний, либо по причине удовлетворенности качеством жизни. Очередной этап хирургического вмешательства, в ходе которого не было выявлено данных за рецидив инфекционного процесса (при проведении МБИ интраоперационного материала не было получено роста микроорганизмов), перенесли 58 человек (34 %).
К группе 2 были отнесены 78 пациентов (45 %), из которых 59 пациентов (34 %) перенесли очередную санирующую операцию по поводу рецидива инфекционного процесса, как в нашем Центре, так и за его пределами. Кроме того, в этой группе было зарегистрировано 18 летальных исходов (10 %).
На основе медицинской документации и результатов телефонного опроса сформирована база данных, в которую включены:
-
— антропометрические данные (возраст, пол, индекс массы тела (ИМТ);
-
— данные анамнеза (локализация инфекционного процесса, длительность с момента проведения первичного хирургического вмешательства или того вмешательства, после которого развилась ИАИ до манифестации инфекции, длительность инфекционного процесса, число санирующих хирургических вмешательств в анамнезе, длительность с момента последней санации до индексной операции);
-
— результаты лабораторного исследования крови на момент поступления и перед выпиской из стационара: количество лейкоцитов, СОЭ, уровень СРБ, гемоглобина, общего белка, альбумина, креатинина;
-
— результаты микробиологических исследований (МБИ) образцов биоматериала (биоптаты из свища, синовиальная жидкость, раневое отделяемое, тканевые биоптаты, удаленная металлоконструкция, гематома), полученные в до-, интра- и послеоперационном периоде;
-
— вид хирургического вмешательства, его длительность, интраоперационная кровопотеря, объем дренажного отделяемого;
-
— особенности фармакотерапии на стационарном (антибактериальная терапия (АБТ), внутривенная инфузия альбумина, препаратов железа) и амбулаторном этапах;
-
— наличие или отсутствие санирующего ревизионного вмешательства в раннем послеоперационном периоде после индексной операции;
-
— наличие имплантата на момент выписки из стационара.
Полученные данные регистрировали в виде электронных таблиц программы MS Office Excel, 2007 (Microsoft, США), визуализацию структуры данных и их анализ проводили с помощью программы IBM SPSS STATISTICS (версия 26). Количественные показатели оценивали на предмет соответствия нормальному распределению с помощью критерия Колмогорова – Смирнова. В случае отсутствия нормального распределения количественные данные описывали с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Категориальные данные описывали с указанием абсолютных значений и процентных долей. Сравнение двух групп по количественному показателю, распределение которо- го отличалось от нормального, выполняли с помощью U-критерия Манна – Уитни. Для оценки риска в группах сравнения выполняли расчет отношения шансов (OR, 95 % ДИ). Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполняли с помощью критерия хи-квадрат (χ2) Пирсона (при значениях ожидаемого явления более 10) или точного критерия Фишера (при значениях ожидаемого явления менее 10), оценку связи проводили по критерию Крамера. Различия показателей между группами считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
Антропометрические и анамнестические данные
Анализируемые группы были сопоставимы по полу, возрасту и ИМТ (табл.1). Преимущественной локализацией ИАИ были суставы и кости нижней конечности, ( n = 164, 95 %) в области ТБС ( n = 94, 55 %) или КС ( n = 33, 19 %). Статистически значимого влияния локализации инфекционного процесса на исход лечения не установлено ( p = 0,948).
Таблица 1
Сравнение групп по полу, возрасту, ИМТ
|
Факторы |
Группа 1, n = 95 |
Группа 2, n = 77 |
p |
|
Мужской пол, n (%) |
47 (49) |
33 (43) |
p = 0,443 |
|
Возраст, полных лет, Me [IQR] |
63,0 [49,0–68,0] |
58,0 [45,0–66,0] |
p = 0,114 |
|
ИМТ, вес/рост2, Me [IQR] |
27,5 [24,2–31,6] |
27,8 [23,7–33,0] |
p = 0,838 |
Таблица 2
Сравнение групп по анамнезу ИАИ
|
Факторы |
Me [IQR] |
p |
|
|
Группа 1, n = 95 |
Группа 2, n = 77 |
||
|
Период между установкой имплантата* и манифестацией инфекции (сут.) |
153,5 [30–1247] |
95 [23–730] |
p = 0,331 |
|
Длительность инфекции (сут.) |
610 [161–1410] |
493 [121–1226] |
p = 0,345 |
|
Период между предыдущей и индексной санирующей операции (сут.) |
241 [81–862] |
135 [28–455] |
p = 0,095 |
Примечание : * — после первичной или ревизионной операции.
Несмотря на отсутствие статистической значимости, у пациентов группы 2 манифестация инфекции или её рецидива развивались раньше, а длительность инфекционного процесса была меньше, чем в группе сравнения (табл. 2).
Доля пациентов с впервые выполненным санирующим вмешательством составила 24 % в группе 1 и 14 % в группе 2, а две и более санации в анамнезе перенесли соответственно 40 % и 52 % пациентов ( p = 0,173). Медиана числа санирующих операций в анамнезе составила 1 [1,2] в группе с благоприятным исходом и 2 [1,3] — в группе сравнения ( p = 0,112).
Данные лабораторного обследования
Таблица 3
Результаты лабораторных исследований до хирургического вмешательства и перед выпиской из стационара в исследуемых группах
|
Показатели |
Me [IQR] |
p |
||
|
Группа 1, n = 95 |
Группа 2, n = 77 |
|||
|
До хирургического вмешательства |
Лейкоциты, 109/л |
7,6 [6,5–9,7] |
8,3 [6,0–9,9] |
p = 0,625 |
|
СОЭ, мм/час |
44 [26–63] |
53 [29,5–63] |
p = 0,430 |
|
|
СРБ, мг/л |
25 [10,5–40] |
33 [9–75] |
p = 0,121 |
|
|
Гемоглобин, г/л |
117 [104–131] |
111 [97,5–132] |
p = 0,246 |
|
|
Альбумин, г/л |
40 [35,5–43] |
35 [33–43] |
p = 0,068 |
|
|
Перед выпиской из стационара |
Лейкоциты, 109/л |
6,6 [5,7–8,2] |
6,8 [5,2–8,0] |
p = 0,749 |
|
СОЭ, мм/час |
35 [22–52,5] |
39 [22–55,5] |
p = 0,926 |
|
|
СРБ, мг/л |
23,5 [12–42] |
25,5 [13–52] |
p = 0,284 |
|
|
Гемоглобин, г/л |
99 [95–114,5] |
100 [91–108,5] |
p = 0,250 |
|
|
Альбумин, г/л |
34 [32–41] |
32 [28–35] |
p = 0,002* |
|
При поступлении у пациентов группы 2 отмечалась тенденция к более высокому уровню показателей воспаления (количество лейкоцитов, СРБ и СОЭ) и меньшему — гемоглобина и альбумина, при этом статистически значимых различий в группах не было (табл. 3). Перед выпиской результаты лабораторного обследования у пациентов обеих групп былы схожи и отражали закономерное течение послеоперационного периода. При этом обращает на себя внимание статистически значимое усиление альбуминемии у пациентов с неблагоприятным исходом ( p = 0,002).
Особенности хирургического вмешательства
В исследуемой когорте пациентов наиболее частыми видами хирургического вмешательства были установка антимикробного спейсера ( n = 112, 65 %), резекционная артропластика с мышечной пластикой ( n = 16, 9 %) и ревизионное хирургическое вмешательство с сохранением металлоконструкции ( n = 11, 6 %). При этом вид хирургического вмешательства не оказывал статистически значимого влияния на исход ( p = 0,487). Для изготовления антимикробного спейсера применяли гентамицин-содержащий костный цемент, который дополнительно импрегнировали термостабильным антибактериальным препаратом в дозе 4 г на 40 г цемента. При данном виде хирургического вмешательства в 53 % случаев в костный цемент добавляли ванкомицин, в 15 % — меропенем, в 10 % — фосфомицин. При этом только в 23 % случаев антибиотик был активен в отношении изолированного из интраоперационного материала микроорганизма.
Объем интраоперационной кровопотери составил Me: 600 [400–800] мл, статистически значимых различий в группах по данному параметру не было ( p = 0,133). В группе 1 дренажная кровопотеря была несколько меньше, чем в группе 2: соответственно 450 [340–600] и 500 [380–750] мл ( p = 0,091).
Данные МБИ
По результатам микробиологического исследования биоматериала, в 55 % случаях изолировали K. pneumoniae , в 18 % — A. baumannii и в 27 % случаев — P. aeruginosa . Распределение культуровы-деления в группах сравнения показано на рис. 1.
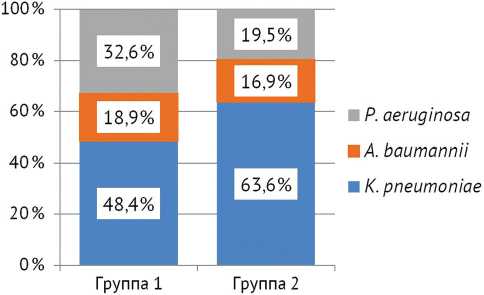
Рис. 1. Распределение пациентов в группах 1 и 2 в зависимости от изолированного возбудителя
В группе 2 в 1,3 раза чаще возбудителем ИАИ была K. pneumoniae и в 1,7 раза реже — P. aeruginos a. При этом статистически значимых различий между группами не получено ( p = 0,097).
На дооперационном этапе при проведении микробиологического исследования биоматериала из области установки имплантата, монокультуры K. pneumoniae, A. baumannii или P. aeruginosa изолировали в 58 % случаев. При этом статистически значимого влияния этиологии инфекционно- го заболевания, информация о которой была получена на дооперационном этапе, на исход лечения не выявлено (p = 0,895). K. pneumoniae, A. baumannii или P. aeruginosa в 9,3 % случаев выделяли также из других локусов (моча — 7,6 %, кровь — 0,6 %, мокрота — 0,6 %), что указывает на потенциальную возможность гематогенного распространения возбудителя ИАИ.
В 94 % случаев ( n = 172) возбудитель был изолирован из интраоперационных тканевых биоптатов. Несмотря на отсутствие статистически значимых различий между группами ( p = 0,192) обращает на себя внимание, что медиана количества тканевых биоптатов, из которых был изолирован микроорганизм, в группе 1 составила 4 [2–5], а в группе 2 — 5 [3–5]. С удаленных металлоконструкций штаммы K. pneumoniae, A. baumannii или P. aeruginosa были выделены в 73 % наблюдений.
Доля полимикробной инфекции в группах сравнения не различалась и составила 66 % и 69 % соответственно в группах 1 и 2 (p = 0,871) (табл. 4). В обеих группах подавляющее большинство микробных ассоциаций с ведущими Гр(–) патогенами содержали в своем составе и Гр(+) бактерии без статистически значимых влияний состава на исход лечения ( p = 0,570).
Таблица 4
Состав микробных ассоциаций, выделенных из биоматериала пациентов групп сравнения
|
Состав микробных ассоциации |
Группа 1, n = 63 |
Группа 2, n = 53 |
||
|
абс. |
% |
абс. |
% |
|
|
В составе только с Гр(–) бактериями, в том числе E. coli, Enterobacter spp. и др. |
9 |
14 |
5 |
9 |
|
В составе с Гр(+) бактериями, в том числе S. aureus, S. epidermidis и др. |
54 |
86 |
48 |
91 |
Доля пациентов, у которых изолированные штаммы P. aeruginosa, K. pneumoniae, A. baumannii были чувствительны к фторхинолонам, в группе 1 была в 5,25 раз больше, чем в группе 2, а доля пациентов с экстремально резистентными штаммами, напротив, в группе 2 была в 1,3 раза выше (рис. 2). При этом показано статистически значимое влияние чувствительности к антибактериальным препаратам на исход ( p = 0,011, V Крамера = 0,254).
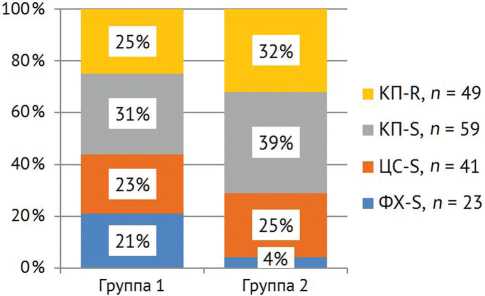
Рис. 2. Анализ чувствительности Гр(–) штаммов к основным антибактериальным препаратам в группах сравнения. Штаммы: ФХ-S — фторхи-нолон-чувствительные, ЦС-S — чувствительные к цефалоспоринам, но резистентные к фторхи-нолонам, КП-S — чувствительные к карбапене-мам, но устойчивые к фторхинолонам и цефалоспоринам, КП-R — карбапенем-резистентные
Особенности послеоперационного периода
Системную АБТ проводили всем пациентам. При этом в 10 % случаев потребовалось начать АБТ до проведения индексной операции по причине либо наличия жизнеугрожающего септического состояния, либо перенесенного ранее санирующего хирургического вмешательства. Эмпирическую АБТ ванкомицином и представителем группы фторхинолонов (ципро- или левофлоксацин) со дня хирургического вмешательства получили 9 % пациентов, а ванкомицином и цефоперазоном-сульбактамом — 29 %. В остальных случаях назначена АБТ по результатам дооперационных посевов. Этиотропная АБТ со дня хирургического вмешательства назначена 61 % пациентов, при этом статистически значимого влияния на исход это не оказало (p = 0,120). Установлена тенденция к более короткому курсу антибактериальной терапии в стационаре у пациентов группы 1 в сравнении с группой 2: 13 [10–15] и 16 [11–24] ( p = 0,096) соответственно.
В 86 % случаев на амбулаторном этапе назначены какие-либо пероральные антибактериальные препараты. Среди пациентов с данными рекомендациями неблагоприятные исходы встречались несколько реже ( p = 0,077, OR 0,443, 95 % ДИ: 0,178–1,052). При этом на амбулаторном этапе фторхинолоны были рекомендованы в 55 % случаев, ко-тримоксазол — в 13 %, а одновременно фторхинолоны и ко-тримоксазол — в 9 %. Несмотря на то, что сам факт назначения данных препаратов статистически значимого влияния на исход не оказал ( p = 0,446, p = 0,665 и p = 0,300 соответственно), подтверждено, что в случае, когда изолированный микроорганизм был чувствителен к назначаемому на амбулаторном этапе препарату, вероятность благоприятного исхода статистически значимо ( p = 0,001) увеличивалась в 7,87 раз (95 % ДИ: 2,26–27,03).
Пациентам группы 2 в сравнении с группой 1 чаще требовалось назначение инфузии раствора альбумина (в 26 % и 2 % случаев, p = 0,003) и препаратов железа (в 27 % и 15 % случаев, p = 0,056). При этом длительность назначенной симптоматической терапии в группе 2 также была дольше (табл. 5).
Таблица 5
Кратность введения препаратов для симптоматической терапии
|
Препарат для инфузии |
Me [IQR] |
p |
|
|
Группа 1, n = 63 |
Группа 2, n = 53 |
||
|
Раствор альбумина |
5,0 [5,0–5,0] |
10,0 [5,0–11,0] |
p = 0,101 |
|
Препараты железа |
4,0 [3,0–5,0] |
5,0 [5,0–10,0] |
p = 0,286 |
В послеоперационном периоде у 40 пациентов (23 %) в интраоперационном материале, содержимом гематомы или раневого отделяемого получен повторный рост исследуемых возбудителей, что в 3,4 раза (95 % ДИ 1,61–7,2; p = 0,001) повышало риск неблагоприятного исхода в дальнейшем. Проведение ревизионного хирургического вмешательства в раннем послеоперационном периоде потребовалось в 38 случаях (22 %), что увеличивало вероятность неблагоприятного исхода в дальнейшем в 4,86 раза (95 % ДИ 2,18–10,84; p = 0,001), из них санация послеоперационной раны была выполнена 19 пациентам (10,9 %), удаление МК и мышечная пластика — 8 пациентам (4,6 %), переустановка антимикробного спейсера — 7 пациентам (4 %), удаление МК — в 3 случаях (1,7 %) и артродез — в одном (0,6 %). В результате на момент выписки МК была имплантирована 133 пациентам (77 %), при этом наличие вновь установленной МК статистически значимо не влияло на вероятность неблагоприятного исхода ( p = 0,101).
ОБСУЖДЕНИЕ
Гр(–) микроорганизмы К. pneumoniae, P. aeruginosa и A. baumannii входят в группу часто встречающихся патогенов с регистрируемым высоким уровнем устойчивости к антибиотикам, обозначенную Infectious Diseases Society of America как «ESKAPE-патогены». По данным ВОЗ, представители этих видов отнесены к группе возбудителей с критически высоким уровнем приоритетности [17]. К. pneumoniae, P. aeruginosa и A. baumannii характеризуются наличием определенного набора факторов патогенности и персистенции, включая способность к биопленкообразованию и интернализации в эукариотические клетки, включая остеобласты [18]. По мере того, как неуклонно растет разнообразие резистентных штаммов, увеличивается и частота их распространения не только среди пациентов, но и среди населения, что вызывает высокую настороженность клиницистов и системы здравоохранения [19].
Устойчивые к карбапенемам Enterobacterales ( англ .: carbapenem resistant enterobacterales, CRE) имеют особое значение из-за их высокой резистентности к антибиотикам, в том числе и расширенного спектра [20]. Согласно отчету Centres for Diseases Control за 2019 г., в США с 2012 по 2017 гг. зарегистрировали 210 500 случаев инфекций, вызванных штаммами Enterobacterales, — продуцентов бета-лактамаз расширенного спектра или карбапенемаз, что приводит к 12 900 случаев смерти ежегодно [21]. Глобальное распространение CRE-патогенов происходит быстрыми темпами, что при развитии инфекционного процесса ограничивает выбор антимикробных препаратов полимиксинами, тигециклином, аминогликозидами и в некоторых случаях высокими дозами карбапенемов. Однако указанные препараты могут быть недостаточно эффективными и вызывать множество нежелательных реакций [22]. Кроме того, наличие у патогенов резистентности к бета-лактамам и фторхинолонам делает невозможным назначение пролонгированной этиотропной антибактериальной терапии, которая является стандартной для лечения инфекции костей и суставов, в виду отсутствия других пероральных препаратов, активных в отношении Гр(–) патогенов.
Несмотря на невысокую распространенность ИАИ, вызванной Гр(–) возбудителями [7], исходы лечения таких пациентов значительно хуже. Помимо рифампицин-устойчивых стафилококков и устойчивых к флуконазолу грибов рода Candida , Гр(–) микроорганизмы, резистентные к фторхинолонам, также относят к категории возбудителей, вызывающих трудноизлечимую ППИ ( англ .: Difficult-to-treat, DTT), для которой доказана более высокая частота рецидивов, требующих проведения повторных санирующих хирургических вмешательств [23].
Результаты целого ряда исследований демонстрируют, что Гр(–) этиология ИАИ является самостоятельным предиктором неблагоприятного исхода [8, 9, 12]. К примеру, I.L. Kalbian et al. неудовлетворительные результаты лечения значимо чаще наблюдали у пациентов с ППИ, вызванной Гр(–) микроорганизмами и ассоциациями Гр(–) и Гр(+) бактерий, в сравнении с инфекцией, обусловленной исключительно Гр(+) возбудителями (ОР = 2,9, p < 0,0001; ОР = 2,5, p = 0,013 соответственно) [24]. А метаанализ показал, что ИАИ, обусловленная микробными ассоциациями с участием Гр(–) бактерий, чаще становится причиной неудач лечения по сравнению с монобактериальной инфекцией [12]. В нашей выборке большинство случаев ИАИ (67 %) обусловлено ассоциациями бактерий, при этом доля пациентов с неблагоприятным исходом по истечению двухлетнего периода наблюдения составила 45 %, что в целом подтверждает общемировые тенденции. Также для этой когорты отмечалась высокая летальность, — 10 %, что существенно выше, чем среди пациентов с ИАИ без учета этиологии инфекционного процесса, — около 3 % в течение первого года [25]. В зависимости от вида Гр(–) возбудителя, участвующего в этиологии ИАИ, доля пациентов с благоприятным исходом лечения составила 65 % для P. aeruginosa , 58 % — для A. baumannii и 48 % — для K. pneumoniae . Какого-либо значимого влияния состава микробных ассоциаций на исход комплексного лечения не установлено ( p = 0,871).
В нашем исследовании пациенты групп сравнения сопоставимы по полу, возрасту и ИМТ вне зависимости от исхода лечения. Данные научных публикаций по этому вопросу разнятся. Одни авторы утверждают, что эти показатели не отличаются в группах с благоприятным и неблагоприятным исходами [26], другие считают, что фактором риска неудачного исхода является женский пол и ожирение [12], третьи в качестве предиктора неблагоприятного исхода указывают пожилой возраст [15]. P.H. Hsieh et al. в исследовании, проведенном на 346 пациентах, сравнили влияние различных факторов на течение ИАИ, вызванной Гр(+) и Гр(–) микроорганизмами. В результате авторы пришли к выводу, что пациенты с ИАИ, вызванной Гр(–) микроорганизмами, были старше (средний возраст 68 лет против 59 лет; р < 0,001), срок от первичного ЭП до манифестации инфекционного процесса у них был короче (74 суток против 109 суток; p < 0,001) [27].
ИАИ, вызванная Гр(–) бактериями, часто имеет длительное, волнообразное течение, сочетающее в себе периоды обострений, требующих проведения хирургического вмешательства и антибактериальной терапии, и ремиссии. В нашем исследовании длительность инфекционного процесса в обеих группах была больше года и значимо не различалась. Интервал времени со дня хирургического вмешатель- ства до манифестации инфекции и с момента последней санирующей операции до индексной был несколько меньше в группе с неблагоприятным исходом (p = 0,331 и p = 0,095 соответственно). По данным метаанализа 11 клинических исследований, включающего 593 пациента с ППИ, вызванной Гр(–) возбудителями, острая инфекция в сравнении с хронической имела более неблагоприятное течение: доля пациентов с благоприятным исходом после двухэтапного лечения составила соответственно 66 % и 75 % при двухлетнем наблюдении [12]. Кроме того, установлено, что исходы лечения при локализации инфекции в КС были значимо хуже, чем в ТБС (соответственно 35 % против 15 %, p = 0,002). В нашем исследовании эти показатели не различались: при локализации ИАИ в ТБС доля пациентов с неблагоприятным исходом составила 37 %, а в КС — 39 %.
B.G. Pfang et al. пришли к выводу, что наличие большого количества санирующих операций в анамнезе является самостоятельным предиктором неблагоприятного исхода ИАИ, вызванной представителями семейства энтеробактерий [8]. Ранее при анализе исходов ИАИ, вызванных только K. pneumoniae , нами получены идентичные результаты [14]. В текущем исследовании не установлено межгрупповых значимых различий ( p = 0,112) по количеству проведенных ранее санирующих операций, при этом в группе 2 было на 30 % больше пациентов с двумя и более санациями в анамнезе.
Уровни лабораторных маркеров воспаления в группах сравнения были сопоставимы в до- и послеоперационном периодах. Однако у пациентов группы 2 при поступлении наблюдалась тенденция к более выраженной гипоальбуминемии, уровень которой к моменту выписки статистически значимо отличался от группы 1 ( p = 0,002), несмотря на то, что после операции им чаще ( p = 0,002) и более длительно ( p = 0,101) проводили инфузии раствора альбумина. Полученные результаты согласуются с данными N.R. Scarcella et al., которые установили, что у пациентов со сниженным уровнем альбумина чаще развивались рецидивы инфекционного процесса. Авторы считают, что значительную роль в развитии гипоальбуминемии играет наличие хронического воспаления, приводящего к иммуносупрессии, которая, в свою очередь, затрудняет ликвидацию самого инфекционного процесса, замыкая этот порочный круг [28]. Помимо этого, гипоальбуминемия приводит к снижению эффективности антибактериальной терапии за счет снижения количества транспортных белков. В результате в крови увеличивается несвязанная с альбумином фракция антибиотика, что повышает риск развития нежелательных реакций на фоне снижения антибактериальной активности препарата [29]. В связи с этим как зарубежные, так и отечественные авторы приходят к выводу, что гипоальбуминемия повышает риск инфекционных осложнений после проведения ортопедических вмешательств. Это позволяет считать данный симптом самостоятельным предиктором неудачи комплексного лечения пациентов с ИАИ [30, 31]. Еще одним возможным предиктором неудачного исхода при инфекционных заболеваниях, в том числе ИАИ, считают анемию [32]. В нашем исследовании потребность в назначении внутривенных препаратов железа также чаще наблюдалась среди пациентов группы 2 ( p = 0,056).
Нами установлено статистически значимое ( p = 0,011, V Крамера = 0,254) влияние чувствительности выделенных микроорганизмов к тестируемым антибактериальным препаратам на исход комплексного лечения. Среди пациентов, у которых этиология ИАИ представлена штаммами Гр(–) микроорганизмов, чувствительных к фторхинолонам, была наибольшая частота благоприятных исходов — 87 %. А среди пациентов, у которых были изолированы Гр(–) бактерии, резистентные к фторхинолонам и цефалоспоринам, и микроорганизмы с экстремальной резистентностью, доля благоприятных исходов составила 49,2 и 49 % соответственно. Аналогичные результаты показали M. Fantoni et al., в работе которых успешные результаты лечения пациентов с инфекцией, обусловленной карбапенем-резистент-ными штаммами Гр(–) микроорганизмов, были достигнуты только в 50 % случаев [13].
Выбор препаратов для АБТ, как на стационарном, так и на амбулаторном этапах — краеугольный камень в лечении пациентов с ИАИ, вызванной Гр(–) возбудителями. Основой АБТ принято считать парентеральное введение преимущественно бактерицидных антибиотиков в течение 7–14 дней со дня операции с последующим переходом на пероральные препараты до 6–8 недель после каждого из этапов хирургического лечения [33] или до трех месяцев после одноэтапного вмешательства [34]. Все включенные в наше исследование пациенты получали системную АБТ как минимум двумя препаратами. Терапию считали этиотропной при наличии чувствительности выделенного от пациента штамма микроорганизма хотя бы к одному получаемому антибиотику. Этиотропную АБТ со дня операции с учетом результатов МБИ дооперационных биоматериалов получили 61 % пациентов, включенных в исследование. При этом, медиана длительности АБТ на стационарном этапе пациентов в группе 2 была несколько больше, чем в группе 1: соответственно 16 [11–24] и 13 [10–15] суток ( p = 0,096), что было обусловлено более частой необходимостью выполнения ревизии послеоперационной раны или невозможностью перевода пациента на этиотропную пероральную АБТ пациентов в группе 2.
Малое количество активных в отношении изучаемых патогенов пероральных антибиотиков определяет трудности с проведением пролонгированной этиотропной терапии у профильных пациентов. Выбор препаратов ограничивается представителями класса фторхинолонов и ко-тримоксазолом. Фторхинолоны выгодно отличает антибиопленочная активность, хорошая пенетрация в костную ткань и относительно хорошая переносимость [35]. В исследовании D. Rodríguez-Pardo et al., включающем 242 пациента с ИАИ, доля чувствительных к фторхинолонам изолятов Гр(–) бактерий составила 81 %, что при выполнении ревизии с сохранением МК и назначении длительной этиотропной пероральной терапии в 79 % случаев позволило купировать инфекцию при двухлетнем наблюдении [36]. В нашем исследовании именно в аналогичной группе пациентов была максимальная частота благоприятных исходов — 87 %, что подтверждает значимое влияние чувствительности патогенов к антибиотикам на исходы лечения ( p = 0,011). Однако высокий уровень резистентности Гр(–) микроорганизмов к антибиотикам данной группы сильно ограничивает возможности их применения [37]. В исследуемой нами выборке 87 % возбудителей были устойчивы к фторхинолонам, что по данным научных публикаций неблагоприятно влияет на прогноз результатов лечения таких пациентов [36].
До настоящего времени открытым остается вопрос, есть ли целесообразность назначения фторхино-лонов на амбулаторном этапе лечения при отсутствии чувствительности к ним изолятов, выделенных от пациента. Исследований, посвященных эффективности монотерапии фторхинолонами для лечения инфекции, вызванной резистентными к ним штаммами, мы не нашли. O. Grossi et al. показали, что дополнительное назначение фторхинолонов к продленной инфузии бета-лактамов весь период лечения (медиана — 90 суток) не оказывало влияния на исход лечения пациентов с ИАИ, обусловленной устойчивыми к ФХ штаммами [26]. В другом исследовании 28 профильных пациентов после санирующей операции получали комбинированную терапию цефепимом и фторхинолоном. Эффективность при двухлетнем периоде наблюдений составила 79 %, однако в работе не анализировали влияние на нее каждого антибиотика в отдельности [38]. В нашем исследовании мы также не получили значимых различий ( p = 0,446) в эффективности лечения в зависимости от наличия или отсутствия в составе продленной АБТ препарата из группы фторхинолонов в случае устойчивости к ним патогенов.
Другим препаратом, теоретически активным в отношении ведущих Гр(–) возбудителей ортопедической инфекции, за исключением имеющей природную резистентность к препарату P. aeruginosa , является ко-тримоксазол. Антибиотик действует бактерицидно и способен проникать в костную ткань [39]. Однако ко-тримоксазол не обладает антибиопленочной активностью и около 70 % штаммов K. pneumoniae и A. baumannii имеют к нему устойчивость [37, 40]. H. Cisse et al. показали, что применение комбинации фторхинолонов и ко-тримоксазола в течение 8–12 недель после хирургической санации у 30 пациентов с ИАИ, вызванной E. cloacae , было эффективным в 80 % случаев [41]. Эффективность ко-тримоксазола при ИАИ, вызванной другими Гр(–) возбудителями, в настоящее время не изучена. В нашем исследование назначение ко-тримоксазола или фторхинолона при наличии чувствительности к ним выделенных от пациента изолятов статистически значимо (p = 0,001) увеличивало вероятность благоприятного исхода в 7,87 раз (95 % ДИ 2,26–27,03), что еще раз подтверждает важнейшую роль антибиотикорезистентности в прогнозе результата лечения для пациентов с ИАИ.
Ревизия области хирургического вмешательства в раннем послеоперационном периоде понадобилась каждому пятому пациенту, что в 4,86 раза (95 %ДИ 2,18–10,84) увеличивало риск неблагоприятного исхода. Кроме того, получение роста Гр(–) бактерий в раннем послеоперационном периоде в 3,4 раза (95 %ДИ 1,61–7,21) увеличивало вероятность неблагоприятного исхода (V Крамера = 0,252). Культуро-выделение зарегистрировано у 23 % пациентов. В большинстве случаев изолят выделяли из интраоперационного материала при выполнении ревизионной операции, реже из гематомы или раневого отделяемого.
Известно, что операция с сохранением инфицированного имплантата часто приводит к рецидивам ИАИ [8, 15]. В нашем исследовании в подавляющем большинстве случаев индексная операция включала полное удаление или замену инфицированного имплантата на новый. В исследуемой выборке 77 % пациентов выписаны с наличием вновь установленных МК, чаще всего антимикробных спей-серов. В результате мы не выявили статистически значимого влияния наличия МК на исход лечения ( p = 0,101).
ЗАКЛЮЧЕНИЕ
Комплексное лечение ИАИ, обусловленной Гр(–) бактериями, при двухлетнем наблюдении в 45 % случаев ведет к неблагоприятному исходу, включая 10 % летальности. Ведущие грамотрицательные возбудители в большинстве случаев встречаются в составе смешанных с Гр(+) бактериями микробных ассоциаций. ИАИ данной этиологии характеризуется длительным рецидивирующим течением. Значимыми факторами, влияющими на риск неблагоприятного исхода в ближайшие два года после санирующей операции, являются гипоальбуминемия, как исходная, так и в послеоперационном периоде, и ранняя ревизия послеоперационной раны с положительным ростом возбудителя из биоматериала, полученного из области хирургического вмешательства. Помимо этого на прогноз у таких пациентов значимо влияет чувствительность изолированных Гр(–) патогенов к антибактериальным препаратам, что вызывает особую озабоченность в период повсеместно растущей антибактериальной резистентности и требует разработки новых тактических подходов к лечению.


