Особенности термического поведения двойного комплекса [Ni(NH3)6]3[Fe(CN)6]2
Автор: Домонов Денис Петрович, Печенюк София Ивановна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 4 т.8, 2016 года.
Бесплатный доступ
Рассмотрено термическое поведение двойного комплекса [Ni(NH3)6]3[Fe(CN)6]2 в окислительной (воздух), инертной (аргон, азот) и восстановительной (водород) атмосферах. Изучены твердые и газообразные продукты термолиза. Установлено, что в атмосфере воздуха образуются твердые оксиды металлов-комплексообразователей, аммиак, СО2 и N2O, в инертных атмосферах в газовой фазе - аммиак, циановодород и азот, в твердой фазе при температуре 600 °C - металлы и значительное количество рентгеноаморфного углерода. В атмосфере водорода в газовую фазу также выделяются аммиак, циановодород и азот, но координированные цианогруппы частично гидрируются до аммиака и углеводородов, преимущественно метана. Чистые металлы в твердой фазе (твердый раствор Ni-Fe) образуются при температуре не ниже 800 °C.
Двойные комплексные соединения, термолиз, водород, азот, аргон, воздух, аммиак, интерметаллиды
Короткий адрес: https://sciup.org/147160373
IDR: 147160373 | УДК: [544.016.2:543.573]:546.72/74 | DOI: 10.14529/chem160407
Текст научной статьи Особенности термического поведения двойного комплекса [Ni(NH3)6]3[Fe(CN)6]2
В большинстве работ, посвященных двойным комплексным соединениям (ДКС), особенно отечественных, отмечается, что эти соединения являются перспективными прекурсорами для получения однородных полиметаллических фаз с широко варьируемым составом [1]. Из числа двойных комплексных соединений металлов I переходного ряда [2–4] особенный интерес представляет ДКС [Ni(NH 3 ) 6 ] 3 [Fe(CN) 6 ] 2 . В качестве прекурсора для получения биметаллических Fe– Ni порошков он очень привлекателен, так как, кроме металлов, содержит только водород, азот и минимально возможное для цианокомплексов количество углерода, а никель и железо образуют интерметаллические соединения и твердые растворы, а также сложные оксиды типа шпинели, что позволяет получать из него разнообразные продукты.
Для получения чистых биметаллических продуктов важно, чтобы все атомы, входящие в состав лигандов, полностью удалялись в процессе термолиза. Известно, что аммиак слабо удерживается никелем (для катиона [Ni(NH 3 ) 6 ]2+ K уст =108[5]) и, казалось бы, не должно быть проблем с удалением основной части азота. Однако простота задачи получения чистых биметаллических фаз из этого соединения оказалась мнимой. Цель настоящей работы состоит в том, чтобы дать полную картину термического поведения данного комплекса и определить условия, в которых возможно получение чистых биметаллических продуктов.
Экспериментальная часть
Изучаемое ДКС получали смешиванием водных растворов эквивалентных количеств [Ni(NH 3 ) 6 ]Cl 2 , синтезированного согласно [6], и реактивного K 3 [Fe(CN) 6 ] (х.ч.).
Для C 12 H 54 N 30 Ni 3 Fe 2 (м.м. 905.8) вычислено (масс. %): C – 15,9; Ni – 19,4; Fe – 12,3.
Найдено (масс. %): C – 15,8; Ni – 19,7; Fe – 12,3.
Для изучения ДКС и продуктов его термолиза использовали элементный анализ, рентгенофазовый анализ (РФА), ИК-спектроскопию и хроматографический анализ. Анализ на содержание углерода производили на автоматическом анализаторе ELTRA CS-2000. Для определения содержания металлов навески комплекса и продуктов его термолиза растворяли в смеси концентрированных кислот HNO3 и HCl (табл. 1). Полученные растворы анализировали атомноабсорбционным методом на спектрометре «АAnalyst 400». Дифрактограммы получали на дифрактометре Shimadzu XRD 6000 с использованием CuKα-излучения (монохроматор графит) и сравнивали их с данными базы JCPDS-ICDD 2002 [7]. ИК-спектры исходных веществ и твёрдых продуктов термолиза снимали на спектрометре Nicolet 6700 FT-IR в таблетках с KBr, используя для отнесения спектров монографию [8].
Кривые термического анализа в атмосфере воздуха и аргона получали на приборе NETZSCH STA 409 PC/PG в корундовом тигле с крышкой (навески образца 7–10 мг, диапазон температур 20-1000 ° С) (рис. 1, 2). Скорость потока газа составляла 40 мл/мин, скорость нагревания -10 ° С/мин.
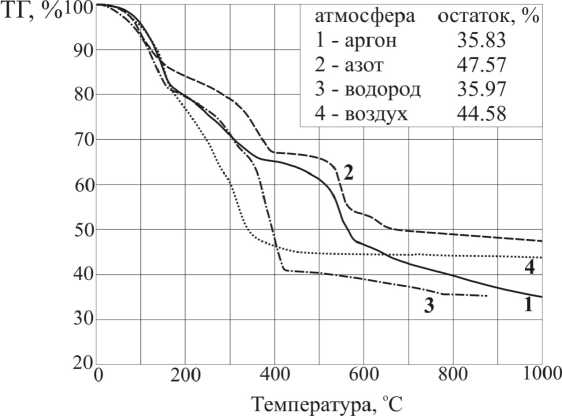
Рис. 1. Кривые ТГ в различных газовых средах ДКС [Ni(NH 3 ) 6 ] 3 [Fe(CN) 6 ] 2
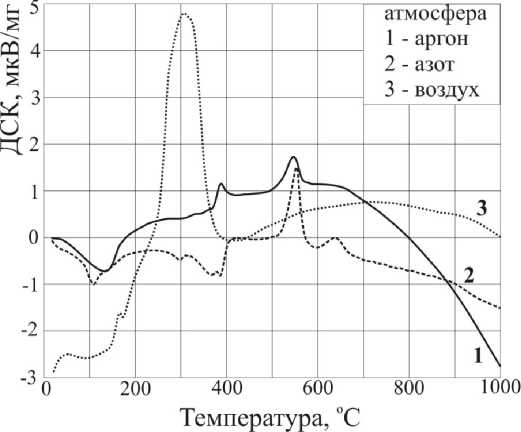
Рис. 2. Кривые ДСК в различных газовых средах ДКС [Ni(NH 3 ) 6 ] 3 [Fe(CN) 6 ] 2
Термогравиметрические измерения в атмосфере водорода (смесь гелия и водорода 5,8 % об. водорода) проводили с использованием термовесов TG 209 F1 Iris® фирмы NETZSCH (масса навески 20 мг, корундовый тигель, скорость потока газа 60 мл/мин (рис. 1)1. ИКС-исследование газообразных продуктов проводили на приборе Netzsch STA 449F3 Jupiter, совмещенном с ИК-Фурье-спектрометром Bruker Tensor 27 в атмосфере синтетического воздуха и азота2 в корундо- вых тиглях при скорости потока газа носителя 50 мл/мин. Регистрировали ИК-спектры (рис. 3) в диапазоне 550-4000см–1 с разрешением 4 см–1 и усреднением по 32 сканам. Идентификация соединений проводилась путем сравнения с базой данных NIST. Скорость нагревания во всех экспериментах была 10°С/мин.
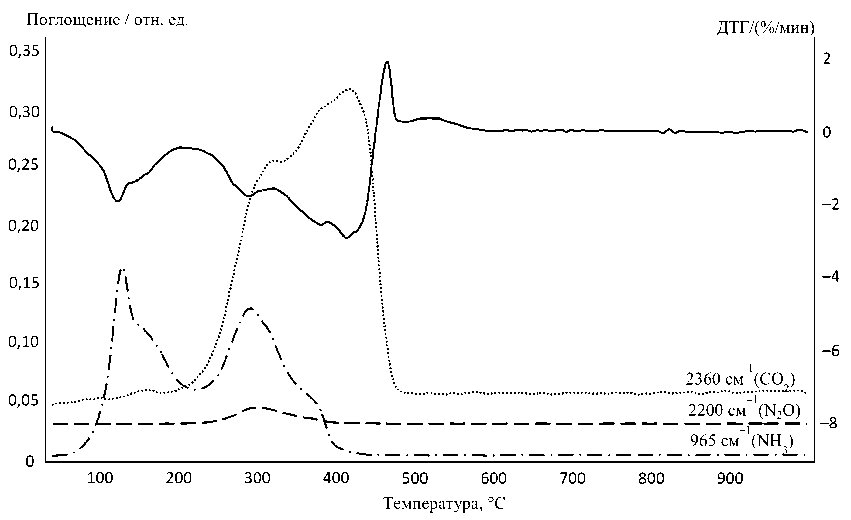
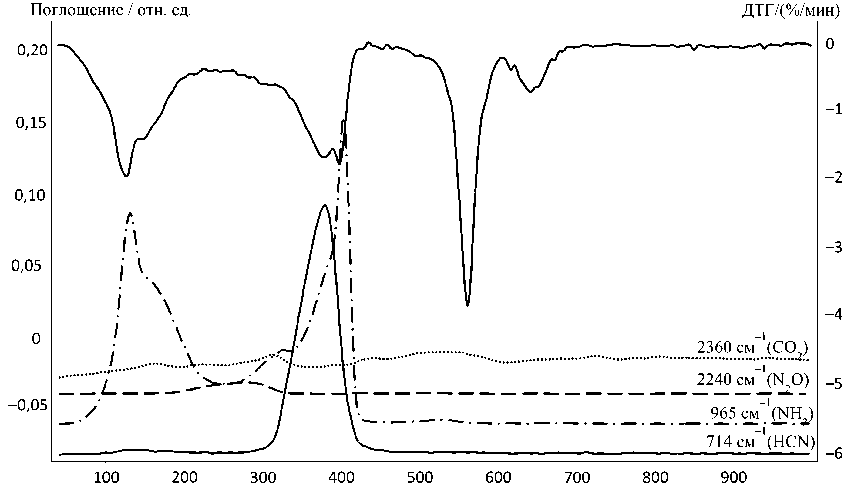
Температура, °C
б)
Рис. 3. Кривые ДТГ и изменение интенсивности полос в ИК спектрах газообразных продуктов термолиза ДКС [Ni(NH 3 ) 6 ] 3 [Fe(CN) 6 ] 2 в атмосфере: а – воздуха; б – азота
Для температур, соответствующих окончанию определенных этапов термолиза (точки перегиба на кривой ТГ), выполняли точечные (статические) эксперименты для подробного исследования твердых и газообразных продуктов. Точечные эксперименты осуществляли в проточном трубчатом кварцевом реакторе, вставленном в трубчатую печь SNOL-0.2/1250, с навесками ~ 0,5 г, в токе воздуха, аргона и чистого водорода (12–15 л/ч). Аргон и азот предварительно пропускали через щелочную суспензию Mn(OH)2 для очистки от следов кислорода, а затем через концентрированную серную кислоту для осушки. Водород получали с помощью генератора водорода ГВЧ-12К. По достижении заданной температуры реактор извлекали из печи и охлаждали. Поскольку ИК-спектрометрическое изучение газообразных продуктов термолиза свидетельствует о выделении аммиака, СО2 и HCN, для их количественного определения поток газообразных продуктов термолиза последовательно пропускали через растворы HCl, а затем H2O2 + NaOH при температуре ~ 80 °С, предполагая, что HCN в щелочном растворе окисляется до карбонат- и нитрат-ионов. Растворы анализировали на содержание ионов аммония, карбонат- и нитрат-ионов (табл. 2) (методами Кьельдаля и титриметрическим [9]). Хроматографический анализ газообразных продуктов термолиза ДКС в атмосфере водорода выполняли на хроматографе «Цвет 102» (табл. 3).
Таблица 1
Результаты термолиза [Ni(NH 3 ) 6 ] 3 [Fe(CN) 6 ] 2 в различных атмосферах в статических условиях
|
Температура (выдержка) |
Остаток, % |
Содержание в твердом остатке, % |
Брутто-состав |
М.м. |
|||
|
Ni |
Fe |
C |
|||||
|
В атмосфере воздуха |
|||||||
|
200 (2 ч) |
47,2 |
44,5 |
28,9 |
1,8 |
C 0.6 O 8 Ni 3 Fe 2 или C 0.6 N 2.5 O 6 Ni 3 Fe 2 |
421 427,6 |
|
|
350 (1 ч) |
45,4 |
45,4 |
28,6 |
0,1 |
N 2 O 6 Ni 3 Fe 2 |
411 |
|
|
325* |
63,8 |
– |
– |
13,3 |
C 6.5 Н 11 N 9.1 Ni 3 Fe 2 |
502,8 |
|
|
450 |
52,3 |
38,1 |
23,3 |
5,2 |
C 2 O 9 Ni 3 Fe 2 |
455,8 |
|
|
В атмосфере аргона |
|||||||
|
200 |
91,6 |
20,7 |
12,5 |
17,0 |
C 12 Н 45 N 27 Ni 3 Fe 2 |
854,8 |
|
|
275 |
89,9 |
23,9 |
15,0 |
19,1 |
C 12 Н 24 N 20 Ni 3 Fe 2 |
735,8 |
|
|
410 |
67,6 |
31,0 |
19,6 |
19,1 |
C 9 Н 15 N 10 Ni 3 Fe 2 |
550,8 |
|
|
600 |
61,3 |
33,4 |
20,9 |
19,4 |
C 9 N 9 Ni 3 Fe 2 |
521,8 |
|
|
1000 |
41,4 |
– |
– |
25,5 |
C 8 Ni 3 Fe 2 |
383,8 |
|
|
В атмосфере азота |
|||||||
|
420 |
74,0 |
26,4 |
16,7 |
16,0 |
C 8.9 Н 22 N 19.4 Ni 3 Fe 2 |
688,2 |
|
|
600 |
51,7 |
41,6 |
26,5 |
10,3 |
C 3.6 N 6.6 Ni 3 Fe 2 |
423,4 |
|
|
1000 |
39,1 |
52,6 |
33,5 |
0,2 |
O 2.5 N 0.5 Ni 3 Fe 2 |
334,8 |
|
|
В атмосфере водорода |
|||||||
|
200(2 ч) |
89,7 |
24,0 |
14,7 |
17,5 |
C 11 N 25 Н 42 Ni 3 Fe 2 |
812 |
|
|
350 (1 ч) |
45,2 |
44,2 |
27,9 |
14,1 |
C 5 N 5 Ni 3 Fe 2 |
418 |
|
|
500 (1 ч) |
41,0 |
– |
– |
11,1 |
C 3.4 N 3 Ni 3 Fe 2 |
370 |
|
|
700(1 ч) |
38,0 |
– |
– |
6,7 |
C 2 N 2.4 Ni 3 Fe 2 |
346 |
|
|
420 |
39,4 |
10,94 |
C 3.3 N 2.3 Ni 3 Fe 2 |
359,6 |
|||
|
870 |
34,6 |
– |
– |
0,004 |
Ni 3 Fe 2 |
287,8 |
|
* Если время выдержки не указано, то эксперимент проводился без выдержки.
Таблица 2
Результаты анализа поглотительных жидкостей при термолизе [Ni(NH 3 ) 6 ] 3 [Fe(CN) 6 ] 2 в атмосфере водорода и аргона
|
Условия эксперимента, ºC |
Кол-во NH 3 в % от общего числа коорд. мол. NH3 |
Кол-во HCN в % от общего числа коорд. CN– |
Остаток от прокаливания, % |
Содержание С в остатке от прокаливания |
||
|
% |
% от исх. |
|||||
|
в атмосфере аргона |
||||||
|
Без выдержки |
20–400 20–800 |
83,3 |
25,0 |
66,0 |
19,1 |
79,8 |
|
100 |
29,0 |
46,9 |
24,3 |
72,1 |
||
|
в ат мосфере водород а |
||||||
|
Без выдержки |
20–300 |
15,9 |
9,5 |
35,6 |
0,09 |
2,0 |
|
300–800 |
73,9 |
11,7 |
||||
|
С выдержкой |
20–300 |
97,4 |
11,9 |
35,2 |
0,02 |
0,4 |
|
300–800 |
3,4 |
18,7 |
||||
Таблица 3
Результаты качественного анализа смеси газообразных углеводородов, образующихся при восстановительном термолизе [Ni(NH 3 ) 6 ] 3 [Fe(CN) 6 ] 2
|
T разл , ºС |
Газообразные углеводороды, n·10–3, об. % |
||||||||||
|
и |
и |
и |
и |
и |
и |
। с |
и й |
и |
и 1 |
и 1 й |
|
|
200 |
2,7 |
н/о |
н/о |
н/о |
н/о |
н/о |
н/о |
н/о |
н/о |
н/о |
н/о |
|
350 |
1400,0 |
113,0 |
27,5 |
89,9 |
4,9 |
0,19 |
14,2 |
1,37 |
3,5 |
1,2 |
0,43 |
|
500 |
659,0 |
0,68 |
0,63 |
0,48 |
0,11 |
н/о |
н/о |
н/о |
н/о |
н/о |
н/о |
|
700 |
540,0 |
0,11 |
н/о |
н/о |
н/о |
н/о |
н/о |
н/о |
н/о |
н/о |
н/о |
|
Соотношение компонентов газовой смеси |
|||||||||||
|
350 |
СН 4 :С 2 Н 4 :С 2 Н 6 :С 3 Н 6 :С 3 Н 8 :i-С 4 Н 10 :α-С 4 Н 8 :n-С 4 Н 10 :β-С 4 Н 8 :i–С 5 Н 12 : n–С 5 Н 12 =7368 : 595 : 145 : 473 : 26 : 1 : 75: 7 : 18 : 6 : 2 |
||||||||||
|
500 |
СН 4 : С 2 Н 4 : С 2 Н 6 : С 3 Н 6 : С 3 Н 8 =5990 : 6 : 6 : 4 : 1 |
||||||||||
|
700 |
СН 4 : С 2 Н 4 =4909 : 1 |
||||||||||
Результаты и обсуждение
Термолиз в атмосфере воздуха
Кривые термического анализа и ИКС-исследование газообразных продуктов термолиза (рис. 1, 2, 3) показывают, что в интервале 30-450 ° C выделяется аммиак с двумя максимумами в областях 125 и 300 ° C. Углерод цианогрупп окисляется в интервале 200-480 ° C с образование СО2. Кроме того, в области 300 ° C наблюдается выделение некоторого количества N 2 O. В сумме эти процессы приводят к появлению широкого экзопика на кривой ДСК в области 250-460 ° C (рис. 2). Остаток от прокаливания при 325 ° С представляет собой смесь Fe3O 4 [88-0866], NiO[78-0423] и Ni[04-0850], а при 450 ° С Fe3O 4 [88-0866], и Ni[04-0850] [7]. Оба продукта содержат остаточный углерод. Брутто-состав см. в табл. 1. Промежуточные продукты разложения при 200– 300 ° С еще частично сохраняют в своем составе анионы [Fe(CN)6]3-, так как в ИК-спектре твердого остатка имеется соответствующая полоса поглощения (ν(CN) 2107–2110 см–1) [8]. Полное удаление остаточного углерода из продукта термолиза на воздухе достигается путем выдержки остатка при постоянной температуре в течение некоторого времени, например, при 350 ° С для этого достаточно выдержки в течение 1 часа.
Термолиз в инертных атмосферах
Как показано на рис. 1, кривые ТГ во всех атмосферах совпадают до ~ 150 oC. В атмосферах азота и аргона кривые ТГ имеют почти одинаковую форму, но потеря массы в атмосфере азота при одних и тех же температурах на 3–7 % ниже, чем в атмосфере аргона. Потеря массы продолжается во всем интервале температур от комнатной до 1000 ° С, и кривая ТГ на плато не выходит, т.е. процесс разложения, по-видимому, не заканчивается. Согласно кривой ТГ, в интервале от 50 до ~210 ° C удаляется 10-11 из 18 молекул аммиака, и оставшиеся удаляются до 420 ° С, что подтверждается данными ИК-спектроскопии газообразных продуктов для атмосферы азота (рис. 3б). Согласно этим данным, основными газообразными продуктами термолиза здесь являются NH 3 и HCN. В работе [10] было описано образование дициана при термолизе K 3 [Fe(CN) 6 ] в атмосфере аргона. Однако в данном случае он не зарегистрирован. Аммиак выделяется в двух температурных областях: 100-230 ° С, как и в атмосфере воздуха, и 280-425 ° С, максимумы при 130 и 400 ° С, соответственно. Циановодород выделяется в одну стадию в области 300-425 ° С, пик при 380 ° С. Анализ поглотительного раствора (H2O2 + NaOH) для атмосферы аргона показывает, что в виде HCN выделяется не более 30% содержащихся в ДКС цианогрупп, то есть около 1,5–1,7 из каждого аниона (табл. 2). При ~ 550 ° С в обеих атмосферах наблюдаются экзоэффекты и резкие пики потери массы (рис. 2, 3, б), которым в ИК-спектре газообразных продуктов не соответствует никакого сигнала и которые связаны с выделением молекулярного азота, так как при температуре > 550 ° С содержание азота в твердых остатках резко снижается. В точечном эксперименте при 275 ° С в атмосфере аргона найден остаток брутто-состава C i 2H24N20Ni3Fe2, а РФА показывает наличие изоструктурных кристаллических фаз [9]: Ni 2 [Fe(CN) 6 ] [46-0908] (d,Å/ I : 5,00/100; 3,54/96;
3,02/18; 2,50/55; 2,24/11; 2,04/17; 1,77/20 1,58/22) и Fe 4 [Fe(CN) 6 ] 3 [73-0687] (d,Å/ I : 5,07/100; 3,58/16; 2,53/12; 2,27/12; 2,07/2; 1,79/3; 1,60/2). Такому составу соответствует соотношение этих фаз 21:1. Остаток с тем же содержанием углерода, но значительно большим содержанием азота получен в атмосфере азота при 420 ° С. В точечном эксперименте (см. табл. 1) при 410 ° С в атмосфере аргона получен кристаллический остаток неидентифицированной структуры брутто-состава C 9 H15N10Ni3Fe2, при 600 ° С в атмосфере аргона получен рентгеноаморфный C 9 N 9 Ni3Fe2, а при 1000 ° С - C8Ni3Fe2, состоящий из Ni3Fe[65-3244], Fe и рентгеноаморфного углерода. Видно, что при термолизе в атмосфере аргона твердый остаток теряет главным образом азот, а содержание углерода в твердом остатке изменяется очень мало. В атмосфере же азота, напротив, теряется углерод (табл. 1). До 1000 ° С идет плавная потеря массы. По кривой ТГ в аргоне остаток составляет 35,83 %, что на 4,06 % превышает сумму содержания металлов в исходном соединении. В атмосфере азота остаток по кривой ТГ составляет 47,6 %. Это превышение мы объясняем присутствием остаточного углерода в первом случае и азота с кислородом3 во втором.
В инертных атмосферах наблюдаются одинаковые закономерности: в твёрдых остатках при температурах 200 и 275 ° С найдены Ni2[Fe(CN)6] и Fe4[Fe(CN)6]3 - продукты разложения исходного ДКС, основными газообразными продуктами являются аммиак и циановодород. Специально поставленные эксперименты показали, что остатки от прокаливания ДКС в атмосфере азота при 1000 ° С содержат остаточный азот. Так, при растворении остатка от прокаливания в 6 N HCl найдено количество ионов NH 4 +, соответствующее cодержанию ~ 2 масс. % азота. Согласно [11–13], нитриды Fe и Ni легко растворяются в водных растворах кислот с образованием в растворе ионов NH 4 +, поэтому можно предполагать, что этот азот находится в составе нитридов.
Некоторые различия в термоаналитических кривых, записанных в близких по свойствам инертных газов, можно объяснить особенностями проведения термического анализа в аргоне и в азоте (разные приборы, разные скорости продувки газа-носителя). В каком-то случае, вероятно, сказалось частичное удаление аммиака из катиона до начала анализа.
Термолиз в атмосфере водорода
Термический анализ был выполнен в атмосфере водородно-гелиевой смеси (см. эксп. часть), а точечные эксперименты в атмосфере чистого водорода. До 320 ° С кривые ТГ в атмосферах водородно-гелиевой смеси и аргона практически совпадают друг с другом. Остаток от прокаливания, согласно ТГ, составляет 35-36%. Эта величина больше суммы чистых металлов в соединении (31,77 %), а элементный анализ продуктов точечных экспериментов показывает значительное содержание углерода. На кривой ТГ хорошо различимы 4 стадии потери массы. На первой стадии (25–160 ºС) отщепляются 9-10 молекул аммиака из катиона. На второй стадии (160– 350 ºС) идёт выделение оставшегося аммиака. Анализ поглотительных жидкостей (см. табл. 2) показал, что даже при термолизе в атмосфере чистого водорода также выделяется циановодород. Определили количество выделившихся NH 3 и HCN в интервалах 20-300 и 300-800 ° С, для чего по достижении 300 ° С поглотительные жидкости меняли и нагревали систему до 800 ° С с выдержкой и без (табл. 2). С повышением температуры термолиза относительное содержание в газообразных продуктах HCN возрастает, а NH 3 снижается (см. табл. 2). В условиях, соответствующих получению кривой ТГ (без выдержки), из навески ~ 0,5 г до 300 ºС выделяется всего 1/6 координированного аммиака, тогда как с выдержкой в течение 1 ч – 3/4. Соответственно изменяется и выход HCN. В твёрдом остатке от прокаливания при 800 ° С с выдержкой в течение 1 часа углерод практически отсутствует (табл. 2), при отсутствии выдержки остаток, не содержащий углерода, получен при 870 ° С (см. табл. 1). Оба остатка состоят из Ni3Fe[65-3244] по картотеке JCPDS [7] и твёрдого раствора NiFe[47-1417] [7].
Согласно более ранним нашим исследованиям [14], координированные CN-группы при термолизе в атмосфере чистого водорода восстанавливается до NH3 и углеводородов. Однако теперь видно, что этот процесс в атмосфере водорода происходит не полностью, а часть цианогрупп выделяется в виде циановодорода. Количество С, выделившегося от 20 до 800 °С в виде HCN составляет 30,6 %, следовательно, около 70 % углерода выделяется в виде других газообразных соединений, которыми здесь могут быть только углеводороды (см. табл. 2). В то же время в атмо- сфере аргона сумма углерода, выделившегося в виде HCN и оставшегося в твёрдом остатке, соответствует 100±5 % (см. табл. 2).
Из табл. 3 хорошо видно, что образуются как предельные углеводороды, главный из которых – метан, так и непредельные. Наибольшее разнообразие продуктов наблюдается при средних температурах термолиза (350 ° С), в то время как при более низких и высоких температурах углерод выделяется почти исключительно в виде метана. Выход CH 4 при 350 ° С также является максимальным (см. табл. 3), а при более высоких температурах снижается. Твердыми продуктами термолиза ДКС в атмосфере водорода при высоких температурах является твердый раствор Ni– Fe c небольшим содержанием углерода и азота.
Заключение
Соединение начинает терять свою индивидуальность уже при комнатной температуре, поскольку ДКС содержит термодинамически малоустойчивый катион [Ni(NH 3 ) 6 ]3+. Приблизительно до 150 ° С ход процесса одинаков во всех атмосферах. Сначала идёт отщепление молекул NH3 в две стадии. Анион [Fe(CN) 6 ]3– как структурная единица промежуточного продукта частично сохраняется вплоть до 400 ° С, когда катионная часть ДКС уже полностью распалась, и центральный ион катионной части потерял все свои координированные лиганды. В зависимости от атмосферы анионная часть комплекса разрушается с образованием CO 2 и N 2 O (на воздухе) и HCN, N 2 и рентгеноаморфного углерода (в инертной среде). В атмосфере водорода происходит частичное гидрирование цианогрупп с образованием углеводородов и NH 3 . Получение чистых биметаллических фаз в инертных атмосферах невозможно, а получение чистых оксидов в атмосфере воздуха и металлических Ni и Fe в атмосфере водорода возможно при температурах более 400 и 800 ºС, соответственно, при 1-2-часовой выдержке при постоянной температуре. Однако биметаллические порошки в обоих случаях не являются гомогенными
Список литературы Особенности термического поведения двойного комплекса [Ni(NH3)6]3[Fe(CN)6]2
- Синтез и структура двойных комплексов платиновых металлов -предшественников металлических материалов/С.В. Коренев, А.Б. Венедиктов, Ю.В. Шубин, С.А. Громилов, К.В. Юсенко//Журн. структур. химии. -2003. -Т. 44, № 1. -С. 58-73.
- О влиянии природы аниона на процесс термолиза двойных комплексов и 43/С.И. Печенюк, Д.П. Домонов, Д.Л. Рогачев, А.Т. Беляевский//Журн. неорг. химии. -2007. -Т. 52, № 7. -С. 1110-1115.
- Синтез и термическое разложение двойных комплексных соединений, содержащих медь и 1,3-диаминопропан/С.И. Печенюк, А.Н. Гостева, Д.П. Домонов, Т.И. Макарова//Вестник Южно-Уральского гос. ун-та. Серия «Химия». -2012. -Вып. 9, № 24. -С. 4-12.
- Thermal decomposition of ∙2H2O: Topotactic dehydration process, valence and spin exchange mechanism elucidation/Z. Travniček, R. Zbořil, M. Matikova-Malarova В. Drahoš, J. Černák//Chem. Central J. -2013. -7:28.
- Лурье, Ю.Ю. Справочник по аналитической химии/Ю.Ю. Лурье. -4-е изд., перераб. и доп. -М.: Химия, 1971. -456 c.
- Brauer, G. Handbuch der Präparativen Anorganischen Chemie: in Drei Bänden/G. Brauer -Stuttgart: Ferdinand Enke, 1978. -2113 p.
- Картотека JCPDS. -2002.
- Nakamoto, K. Infrared and Raman Spectra of Inorganic and Coordination Compounds/K. Nakamoto -New York: John Wiley & Sons Inc., 1986. -484 p.
- Fritz, J.S. Quantitative Analytical Chemistry/J.S. Fritz, G.H. Schenk. -Boston: Allyn and Bacon, 1974. -560 p.
- Thermoanalytical Studies on the Double Complexes and (M=Cr, Co, Ru, Rh; M′=Fe, Co)/S. Kohata, M. Asakawa, T. Maeda, H. Shyo, A. Ohyoshi//Anal. Sci. -1986. -V. 2, no. 4. -P. 325-330.
- Gmelins Handbuch der anorganische Chemie. S-N4. Stickstoff. Lfg. 2. 1936. S. 320-344.
- Gmelins Handbuch der anorganische Chemie, Eisen, Teil A8, S. 137-156.
- Gmelins Handbuch der anorganische Chemie, 8 Aufl., Nickel, Teil B, Lfg. 2, 1966, S. 496-500.
- Превращения координированных лигандов при восстановительном термолизе некоторых двойных комплексных соединений/С.И. Печенюк, Д.П. Домонов, А.А. Аведисян, С.В. Икорский//Журн. неорг. химии. -2010. -Т. 55. -№ 5. -С. 788-792.

![Особенности термического поведения двойного комплекса [Ni(NH3)6]3[Fe(CN)6]2 Особенности термического поведения двойного комплекса [Ni(NH3)6]3[Fe(CN)6]2](/file/cover/147160373/osobennosti-termicheskogo-povedenija-dvojnogo-kompleksa-ni-nh3-6-3-fe-cn-6-2.png)
