Особенности углеводного и водно-солевого обменов крыс с экспериментальной моделью сахарного диабета на фоне приема электроактивированных водных растворов
Автор: Гайдарова Анна Павловна
Журнал: Science for Education Today @sciforedu
Рубрика: Биологические, химические, медицинские науки
Статья в выпуске: 2 (12), 2013 года.
Бесплатный доступ
В экспериментах на животных оценена эффективность применения электроактивированных водных растворов при экспериментальной модели сахарного диабета. Было показано, что на фоне сахарного диабета «анолит» оказывал выраженный гипогликемический эффект, вызывая задержку развития сахарного диабета, тогда как «католит» не проявлял протективного сахаропонижающего эффекта. Прием электрохимически активированных водных растворов (ЭВР) не вызывает изменений функций почек и водно-солевого обмена у здоровых животных, тогда как при сахарном диабете наблюдается увеличение диуреза и экскретируемой фракции калия после приема ЭВР требует дальнейшего изучения. Гистологический анализ показал положительное влияние «анолита» на структуру поджелудочной железы крыс с аллоксановой моделью сахарного диабета. Влияние ЭВР на морфологическую структуру почек крыс в ходе эксперимента не установлено. Полученные результаты свидетельствуют об эффективности использования «анолита» для коррекции структуры и функций поджелудочной железы крыс с аллокановой моделью сахарного диабета.
Электроактивация, "католит", "анолит", водно-солевой обмен, сахарный диабет, почка, поджелудочная железа, крыса
Короткий адрес: https://sciup.org/147137456
IDR: 147137456 | УДК: 591.133
Текст научной статьи Особенности углеводного и водно-солевого обменов крыс с экспериментальной моделью сахарного диабета на фоне приема электроактивированных водных растворов
Все права защищены

2(12) 2013
ISSN 2226-3365
По данным ВОЗ, в настоящее время в мире насчитывается 285 млн больных СД, а к 2025 г. их количество составит 380 млн и 435 млн – в 2030 г. При этом реальные темпы прироста заболеваемости значительно опережают даже столь удручающие прогнозы статистиков. Так, в 2000 г. количество больных СД оказалось на 11 % больше – 175 млн. против 154 млн. по расчетным данным 1998 г. [1, с. 1–13].
Поиск новых эффективных способов лечения СД является одной из важнейших проблем мировой медицины и здравоохранения [2, с. 160; 14, с. 33–40]. Одним их возможных способов решения данного вопроса является использование электроактивированных водных растворов (ЭВР) [3].
Электрохимическая активация (ЭХА) – сравнительно новая отрасль в медицине, открывающая широкие возможности применения водных растворов, обработанных электрическим током, в качестве лекарственных средств в эксперименте и в клинике [4, с. 88–91; 5, с. 54; 6, с. 26; 7, с. 23–25].
Реализуется ЭХА путем анодной или катодной (униполярной) активации солевого раствора в электроактиваторе, представляющим собой в общем случае разновидность диафрагменного электролизера [8, с. 317–319]. «Анолит» (кислотная вода, бактерицид) характеризуется электронноакцепторными свойствами, способен стимулировать биологическое окисление, к тому же он способствует непрямой электрохимической детоксикации организма путем окислительного гидроксилирования токсинов и шлаков [9, с. 15–23]. «Католит» (щелочная вода, биостимулятор) обладает антиоксидантными, иммуностимулирующими, детоксицирующими свойствами, нормализует метаболические процессы (повышение синтеза АТФ, изменение активности ферментов), стимулирует регенерацию тканей, улучшает трофические процессы и кровообращение в тканях, усиливает детоксикационную функцию печени [10, с. 5].
В настоящее время в медицине накоплено достаточно фактов значимости феномена ЭХА для регуляции физиологического гомеостаза, о возможности биофизического управления тонкой структурной организацией воды в составе живых тканей и процессами электронного обмена в биологических субстратах. Благодаря этому ЭХА-вода, ее растворы и другие электроактивированные жидкие среды достаточно широко используются во многих странах мира как профилактическое и терапевтическое средство для лечения широкого круга заболеваний [1, с. 1–13].
Несмотря на то, что в настоящее время имеются многочисленные публикации об использовании ЭВР в клинической медицине [12, с. 4–5; 12, с. 85], их механизмы действия и фармакологические эффекты изучены далеко не полностью.
В свете этой проблемы особую актуальность имеет изучение воздействия водных растворов на организм в норме и при сахарном диабете.
Методика . В работе использована аллоксановая модель сахарного диабета, впервые полученная в 1943 г. Экспериментальная модель сахарного диабета создавалась посредством однократного введения 10 % раствора аллоксана из расчета 0,1мл/100 г массы тела.
В работе использовались 49 взрослых крыс линии Wistar массой 200–250 г., разделенных на 2 равные группы – контрольную и экспериментальную, каждая из которых, в свою очередь, была поделена на
Все права защищены

2(12) 2013
ISSN 2226-3365
три подгруппы: животные, получающие воду, раствор католита (ЭВР-К) или анолита (ЭВР-А).
На 1, 3 и 6 сутки эксперимента у животных брали пробы крови путем надсечки хвоста для определения уровня глюкозы. На 6 сутки животных высаживали в обменные клетки для сбора мочи. В конце эксперимента у всех животных под эфирным наркозом из нижней полой вены забирали пробы крови объемом 5 мл для последующего физикохимического анализа показателей, а также образцы тканей поджелудочной железы и почки.
Для определения уровня глюкозы к 0,1 мл. плазмы крови добавлялось 0,9 мл дистиллированной воды и 0,5 мл пикриновой кислоты (1,2 % р-р), тщательно перемешивали и центрифугировали в течение 10 минут при скорости вращения 3000 об/мин. Затем к 1 мл центрифугата приливали 0,2 мл гидроксида натрия (20 % р-р) и помещали в кипящую водяную баню на 5 минут. После охлаждения, растворов фотометрировали при длине волны 560 нм на спектрофотоколориметре «Spekol». Концентрацию глюкозы определяли по стандартной кривой.
Концентрацию глюкозы в моче определяли тем же способом. Моча предварительно разводилась от 10 до 50 раз в зависимости от концентрации в ней глюкозы.
Концентрацию ионов Na+ и K+ в моче, плазме крови определяли методом пламенной фотометрии с использованием фотометра «BMW Technologies» производства США.
Для определения осмотической концентрации мочи и плазмы крови использовали метод криоскопии. Измерения выполняли на миллиосмометре «OSMOMAT», производство Германия.
Концентрацию осмотически активных веществ в пробах определяли по калибровочным графикам, построенным на основании показаний прибора при измерении стандартных растворов мочевины с известной осмолярностью (300, 1000, 2000 мосм/л).
Парциальные функции почек рассчитывали по общепринятым формулам [14, с. 293].
Для светооптического исследования образцы поджелудочной железы и почек фиксировали в 10 % растворе нейтрального формалина, обезвоживали в серии спиртов возрастающей концентрации и заключали в парафин. Срезы толщиной 5–6 микрон, окрашивали гематоксилином Майера, эозином, альциановым синим и заключали в канадский бальзам.
Статистический анализ результатов исследования проводился на основе определения средне арифметических (М) и их ошибок (±m). Различие показателей оценивалось методами вариационной статистики по t-критерию Стьюдента и считались достоверными при p≤0,05, также использовались критерии Anova. Расчеты производились по общепринятым формулам с использованием стандартных программ пакета Microsoft Office.
Все животные находились в стандартных условиях вивария при свободном доступе к воде или соответствующему раствору и пище. Полученные результаты обработаны общепринятыми методами статистики (Statistica-6.0).
Результаты. На первом этапе исследования был проведен анализ концентрации глюкозы в плазме крови крыс в динамике развития экспериментального сахарного диабета (табл.1).
Все права защищены

2(12) 2013
ISSN 2226-3365
Таблица 1
|
Время эксперимента, сутки |
Контроль (интактные) |
СД |
||||
|
вода |
ЭВР-А |
ЭВР-К |
вода |
ЭВР-А |
ЭВР-К |
|
|
1 |
6,7±0,39 |
6,5±0,35 |
6,6±0,18 |
14,7±3,4* |
7,06±1,15▲ Δ |
23,06±4,03* |
|
3 |
18,1±4,0* |
9,3±1,4▲ Δ |
23,18±5,01* |
|||
|
6 |
16,1±5,3 |
11,2±3,2 |
12,05±2,8 |
|||
Примечание (здесь и далее):
* – достоверные отличия от аналогичных показателей контроля (р ≤0,05) ;
Δ – достоверные отличия между экспериментальными группами (католит, анолит) (р ≤0,05);
▲ – достоверные отличия по сравнению с группой «вода» (р ≤0,05).
Концентрация глюкозы в плазме крови крыс (M±m), ммоль/л
Из данных табл. 1 видно, что у здоровых животных «католит» и «анолит» не вызывали изменения уровня глюкозы в крови на протяжении всего периода наблюдения. У животных экспериментальной группы уже на первые сутки после инъекции аллоксана уровень глюкозы был достоверно выше аналогичных показателей контроля, что свидетельствовало о развитии сахарного диабета. Только в группе «ЭВР-А» этот показатель был достоверно ниже показателей остальных групп и достоверно не отличался от контроля. Подобная ситуация сохранилась на 3 сутки эксперимента. На 6 сутки наблюдения уровень глюкозы у всех экспериментальных животных достоверно не различался между группами и был в 2 раза выше интактных животных.
Таким образом, можно заключить, что у здоровых животных ЭВР не вызывали изменений уровня глюкозы в крови, тогда как на фоне сахарного диабета ЭВР-А оказывал выраженный гипогликемический эффект, вызывая задержку развития сахарного диабета, тогда как ЭВР-К не проявлял протективного сахаропонижающего эффекта.
При анализе ионно-осмотических показателей плазмы крови и мочи крыс было выявлено, что у интактных животных различные водные растворы не вызывали существенных изменений концентрации ионов и показателей функций почек, кроме снижения мочевины в плазме крови после приема ЭВР-А. На фоне сахарного диабета концентрация натрия и калия не изменялись, а содержание мочевины имело тенденцию к повышению, и уровень креатинина был достоверно выше аналогичных показателей здоровых животных. Полученные изменения могут свидетельствовать о нарушении функционального состояния почек и развитии почечной недостаточности в условиях СД. При этом существенных отличий между животными, принимавшими разные ЭВР, не обнаружено, за исключением некоторого увеличения концентрации креатинина и гипокалиемии после приема ЭВР-К (табл. 2).
Все права защищены

2(12) 2013
ISSN 2226-3365
Таблица 2
Ионно-осмотические показатели плазмы крови крыс (M±m)
|
Концентрация, ммоль/л |
контроль |
СД |
||||
|
вода |
ЭВР-А |
ЭВР-К |
вода |
ЭВР-А |
ЭВР-К |
|
|
натрия |
139,4±13,5 |
138,3±12,1 |
129,7±13,0 |
148,0±23,7 |
124,0±8,6 |
131,0±34,1 |
|
калия |
4,1±0,2 |
3,9±0,2 |
4,0±0,3 |
3,8±0,2 |
3,6±0,3 |
3,0±0,3*▲ |
|
креатинина |
1,14±0,04 |
1,1±0,05 |
1,09±0,02 |
1,4±0,03* |
1,4±0,04* |
1,5±0,01*▲ Δ |
|
мочевины |
54,0±4,9 |
33,8±5,6▲ Δ |
49,8±4,8 |
60,0±7,7 |
64,8±7,2* |
63,6±8,7 |
Примечание: см. таблицу 1
Изучение гидро- и ионоуретической функций почек позволило выявить увеличение уровня диуреза на фоне сахарного диабета в группах животных, принимавших как «анолит», так и «католит» (табл. 2). Скорость клубочковой фильтрации и уровень канальцевой реабсорбции не отличались между группами СД и контроля. Параллельно возрастала экскретируемая фракция калия, что, вероятнее всего, отражало увеличение секреции катиона. Указанные факты свидетельствуют в пользу усиления экскреции осмотически активных веществ (например, глюкозы) под влиянием ЭВР в условиях СД, в результате чего повышалась скорость мочеотделения и очищение калия, а концентрация глюкозы в плазме была ниже, чем у животных, получающих воду и ЭВР-А.
Поскольку функциональные изменения органа обусловлены изменением его морфологической структуры, на следующем этапе нашего исследования был проведен анализ морфологической структуры поджелудочной железы и почек животных.
Таблица 3.
Гидро- и ионоуретическая функции почек крыс (M±m)
|
Показатель |
контроль |
СД |
||||
|
вода |
ЭВР-А |
ЭВР-К |
вода |
ЭВР-А |
ЭВР-К |
|
|
V, мл/100г*час |
0,05±0,02 |
0,03±0,01 |
0,04±0,01 |
0,06±0,01 |
0,11±0,02*▲ |
0,11±0,03* |
|
СКФ, мл/100г*час |
13,7±3,4 |
20,6±2,12 |
12,2±2,5 Δ |
10,4±2,0 |
15,2±3,7 |
12,2±4,9 |
|
R H 2 O, % |
99,6±0,1 |
99,7±0,03 |
99,6±0,09 |
99,6±0,04 |
99,7±0,1 |
99,0±0,6 |
|
U Na *V, мкмоль/100г* час |
4,0±1,5 |
13,7±0,6▲ Δ |
7,0±2,8 |
4,3±1,6 |
6,8±2,4* |
16,5±5,5 Δ |
Все права защищены
2(12) 2013
ISSN 2226-3365
|
U K *V, мкмоль/100г*час |
15,6±6,4 |
12,0±1,5 |
8,9±3,1 |
17,1±8,6 |
16,6±1,07 |
17,1±6,7 |
|
EF Na , % |
0,2±0,1 |
0,4±0,05 |
0,4±0,2 |
0,3±0,09 |
0,3±0,10 |
2,11±0,97 |
|
EF K , % |
22,8±10,2 |
15,03±3,3 |
13,06±2,8 |
54,2±6,2 |
40,6±2,2* |
58,5±11,8* |
Примечание: см. таблицу 1

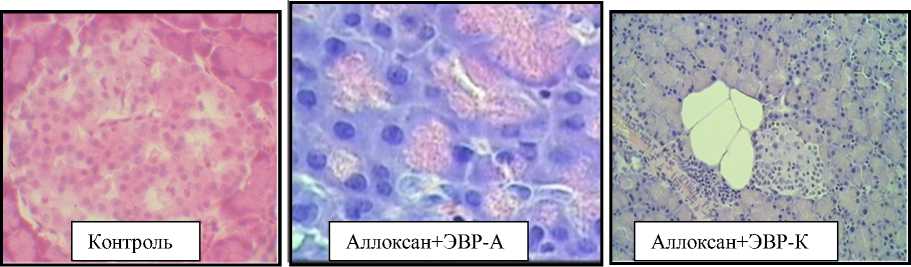
Анализ структурной организации поджелудочной железы крыс контрольной группы показал, что структура органа соответствует норме: клетки расположены довольно равномерно с хорошо контурируемыми ядрами.
Анализ структурной организации поджелудочной железы крыс в условиях аллоксановой модели сахарного диабета показал, что происходит блокада протоков разных уровней, слабо выраженный кистоз, а также отмечен междольковый отек. Экскреторная паренхима железы при диабете атрофична, строение ее стерто.
При анализе структурной организации поджелудочной железы крыс с аллоксановой моделью сахарного диабета после приема ЭВР-А обнаружена кольцевидная трансформация ацинуса, гипертрофия островков Лангерганса, субнекроз. Иная картина наблюдалась в структурной организации поджелудочной железы крыс, употреблявших ЭВР-К при аллоксановой модели сахарного диабета. Наряду с кольцевидной трансформацией ацинуса, гипертрофией островков Лангерганса, субнекрозом, которые наблюдались в группе СД+ЭВР-А, отмечена гипертрофия и гиперплазия островков Лангерганса, междольковый отек, очаговые некрозы ткани, псевдокистоз, а также соединительнотканное замещение ацинусов, элементы жировой атрофии, тяжелый протеолиз в сочетании с липолизом (рис. 1).
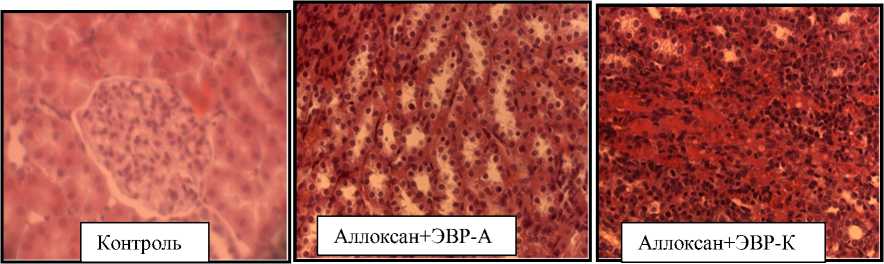
Почки практически всех животных контрольной группы имели нормальную структурную организацию. Отчетливо обозначены корковое и мозговое вещество почечной паренхимы. Проксимальные и дистальные канальцы нефрона сохраняют свое трубчатое строение. Ядра нефроцитов хорошо прокрашены ядерными красками, четко различимы. Собирательные трубки расположены компактно, не расширены. Эпителий кубический с хорошо видимыми и прокрашенными ядрами округлой и округлоовальной формы. Анализ структурной организации почек крыс с аллоксановой моделью сахарного диабета после приема ЭВР-А показал кистозную множественную трансформацию, гидрофическую дистрофия канальцев, выраженную полифибропласти-ческую реакцию на уровне капилляров, канальцевые некрозы, начинаются фибропластические реакции.
В почках крыс с аллоксановой моделью сахарного диабета после приема ЭВР-К обнаружен слабо выраженный кистоз, гидрофическая дистрофия, акцентированная на проксимальных канальцах, ячеистая структура на фоне тотальных некрозов, очаговый некроз с плазматическим пропитыванием интерстиция (рис. 2).
Было установлено, что во всех экспериментальных группах по сравнению с контролем наблюдались некротические изменения, вызванные интоксикацией аллоксаном. При этом у животных, которые
Все права защищены


2(12) 2013
ISSN 2226-3365
пили ЭВР-А, в структуре поджелудочной железы по сравнению с другими экспериментальными группами отмечались минимальные изменения органа (рис. 1).
Морфологическая структура поджелудочной железы
Рисунок 1.
На фоне аллоксанового диабета в почках животных всех экспериментальных групп по сравнению со здоровыми животными обнаружены тяжелые последствия аллоксановой интоксикации. Регенерирующее действие ЭВР на почки в ходе эксперимента не установлено (рис. 2).
Рисунок 2.
Морфологическая структура почки
Таким образом, прием электрохимически активных водных растворов не вызывает изменений функций почек и водно-солевого обмена у здоровых животных, тогда как при сахарном диабете увеличение диуреза и экскретируемой фракции калия после приема ЭВР требует дальнейшего изучения. В то же время «анолит» на фоне изучаемой патологии способствует задержке развития данного заболевания, что проявляется в более низких показателях уровня глюкозы в крови, тогда как «католит» не оказывает подобного протективного эффекта. Гистологический анализ показал положительное влияние «анолита» на структуру поджелудочной железы крыс с аллоксановой моделью сахарного диабета. Полученные данные
Все права защищены

2(12) 2013
ISSN 2226-3365
требуют исследования биохимических гипогликемический и протективный эффекты процессов, определяющих подобный «анолита».
Список литературы Особенности углеводного и водно-солевого обменов крыс с экспериментальной моделью сахарного диабета на фоне приема электроактивированных водных растворов
- Дедов И. И. Сахарный диабет: развитие технологий в диагностике, лечении и профилактике (пленарная лекция)//ФГУ Эндокринологический центр. -2010. -№ 3. -с. 1-13.
- Дедов И. И., Кураева Т. Л., Петеркова В. А. Сахарный диабет у детей и подростков (руководство для врачей). -М.: Медицина, 2008. -172 с.
- Гайдарова А.П., Хорина Ю.А., Корощенко Г.А., Серкина О.А., Хачатрян А.П., Ларионов П.М., Айзман Р.И. Влияние электроактивированных водных растворов на морфофункциональные показатели поджелудочной железы и почек крыс с экспериментальной моделью сахарного диабета//Вестник Новосибирского государственного педагогического университета. -2012. -№ 4. -С. 53-61.
- Зарезаев О. А., Корнева Т. К., Паничева С. А. Обработка рук хирурга электрохимическими активированными растворами и микробиологический контроль метода//Электрохимическая активация в медицине, сельском хозяйстве, промышленности: тезисы докл. всерос. конф. -М., 1994.
- Петросян Э. А. Патогенетические принципы и обоснование лечения гнойной хирургической инфекции методом непрямого электрохимического окисления: авт. … д-ра мед. наук. -М.,1991.
- Метод непрямой электрохимической детоксикации организма с использованием гипохлорита натрия в практической медицине//Добриянец А. И., Жидков С. А., Кузьмин Ю. В. Методические рекомендации. -Минск, 2000.
- Гительман Д. С., Збрижер Э. Р. Исследование влияния электроактивированного раствора католита на иммунный ответ и кроветворение у сублетально облученных мышей//Электрохимическая активация в медицине, сельском хозяйстве, промышленности: тезисы докл. всерос. конф. -М., 1994.
- Бредли Е. Е. Функция почек. Щитовидная железа. -Л., Гос. Изд. мед. лит., 1963.
- Бахир В. М. Электрохимическая активация в практической медицине//Второй Международный симпозиум "Электрохимическая активация", Тез. докл. и краткие сообщения. -Ч. 1. -М. -1999.
- Назаренко К. И. О свойствах воды//Электроактивированная вода -источник жизни и здоровья. -Киев, НПФ «ЭкоВод». -2003.
- Бахир В. М. Определение терминов «вода» и «раствор» применительно к технологии электрохимической активации//Электрохимическая активация в медицине, сельском хозяйстве, промышленности. -1999. -№ 14.
- Прилуцкий В. И. Электрохимическая активированная вода: аномальные свойства, механизм биологического действия. -М.: 1995.
- Алехин С. А. Методические материалы по применению электроактивированных водных растворов для профилактики и лечения наиболее распространенных болезней человека.-Ташкент, 1994. -85 с.
- Лакин Г. Ф. Биометрия. -М.: Высшая школа, 1980. -285 с.
- Wang G.-W. Effects of insulin therapy fracture healing and expression of VEGF in diabetic rats//Journal of Applied Biomedicinae. -2013. -№ 11.


