Особенности ультраструктуры и микроциркуляторного русла простаты при ДГПЖ у мужчин с различной массой тела
Автор: И.К. Нотов, С.В. Залавина, И.В. Феофилов, К.Г. Нотов, С.В. Позднякова
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Биологические науки
Статья в выпуске: 4, 2024 года.
Бесплатный доступ
Доброкачественная гиперплазия предстательной железы (ДГПЖ) - распространенное среди пожилых мужчин заболевание. Основными факторами, ведущими к его развитию, являются гормональные, возрастные, алиментарные и метаболические, в т.ч. избыточная масса тела и ожирение. Цель. Оценить выраженность клинической симптоматики, площадь микроциркуляторного русла (МЦР) и ультраструктурные особенности предстательной железы у мужчин с различной массой тела при ДГПЖ. Материалы и методы. Пациенты (п=131) с ДГПЖ по индексу массы тела были разделены на 3 группы: группа 1 - нормальная масса тела (п=38); группа 2 - избыточная масса тела (п=55); группа 3 - ожирение 1-й степени (п=38). 100 пациентов были анкетированы опросниками 1РББ и 0>оЬ. У части мужчин интраоперационно забирался фрагмент хирургической капсулы простаты. Гистологический материал для проведения световой и электронной микроскопии, а также имму-ногистохимического выявления СБ31 подготавливался стандартно. Результаты. Пациенты 2-й и 3-й групп отмечают более низкое качество жизни ^оЬ) и более выраженную симптоматику нижних мочевых путей (СНМП). У данных мужчин увеличивается доля соединительной ткани вокруг концевых отделов желез на 18,5 и 19 % соответственно. Относительная площадь микрососудов при избыточной массе тела снижается более чем в 2 раза, а при ожирении 1-й степени - в 4 раза. Электронная микроскопия выявила увеличенное количество кол-лагеновых волокон вокруг сосудов МЦР. Выводы. Увеличение массы тела отягощает клиническое течение ДГПЖ за счет усиления выраженности СНМП, вызывает уменьшение площади сосудов МЦР и увеличение доли соединительной ткани в компонентах простаты.
Предстательная железа, симптомы нижних мочевых путей, морфометрия, ДГПЖ, индекс массы тела, эндотелиальный фактор СБ31, микрососуды
Короткий адрес: https://sciup.org/14132311
IDR: 14132311 | DOI: 10.34014/2227-1848-2024-4-122-132
Текст научной статьи Особенности ультраструктуры и микроциркуляторного русла простаты при ДГПЖ у мужчин с различной массой тела
Введение. Среди заболеваний предстательной железы доброкачественная гиперплазия (ДГПЖ) является одним из наиболее распространенных и влияющих на качество жизни мужчин. Имеется четкая связь ДГПЖ с возрастным фактором: чем старше мужчина, тем выше вероятность выявления данного заболевания [1]. Увеличение средней продолжитель- ности жизни мужчин привело к росту числа пациентов с симптоматической ДГПЖ, нередко требующей хирургического лечения.
Изучение факторов инициации и прогрессии данной патологии продолжается длительное время. По результатам многих исследований доказана полиэтиологичность ДГПЖ. Среди ведущих причинных факторов особенно выделяют гормональные [2], возрастные, алиментарные и метаболические, в т.ч. и ожирение [3, 4].
Принято считать, что нарушение соотношения мужских и женских половых гормонов является одной из основных причин развития ДГПЖ. С возрастом баланс между этими гормонами смещается в сторону преобладания эстрогенов, что способно инициировать гиперплазию простаты. В условиях ожирения, когда количество жировой ткани увеличивается, гормональный дисбаланс нарастает за счет той доли эстрогенов, которые вырабатываются в белой жировой ткани из андрогенов. Кроме этого, инсулинорезистентность и гипе-ринсулинемия, которые сопровождают ожирение, усугубляют эндокринные сдвиги и ускоряют патогенетические механизмы развития ДГПЖ. В настоящее время избыточная масса тела и ожирение рассматриваются не просто как повышенное накопление в организме белой жировой ткани, но прежде всего как состояние, вызывающее повреждение сосудистой системы, что приводит к развитию эндотелиальной дисфункции, а также формирует хроническое воспаление в органах и тканях, в т.ч. и в предстательной железе [5]. Повреждение сосудов вызывает тканевую гипоксию, при которой в органах инициируется клеточная пролиферация, приводящая к нарушению нормальной структурной организации, в т.ч. за счет фиброза. В предстательной железе происходит пролиферация эпителия концевых отделов желез и/или стромальных клеток транзиторной зоны [6]. Понимание основных процессов, протекающих в тканях и клетках предстательной железы при ДГПЖ, позволит расширить представление о клинических особенностях течения заболевания.
Цель исследования. Оценить выраженность клинической симптоматики, площадь микроциркуляторного русла (МЦР) и уль-траструктурные особенности компонентов предстательной железы у мужчин с различной массой тела при ДГПЖ.
Материалы и методы. В исследовании принял участие 131 мужчина с диагнозом ДГПЖ. Все пациенты получили эндоскопи- ческое, трансуретральное хирургическое лечение.
Больные были разделены на 3 группы по индексу массы тела (ИМТ): 1-я группа включала 38 (29 %) мужчин с нормальной массой тела (ИМТ 18-24,9), 2-я группа - 55 (42 %) мужчин с избыточной массой тела (ИМТ 25–29,9), а 3-я группа - 38 (29 %) мужчин с ожирением 1-й степени (ИМТ 30-34,9). По возрасту и объему простаты, оцененному при ультразвуковом исследовании, пациенты не имели статистически значимых отличий (p>0,05). 100 (76 % от всех обследованных) пациентов с сохранным самостоятельным мочеиспусканием приняли участие в анкетировании с использованием Международной шкалы простатических симптомов (IPSS) и Шкалы качества жизни (QoL).
Обследование проводили с соблюдением Этических принципов проведения научных медицинских исследований с участием человека и в соответствии с Правилами клинической практики в Российской Федерации; все обследованные мужчины дали информированное согласие на участие.
Для исследования структуры предстательной железы у части пациентов, выбранных случайным образом, интраоперационно был забран фрагмент хирургической капсулы простаты. Для гистологического исследования материал забирали у 6 (19,4 %) пациентов 1-й группы, 15 (46,88 %) пациентов 2-й группы и 10 (31,25 %) пациентов 3-й группы. При подготовке гистологического материала фрагменты предстательной железы фиксировали в забуференном формалине, выполнялась стандартная проводка и заливка в гистомикс.
Толщина готовых срезов составила 5 мкм. Иммуногистохимическое (ИГХ) исследование эндотелиального фактора CD31+ (клон JC70A) проводили с помощью готовых к использованию первичных моноклональных антител (Da-ko Cytomation, Дания) согласно инструкции производителя. АГ-позитивные эндотелио-циты в составе МЦР простаты определялись по характерному коричневому окрашиванию при световой микроскопии и увеличении ×100 (микроскоп Primo Star, Zeiss, Германия). Обсчет количества сосудов осуществлялся мето- дом точечного счета в квадратной тестовой системе на 88 точек в 40 изображениях на группу. Морфометрическое исследование проводилось в 2 структурных компонентах простаты: в фиброзно-мышечной строме простаты, где учитывалась относительная площадь МЦР и площадь мышечно-фиброзной стромы, и в железистомышечных комплексах, где определялись относительные площади четырех структурных компонентов: сосудов МЦР, просвета и эпителиальной выстилки концевых отделов желез, а также мышечно-соединительнотканного компонента, окружающего базальную мембрану желез.
Статистическая обработка данных морфометрического исследования проводилась с использованием лицензионного пакета Excel MSOffice 2016 и SPSS Statistics 22. Полученные показатели проверяли на нормальность распределения с использованием критерия Колмогорова – Смирнова. При негауссовом распределении показателей выборки использовали U-критерий Mann – Whitney с поправкой Бонферрони. Количественные показатели представлены в виде среднего значения, медианы Mе и межквартильного интервала [Q1; Q3], а также минимальных и максимальных значений выборки. При проведении статистического анализа критический уровень значимости р принимался ≤0,05.
Результаты и обсуждение. При проведении анкетирования пациентов в группах были выявлены различия в выраженности клинической симптоматики. Так, в 1-й группе симптомы нижних мочевых путей, по данным шкалы IPSS, были менее выражены, чем в группах с избыточной массой тела и ожирением 1-й степени: 16,86, 20,49 (p<0,05) и 22,2 балла (p<0,05) соответственно.
При оценке обструктивной симптоматики по шкале IPSS выявлено, что в 1-й группе симптомы опорожнения были менее выражены, чем во 2-й и 3-й группах: 9,75, 12,89 (p≤0,001) и 13,26 балла (p<0,001) соответственно. Ирритативную симптоматику пациенты первой группы отмечали чаще, чем третьей, но не второй: 7,11 балла в 1-й группе, 7,59 – во 2-й (p>0,05) и 8,94 (p<0,05) – в 3-й.
При сравнении 2-й и 3-й групп различий по общему баллу и обструктивной симптоматике не выявлено (p>0,05), но выявлена достоверная разница в ирритативных нарушениях (p<0,05).
Качество жизни пациентов 2-й и 3-й групп, по данным шкалы QOL, было ниже, чем в 1-й: 4,18 балла – в 1-й группе, 4,73 – во 2-й (p<0,05) и 5 – в 3-й (p<0,05). Значимой разницы в показателях качества жизни у пациентов 2-й и 3-й групп не выявлено (p>0,05) (табл. 1).
Таблица 1
Table 1
|
Показатель Parameter |
Группа 1 Group 1 |
Группа 2 Group 2 |
Группа 3 Group 3 |
p 1-2 |
p 1-3 |
p 2-3 |
|
Общий балл IPSS |
16,86 [11,0; 21,5] |
20,49 [19,0; 23,0] |
22,20 [18,0; 26,0] |
p<0,05 |
p<0,05 |
p>0,05 |
|
Обструктивная симптоматика Obstructive symptoms |
9,75 [7,5; 12,0] |
12,89 [11,0; 15,0] |
13,26 [11,0; 16,0] |
p≤0,001 |
p<0,001 |
p>0,05 |
|
Ирритативная симптоматика Irritative symptoms |
7,11 [4,0; 9,0] |
7,59 [7,0; 9,0] |
8,94 [7,0; 10,0] |
p>0,05 |
p<0,05 |
p<0,05 |
|
Шкала QoL QoL scale |
4,18 [3,0; 5,0] |
4,73 [4,0; 5,0] |
5,00 [4,0; 6,0] |
p<0,05 |
p<0,05 |
p>0,05 |
Результаты анкетирования пациентов, баллов Results of patient survey (IPSS, QoL)
МЦР простаты оценивалось путем световой микроскопии после проведенного ИГХ-выявления CD31+-эндотелиоцитов. CD31 (или PECAM-1 – platelet/endothelial cell adhesion molecule 1) является гликозилированным трансмембранным гомофильным белком адгезии, который в значительном количестве экспрессируется в эндотелиоцитах, необходим для миграции лейкоцитов и играет ключевую роль в удалении старых нейтрофилов [7].
При выявлении СD31+-сосудов МЦР в соединительной ткани, окружающей конце- вые отделы простатических желез, были определены три характерных варианта плотности расположения сосудов.
Выявлялись концевые отделы желез, окруженные микрососудами, расположенными в два яруса, при этом первый ярус был приближен к базальной мембране концевого отдела железы. Второй капиллярный слой располагался в наружных слоях соединительной ткани, окружающей концевые отделы желез (рис. 1 А, Б).
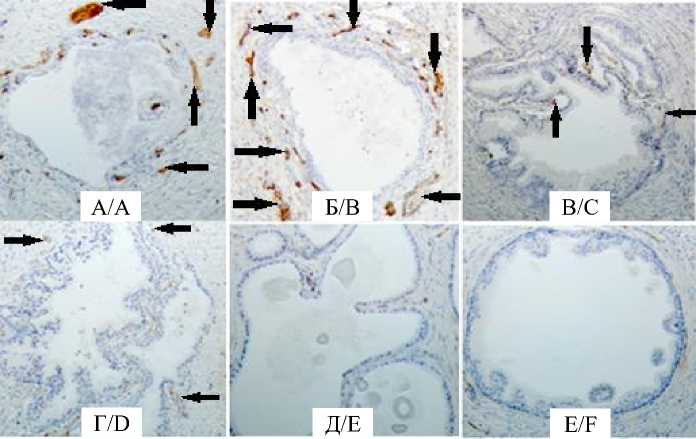
Рис. 1. Расположение сосудов МЦР в два слоя (А, Б), единичные микрососуды (В, Г) и бессосудистые пространства (Д, Е) вокруг концевых отделов простатических желез. ИГХ-исследование экспрессии маркеров CD31, докраска ядер гематоксилином Майера, ув. ×100
Fig. 1. Two-layer arrangement of microvascular vessels (A, B), single microvessels (C, D) and avascular spaces (E, F) around adenomeres of the prostate glands. IHC study of CD31 expression, Mayer’s hematoxylin stain, 100× magnification
Кроме такого варианта расположения микрососудов, во всех группах выявлялось обеднение МЦР вокруг концевых отделов желез. При этом более часто во 2-й и 3-й группах определялись одноэтажные картины с редким расположением сосудов МЦР (рис. 1 В, Г), окружающих концевые отделы простатических желез.
Вокруг кистозно-расширенных концевых отделов с частичной атрофией эпителия и истончением стенки железы, а также вокруг желез, в просвете которых происходит сгущение секрета и образование амилоидных телец в составе секрета простаты, также наблюдается обеднение рисунка микрососудистого русла.
Отмечается разрежение сосудов МЦР. Вместо двухэтажных разветвленных сетей формируются одноэтажные капиллярные с очень редким расположением микрососудов под базальной мембраной концевых отделов желез, выявляются лишенные сосудов бессосудистые участки (рис. 1 Д, Е). С функциональной точки зрения перерастянутые, увеличенного диаметра, дилатированные концевые отделы желез отражают снижение реологических свойств секрета и затруднение его перемещения по протокам простаты.
При электронной микроскопии в соединительной ткани вокруг концевых отделов про- статических желез в увеличенном количестве щие базальную мембрану гемокапилляров выявляются коллагеновые волокна, окружаю (рис. 2).
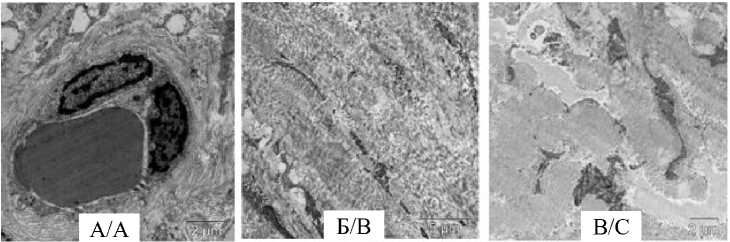
Рис. 2. Увеличенное количество коллагеновых волокон в перикапиллярном пространстве в составе железисто-соединительного отдела предстательной железы (А) и в фиброзно-мышечном компоненте предстательной железы у пациентов 3-й группы: Б – продольный срез; В – поперечный срез. Ув. ×7500
Fig. 2. Increased amount of collagen fibers in the pericapillary space in the glandular and connective tissues of the prostate gland (A) and in the fibromuscular component of the prostate gland in Group 3 patients: B – longitudinal section; C – cross section. 7500× magnification
Определение CD31+-структур в мышечнофиброзных компонентах простаты у пациентов 2-й и 3-й групп позволило выявить микрососуды, чаще всего имеющие не округлую, а уз- кую, сжатую, линейную форму (рис. 3 А, В). Суженные, уплощенные гемокапилляры также выявлялись и при электронно-микроскопическом исследовании (рис. 3 В, Г).
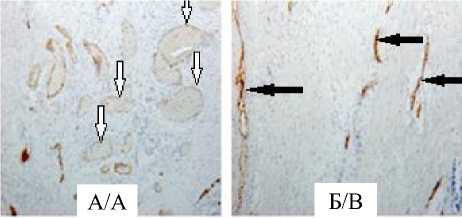
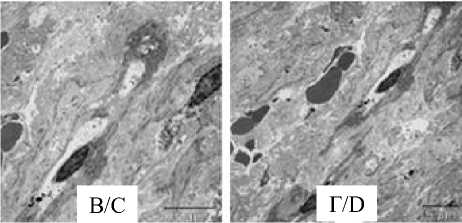
Рис. 3. Поперечные срезы сосудов МЦР в мышечно-фиброзном компоненте простаты у пациента 1-й группы (белые стрелки с черным контуром) (А) и пациента 3-й группы (черные стрелки) (Б). ИГХ-исследование экспрессии маркеров CD31, докраска ядер гематоксилином Майера, × 100.
Узкие уплощенные гемокапилляры, вытянутые вдоль оси расположения коллагеновых волокон, фибробластов и гладких миоцитов в строме мышечно-соединительнотканного модуля простаты (В, Г).
Увел. × 3000
Fig. 3. Cross sections of microvascular vessels in the muscular and fibrous prostate component in Group 1 patient (white arrows) (A), and in Group 3 patient (black arrows) (B). IHC study of CD31 expression, Mayer’s hematoxylin stain, 100× magnification. Narrow flattened hemocapillaries, elongated along the axis of collagen fibers, fibroblasts and smooth myocytes in the stroma of the musculoskeletal prostate tissue module (C, D).
3000× magnification
Морфометрия структур железистого компонента простаты (просвет желез, эпителий, выстилающий концевые отделы желез) показала, что достоверные различия их относительных площадей во всех 3 группах отсут- ствуют. В то время как площадь соединительной ткани, окружающей концевые отделы желез, у мужчин 2-й и 3-й групп значимо превышает таковую в 1-й группе – на 18,5 % и 19 % соответственно (рис. 4 А).
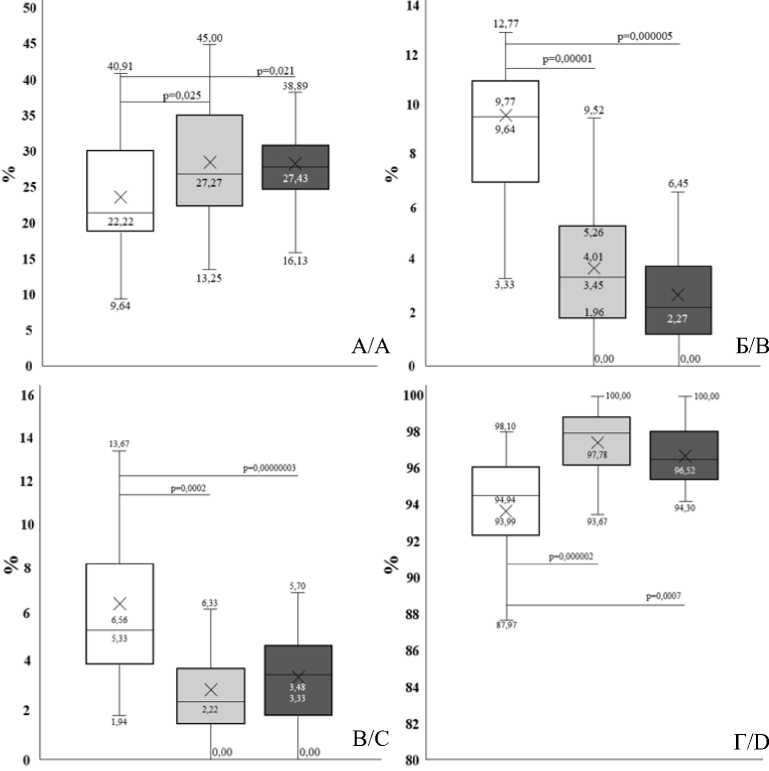

Группы падиентов: Нормальный вес Избыточная масса тела Ожирение 1 ст.
Groups of patients: Normal weight Overweight 1st class obesity
Рис. 4. Показатели морфометрии предстательной железы: площадь соединительной ткани вокруг концевого отдела простатических желез (А); площадь микрососудов в мышечно-железистом компоненте (B); площадь сосудов микроциркуляторного русла в мышечно-фиброзном модуле (С); площадь соединительной ткани в мышечно-фиброзном модуле простаты (D)
Fig. 4. Parameters of prostate gland morphometry: the area of connective tissue around the adenomere of the prostate glands (A); area of microcirculatory vessel in the muscular and glandular component (B); area of microvasculature vessels in the muscular and fibrous module (C); area of connective tissue in the muscular and fibrous prostate module (D)
Общее количество концевых отделов желез с обеднением микрососудистого русла значимо растет во 2-й и 3-й группах. У пациентов с избы- точной массой тела относительная площадь сосудов МЦР снижается более чем в 2 раза, а при ожирении 1-й степени – в 4 раза (рис. 4 Б).
При морфометрии мышечно-фиброзного отдела простаты выявлено, что доля сосудов МЦР в 1-й группе имеет тенденцию к превышению показателей 2-й и 3-й групп 2 раза (рис. 4 В).
Площадь соединительной ткани в мышечнофиброзном модуле простаты значимо увеличивается у мужчин при ожирении 1 степени (рис. 4 Г).
При электронно-микроскопическом исследовании мышечно-фиброзного модуля простаты выявлено увеличение количества коллагеновых волокон, среди массивных скоплений которых расположены узкие прослойки гладких миоцитов у пациентов 2-й и преимущественно 3-й групп (рис. 2).
Полученные результаты морфометрии простаты свидетельствуют о том, что уменьшение плотности сосудов МЦР в компонентах предстательной железы более выражено у пациентов, имеющих избыточную массу тела. Системный эффект жировой ткани в научной литературе известен как «липоток-сичность», которая реализуется и через негативное местное воздействие адипоцитов, расположенных внутри паренхиматозных органов (цитокиновые реакции, нарушение термообмена в органе и т. д.), и за счет системного негативного влияния свободных радикалов и продуктов перекисного окисления липидов и свободных жирных кислот (мем-брано-дестабилизирующие процессы в клетках) [8, 9]. Доказано, что ожирение является фактором риска развития ДГПЖ [10] и тесно связано с рядом установленных сердечно-сосудистых факторов риска, включая сахарный диабет, инсулинорезистентность, атеросклероз, дислипидемию и гипертонию, которые кумулятивно повреждают эндотелий сосудов [11], приводя к развитию эндотелиальной дисфункции. Выраженное потенцирование эндотелиальной дисфункции и расстройства микрососудистой реактивности приводят к повышенному фиброзообразованию в предстательной железе [12]. Нарушения функционирования NО-синтаз и вызванный ими дефицит оксида азота (NО), будучи проявлением эндотелиальной дисфункции, могут играть важнейшую роль в другом возможном этиологическом механизме простатической пролифера- ции - развитии тазового и простатического атеросклероза, вызывающего ишемию мочевого пузыря и предстательной железы [13].
Хроническая простатическая ишемия приводит к фиброзу железы. В нашем исследовании, по данным морфометрии, хроническая простатическая ишемия проявила себя увеличением доли соединительной ткани в мышечно-железистом и мышечно-фиброзном модулях простаты. Выявление увеличенного количества коллагеновых волокон в перикапиллярных пространствах и в составе мышечнофиброзных компонентов при электронной микроскопии также расценено как подтверждение развития фиброзных изменений.
Заключение. Полученные данные свидетельствуют о том, что повышение массы тела отягощает клиническое течение ДГПЖ. Это в первую очередь проявляется в усилении симптоматики нарушенного мочеиспускания, следствием чего является ухудшение субъективной оценки качества жизни пациентом. Кроме того, проведенное исследование показало возможность использования ИГХ-метода выявления CD31 для оценки МЦР в компонентах предстательной железы.
При световой и электронной микроскопии выявлены структурные изменения, сопровождающие избыточную массу тела у пациентов с ДГПЖ. Такие морфологические находки, как уменьшение плотности сосудистого русла, появление бессосудистых участков, увеличение доли соединительной ткани, по нашему мнению, являются проявлением фиброза в компонентах простаты. Выявленные тенденции нарастающих морфологических трансформаций, усугубления клинических проявлений симптомов нижних мочевых путей при повышении массы тела у пациентов с ДГПЖ можно расценить как дополнительный, не полностью оцененный фактор патогенеза этого заболевания.
Более глубокое понимание механизмов развития патологии предстательной железы при избыточной массе тела и ожирении могло бы заложить основу для разработки новых маркеров, прогностических индикаторов, лекарственных средств, а также скорректировать показания к оперативному лечению ДГПЖ.
Список литературы Особенности ультраструктуры и микроциркуляторного русла простаты при ДГПЖ у мужчин с различной массой тела
- Аляев Ю.Г., Глыбочко П.В., Пушкарь Д.Ю. Урология. Российские клинические рекомендации. М.: Медфорум; 2С17. 544.
- Золотухин О.В., Есин А.В., Мадыкин Ю.Ю. Патогенетическое обоснование использования ингибиторов 5-альфа редуктазы в лечении доброкачественной гиперплазии предстательной железы. Экспериментальная и клиническая урология. 2022; 15 (3): 94-101. DOI: https://doi.org/10.29188/ 2222-8543-2022-15-3-94-101.
- De Nunzio C., Giglio S., Baldassarri V., Cirombella R., Mallel G., Nacchia A. Impairment of autophagy may represent the molecular mechanism behind the relationship between obesity and inflammation in patients with BPH and LUTS. Minerva Urol Nephrol. 2021; 73 (5): 631-637. DOI: https://doi.org/ 10.23736/S2724-6051.20.03992.
- Xue B., Wu S., Sharkey C., Tabatabaei S., Wu C.L., Tao Z. Obesity-associated inflammation induces androgenic to estrogenic switch in the prostate gland. Prostate Cancer Prostatic Dis. 2020; 23 (3): 465474. DOI: https://doi.org/10.1038/s41391-020-0208-4.
- Тюзиков И.А., Калинченко С.Ю. Доброкачественная гиперплазия предстательной железы как системное гормонально-метаболическое заболевание: время изменить парадигмы патогенеза и фармакотерапии. Эффективная фармакотерапия. 2С16; 33 (4): 32-53.
- Панферов А.С., Котов С.В., Юсуфов А.Г., Елагин В.В., Бекреев Е.А., Бадаква Г.В., Семенов А.П. Лапароскопическая трансвезикальная аденомэктомия при крупных и гигантских размерах предстательной железы. Экспериментальная и клиническая урология. 2С22; 15 (1): 1С2-110. DOI: https://doi.org/10.29188/2222-8543-2022-15-1-102-110.
- Гончаров Н.В., Попова П.И., Головкин А.С., Залуцкая Н.М., Пальчикова Е.И., Занин К.В., Авдонин П.В. Дисфункция эндотелия сосудов - патогенетический фактор в развитии нейродегенера-тивных заболеваний и когнитивных расстройств. Обозрение психиатрии и медицинской психологии им. В.М. Бехтерева. 2020; 3: 11-26. DOI: https://doi.org/10.31363/2313-7053-2020-3-11-26.
- Schaffer J.E. Lipotoxicity: when tissues overeat. Curr Opin Lipidol. 2003; 14 (3): 281-287. DOI: https://doi.org/10.1097/00041433-200306000-00008.
- Тюзиков И.А., Мартов А.Г., Греков Е.А. Взаимосвязь компонентов метаболического синдрома и гормональных нарушений в патогенезе заболеваний предстательной железы. Экспериментальная и клиническая урология. 2012; 3: 39-46.
- Parikesit D., Mochtar C.A., Umbas R., HamidA.R. The impact of obesity towards prostate diseases. Prostate Int. 2016; 4 (1): 1-6. DOI: https://doi.org/10.1016/j.prnil.2015.08.001.
- Meyers M.R., Gokce N. Endothelial dysfunction in obesity: etiological role in atherosclerosis. Curr Opin Endocrinol Diabetes Obes. 2007; 14 (5): 365-369. DOI: https://doi.org/10.1097/MED.0b013e3282be90a8.
- Ляшенко В.В., Асфандияров Ф.Р., Полунина Е.А. Взаимосвязи между показателями микрососудистой реактивности, маркерами эндотелиальной дисфункции и фиброза у пациентов с доброкачественной гиперплазией предстательной железы. Международный журнал прикладных и фундаментальных исследований. 2С2С; 8: 17-21.
- Azadzoi K.M., Babayan R.K., Kozlowski R., Siroky M.B. Chronic ischemia increases prostatic smooth muscle contraction in the rabbit. J Urol. 2003; 170 (2 Pt 1): 659-963. DOI: https://doi.org/10.1097/ 01.ju.0000064923.29954.7e.


