Особенности ультраструктуры нейронов неокортекса 5-суточных крыс в условиях пренатальной алкоголизации
Автор: Бонь Е.И., Зиматкин С.М.
Журнал: Тюменский медицинский журнал @tmjournal
Статья в выпуске: 1 т.23, 2021 года.
Бесплатный доступ
Цель работы - изучение ультраструктуры внутренних пирамидных нейронов неокортекса 5-суточных крысят после антенатальной алкоголизации. Исследования выполнены на самках беспородных белых крыс с начальной массой 230 ± 20 г и их потомстве. Пренатальная алкоголизация вызывает глубокие и разнообразные ультраструктурные изменения пирамидных нейронов неокортекса 5-суточных крыс. Причем эти нарушения выглядят не только как следствие прямого повреждающего действия алкоголя, его метаболита ацетальдегида или вызываемого ими окислительного стресса на мембраны и органеллы нейронов в процессе эмбриогенеза, но и как нарушение определенной «программы» развития» нейронов коры головного мозга.
Пренатальная алкоголизация, неокортекс, нейроны, ультраструктура
Короткий адрес: https://sciup.org/140303373
IDR: 140303373 | DOI: 10.36361/2307-4698-2020-23-1-35-38
Текст научной статьи Особенности ультраструктуры нейронов неокортекса 5-суточных крыс в условиях пренатальной алкоголизации
Актуальность. Пренатальная алкоголизация приводит к ряду специфических нарушений в организме потомства, объединяемых в понятие «фетальный алкогольный синдром», входящий в «спектр нарушений плода, вызванных алкоголем». Негативные последствия воздействия алкоголя на развивающийся мозг плода включают структурные аномалии головного мозга, неврологические, поведенческие и когнитивные дефекты. Кора головного мозга особенно чувствительна к антенатальному воздействию этанола. Оно вызывает уменьшение числа и размеров пирамидных нейронов, снижение в них содержания белка и недоразвитие цитоплазмы, глубокие инвагинации ядерной оболочки, распад цистерн комплекса Гольджи на вакуоли, набухание митохондрий, увеличение числа патологических форм нейронов [1-10,13]. В наших предыдущих исследованиях потребление алкоголя крысами во время беременности вызывало утолщение коры и набухание пирамидных нейронов коры головного мозга их потомства на 5 сутки постнатального развития, выявляемые при гистологическом исследовании на светооптическом уровне [15,16,17].
Вместе с тем, представляло интерес выяснение особенностей ультраструктуры нарушений этих набухших нейронов.
Цель работы – изучение ультраструктуры внутренних пирамидных нейронов неокортекса 5-суточных крысят после антенатальной алкоголизации.
Методика эксперимента. Исследования выполнены на самках беспородных белых крыс с начальной массой 230 ± 20 г и их потомстве. Все опыты проведены с учетом «правил проведения работ с использованием экспериментальных животных». На данное исследование получено разрешение комитета по биомедицинской этике Гродненского государственного медицинского университета (протокол № 1, от 11.03.2014).
Животные находились на стандартном рационе вивария. Крысы опытной группы на протяжении всей беременности (от дня обнаружения сперматозоидов во влагалищных мазках до родов) получали 15% раствор этанола в качестве единственного источника питья, а животные контрольной группы – эквиобъемное количество воды. Среднее потребление алкоголя беременными самками составляло 4 ± 2 г/кг/сутки. Забой крысят осуществлялся на 5-е сутки после рождения. Расположение лобной коры в гистологических препаратах головного мозга крыс определяли с помощью стереотаксического атласа [12]. Лезвием вырезали нужные участки коры и помещали их в 1% осмиевый фиксатор на буфере Миллонига (рН = 7,4) на 2 часа при температуре +4º С. Далее их промывали в смеси буфера Миллонига (20 мл) и сахарозы (900 мг), обезвоживали в спиртах возрастающей концентрации, смеси спирта и ацетона и ацетоне, проводили через смесь смол (аралдит М + аралдит Н + дибутилфталат + ДМР-30) и ацетона и заключали в эту заливочную смесь смол. Полутонкие срезы (толщиной около 0,35 мкм) изготавливали на ультрамикротоме МТ-7000 (RMC, США), окрашивали метиленовым синим и вырезали лезвием необходимые для изучения участки внутреннего пирамидного слоя. Ультратонкие срезы (толщиной около 35 нм) изготавливали на том же ультрамикротоме, собирали на опорные сеточки, контрастировали ацетатом урана и цитратом свинца. Для этого сеточки со срезами опускали в каплю уранилацетата и выдерживали 20 минут в темноте при комнатной температуре, затем промывали в 3-х порциях бидистиллированной воды по 5 секунд и контрастировали цитратом свинца в течение 8 минут, промывали в 3-х порциях бидистиллированной воды по 5 секунд. Полученные препараты изучали в электронном микроскопе JEM-1011 (JEOL, Япония) и фотогра- фировали цифровой камерой Olympus MegaView III (Olympus Soft Imaging Solutions, Германия).
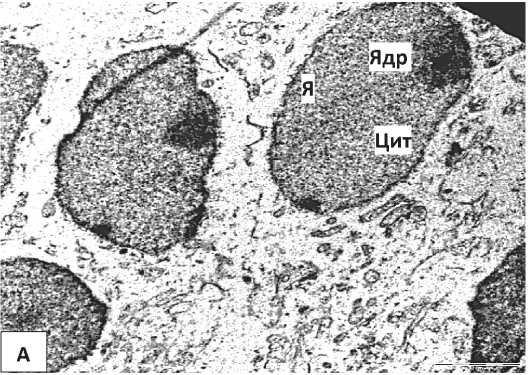
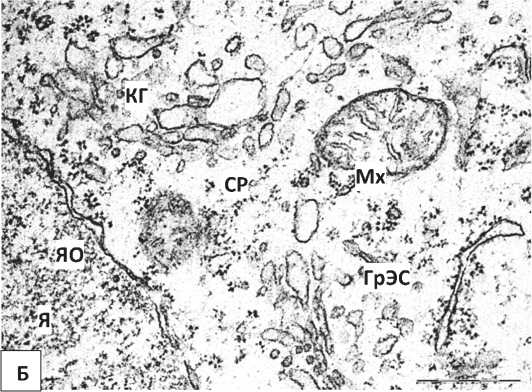
Результаты и их обсуждение. У 5-суточных контрольных крыс во внутреннем пирамидном слое лобной коры преобладают нормохромные нейроны (Рисунок 1, А). Для них характерно наличие крупного, богатого эухроматином клеточного ядра с эксцентрично расположенным ядрышком. Небольшие глыбки гетерохроматина располагаются равномерно по всей кариоплазме, наблюдалось расширение перинуклеарного пространства (Рисунок 1, А). В цитоплазме выявляются канальцы гранулярной эндоплазматической сети (ГрЭС) с небольшим количеством рибосом и умеренное количество митохондрий, чьи кристы не всегда хорошо выражены. Выявлены были и делящиеся митохондрии (Рисунок 1, Б, В). Цистерны комплекса Гольджи на данном этапе постнатального развития еще не сформированы. В цитоплазме диффузно распределены свободные рибосомы в умеренном количестве (Рисунок 1, Б, В).
У нейроны 5-суточных крысят, перенесших пренатальную алкоголизацию, выявлено расширение перинуклеарного пространства и эксцентрическое расположение ядрышка. Цитоплазма некоторых нейронов бедна органеллами (Рисунок 2, Б), а в цитоплазме других клеток увеличивается относительное количество свободных рибосом. Цистерны ГрЭС часто образуют необычную сетевидную структуру, просвет их канальцев иногда неравномерно сужается и расширяется. Наблюдался полиморфизм митохондрий, их гипертрофия (Рисунок 3).
В целом, нейроны контрольных животных имели нормальную ультраструктуру, типичную для больших пирамидных нейронов коры мозга крыс на 5-е сутки постнатального развития [14]. Расширение перинуклеарного пространства и эксцентрическое расположение ядрышка могут свидетельствовать об активном метаболизме развивающихся нейронов в раннем онтогенезе.
В наших предыдущих исследованиях на светооптическом уровне у 5-суточных крысят было выявлено уменьшение общего количества нейронов, а также увеличение размеров и набухание сохранившихся клеток [15, 16, 17].
Дезорганизацию цистерн эндоплазматического ретикулума, гиперплазию и неравномерное их расширение, а также гипертрофию митохондрий можно рассматривать как проявление внутренних репаративных процессов.
Гипертрофия митохондрий в цитоплазме нейронов соответствует ранее полученным гистохимическим данным об активации в них ферментов, что свидетельствует об увеличении энергообеспеченности клеток [15, 16, 17].
Уменьшение количества рибосом, связанных с ГрЭС, и увеличение количества свободных рибосом указывает на переключение биосинтеза белка для собственных нужд нейронов, что необходимо для их выживания в неблагоприятных условиях.
На ранних этапах постнатального развития преобладают попытки компенсировать негативные процессы антенатального воздействия алкоголя. Грубых нарушений ультраструктуры органелл у крысят 5-дневного возраста не наблюдалось. Однако данные наших исследований последствий употребления алкоголя во время беременности показали,
Я
В
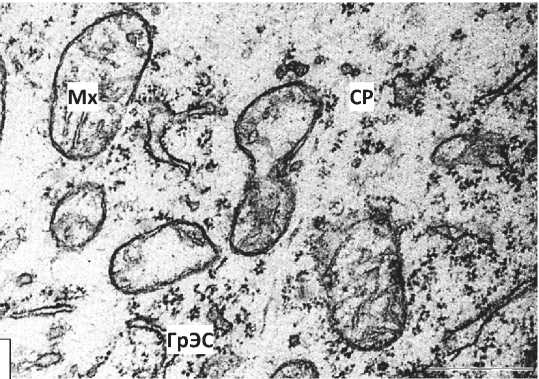
Рисунок 1 – Нейроны внутреннего пирамидного слоя лобной коры контрольных 5-суточных крыс. А – общий вид нейрона. Б, В – фрагменты ядра и цитоплазмы нейрона. Я – ядро, Ядр – ядрышко, ЯО – ядерная оболочка, Цит – цитоплазма, Мх- митохондрии, СР – свободные рибосомы, КГ – комплекс Гольджи. Увеличение: А – 8000, Б, В – 50000. Масштабный отрезок: А -2 мкм, Б, В – 0,5 мкм. Электроннограммы
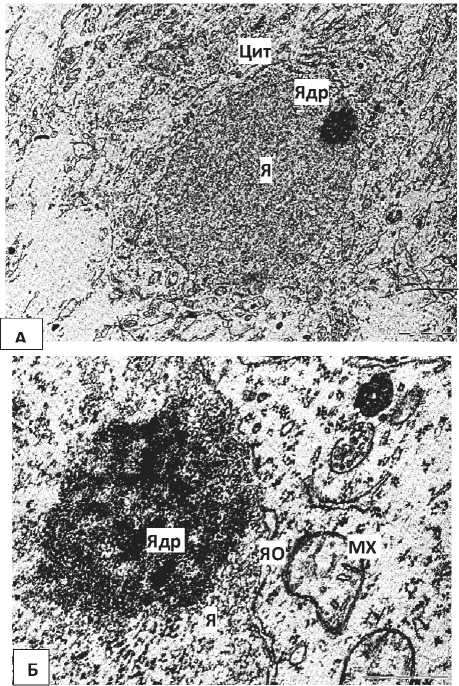
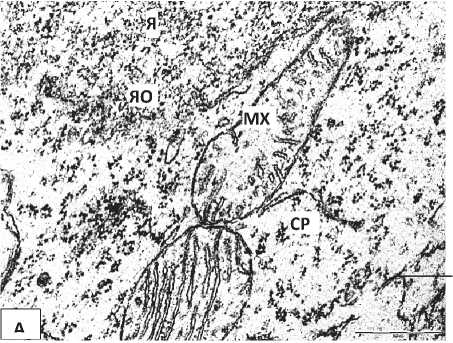
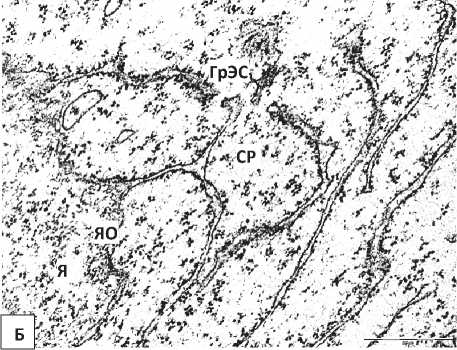
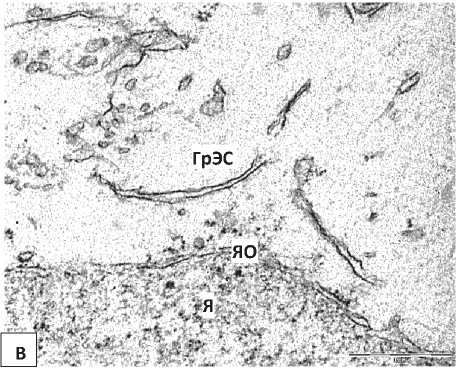
Рисунок 2 – Нейроны внутреннего пирамидного слоя лобной коры 5-суточных крыс, подвергавшихся пренатальной алкоголизации. А – общий вид нейрона. Б, В – фрагменты ядра и цитоплазмы нейрона. Я – ядро, Ядр – ядрышко, ЯО – ядерная оболочка, Цит – цитоплазма, Мх – митохондрии.. Увеличение: А – 8000, Б, В – 50000. Масштабный отрезок: А -2 мкм, Б, В – 0,5 мкм.
Электроннограммы
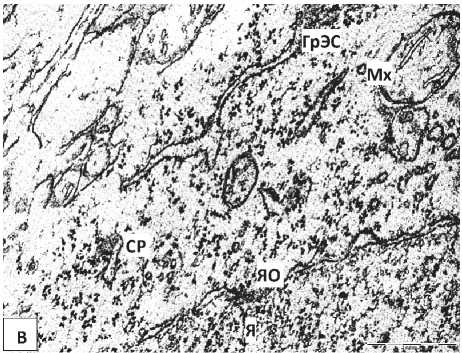
Рисунок 3 – Нейроны внутреннего пирамидного слоя лобной коры 5-суточных крыс, подвергавшихся пренатальной алкоголизации. А, Б, В – фрагменты ядра и цитоплазмы нейрона. Я – ядро, Ядр – ядрышко, ЯО – ядерная оболочка, Цит – цитоплазма, Мх- митохондрии, СР – свободные рибосомы. Увеличение: А, Б, В – 50000. Масштабный отрезок: А, Б, В – 0,5 мкм.
Электроннограммы
что антенатальное воздействие алкоголя приводит к значительным качественным и количественным изменениям постнатального развития органелл внутренних пирамидных нейронов неокортекса крыс. Так, на 20-е, а особенно на 45-е сутки после рождения происходит уменьшение относительного количества митохондрий, количества и длины их крист, что свидетельствует о нарушении энергообеспечения нейронов. Относительное количество свободных рибосом в цитоплазме нейронов коры головного мозга пренатально алкоголизированных крыс не уменьшается с возрастом, а количество связанных рибосом не увеличивается. Это указывает на преобладание биосинтеза белка для собственных нужд перикарио- нов нейронов в ущерб биосинтезу белка для экспорта в их отростки и терминалы. При этом увеличивается количество и размер лизосом, что отражает усиление процессов аутофагии в нейронах [7, 11, 14].
Заключение. Таким образом, пренатальная алкоголизация вызывает глубокие и разнообразные уль-траструктурные изменения пирамидных нейронов неокортекса 5-суточных крыс. Причем эти нарушения выглядят не только как следствие прямого повреждающего действия алкоголя, его метаболита ацетальдегида или вызываемого ими окислительного стресса на мембраны и органеллы нейронов в процессе эмбриогенеза, но и как нарушение определенной «программы» развития» нейронов коры головного мозга в постнатальном онтогенезе, возможно, через генетические и эпигенетические механизмы. Повышенную чувствительность развивающегося мозга к алкоголю можно объяснить особенностями окисления алкоголя как в организме матери во время беременности, так и в мозге плода. Выявленные структурные изменения пирамидных нейронов коры головного мозга могут лежать в основе известных необратимых неврологических и поведенческих нарушений у животных после пренатальной алкоголизации.
Список литературы Особенности ультраструктуры нейронов неокортекса 5-суточных крыс в условиях пренатальной алкоголизации
- Alfonso-Loeches S., Guerri C. Molecular and behavioral aspects of the actions of alcohol on the adult and developing brain // Crit Rev Clin Lab Sci. 2011. V. 48. P. 19-47.
- al-Rabiai S., Miller M. Effect of prenatal exposure to ethanol on the ultrastructure of layer V of mature rat somatosensory cortex // Neurocytol. 1989. V. 18. P. 711-729.
- Brizzee K. R. Early postnatal changes in neuron packing density and volumetric relationships in the cerebral cortex of the white rats // Growth. 1959. V. 23 P. 337-347.
- de la Monte S., Wands J. Role of central nervous system insulin resistance in fetal alcohol spectrum disorders // Popul Ther Clin Pharmacol. 2010. V. 17. P. 390-404.
- Fabregues I., Ferrer I., Gairi J. Effects of prenatal exposure to ethanol on the maturation of the pyramidal neurons in the cerebral cortex of the guinea pig: a quantitative Golgi Study // Neuropathol Appl Neurobiol. 1985. V. 2. P. 291-98.
- Farber N., Creeley C., Olney J. Alcohol-induced neuroapoptosis in the fetal macaque brain // Neurobiol Dis. 2010. V. 40. P. 6-12.
- Lopez Tejero D., Herrera E. Effects of prenatal ethanol exposure om physical growth sensory reflex maturation and brain development in the rat // Neuropathol and appl Neurobiol. 1986. V. 3. P. 251-60.
- Mattson S., Riley E. A review of the neurobehavioral deficits in children with fetal alcohol syndrome or prenatal exposure to alcohol // Alcohol Clin Exp Res. 1988. V. 22. P. 279-294.
- Mattson S., Riley E. Neurobehavioral and Neuroanatomical Effects of Heavy Prenatal Exposure to Alcohol, Washington Press, USA, 1977-195 p.
- Nokelainen P., Heiskala H., Raininko R. Two brothers with macrocephaly, progressive cerebral atrophy and abnormal white matter, severe mental retardation, and Lennox-Gastaut spectrum type epilepsy: an inherited encephalopathy of childhood // Am J Med Genet. 2001. V. 103. P. 198-206.
- Parnavelas J. G. An ultrastructural study of the maturation of neuronal somata in the visual cortex of the rat // Anat. Embriol. 1979. V. 157. P. 311-328.
- Paxinos G., Watson C. The Rat Brain in stereotaxic coordinates. Academic Press, Australia, 1998. 242 p.
- Riley E. P., Infante M. A., Warren K. R. Fetal alcohol spectrum disorders: an overview // Neuropsychology Rev. 2011. V. 21. P. 73-8.
- Sato I., Konishi K., Mikami A. Developmental changes in enzyme activities and in morphology of rat cortex mitochondria // Okajimas Folia Anat Jpn. 2000. V. 76. P. 353-361.
- Zimatkin S. M., Bon L. I. Dinamics of histological changes in the frontal cortex of the brain in rats subjected to antenatal exposure to alcohol // Neurosci Behav Physiol. 2017. V. 47. P. 370-74.
- Zimatkin S. M., Bon L. I. Effects of Antenatal Alcoholization on Brain Cortex Neurons Postnatal Development in Rats // International Journal of Neuroscience and Behavior Studies. 2017. V. 1. P. 7-17.
- Zimatkin S. M., Bon L. I. Maternal alcohol intake induces dramatic ultrastructural changes in offspring brain cortex neurons // Brain and Nerves. 2017. V. 1. P. 1-4.


