Особенности влияния сульфат-ионов на коррозионно-электрохимическое поведение свинца, олова и их сплавов. Диаграммы электрохимического равновесия
Автор: Тюрин Александр Георгиевич, Бирюков Александр Игоревич, Тронов Артем Павлович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 3 т.8, 2016 года.
Бесплатный доступ
Построены диаграммы электрохимического равновесия Е - рН систем Pb -SO42- - H2O, Sn - SO42- - H2O и сплава Pb - Sn - SO42- - H2O. Изучены термодинамические особенности влияния сульфат-ионов на коррозионно-электрохимическое поведение свинца, олова и их сплавов.
Свинец, олово, сульфатные среды, коррозионно-электрохимическое поведения, диаграмма электрохимического поведения
Короткий адрес: https://sciup.org/147160362
IDR: 147160362 | УДК: 541.13:620.173:669.14 | DOI: 10.14529/chem160306
Текст научной статьи Особенности влияния сульфат-ионов на коррозионно-электрохимическое поведение свинца, олова и их сплавов. Диаграммы электрохимического равновесия
Коррозионно-электрохимическое поведение свинца и свинцово-оловянных сплавов с серной кислоте изучено в работах [1, 2]. Авторами установлено, что при анодном окислении свинцово-оловянных сплавов в области потенциалов от минус 0,7 до 0,3 В, в которой происходит образование сульфата свинца, олово присутствует и в пленке, и в электролите. Свинец в электролите не обнаружен. В области потенциалов от 1,9 до 2,4 В. наблюдается аналогичная картина. Сделан вывод о том, что при окислении свинцово-оловянных сплавов происходит активное растворение олова, которое накапливается в анодной пленке и переходит в раствор, повышая при этом пористость образующейся пленки. Происходит увеличение константы диффузионного процесса, что обеспечивает возрастание скорости прохождения сульфат ионов чрез пленку.
В представленных работах показано, что бинарные сплавы Pb–Sn сплавы с содержанием олова 1,5 и 2,0 % обладают наиболее высокой коррозионной стойкостью, а увеличение содержания олова в сплаве до 3 % приводит к сильному снижению стойкости. Также установлено, что при увеличении концентрации олова до 3 % сплав является гетерофазной системой и имеет разу-порядоченную микроструктуру с минимальным размером зерен. В работах методами электронной микроскопии показано, что на поверхности свинцового электрода формируется мелкокристаллическая пленка, в то время как на сплавах, легированных оловом, наблюдаются более крупные кристаллы, что может привести к увеличению пористости пленки.
В литературе отсутствует информация по термодинамическому анализу поведения свинца, олова и их сплавов в серной кислоте. Целью работы было проанализировать диаграммы электрохимического равновесия систем Pb – SO 4 2– – H 2 O, Sn – SO 4 2– – H 2 O и Pb – Sn – SO 4 2– – H 2 O.
Экспериментальная часть
Метод построения диаграмм электрохимического равновесия многокомпонентных металлических и смешанных систем предложен в работе [3]. Для подробного рассмотрения систем Ме – SO 4 2– – H 2 O необходимо проанализировать диаграмму электрохимического равновесия системы SO 4 2– – H 2 O. Данная диаграмма потенциал – рН при 25 ºС, давлении 1 бар (воздух) и a SO42- = 0,1 моль/л была рассчитана авторами и представлена в работах [4].
На ней можно выделить 13 основных областей преобладания фаз и фазовых составляющих системы. В зависимости от рН раствора и потенциала могут протекать катодные реакции восстановления сульфат- или гидросульфат-ионов до сернистой кислоты H2SO3, гидросульфит-ионов HSO 3 –, тетратионат-ионов S 4 O 6 2–, тиосульфат-ионов S 2 O 3 2–, свободной серы S (ромб), сероводородной кислоты H 2 S, гидросульфид-ионов HS– и сульфид-ионов S2–, и анодные реакции окисления сульфат- и гидросульфат-ионов HSO 4 – до персульфат-ионов S 2 O 8 2–.
Стационарный потенциал свинца в сернокислых растворах изменяется в области –0,2…–0,3 В (н.в.э.), что приходится на область термодинамической устойчивости сероводорода. Поэтому в сильнокислых сульфатных растворах необходимо учитывать конкурирующую катодную реакцию восстановления гидросульфат-ионов до сероводорода [5].
Диаграмма электрохимического равновесия свинца в сульфатных растворах приведена на рис. 1.
На данной диаграмме можно выделить 35 областей преобладания. I – Pb + H 2 S + H 2(г) , II – Pb + HS– + H 2(г) , III – Pb + S2– + H 2(г) , IV – PbS + S2– + H 2(г) , V – PbS + HS– + H 2(г) , VI – PbS + H 2 S + H 2(г) , VII – PbS + H 2 S, VIII – PbS + HS–, X – PbS 2 O 3 , XI – PbS + S 2 O 3 2–, XII – PbS + SO 4 2–, XIII – PbS + S 4 O 6 2–, XIV – Pb2+, S 4 O 6 2–, XVI – PbSO 3 , XVII – Pb2+, H 2 SO 3 , XVIII –Pb2+, HSO 4 –, XIX – PbSO 4 + HSO 4 –, XX – PbSO 4 + SO 4 2–, XXI – PbSO 4 *PbO + SO 4 2–, XXII – PbSO 4 *2PbO + SO 4 2– , XXIII – PbSO 4 *3PbO + SO 4 2–, XXIV – PbO + SO 4 2–, XXV – Pb 3 O 4 + SO 4 2–, XXVI – Pb 12 O 17 + SO 4 2–, XXVII – Pb 12 O 19 + SO 4 2–, XXVIII – Pb 12 O 19 + SO 4 2–+O 2(г) , XXXIII – Pb2+ + HSO 4 – +O 2(г) , XXXIV – PbO 2 + HSO 4 – +O 2(г) , XXXV – PbO 2 + S 2 O 8 2–– +O 2(г),
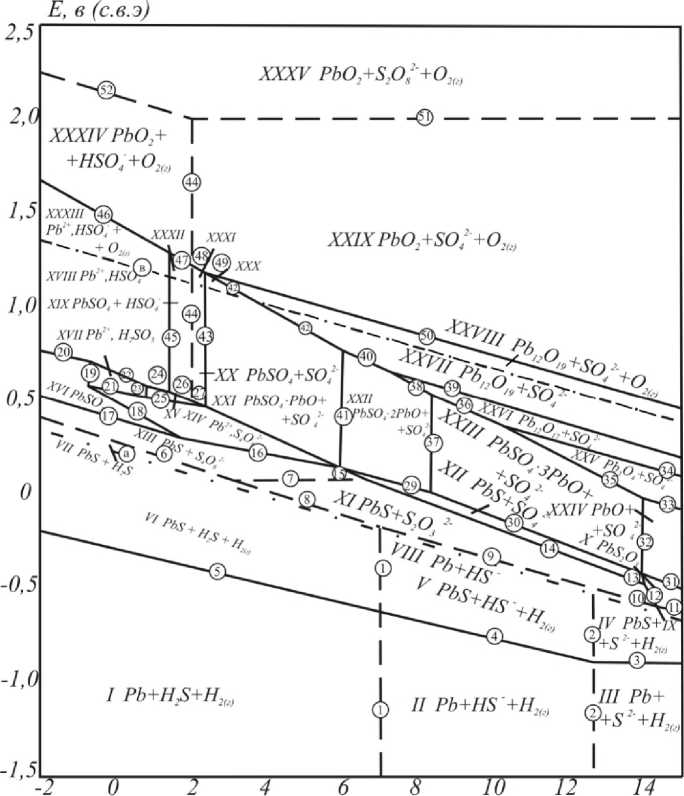
Рис. 1. Диаграмма электрохимического равновесия Е – рН системы Pb – SO 42– – H 2 O при 25 ºС, Р = 1 бар (воздух) и a i = 1 моль/л (негидратированная форма оксидов)
В сульфатсодержащих средах при достаточно отрицательных потенциалах на поверхности свинца может образовываться сульфид свинца PbS во всей области рН. При повышении потенциала в сильнокислых средах присутствует небольшая область активного растворения, а также область существования сульфита свинца PbSO3. Пассивация свинца при анодной поляризации связана с образованием на поверхности в зависимости от рН раствора сульфата свинца PbSO4 в сильнокислых растворах, и смешанных оксидно-сульфатных соединений, образующихся при повышении рН (PbSO4∙PbO; PbSO4∙2PbO; PbSO4∙3PbO). Исключительно оксидная пассивация свин- ца возникает лишь в сильнощелочных средах (рН ≈ 14), а также в щелочных средах при потенциалах положительнее +0,5 В.
На рис. 2. приведена диаграмма электрохимического равновесия олова в сульфатных растворах. На данной диаграмме можно выделить 21 область преобладания. I – Sn (β) + H 2 S + H 2 (г); II – Sn (β) + HS– + H 2 (г); III – Sn (β) + S2– + H 2 (г); IV – SnS + S2– + H 2 (г); V – SnS + HS– + H 2 (г); VI – SnS + H 2 S + H 2 (г); VII – SnO 2 + H 2 S + H 2 (г); VIII – SnO 2 + HS– + H 2 (г); IX – SnO 2 + S2– + H 2 (г); X – SnO 2 + S2–; XI – SnO 2 + HS–; XII – SnO 2 + H 2 S; XIII – SnO 2 + S 4 O 6 2–; XIV – SnO 2 + S 2 O 3 2–; XV – SnO 2 + SO 4 2–; XVI – SnO 2 + HSO 3 –; XVII – SnO 2 + H 2 SO 3 ; XVIII – SnO 2 + HSO 4 –; XIX – SnO 2 + HSO 4 –+ O 2 (г); XX – SnO 2 + SO 4 2–+ O 2 (г); XXI – SnO 2 + S 2 O 8 2– + O 2 (г).
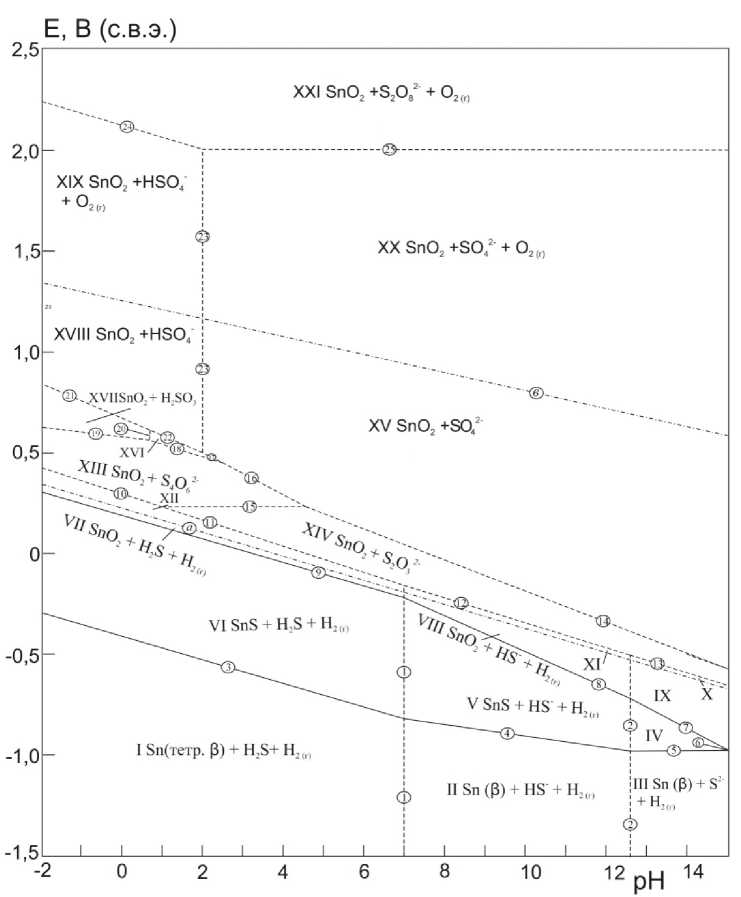
Рис. 2. Диаграмма электрохимического равновесия Е – рН системы Sn – SO 42– – H 2 O при 25 ºС, Р = 1 бар (воздух) и a i = 1 моль/л (негидратированная форма оксидов)
Характерной особенностью коррозионно-электрохимического поведения олова в растворах серной кислоты является также образования сульфида олова SnS при потенциалах ≈ –0,5 В до 0…+0,2 В. При потенциалах выше водородного электрода наблюдается пассивация диоксидом олова SnO 2 вплоть до потенциалов выше +2,0 В. На диаграмме не наблюдается образования таких соединений как сульфиты или сульфаты олова, тем не менее соединения серы претерпевают изменения.
Основные химические и электрохимические равновесия в системе Pb – Sn – SO 4 2– – H 2 O при 25 ºС, давлении 1 бар (воздух) и a i = 1 моль/л, рассчитанные по термодинамическим данным [5], представлены на рис. 3 и в таблице.
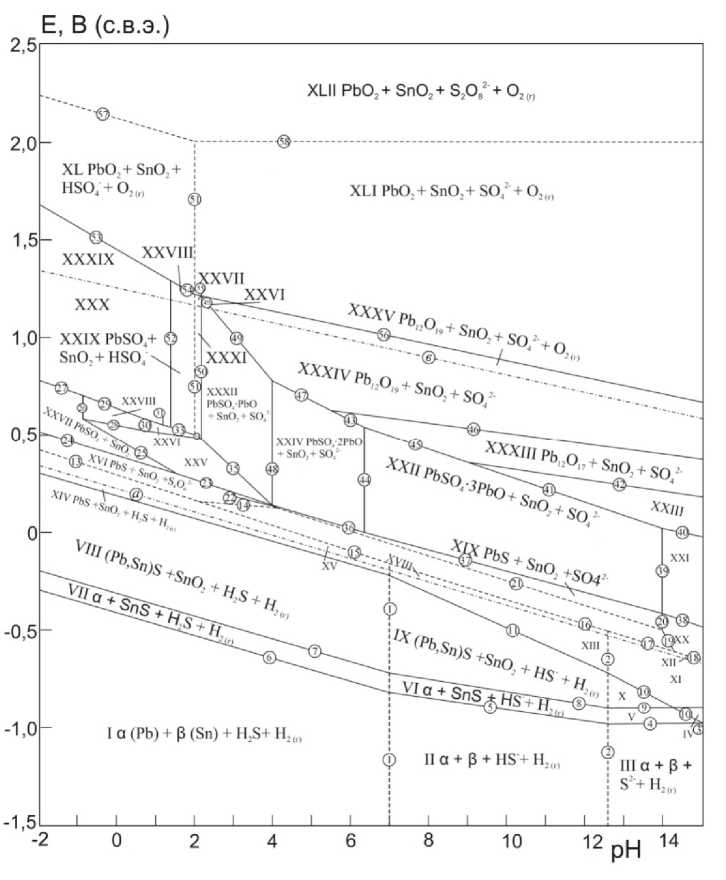
Рис. 3. Диаграмма электрохимического равновесия Е – рН системы Pb –Sn – SO 42– – H 2 O при 25 ºС, Р = 1 бар (воздух) и a i = 1 моль/л (негидратированная форма оксидов)
Основные химические и электрохимические равновесия в системе Pb – Sn – SO 42– – H 2 O при 25 °С, 1 бар (воздух)
|
№ п/п |
Электродная реакция |
Равновесный потенциал, В или рН раствора |
|
a |
2H+ + 2e = H 2 ; P H2 ≈ 5∙10-7 бар |
0,186 – 0,0591рН |
|
b |
О 2 + 4Н+ + 4e = 2H 2 О; P О2 ≈ 0,21 бар |
1,219 – 0,0591рН |
|
1 |
H 2 S ↔ HS– + H+ |
РН = 6,99 + 1g ( a HS - a a H 2 S ) |
|
2 |
HS– ↔ S2– + H+ |
РН = 12,60 + lg ( a 2- att ) S HS |
|
3 |
SnO 2 + 4H+ + 4e = Sn(β) + 2H 2 O; a Sn(β) = 1 |
–0,117 – 0,0591рН |
|
4 |
SnS + 2e = Sn(β) + S2– a Sn(β) = 1 |
-0,998 - 0,02951g a S 2 - |
Продолжение таблицы
|
№ п/п |
Электродная реакция |
Равновесный потенциал, В или рН раствора |
|
5 |
SnS + H+ + 2e = Sn(β) + HS– a Sn(β) = 1 |
–0,626 – 0,0295pH – 0,0295lg a – HS |
|
6 |
SnS + 2H+ + 2e = Sn(β) + H 2 S a Sn(β) = 1 |
–0,419 – 0,0591pH – 0,0295lg a H S |
|
7 |
PbS + 2H+ + 2e = Pb(α) + H 2 S a Pb(α) = 0,97 |
–0,320 – 0,0591pH – 0,0295lg a H S |
|
8 |
PbS + H+ + 2e = Pb(α) + HS– a Pb(α) = 0,97 |
–0,527 – 0,0295pH – 0,0295lg a – HS |
|
9 |
PbS + 2e = Pb(α) + S2– a Pb(α) = 0,97 |
-0,8987 - 0,0295lg a S 2 - |
|
10 |
SnO 2 + S2– + 4H+ + 4e = SnS + 2H 2 O |
-0,764 - 0,1182pH + 0,0295lg a S 2 - |
|
11 |
SnO 2 + HS– + 3H+ + 2e = SnS + 2H 2 O |
0,392 – 0,08865pH + 0,0295lg a – HS |
|
12 |
SnO 2 + H 2 S + 2H+ + 2e = SnS + 2H 2 O |
0,185 – 0,0591pH + 0,0295lg a H S |
|
13 |
S 4 O 6 2– + 20H+ + 18e = 4H 2 S + 6H 2 O |
0,2928 – 0,06567pH + 0,00328lg a a 4 S 4 O 6 H2S |
|
14 |
S 4 O 6 2– + 2e = 2S 2 O 3 2– |
0,08 -0,0295lg ( a S 2O 3 2_/ a S 4o62 _ ) |
|
15 |
S 2 O 3 2– + 10H+ + 8e = 2H 2 S + 3H 2 O |
0,3194 - 0,073875pH + 0,0074lg ( a S^. a h2s ) |
|
16 |
S 2 O 3 2– + 8H+ + 8e = 2HS– + 3H 2 O |
0,216 - 0,0591pH + 0,0074lg ( aq , 2- / a 2 _) S2O 3 HS |
|
17 |
S 2 O 3 2– + 6H+ + 8e = 2S2– + 3H 2 O |
0,030- 0,044325pH + 0,00739lg ( ac . /a 2 2 ) S2O3 S |
|
18 |
PbS 2 O 3 + 6H+ + 8e = PbS + S2– + 3H 2 O |
0,030 - 0,044325pH + 0,00739lg a S 2 - |
|
19 |
PbS 2 O 3 + 6H+ + 8e = 2PbS + S 2 O 3 2– + 3H 2 O |
4,462 - 0,3546pH - 0,0591lg ao .- S2O3 |
|
20 |
PbS+ SO 4 2– + 2H+ = PbS 2 O 3 + H 2 O |
pH = 13,93 + 0,5lg a 2 - SO 4 |
|
21 |
2 SO 4 2–+ 10H+ + 8e = S 2 O 3 2– + 5H 2 O |
0,551 - 0,0739pH + 0,0074lg ( a 2SO 2 - JaS^- ) |
|
22 |
4 SO 4 2– + 20H+ + 14e = S 4 O 6 2–+ 10H 2 O |
0,6185 - 0,0844pH + 0,0042lg ( a4 2- / a , o 2- ) SO4 S4O6 |
|
23 |
4Pb2+ + S 4 O 6 2– + 12H+ + 18e = 4PbS + 6H 2 O |
0,3726 -0,0394pH + 0,00328lg ( a 4p,2+ • a q J Pb S4O6 |
|
24 |
PbSO 3 + 6H+ + 6e = PbS + 3H 2 O |
0,4036 – 0,0591pH |
|
25 |
4PbSO 3 + 12H+ + 6e = S 4 O 6 2– + 4Pb2+ + 6H 2 O |
0,4966 - 0,1182pH + 0,00985lg ( a 4 pb 2 + • a ^O^ - ) |
|
26 |
4PbSO 3 + 2H+ = H 2 SO 3 + Pb2+ |
PH = -0,716 - 0,5lg ( a pb 2 + • a H 2 SO 3 ) |
|
27 |
HSO 4 – + Pb2+ + 2H+ + 3e = PbSO 3 + H 2 O |
0,682 - 0,0394pH + 0,0197lg( a 4 2+ • - . _,) Pb HSO4 |
|
28 |
4H 2 SO 3 + 4H+ + 6e = S 4 O 6 2– + 6H 2 O |
0,553 - 0,0394pH + 0,00985lg ( a 4 h2so3/ a ^O^- ) |
|
29 |
4HSO 4 – + 3H+ + 12e = H 2 SO 3 + H 2 O |
0,553 - 0,0394pH + 0,00985lg ( a 4 h2so3/ a ^O^- ) |
|
30 |
HSO 3 – + H+ = H 2 SO 3 |
PH = 0,715 - lg ( a H 2 SO 3 / a HSO 3- ) |
|
31 |
HSO 4 – + 2H+ + 2e = HSO 3 – + H 2 O |
0,620 -0,0591pH + 0,0295lg ( a HS0 3 -/ a HS0 4 - ) |
|
32 |
4HSO 3 – + 8H+ + 6e = S 4 O 6 2– + 6H 2 O |
0,5565 - 0,04433pH + 0,00985lg ( a 4 HS O - a SO, - ) |
|
33 |
PbSO 4 + 3H++ 2e = 4Pb2+ HSO 3 – + H 2 O |
0,651 - 0,08865pH - 0,0295lg( a ph2+ • a_ n - ) Pb HSO3 |
|
34 |
PbSO 4 + 3H+ + 2e = 4Pb2+ HSO 3 – + H 2 O |
0,651 - 0,08865pH - 0,0295lg( a ph2+ • a_ n - ) Pb HSO3 |
|
35 |
4PbSO 4 ∙PbO + 40H+ + 32e = 5Pb2+ S 4 O 6 2– + 20H 2 O |
0,628 - 0,0739pH - 0,00185lg( a 5.+ • aq .2- ) Pb S4O6 |
Окончание таблицы
|
№ п/п |
Электродная реакция |
Равновесный потенциал, В или рН раствора |
|
36 |
PbSO 4 ∙2PbO + 2 SO 4 2– + 28H+ + 24e = 3PbS + 14H 2 O |
0,5454 - 0,06895pH + 0,00422lg ac „ 2- SO 4 |
|
37 |
PbSO 4 ∙3PbO + 3 SO 4 2–+ 36H+ + 30e = 4PbS + 19H 2 O |
0,5918 - 0,07092pH + 0,0059lg aen 2 - SO 4 |
|
38 |
PbO + 2 SO 4 2–+ 12H++ 8e = PbS 2 O 3 + 6H 2 O |
0,8388 - 0,08865pH + 0,014775lg a en 2- SO4 |
|
39 |
PbSO 4 ∙3PbO + H 2 O = 4PbO + SO 4 2– + 2H+ |
pH = 13,93 + 0,5lg a 2 - SO4 |
|
40 |
PbO + 2H+ + 2e = PbS 2 O 3 + 6H 2 O |
0,804 – 0,0591рН |
|
41 |
4Pb 3 O 4 + 3SO 4 2– + 14H+ + 8e = 3(PbSO 4 ∙3PbO) + 7H 2 O |
1,421 - 0,1034pH + 0,02216lg a en 2- SO4 |
|
42 |
Pb 12 O 17 + 2H+ + 2e = 4Pb 3 O 4 + H 2 O |
0,977 – 0,0591рН |
|
43 |
Pb 12 O 17 + 3SO 4 2– + 14H+ + 10e = 3(PbSO 4 ∙3PbO) + 8H 2 O |
1,332 - 0,09456pH + 0,01773lg a en 2- SO4 |
|
44 |
4(PbSO 4 ∙2PbO) + H 2 O = SO 4 2– + 3(PbSO 4 ∙3PbO) + 2H+ |
pH = 8,34 + 0,5lg a 2 - SO4 |
|
45 |
Pb 12 O 17 + 4SO 4 2– + 18H+ + 10e = 4(PbSO 4 ∙2PbO) + 9H 2 O |
1,4303 - 0,10638pH - 0,0236lg a en 2- SO4 |
|
46 |
Pb 12 O 19 + 4H+ + 4e = Pb 12 O 17 + 2H 2 O |
1,082 – 0,0591рН |
|
47 |
Pb 12 O 19 + 4SO 4 2– + 22H+ + 14e = 4(PbSO 4 ∙2PbO) + 11H 2 O |
1,331 - 0,09287pH - 0,01689lg a en 2- SO4 |
|
48 |
3(PbSO 4 ∙2PbO) + H2O = SO 4 2– + 2(PbSO 4 ∙2PbO) + 2H+ |
pH = 6,04 + 0,5lg a 2 - SO4 |
|
49 |
Pb 12 O 19 + 6SO 4 2– + 26H+ + 14e = 6(PbSO 4 ∙PbO) + 13H 2 O |
1,4323 - 0,109757pH - 0,02533lg a en 2- SO4 |
|
50 |
PbSO 4 + H 2 O = SO 4 2– + PbSO 4 ∙PbO + 2H+ |
pH = 2,41 + 0,5lg a 2 - SO4 |
|
51 |
HSO 4 – = SO 4 2– + H+ |
pH = 2,00 + lg ( a pb 2 +- a H so4 - ) |
|
52 |
PbSO 4 + H+ = HSO 4 – + Pb2+ |
pH = 1,365 - lg ( a рь 2 +- a hso4 - ) |
|
53 |
PbO 2 + 4H+ + 2e = Pb2+ + 2H 2 O |
1,4393 - 0,1182pH - 0,0295lg a p b 2 + |
|
54 |
PbO 2 + HSO 4 – + 3H+ + 2e = Pb2+ + 2H 2 O |
1,399 - 0,08865pH - 0,0295lg a pb 2 + |
|
55 |
PbO 2 + HSO 4 – + 3H+ + 2e = PbSO 4 + 2H 2 O |
1,399 - 0,08865pH + 0,0295lg aue„ - HSO4 |
|
56’ |
Pb 12 O 19 + 12SO 4 2–+ 38H+ + 14e = 12PbSO 4 + 19H 2 O |
1,5543 - 0,1604pH + 0,05067lg ac„ 2- SO4 |
|
56 |
12PbO 2 + 10H++ 10e = Pb 12 O 19 + 5H 2 O |
1,082 – 0,0591рН |
На диаграмме Е – рН присутствуют следующие области преобладания: I – α-фаза (Pb) + +β-фаза (Sn) + H 2 S + H 2 (г); II – α + β + HS– + H 2 (г); III – α + β + S2– + H 2 (г); IV – α + SnO 2 + S2– + H 2 (г); V – α + SnS + S2– + H 2 (г); VI – α + SnS + HS– + H 2 (г); VII – α + SnS + H 2 S + H 2 (г); VIII – (Pb,Sn)S + H 2 S + H 2 (г); IX – (Pb,Sn)S + HS– + H 2 (г); X – (Pb,Sn)S + S2– + H 2 (г); XI – PbS + SnO 2 + S2– + H 2 (г); XII – PbS + SnO 2 + S2–; XIII – PbS + SnO 2 + HS– + H 2 (г); XIV – PbS + SnO 2 + H 2 S + H 2 (г); XV – PbS + SnO 2 + H 2 S; XVI – PbS + SnO 2 + S 4 O 6 2–; XVII – PbS + SnO 2 + S 2 O 3 2–; XVIII – PbS + SnO 2 + S 2 O 3 2– + H 2 (г); XIX – PbS + SnO 2 + SO 4 2–; XX – PbSO 3 + SnO 2 + SO 4 2–; XXI – PbO + SnO 2 + + SO 4 2–; XXII – PbSO 4 ∙3PbO + SnO 2 + SO 4 2–; XXIII – Pb 3 O 4 + SnO 2 + SO 4 2–; XXIV – PbSO 4 ∙2PbO + SnO 2 + SO 4 2–; XXV – SnO 2 + Pb2+,S 4 O 6 2–; XXVI – SnO 2 + Pb2+,HSO 3 –; XXVII – PbSO 3 + SnO 2 ; XXVIII – SnO 2 + Pb2+,H 2 SO 3 ; XXIX – SnO 2 + Pb2+,HSO 4 –; XXX – PbSO 3 + SnO 2 + HSO 4 –; XXXI – PbSO 4 + SnO 2 + SO 4 2–; XXXII – PbSO 4 ∙PbO + SnO 2 + SO 4 2–; XXXIII – Pb 12 O 17 + SnO 2 + SO 4 2–; XXXIV – Pb 12 O 19 + SnO 2 + SO 4 2–; XXXV – Pb 12 O 19 + SnO 2 + SO 4 2– + O 2 (г); XXXVI – PbSO 4 ∙PbO + SnO 2 + SO 4 2– + O 2 (г); XXXVII – PbSO 4 + SnO 2 + SO 4 2– + O 2 (г); XXXVIII – PbSO 4 + SnO 2 + HSO 4 – + O 2 (г); XXXIX – SnO 2 + Pb2+, HSO 4 – + O 2 (г); XL – PbO 2 + SnO 2 + HSO 4 – + O 2 (г); XLI – PbO 2 + SnO 2 + SO 4 2– + O 2 (г); XLII – PbO 2 + SnO 2 + S 2 O 8 2– + O 2 (г).
Согласно данной диаграмме в области иммунности при потенциале ≈ –1,0 В происходит восстановление сульфат ионов до сероводорода в кислой среде. При повышении потенциала олово превращается в сульфид олова SnS, затем образуется смешанный сульфид свинца и олова (Pb, Sn)S. При более положительных потенциалах сульфид олова превращается в диоксид олова SnO2, который встраивается в пассивационную пленку, состоящую из сульфида свинца PbS или сульфа- тов свинца различного состава PbSO4; PbSO4∙PbO. При этом, диоксид олова, обладающий меньшей коррозионной стойкостью в кислых сернокислых средах, очевидно, растворяется и повышает пористость пассивационной пленки на сплавах свинец – олово, тем самым снижая их коррозионную стойкость. Это согласуется с данным, представленными в работах [1, 2]. При проведении рентгенофазового анализа коррозионной пленки, образованной на свинцово-оловянных сплавах при положительных потенциалах, было обнаружено наличие следовых количеств SnO2 в пленке.
Заключение
-
1. Построены диаграммы Е-pH систем Pb – SO 4 2– – H 2 O, Sn – SO 4 2– – H 2 O и сплава Pb – Sn – SO 4 2– – H 2 O при 25 °С.
-
2. Показано, что при саморастворении свинца в кислых сульфатных средах он может подвергаться сульфидной пассивации, а при повышении потенциала – сульфатной пассивации. При увеличении рН возможно образование основных сульфатов с различным содержанием PbO: PbSO 4 ∙nPbO. Олово в кислых сульфатных растворах пассивируется сульфидом SnS и диоксидом олова SnO 2 .
-
3. При коррозии свинцово-оловянных сплавов, согласно диаграмме электрохимического равновесия, в пленке может накапливаться совместно с соединениями свинца диоксид олова, который увеличивает пористость пленки и, соответственно снижает коррозионную стойкость свинцо-во-оловянных сплавов.
Список литературы Особенности влияния сульфат-ионов на коррозионно-электрохимическое поведение свинца, олова и их сплавов. Диаграммы электрохимического равновесия
- Состав и структура пассивирущих слоев на поверхности свинца и многокомпонентных свинцовых сплавов при их анодном окислении в 4,8 М растворе серной кислоты/М.М. Бурашникова, И.В. Зотова, И.А. Казаринов и др.//Электрохимическая энергетика. -2011. -Т. 11, № 4. -С. 213-222.
- Бурашникова, М.М. Механизм анодной пассивации свинцово-оловянных сплавов в растворе серной кислоты/М.М. Бурашникова, И.В. Зотова, И.А. Казаринов//Электрохимическая энергетика. -2013. -Т. 13, № 4. -С. 205-212.
- Тюрин, А.Г. Термодинамика химической и электрохимической устойчивости твердых сплавов железа, хрома и никеля: монография/А.Г. Тюрин. -Челябинск: Изд-во Челяб. гос. ун-та, 2011. -241 с.
- Тюрин, А.Г. Диаграмма электрохимического равновесия стали Ст.3 в сильнокислых сульфатных растворах/А.Г. Тюрин, А. И. Бирюков//Вестник Казанского технологического университета. -Т. 15, № 16. -С. 74-77.
- Справочник по электрохимии/под ред. А.М. Сухотина. -Л.: Химия, 1981. -488 с.


