Особенности воспалительной реакции в слизистой бронха в участках базальноклеточной гиперплазии и плоскоклеточной метаплазии на фоне плоскоклеточного рака легкого
Автор: Панкова О.В., Перельмутер В.М., Савенкова О.В., Денисов Е.В., Васильев С.А., Скрябин Н.А., Тузиков С.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 5 (53), 2012 года.
Бесплатный доступ
Исследование вошли 63 больных, прооперированных по поводу плоскоклеточного рака легкого. Материалом для морфологического исследования явились находящиеся на расстоянии 4–5 см от опухоли фрагменты ткани удаленного легкого с бронхом. Для оценки особенностей характера воспалительной реакции при различных вариантах дисрегенерации исследовали наличие клеток, экспрессирующих Ki67, p53, bcl-2, CD138, CD117, CD68 и CD79α, в инфильтрате каждого из вариантов дисрегенераторных изменений. Воспалительный инфильтрат при плоскоклеточной метаплазии характеризовался наличием большого количества пролиферирующих клеток и клеток, экспрессирующих p53 и bcl-2. Выраженность инфильтрации стромы плазматическими, тучными клетками и макрофагами в этом случае снижалась. Базальноклеточная гиперплазия в присутствии плоскоклеточной метаплазии характеризовалась большим числом пролиферирующих клеток и лейкоцитов, экспрессирующих p53 и bcl-2, большим количеством плазматических клеток и уменьшением числа макрофагов. Характер воспалительной реакции при плоскоклеточной метаплазии был одинаков и не зависел от того, сочетается или нет плоскоклеточная метаплазия с базальноклеточной гиперплазией и неоплазией. Исключение составляла только более выраженная инфильтрация в участках плоскоклеточной метаплазии CD68+ макрофагами в случаях ее сочетания с неоплазией.
Дисрегенераторные изменения бронхиального эпителия, воспалительная инфильтрация, маркеры пролиферативной активности
Короткий адрес: https://sciup.org/14056262
IDR: 14056262 | УДК: 616.24-006.61-007.61:616.233-002
Текст научной статьи Особенности воспалительной реакции в слизистой бронха в участках базальноклеточной гиперплазии и плоскоклеточной метаплазии на фоне плоскоклеточного рака легкого
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2012. № 5 (53)
Прогрессия дисрегенераторных изменений до состояния пре- и неоплазии, а в дальнейшем до плоскоклеточного рака легкого связана с нарушением механизмов регуляции клеточного цикла, апоптоза и дифференцировки клеток бронхиального эпителия. В основе этих процессов могут быть не только генетические и эпигенетические нарушения в самих клетках эпителия, но и влияние клеток микроокружения, в частности воздействие воспалительного инфильтрата. Одним из первых морфологических изменений, предшествующих пре- и неоплазии является базальноклеточная гиперплазия, развивающаяся в условиях хронического воспаления как проявление ускоренной регенерации и замедления дифференцировки эпителия. Известно, что уже при данном дисрегенераторном процессе наблюдается повышение уровня экспрессии маркеров пролиферативной активности и апоптоза – Ki67, bcl-2, р53 [1, 3, 5, 8]. Согласно данным литературы, различные типы дисреге-нераторных, пре- и неопластических изменений могут быть найдены в одном и том же бронхе [4, 6, 9]. Однако практически нет исследований, в которых изучались бы особенности воспалительной инфильтрации в зависимости от сочетания разных типов дисрегенераторных процессов. Например, характеристика воспалительной реакции при сочетании базальноклеточной гиперплазии с плоскоклеточной метаплазией и без таковой. Решению этой задачи и посвящена настоящая статья.
Материал и методы
В исследование вошли 63 больных в возрасте от 41 до 73 лет, прооперированные в клинике ФГБУ «НИИ онкологии» СО РАМН по поводу плоскоклеточного рака легкого T1-4N0-Х M0 стадии. В предоперационном периоде 26 (41,3 %) пациентов получили неоадъювантную химиотерапию по схеме: паклитаксел 175 мг/м2 в/в 1день + карбоплатин AUC 6 в/в 1 день, 2–3 курса с интервалом в 3 нед. Во время проведения радикальной операции 22 (34,9 %) больным проведен сеанс интраоперационной лучевой в разовой дозе 10–15 Гр, из них 13 (59,1 %) – перед облучением вводили цисплатин или гемзар в радиосенсибилизирующих дозировках.
Морфологический диагноз рака легкого устанавливался согласно «Гистологической классификации опухолей легкого» (ВОЗ, Женева, 2003). Пренеопластические (дисплазия I степени) и нео- пластические процессы (дисплазия II–III степени) оценивались согласно критериям, предложенным S. Lantue, joul et al. [7]. Материалом для морфологического исследования были опухоль и фрагменты ткани удаленного легкого с бронхом, находящиеся на расстоянии 4–5 см от опухоли. Ткань фиксировалась в нейтральном формалине, проводилась по стандартной методике и заливалась в парафин. Срезы толщиной 5–6 мкм окрашивались гематоксилином и эозином. Морфологическое исследование осуществлялось с помощью светового микроскопа «Axiostar plus» фирмы «К. Zeiss» (Германия).
Иммуногистохимическое исследование проводилось по общепринятой методике. Демаскировку антигенов осуществляли путем инкубации срезов в микроволновой печи в течение 20 мин в цитратном буфере или ЭДТА-8. В качестве хромогена применяли диаминобензидин (ДАБ). Визуализацию реакции антиген – антитело осуществляли с помощью системы «Super Sensitive Polymer – HRP Detection System» (Bio Genex, США).
Для иммуногистохимического исследования использовались моноклональные антитела к белкам: р53 (clon CM1, рабочее разведение 1:150, «Novocastra»), выявляющий «дикий» и «мутантный» варианты протеина, bcl-2 (clon bcl-2/100/ D5, рабочее разведение 1:80, «Novocastra»), Ki67 (clon MIB-11, RTU, «Daco»), CD138 (клон MI 15, RTU, «Daco»), CD68 (клон PG-M1, RTU, «Daco»), CD79α (клон JCB 117, RTU, «Daco»), CD117 (ckit, рабочее разведение 1:500). Экспрессия исследуемых маркеров в воспалительном инфильтрате оценивалась отдельно под каждым участком того или иного варианта дисрегенераторного изменения. Результаты иммуногистохимической реакции оценивали по процентному содержанию окрашенных клеток при любой степени положительной экспрессии маркера (100 клеток в 10 полях зрения). При сравнении частоты встречаемости разных типов клеток воспалительного инфильтрата в исследуемых группах подсчитывался % случаев с наличием соответствующих лейкоцитов.
Обработка полученных результатов выполнялась с помощью пакета программ «Statistica for 6.0». Для оценки различий между группами по частоте встречаемости признака использовался критерий χ2.
Результаты и обсуждение
Поскольку развитие дисрегенераторных изменений, их характер во многом могут быть связаны с вариантом местной воспалительной реакции, мы предположили, что наличию базальноклеточной гиперплазии и плоскоклеточной метаплазии, на фоне которой часто развивается дисплазия, сопутствует разный характер воспаления [2]. В этой связи представляло интерес сопоставить особенности воспалительной реакции при различных вариантах сочетания базальноклеточной гиперплазии (БКГ) и плоскоклеточной метаплазии (ПМ).
Из 63 больных, вошедших в исследование, у 53 (84,1 %) в смежном с опухолью бронхиальном эпителии отмечалась базальноклеточная гиперплазия. Из них у 30 (56,6 %) пациентов наблюдалась изолированная базальноклеточная гиперплазия (БКГ+ПМ-). Пре- и неопластических изменений у данных больных не было найдено. У 23 (43,4 %) пациентов базальноклеточная гиперплазия сочеталась с плоскоклеточной метаплазией (БКГ+ПМ+). В этой группе только в 1 (4,3 %) случае выявлялась пренеоплазия. У 10 (15,9 %) больных в слизистой бронха обнаружена плоскоклеточная метаплазия при отсутствии базальноклеточной метаплазии (БКГ-ПМ+). В данной группе отмечена высокая частота встречаемости пре- и неоплазии – 9 (90 %) наблюдений.
Сравнительная характеристика качественного состава воспалительного инфильтрата
Состав воспалительного инфильтрата в исследуемых группах больных был практически однотипен и включал различные варианты лейкоцитов: CD68+ макрофаги, CD138+ плазматические клетки, CD117+ тучные клетки, CD79α+ В-лимфоциты.
При этом качественный состав инфильтрата (рис. 1) имел ряд отличий, проявляющихся уменьшением количества случаев инфильтрации плазматическими клетками в группе БКГ+ПМ+ по сравнению с группой БКГ+ПМ- (CD138+ клетки, χ2=3,16; р=0,05), более частым обнаружением в этой группе макрофагов (CD68+, χ2 =7,76; р=0,005) и тучных клеток (CD117+, χ2=7,55; р=0,006). Частота встречаемости В-лимфоцитов (CD79+ клетки) в обеих группах была одинакова (χ2=0,62, р=0,43). Следует отметить, что в воспалительном инфильтрате при наличии изолированной базальноклеточной гиперплазии (БКГ+ПМ-) отсутствовали сегментоядерные нейтрофилы. В группе БКГ+ПМ+ данный тип клеток присутствовал в инфильтрате у 13 % больных (χ2 =18,03;р=0,000).
При сравнении характера воспалительной инфильтрации в группах больных, у которых выявлялась плоскоклеточная метаплазия, сочетающаяся или нет с базальноклеточной гиперплазией, были отмечены следующие особенности. По частоте встречаемости различных типов клеток воспалительного инфильтрата группа больных (БКГ-ПМ+) отличалась от группы БКГ+ПМ+ только увеличением числа случаев инфильтрации стромального компонента CD138+ клетками (χ2=19,47; р=0,000) и CD79α+ клетками (χ2 =5,38; р=0,02) (рис. 2).
Сравнительная характеристика воспалительного инфильтрата БКГ и ПМ
Для оценки особенностей характера воспалительной реакции в каждом случае отдельно изучали состав воспалительного инфильтрата вблизи
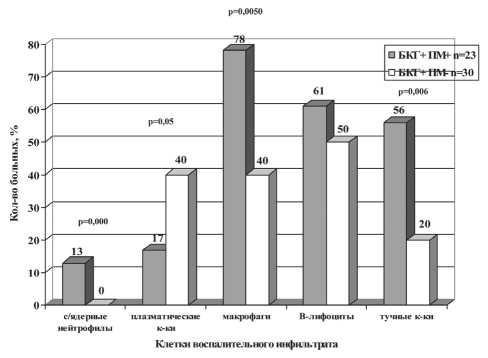
Рис. 1. Частота встречаемости клеток воспалительного инфильтрата при различных вариантах базальноклеточной гиперплазии
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2012. № 5 (53)
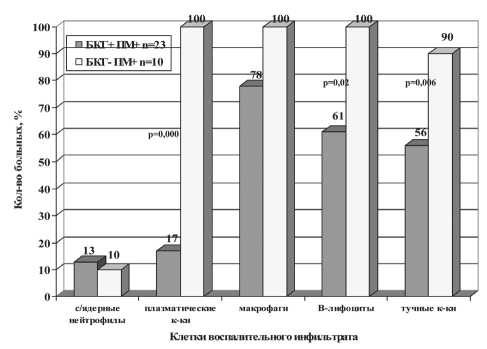
Рис. 2. Частота встречаемости клеток воспалительного инфильтрата при различных вариантах плоскоклеточной метаплазии
каждого из вариантов дисрегенерации (например, в группе БКГ+ПМ+ подсчитывалось количество клеток с позитивной экспрессией отдельно в участках БКГ и ПМ). В группе БКГ+ПМ+ показатели пролиферативной активности и апоптоза (Ki67, p53 и bcl-2) клеток воспалительного инфильтрата под очагами плоскоклеточной метаплазии характеризовались более высокими значениями по сравнению с таковыми под участками базальноклеточной гиперплазии (табл. 1). Вместе с тем в воспалительном инфильтрате в участках ПМ отмечалось уменьшение процента CD138+ плазматических клеток, CD117+ тучных клеток и CD68+ макрофагов.
Сравнительная характеристика воспалительного инфильтрата БКГ в зависимости от ее сочетания с ПМ
Характер экспрессии показателей пролиферативной активности и апоптоза в клетках воспалительного инфильтрата имел следующие особенности. Процентное содержание клеток с экспрессией Ki67, p53 и bcl-2 в очагах инфильтрата под БКГ, сочетающейся с ПМ, было значительно выше по сравнению с изолированной БКГ (БКГ+ПМ-, табл. 2). При этом в случаях сочетания БКГ с ПМ в отличие от изолированной БКГ определялось большее количество CD138+ плазматических клеток (p=0,0002) и меньшее число CD68+ макрофагов (р=0,004). Показатель экспрессии CD79α+ В- лимфоцитов в строме разных вариантов БКГ не имел статистически значимых отличий (табл. 2).
Сравнительная характеристика воспалительного инфильтрата ПМ в зависимости от наличия или отсутствия дисплазии
В случаях сочетания плоскоклеточной метаплазии с базальноклеточной гиперплазией (БКГ+ПМ+), как отмечалось выше, только у одного пациента была выявлена пренеоплазия, а при ПМ, не сочетающейся с БКГ (БКГ-ПМ+), диспластиче-ские процессы наблюдались с высокой частотой. Причем в 70 % случаев это – неоплазия (ДII–III степени). Сравнение показателей экспрессии Ki67, p53 и bcl-2 воспалительного инфильтрата под участками ПМ групп БКГ+ПМ+ и БКГ-ПМ+Д не выявило статистически значимых различий (табл. 3). Незначительно отличались данные варианты ПМ и по составу клеток воспалительного инфильтрата. Только в случаях сочетания ПМ с дисплазией в воспалительном инфильтрате отмечался более высокий, чем при ПМ, сочетающейся с БКГ, процент CD68 + макрофагов (р=0,003).
Таблица 1
Иммунофенотип воспалительного инфильтрата базальноклеточной гиперплазии и плоскоклеточной метаплазии в группе БКГ+ПМ+
|
Показатель |
Клетки с позитивной экспрессией, % |
|
|
БКГ+ |
ПМ+ |
|
|
Ki67 |
28,4 ± 8,3 |
38,6 ± 4,7 |
|
р=0,0001 |
||
|
p53 |
17,6 ± 7,6 |
22,2 ± 4,9 |
|
р=0,05 |
||
|
Bcl-2 |
15,2 ± 6,8 |
28,9 ± 6,8 |
|
р=0,000002 |
||
|
CD138 |
23,1 ± 1,8 |
15,6 ± 4,4 |
|
р=0,004 |
||
|
CD117 |
15,9 ± 3,2 |
10,02 ± 2,9 |
|
р=0,00002 |
||
|
CD68 |
17,5 ± 5,1 |
11,6 ± 2,3 |
|
р=0,0001 |
||
|
CD79α |
15,5 ± 2,0 |
15,9 ± 7,9 |
|
р=0,85 |
||
Таблица 2
Иммунофенотип воспалительного инфильтрата при изолированной базальноклеточной гиперплазии и базальноклеточной гиперплазии,сочетающейся с плоскоклеточной метаплазией
|
Показатель |
Клетки с позитивной экспрессией, % |
|
|
БКГ+ (БКГ+ПМ+) |
БКГ+ (БКГ+ПМ-) |
|
|
Ki67 |
28,4 ± 8,3 |
20,1 ± 4,4 |
|
р=0,0004 |
||
|
p53 |
17,6 ± 7,6 |
9,3 ± 2,6 |
|
р=0,00005 |
||
|
Bcl-2 |
15,2 ± 6,8 |
9,5 ± 2,2 |
|
р=0,001 |
||
|
CD138 |
23,6 ± 1,8 |
13,3 ± 3,4 |
|
р=0,0002 |
||
|
CD117 |
14,7 ± 4,2 |
15,6 ± 1,3 |
|
р=0,6 |
||
|
CD68 |
18,1 ± 4,9 |
23,1 ± 3,6 |
|
р=0,004 |
||
|
CD79α |
14,6 ± 3,1 |
15,8 ± 1,8 |
|
р=0,17 |
||
Таблица 3
Иммунофенотип воспалительного инфильтрата различных вариантов плоскоклеточной метаплазии
|
Показатель |
Клетки с позитивной экспрессией, % |
|
|
ПМ+ (БКГ+ПМ+) |
ПМ+ (БКГ-ПМ+) |
|
|
Ki67 |
38,6 ± 4,7 |
40,6 ± 4,5 |
|
р=0,3 |
||
|
p53 |
22,2 ± 4,9 |
19,9 ± 2,5 |
|
р=0,2 |
||
|
Bcl-2 |
28,9 ± 6,8 |
24,1 ± 5,3 |
|
р=0,006 |
||
|
CD138 |
15,6 ± 4,4 |
14,2 ± 5,2 |
|
р=0,4 |
||
|
CD117 |
10,02 ± 2,9 |
8,7 ± 4,3 |
|
р=0,4 |
||
|
CD68 |
11,6 ± 2,3 |
19,7 ± 10,3 |
|
р=0,003 |
||
|
CD79α |
15,9 ± 7,9 |
15,4 ± 4,1 |
|
р=0,8 |
||
Таким образом, в каждом случае в пределах одного фрагмента слизистой бронха воспалительный инфильтрат в участках базальноклеточной гиперплазии и плоскоклеточной метаплазии отличался по составу. Воспалительный инфильтрат при плоскоклеточной метаплазии характеризовался наличием большого количества пролиферирующих клеток и клеток, экспрессирующих bcl-2 и p53. Кроме этого, обнаружено снижение выраженности инфильтрации стромы плазматическими, тучными клетками и макрофагами. Выраженность воспалительных изменений в участках базальноклеточной гиперплазии зависела от того, сопровождается или нет последняя плоскоклеточной метаплазией. Базальноклеточная гиперплазия в присутствии плоскоклеточной метаплазии характеризовалась большим числом пролиферирующих клеток и лейкоцитов, экспрессирующих bcl-2 и p53, большим количеством плазматических клеток и некоторым уменьшением числа макрофагов.
Характер воспалительной реакции при плоскоклеточной метаплазии был одинаков и не зависел от того, сочетается или нет плоскоклеточная метаплазия с базальноклеточной гиперплазией и дисплазией. Исключение составляла только более выраженная инфильтрация в участках плоскоклеточной метаплазии CD68+ макрофагами в случаях ее сочетания с неоплазией. Причины и механизмы, обусловливающие различия воспалительной инфильтрации в участках с разными вариантами дисрегенераторных процессов, требуют дальнейших исследований.
Работа выполнена при поддержке гранта ФЦП «Научные и научно-педагогические кадры инновационной России на 2009–2013 годы» (#8719).


