Особенности выбора антибиотиков для лечения пациентов с ортопедической инфекцией, вызванной грамотрицательными возбудителями: результаты 12-летнего наблюдения
Автор: Туфанова О.С., Божкова С.А., Касимова А.Р., Гордина Е.М., Гвоздецкий А.Н., Тихилов Р.М.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 5 т.31, 2025 года.
Бесплатный доступ
Введение. Лечение пациентов с ортопедической инфекцией является сочетанием оптимального вида санирующего хирургического вмешательства и адекватной антибактериальной терапии. Доля Грам(–) возбудителей в структуре ортопедической инфекции относительно невелика (1–28 %), однако прогрессирование антибактериальной резистентности A. baumannii, K. pneumoniae, P. aeruginosa вызывает трудности в выборе антибиотиков, что ухудшает прогноз лечения таких пациентов. Цель работы — обосновать выбор лекарственных средств для таргетной эмпирической и этиотропной антибактериальной терапии на основании анализа резистентности к антибактериальным препаратам ведущих грамотрицательных бактерий (A. baumannii, K. pneumoniae, P. aeruginosa), изолированных от пациентов с ортопедической инфекцией. Материалы и методы. Выполнено ретроспективное исследование данных о чувствительности к антибактериальным препаратам ведущих Грам(–) микроорганизмов, изолированных от пациентов с ортопедической инфекцией с 01.01.2011 по 31.12.2022. Исследована средняя частота выделения устойчивых штаммов и определены тренды резистентности ведущих Грам(–) возбудителей к различным антибактериальным препаратам (фторхинолоны, котримоксазол, цефалоспорины, карбапенемы, монобактамы, аминогликозиды, фосфомицин, колистин). Результаты. За 12-тилетний период выявлены статистически значимые тренды роста доли штаммов A. baumannii, резистентных к ципрофлоксацину (p = 0,024) и левофлоксацину (p = 0,012), штаммов P. aeruginosa (p = 0,018) и K. pneumoniae (p = 0,018) — к ципрофлоксацину. Прогнозируемая доля резистентных к фторхинолонам штаммов A. baumannii стремится к 100 %. Отмечен значимый рост штаммов A. baumannii и P. aeruginosa, резистентных к цефоперазону+[сульбактаму] (p = 0,027 и p = 0,010, соответственно), штаммов K. pneumoniae, резистентных к меропенему и имипенему (p = 0,037 и p = 0,003), и штаммов P. aeruginosa, резистентных к имипенему (p = 0,001). Для остальных антибиотиков не выявлено статистически значимых трендов, резистентность к препаратам исследуемых возбудителей в течение 12-тилетнего периода оставалась на стабильном уровне или имела волнообразное течение. Определено, что оптимальным препаратом, активным в отношении Грам(–) бактерий, является цефоперазон+[сульбактам]. Обсуждение. Перечень антибактериальных препаратов, активных в отношении штаммов A. baumannii, K. pneumoniae, P. aeruginosa, достаточно внушительный и в основном содержит лекарства для парентерального введения. Для резистентных штаммов перечень ограничен одной или двумя группами, при этом препаратов, существующих в пероральной форме, в нем нет. Это обуславливает трудности в лечении и высокую долю рецидивов. Отрицательная динамика нарастания антибиотикорезистентности ведущих Грам(–) возбудителей к фторхинолонам, цефалоспоринам и карбапенемам является общемировой проблемой, вынуждающей прибегать к применению антибиотиков резерва. Заключение. Применение для таргетной эмпирической стартовой антибактериальной терапии защищенного цефалоспорина представляется более рациональным в виду меньшего риска селекции устойчивых к нему штаммов. Фторхинолоны и карбапенемы целесообразно применять только при доказанной к ним чувствительности. Полимиксин В и фосфомицин необходимо рассматривать как препараты резерва для лечения инфекции, вызванной устойчивыми к другим АБ штаммами, и назначать только в составе комбинированной терапии. Аминогликозиды и незащищенные цефалоспорины в связи с особенностями фармакокинетики и высоким уровнем устойчивости являются альтернативой только при невозможности назначения более активных препаратов.
Имплантат-ассоциированная инфекция, ортопедическая инфекция, перипротезная инфекция, Pseudomonas aeruginosa, Klebsiella pneumoniae, Acinetobacter baumannii, антибактериальная терапия, антибиотикорезистентность, эмпирическая терапия, этиотропная терапия
Короткий адрес: https://sciup.org/142246009
IDR: 142246009 | УДК: 616.71-089.843-06:616-022.1-035:615.33 | DOI: 10.18019/1028-4427-2025-31-5-587-601
Текст научной статьи Особенности выбора антибиотиков для лечения пациентов с ортопедической инфекцией, вызванной грамотрицательными возбудителями: результаты 12-летнего наблюдения
Периимплантные инфекции в настоящее время относят к наиболее тяжелым осложнениям операций на костно-мышечной системе [1]. В структуре возбудителей ортопедической инфекции (ОИ) традиционно преобладают Грам(+) бактерии S. aureus и S. epidermidis , а доля Грам(–) микроорганизмов составляет 13–28 % [2, 3]. Существуют локальные особенности распространенности данных возбудителей, в отдельных странах показатель доходит до 61 % [4]. Среди Грам(–) бактерий ведущая роль принадлежит представителям семейства Enterobacteriaceae ( K. pneumoniae и E. coli ) и неферментирующим бактериям ( P. aeruginosa и A. baumannii ).
Грам(–) бактерии К. pneumoniae, P. aeruginosa и A. baumannii входят в группу часто встречающихся патогенов с регистрируемыми критическим и высоким уровнями устойчивости к антибиотикам, обозначенную Американским обществом инфекционных заболеваний как ESKAPE-патогены. Стремительный рост устойчивости к антибиотикам из групп фторхинолонов (ФХ), цефалоспоринов (ЦС), карбапене-мов (КП), которые традиционно считали препаратами выбора, вызывает большую настороженность среди клиницистов.
Участие Грам(–) бактерий в этиологии имплантат-ассоциированной инфекции (ИАИ) на сегодняшний день считают неблагоприятным прогностическим признаком. Рецидивы инфекционного процесса Грам(–) этиологии в течение первых двух лет после проведения санирующей операции пациенту с ИАИ регистрируют в 50–60 % случаев [5, 6]. При этом исследователи указывают на прямую корреляцию между антибиотикорезистентностью изолированных от пациентов бактерий и частотой неблагоприятных исходов [7]. Данные обосновывают необходимость постоянного локального мониторинга чувствительности этих микроорганизмов к антибактериальным препаратам, что дает возможность своевременно пересматривать варианты стартовой эмпирической и этиотропной АБТ в стационаре и на амбулаторном этапе.
Основными препаратами, в спектр действия которых входят Грам(–) бактерии, являются ФХ, незащищенные и защищенные ЦС III–IV поколений, КП, монобактамы, аминогликозиды, фосфомицин, колистин и ко-тримоксазол. Практическое применение лекарственных препаратов этих групп имеет свои преимущества и недостатки, которые будут рассмотрены в данной работе.
Цель работы — обосновать выбор лекарственных средств для таргетной эмпирической и этиотропной антибактериальной терапии на основании анализа резистентности к антибактериальным препаратам ведущих грамотрицательных бактерий ( A. baumannii, K. pneumoniae, P. aeruginosa ), изолированных от пациентов с ортопедической инфекцией.
МАТЕРИАЛЫ И МЕТОДЫ
Выполнено ретроспективное исследование данных о резистентности к антибактериальным препаратам ведущих Грам(–) возбудителей, изолированных от пациентов с ОИ, с 1 января 2011 года по 31 декабря 2022 года. К ведущим возбудителям относили микроорганизмы, доля которых, по данным опубликованного ранее центрового мониторинга [8], в общем спектре возбудителей ОИ превышала 3,5 %.
Данные об антибиотикорезистентности получали из программы «Система микробиологического мониторинга «Микроб-2»» (МедПроект-3, 2002–2020), а также из лабораторной информационной системы «Акросс-Инжиниринг» (2021–2022). Бактериологический анализ полученных от пациентов биоматериалов выполняли в соответствии с принятыми международными стандартами микробиологических исследований (UK SMI). Видовую идентификацию выросших культур до 2021 года проводили биохимическим методом на панелях Microlatest (Erba Lachema) с помощью iEMS Reader MF (Labsistems, Финляндия), а с 2021 года — методом MALDI-TOF масс-спектрометрии.
Чувствительность выделенных штаммов Грам(–) бактерий определяли к включенным в формулярный перечень центра антимикробным препаратам:
-
— A. baumannii — к ципрофлоксацину, левофлоксацину, ко-тримоксазолу, цефоперазону+[сульбактаму] (определение происходило по цефоперазону), имипенему, меропенему, амикацину, гентамицину, колистину;
-
— K. pneumoniae — к ципрофлоксацину, ко-тримоксазолу, цефтриаксону, цефоперазону+[сульбактаму] (определение происходило по цефоперазону), цефепиму, имипенему, меропенему, азтреонаму, колистину, фосфомицину (с 2017 года);
-
— P. aeruginosa — к ципрофлоксацину, левофлоксацину, цефтазидиму, цефтазидиму+[авибактаму], цефоперазону+[сульбактаму] (определение происходило по цефоперазону), цефепиму, имипенему, меропенему, азтреонаму, амикацину, гентамицину, колистину.
В течение всего 12-летнего периода чувствительность штаммов определяли согласно контрольным точкам в актуальной версии EUCAST на момент выполнения первичного микробиологического исследования.
Для описания категориальных переменных использовали абсолютные значения и доли от целого ( n , %). Переменные, имеющие непрерывный характер распределения, описывали средним и стандартным отклонениями (М ± σ ), дискретные переменные и упорядоченные данные — медианой, 1–3 квартилями (Md [Q1; Q3]). Также вычисляли минимальное и максимальное значения (|min; max|). Основные тренды антибиотикорезистентности представляли для анализируемых возбудителей по группам антибиотиков: ФХ, ко-тримоксазол, ЦС, КП, монобактамы, аминогликозиды, фосфомицин, полимиксин Е (колистин).
Моделирование кривой «резистентность–время» проводили при помощи библиотеки `mgcv`. В качестве зависимой переменной выступала доля резистентных штаммов в году, в качестве независимых — время и вид бактерий. Моделирование нелинейной зависимости проводили методом кубической сплайн-трансформации от времени с эффектом взаимодействия с групповой принадлежностью. Так как зависимая переменная принадлежит диапазону (0, 1), применяли модель бета-распределения. Для исключения экстремальных значений (0 и 1) выполняли следующую трансформацию зависимой переменной (y × (n - 1) + 0,5) / n , где y — зависимая переменная, n — количество наблюдений. Синтаксис модели был следующим:
gam (y ~ s(time, bs = 'cr', k = 5) + name + s(time, by = name, bs = 'cr', k = 5), family = betar()) .
Модель характеризовали коэффициентом псевдодетерминации R2, нормализованным корнем из среднеквадратичной ошибки (nRMSE), степенями свободы. Для уточнения данных на полученных моделях тестировали гипотезы линейного тренда. Для коррекции множественного тестирования гипотез использовали среднюю долю ложных отклонений (FDR). Все расчёты выполняли на языке программирования R v4.4.0.
РЕЗУЛЬТАТЫ
Фторхинолоны (ципрофлоксацин, левофлоксацин)
Средняя доля штаммов A. baumannii, K. pneumoniae и P. aeruginosa , резистентных к ципрофлоксацину, составила 83,7 % [62,5–98,7], к левофлоксацину — 87,6 % [50–98,6]. Весь анализируемый период наблюдали статистически значимое нарастание доли резистентных к ципрофлоксацину штаммов ведущих Грам(–) бактерий ( p = 0,024). При этом доля резистентных штаммов с 2011 г. до 2022 г. увеличилась на 36,2 %, 25,0 % и 33,4 % соответственно для A. baumannii ( p = 0,024) (рис. 1, A), K. pneumoniae ( p = 0,018) (рис. 1, B) и P. aeruginosa ( p = 0,018) (рис. 1, C), и достигла к концу срока наблюдения 98,7 %, 98,2 % и 66,7 %.
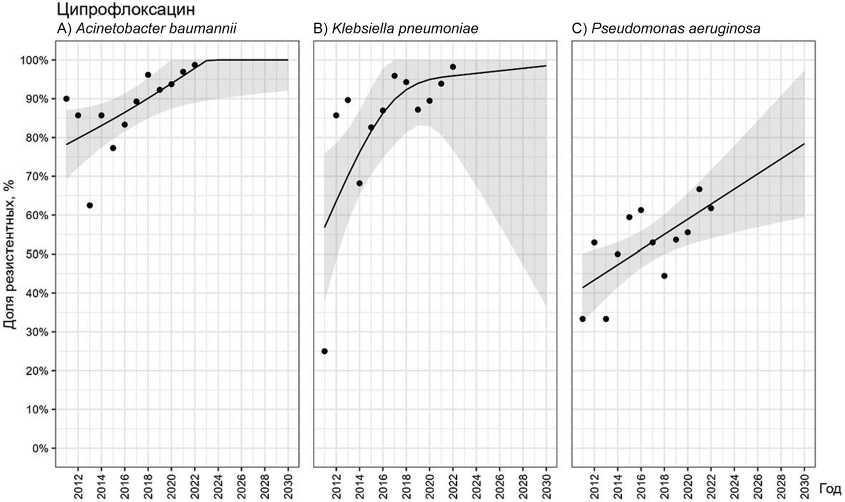
Рис. 1. Прогнозирование резистентности A. baumannii (A), K. pneumoniae (B) и P. aeruginosa (C) к ципрофлоксацину
Схожую картину наблюдали в отношении левофлоксацина. Общий тренд характеризовался статистически значимым нарастанием доли резистентных к нему штаммов A. baumannii ( p = 0,012). Однако выделение резистентных к левофлоксацину штаммов P. aeruginosa имело волнообразный характер, несмотря на прогнозируемое увеличение доли устойчивых изолятов, однозначного тренда не выявлено ( p = 0,461).
Прогнозируемая частота выделения резистентных к фторхинолонам A. baumannii в ближайшие годы достигнет 100 %. Для K. pneumoniae и P. aeruginosa , несмотря на очевидный рост резистентности к ФХ, уровень 100 % достигнут не будет.
Сульфаметоксазол-триметоприм (ко-тримоксазол)
В среднем 74,8 % [47,1–92,6] штаммов A. baumannii были резистентны к ко-тримоксазолу. Динамика выделения резистентных штаммов имела два основных тренда: с 2011 г. по 2016 г. доля устойчивых изолятов снизилась на 38,9 %, а с 2017 г. по 2022 г. наблюдали обратную динамику в виде нарастания доли резистентных штаммов на 45,5 % (рис. 2, A). Несмотря на прогнозируемое увеличение частоты выделения резистентных штаммов, говорить об однозначном тренде не представляется возможным ( p = 0,978).
Среди K. pneumoniae в среднем 81,9 % [52,4–97,1] штаммов демонстрировали устойчивость данному антибиотику. Частота выделения устойчивых к ко-тримоксазолу штаммов K. pneumoniae характеризовалась постоянными колебаниями. Несмотря на снижение данного показателя в последние три года наблюдения, общий тренд демонстрирует статистически незначимое увеличение доли резистентных штаммов ( p = 0,195), которая, вероятно, к 2030 году достигнет 100 % (рис. 2, B).
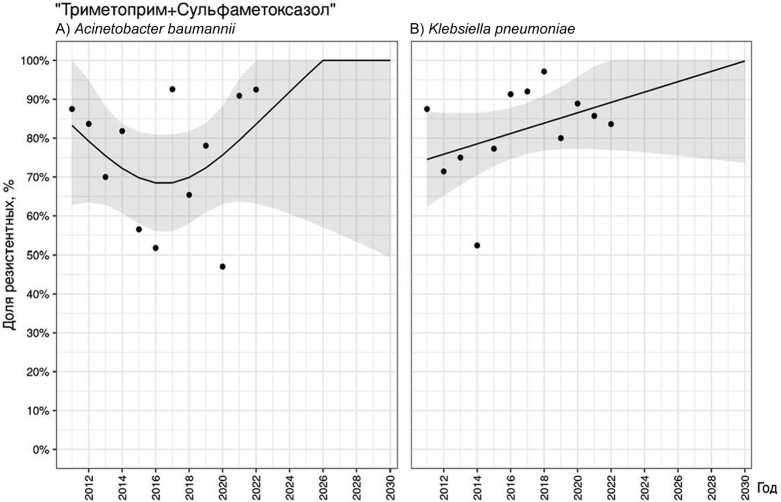
Рис. 2. Прогнозирование резистентности A. baumannii (A) и K. pneumoniae (B) к ко-тримоксазолу
Защищенные и незащищенные цефалоспорины
Средняя доля резистентных к цефоперазону+[сульбактаму] штаммов A. baumannii составила 53,3 % [18,8–83,3]. Динамика показателя имела нелинейный характер на всем протяжении наблюдения (рис. 3, A), однако общий тренд за 12 лет характеризовался устойчивым нарастанием доли резистентных штаммов ( p = 0,027), которая по прогнозу достигнет 100 % к 2026 году. Частота выделения резистентных к цефепиму и цефтриаксону штаммов K. pneumoniae практически не менялась за 12 лет наблюдения и в среднем составляла 86,3 % [76,2–97,4] и 85,0 % [76,9–96,4] соответственно. В связи с этим прогнозируемая частота выделения резистентных штаммов близка к средней.
Динамика выделения резистентных к цефоперазону+[сульбактаму] штаммов К. pneumoniae имела волнообразный характер, в период с 2015 г. до 2017 г. регистрировали снижение данного показателя (рис. 3, B). Однако общий тренд демонстрирует статистически незначимое увеличение устойчивости ( p = 0,225). В отношении P. aeruginosa наиболее эффективен был цефоперазон+[сульбактам], к которому были устойчивы только 32,8 % [7,8–60,3] штаммов, включенных в исследование.
Для сравнения средняя доля штаммов, резистентных к цефтазидиму + [авибактаму], составила 41,2 % [25,4–50,0], к цефтазидиму — 45,9 % [17,3–75,0], а к цефепиму — 49,1 % [19,2–75,0]. При этом именно для цефоперазона+[сульбактама] выявлен негативный тренд увеличения доли устойчивых штаммов P. aeruginosa ( p = 0,010) (рис. 3, C). Для цефтазидима прогнозируется незначимое увеличение доли, а для цефепима — отсутствие роста доли резистентных штаммов P. aeruginosa .
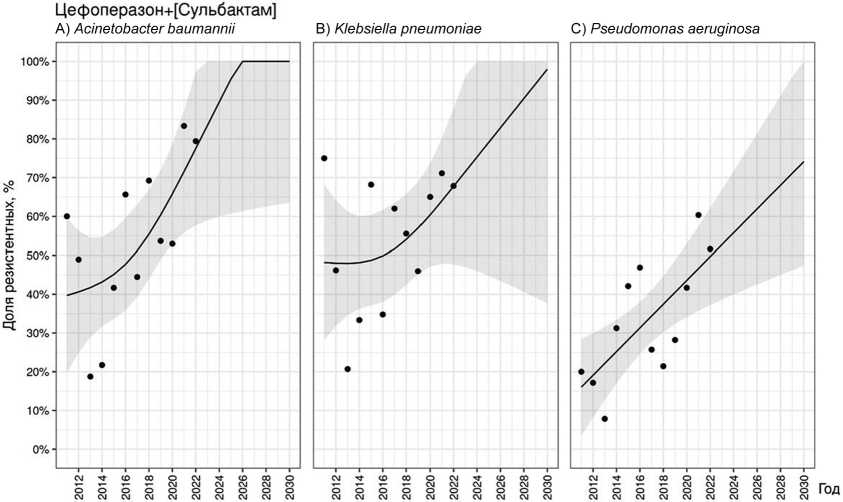
Рис. 3. Прогнозирование резистентности A. baumannii (A), K. pneumoniae (B) и P. aeruginosa (C) к цефоперазону+[сульбактаму]
Карбапенемы
Средняя частота выделения резистентных к имипенему A. baumannii составила 56,7 % [33,3–75,0] с волнообразной динамикой и отсутствием какого-либо тренда ( p = 0,877). Прогнозируемая частота выделения резистентных штаммов в ближайшие годы останется близка к среднему значению. Несмотря на большую по сравнению с имипенемом среднюю долю резистентных к меропенему штаммов A. baumannii (68,0 % [48,7–90,0]), показатель снизился за время наблюдения на 41,3 % (рис. 4, A). Установлен статистически значимый тренд к снижению частоты выделения резистентных к меропенему штаммов ( p = 0,010), которая по прогнозам снизится до 35 % к 2030 году.
Средний уровень резистентности штаммов K. pneumoniae к имипенему и меропенему схож и составил 23,0 % [3,6–42,9] и 22,9 % [1,8–42,9] соответственно. Сопоставимы также и тренды, характеризующиеся, несмотря на волнообразное течение, устойчивым, статистически значимым увеличением распространенности резистентных к имипенему ( p = 0,003) и меропенему ( p = 0,037) штаммов K. pneumoniae . Согласно прогнозу к 2030 г. более 50 % штаммов данного вида будут резистентными к КП (рис. 4, B).
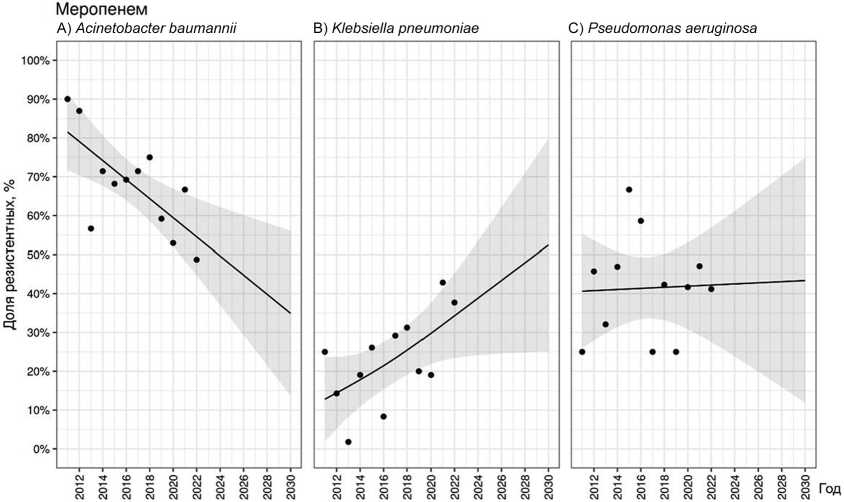
Рис. 4. Прогнозирование резистентности A. baumannii (A), K. pneumoniae (B) и P. aeruginosa (C) к меропенему
Доля чувствительных к имипенему штаммов P. aeruginosa сокращалась на протяжении 12 лет наблюдения. Несмотря на отсутствие линейного характера динамики, средняя доля устойчивых штаммов составила 34,3 % [9,6–56,1]. Общий тренд можно охарактеризовать как значимое нарастание частоты выделения резистентных штаммов ( p = 0,001), которая к 2022 г. составила 50 %. Согласно прогнозу около 75 % штаммов P. aeruginosa будут резистентными к имипенему к 2030 году. В отношении меро-пенема средняя доля устойчивых штаммов составила 41,4 % [25,0–66,7], а прогнозируемая частота выделения к 2030 г. будет сопоставима с ней и составит чуть менее 45 % (рис. 4, C).
Монобактамы
Установлено отсутствие динамики уровня резистентности к азтреонаму штаммов P. aeruginosa и K. pneumoniae . Средняя частота выделения резистентных к азтреонаму штаммов P. aeruginosa составляет 48 % [29,4–62,5], K. pneumoniae — 85,7 % [75–96,9]. Статистически значимых трендов изменения чувствительности данных возбудителей к азтреонаму не установлено.
Аминогликозиды (гентамицин, амикацин, тобрамицин)
Средняя частота выделения резистентных штаммов A. baumannii к амикацину и гентамицину была схожа и составила соответственно 78,1 % [40,0–97,4] и 78,2 % [50,0–98,1]. При этом общие тренды характеризовались нарастанием доли резистентных штаммов статистически значимым в отношении амикацина ( p = 0,091) и незначимым в отношении гентамицина ( p = 0,869). Прогнозируемая частота выделения резистентных штаммов A. baumannii к аминогликозидам достигнет 100 % уже к 2025–2026 гг. (рис. 5, A).
В среднем 52,5 % [13,0–87,5] штаммов K. pneumoniaе были резистентными к амикацину. При этом отмечали два тренда: с 2011 г. по 2016 г. наблюдали стойкое снижение доли устойчивых штаммов на 74,5 %, однако с 2017 г. по 2021 г. определяли обратную динамику (рис. 5, B). Несмотря на незначительное снижение доли резистентных штаммов в 2022 г. по сравнению с 2021 г., общий тренд можно охарактеризовать как увеличение доли резистентных штаммов ( p = 0,481).
Динамика выделения резистентных к амикацину P. aeruginosa подвержена меньшей вариабильности (рис. 5, C), чем для A. baumannii и K. pneumoniae . В среднем только в 35 % [19,1–58,3] случаев штаммы P. aeruginosa были к нему устойчивы. Общий тренд демонстрирует уменьшение частоты выделения резистентных штаммов, но статистическая значимость прогноза низкая ( p = 0,762). При этом в отношении гентамицина с 2011 г. по 2017 г. выявлено стойкое увеличение доли резистентных штаммов P. aeruginosa с 25 % до 83 %, при этом средняя доля составила 41,0 % [25,0–83,0]. С 2019 г. чувствительность P. aeruginosa к гентамицину не определяют.
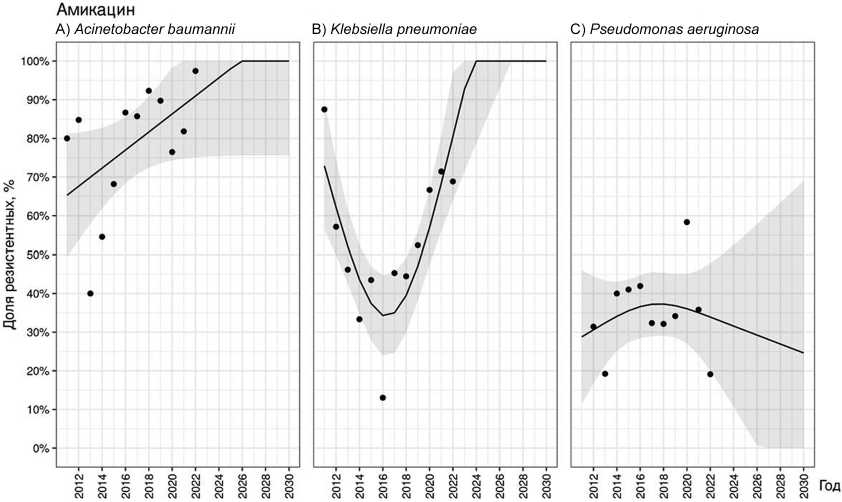
Рис. 5. Прогнозирование резистентности A. baumannii (A), K. pneumoniae (B) и P. aeruginosa (C) к амикацину
Полимиксин Е (колистин)
Средняя частота выделения резистентных к колистину штаммов A. baumannii составила 11,4 % [1,6–25], K. pneumoniae — 13,2 % [6,7–30,8], P. aeruginosa — 15,3 % [1,2–50].
Частота выделения резистентных штаммов A. baumannii была нелинейной: с 2012 г. по 2015 г. отмечали увеличение доли, в последующие четыре года тенденция была обратной (рис. 6, A). Общий тренд можно охарактеризовать как отсутствие выраженной динамики, при этом ожидаемая частота выделения резистентных к колистину A. baumannii близка к средней ( p = 0,390). Чувствительность K. pneumoniae к колистину определяли с 2017 г. Частота выделения резистентных штаммов за эти шесть лет наблюдения имела нелинейный характер (рис. 6, B) с трендом на статистически незначимое снижение уровня резистентности ( p = 0,151). Доля устойчивых к колистину штаммов P. aeruginosa также снижалась на всем протяжении наблюдения (рис. 6, C) и достигла 1,2 % к 2022 г. ( p = 0,054).
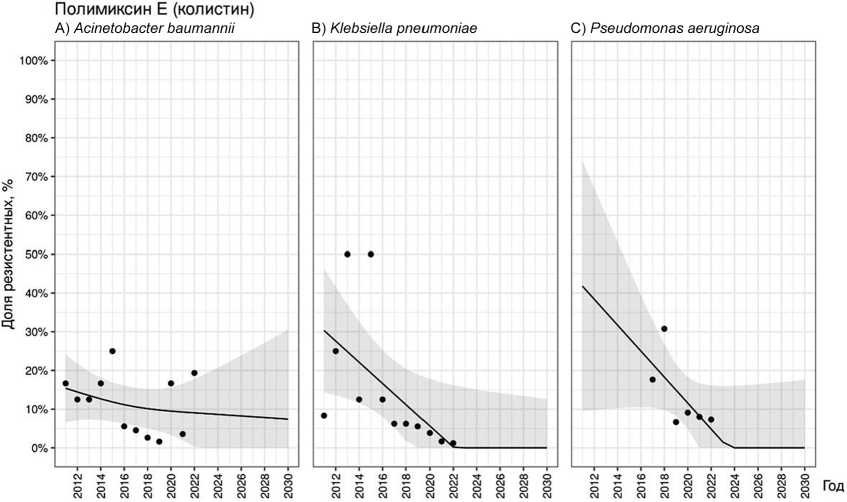
Рис. 6. Прогнозирование резистентности A. baumannii (A), K. pneumoniae (B) и P. aeruginosa (C) к полимиксину Е (колистину)
Фосфомицин
Чувствительность к фосфомицину определяли только для K. pneumoniae , начиная с 2017 г. Средний уровень резистентности к фосфомицину штаммов K. pneumoniae за шесть лет составил 22,4 % [3,6–48,7]. С 2017 г. по 2020 г. наблюдали снижение частоты выделения резистентных к фосфомицину штаммов с 30 % до 5 % с последующим увеличением до 10 % к 2022 г. Тренд установить не удалось ввиду малого количества наблюдений.
ОБСУЖДЕНИЕ
Ассоциированная с ортопедическими имплантатами инфекция требует комплексного подхода, сочетающего радикальную хирургическую обработку гнойного очага с удалением инфицированной металлоконструкции, и проведение этиотропной АБТ. Особенностью АБТ при ИАИ является пролонгированный характер, включающий курс парентерального введения препаратов (7–14 дней) и курс перорального приема (4–8 недель). Однако при лечении пациентов с ИАИ, вызванной Грам(–) бактериями с фенотипами MDR ( англ .: multidrug-resistant) и XDR ( англ .: extensively drug resistant) чувствительности, главной сложностью является ограничение выбора активных в отношении возбудителей препаратов. И если перечень антибиотиков для парентерального применения представлен достаточно широко (ЦС, КП, монобактамы, аминогликозиды, тигециклин, фосфомицин, полимиксин В, диоксидин), то количество препаратов в пероральной форме для проведения ступенчатой АБТ на амбулаторном этапе ограничено (ФХ, ко-тримоксазол, миноциклин и цефиксим).
Частота встречаемости Грам(–) микроорганизмов с MDR и XDR фенотипами чувствительности к антибиотикам, описанная в исследовании N. Benito et al. [9], подтверждена в нашей работе. Ранее по результатам нашего исследования за 12-летний период 2011–2022 гг. к ведущим Грам(–) возбудителям были отнесены K. pneumoniae (4,78 %), P. aeruginosa (3,88 %) и A. baumannii (3,65 %) [8]. Наши данные в целом сопоставимы с результатами отечественных [2] и зарубежных [10] коллег.
Фторхинолоны (ципрофлоксацин, левофлоксацин)
На сегодняшний день ФХ, в частности ципро- и левофлоксацин, являются препаратами, которые широко применяют при лечении пациентов с ОИ. Ципрофлоксацин является препаратом выбора при лечении пациентов с ИАИ, вызванной Грам(–) бактериями, в особенности P. aeruginosa . Он создает высокие концентрации в костной ткани, обладает антибиопленочной активностью (табл. 1), пероральные формы характеризуются высокой биодоступностью [12]. Еще одним положительным моментом является возможность проведения ступенчатой терапии. Несмотря на то, что левофлоксацин немного уступает ципрофлоксацину по степени пенетрации в костную ткань [16], концентрация левофлоксацина в синовиальной жидкости превышает сывороточную, а, по данным научных публикаций, ципрофлоксацин и левофлоксацин характеризуются схожим уровнем активности. Такие фармакокинетические особенности являются причиной широкого применения ФХ при лечении пациентов с ИАИ, вызванной Грам(–) возбудителями. С учетом необходимости назначения АБ-терапии на длительный срок, важно помнить о кардио- и нейротоксичности [13] ФХ, а также повышенном риске разрыва сухожилий, тендинита, аневризмы аорты и различных психических нарушений [12].
Таблица 1
Особенности фармакокинетических параметров основных групп антибиотиков, применяемых при лечении пациентов с ИАИ
|
МНН |
Остаточная/средняя концентрация в крови (мкг/мл)1 |
Концентрация в губчатом/кортикальном слое (мкг/мл) |
Концентрация в синовиальной жидкости (мкг/мл) |
Влияние на биопленки |
Возможность ступенчатой АБТ |
Степень выраженности НР1 |
Источники |
|
Фторхинолоны |
ципро — 0,2; лево — 0,6 |
ципро — 13,8/13,8; лево — 10/4,6 |
ципро — хорошо проникает1; лево — 8,9 |
да |
да |
+ |
[11–14] |
|
Триметоприм / сульфаметоксазол |
1,3–2,8/32–63 |
Соотношение C в сыворотке крови к костной ткани для триметоприма 1,2; для сульфаметоксазола — 0,36 |
нет |
да |
++ |
[15–17] |
|
|
ЦС III поколения |
цефтриаксон — 10,5; цефтазидим — 3 |
цефтриаксон — НД/10,7; цефтазидим — 32,1/32,1 |
цефтриаксон 60–100 % от С в плазме; цефтазидим — 25,6 |
нет |
нет |
+ |
[11, 16, 18] |
|
Цефоперазон+ [сульбактам] |
69,23/6,49 |
хорошо проникает1 |
хорошо проникает1 |
нет |
нет |
+ |
[19, 20] |
|
Цефепим |
0,7 |
67,6/99,8 |
плохо проникает |
нет |
нет |
+ |
[16, 21] |
|
Карбапенемы |
меропенем — 8,0; имипенем — 1,0 |
меропенем — 10,6/10,6; имипенем — 2,6/2,6 |
меропенем — 12,5; имипенем — 13,8 |
да/нет |
нет |
+ |
[16, 22, 23] |
|
Азтреонам |
не существует; С max — 90 |
16 (20 % от C в сыворотке) |
83 (95 % от C в сыворотке) |
да |
нет |
+ |
[16, 24] |
|
Аминогликозиды |
гентамицин — 2,0; амикацин — 10 |
низкие C1 |
25–50 % от C в сыворотке |
на незрелые |
нет |
+++ |
[16, 25, 26] |
|
Полимиксин В |
2,0 |
НД |
плохо проникает1 |
да ( in vitro ) |
нет |
+++ |
[27–31] |
|
Фосфомицин |
11,4 |
проникает хорошо, соотношение C в костях и плазме 0,43 |
хорошо проникает1 |
да |
нет |
++ |
[16, 32–37] |
Примечание : 1 — Реестр ОХЛП и ЛВ ЕАЭС, Государственный реестр лекарственных средств. Обозначения: C — концентрация, НД — нет данных, C max — максимальная сывороточная концентрация.
По данным платформы AMRmap, в России к ципрофлоксацину устойчивы 93 % штаммов P. aeruginosa , изолированных от пациентов с инфекцией костей и суставов за период 2012–2022 гг., что на 37 % выше, чем за период 2002–2012 гг. Для A. baumannii и K. pneumoniae также отмечают рост доли резистентных к ципрофлоксацину штаммов, — с 76 % до 93 % и с 66 % до 84 % соответственно [38]. В нашем исследовании для всех указанных возбудителей также получен статистически значимый тренд на рост резистентности к ципрофлоксацину ( p = 0,025 для A. baumannii и p = 0,018 для K. pneumoniae и P. aeruginosa ). Рост резистентности к левофлоксацину выявлен только для A. baumannii ( p = 0,012). При этом в последние годы доля резистентных к ципрофлоксацину штаммов A. baumannii и K. pneumoniae стремится к 100 %, а резистентность P. aeruginosa к концу периода исследования составила 63 %. Катастрофический рост резистентности к ФХ основных Грам(–) бактерий отмечают и зарубежные исследователи [39].
Помимо высочайшего уровня резистентности еще одним сложным вопросом, на который мы не нашли однозначного ответа, является целесообразность применения ФХ в монотерапии в случае, когда инфекция вызвана резистентным к антибиотикам штаммом Грам(–) бактерии. Попытки комбинировать ФХ при наличии к ним резистентности с представителями других групп антибиотиков не выглядят убедительно. O. Grossi et al. показали, что дополнительное назначение пероральных ФХ к продленной инфузии бета-лактамных антибиотиков, активных в отношении бактерий, весь период лечения (медиана — 90 суток) не оказало значимого влияния на исход лечения пациентов с ИАИ, вызванной резистентными к ФХ штаммами [40].
Сульфаметоксазол-триметоприм (ко-тримоксазол)
Одной из альтернатив ФХ с позиции возможности проведения ступенчатой АБТ ОИ, вызванной Грам(–) бактериями (за исключением природно резистентной Р. aeruginosa ), является ко-тримоксазол. Благодаря синергизму его компонентов (триметоприм и сульфаметоксазол) ко-тримоксазол оказывает бактерицидное действие в относительно невысоких концентрациях [41]. К тому же препарат хорошо проникает в костную ткань (см. табл. 1), в перечень показаний к его применению внесен острый и хронический остеомиелит, его можно назначать в виде ступенчатой терапии. Однако в отличие от ФХ у ко-тримоксазола отсутствует антибиопленочная активность [16].
Применение ко-тримоксазола для лечения пациентов с ОИ, вызванной Грам(–) возбудителями, крайне мало освещено в литературе. Самое крупное исследование его эффективности включало 51 пациента с инфекцией костей и суставов. Однако во всех случаях препарат назначали в составе комбинированной АБТ, поэтому оценить его персональный вклад не представляется возможным [42]. Ранее нами показано, что назначение ко-тримоксазола на амбулаторном этапе при лечении пациентов с ИАИ, вызванной K. pneumoniae , значимо улучшало вероятность благоприятного исхода ( p = 0,038) [43]. Есть публикации, посвященные опыту применения ко-тримоксазола для лечения пациентов с инфекциями костей и суставов, вызванных E. сloacae , Burkholderia spp . и Stenotrophomonas maltophilia . На фоне длительной терапии ко-тримоксазолом возможно развитие различных побочных реакций разной степени выраженности, прежде всего со стороны системы кроветворения и кожных покровов [15].
По данным отечественных ученых, более 70 % штаммов K. pneumonia и A. baumannii , изолированных от пациентов с ОИ, устойчивы к ко-тримоксазолу [2, 44]. По данным платформы AMRmap, в России в периоды 2002–2012 гг. и 2012–2022 гг. к данному препарату были резистентны соответственно 50 % и 54 % штаммов A. baumannii и 61 % и 69 % представителей семейства Entrobacteriaceae , изолированных от пациентов с инфекцией костей и суставов [38]. В нашем исследовании картина более негативна: резистентность A. baumannii к ко-тримоксазолу составила 74,8 %, K. pneumoniae — 81,9 %.
Бета-лактамные антибиотики
Данные препараты характеризуются в целом хорошей пенетрацией в костную ткань (см. табл. 1), при этом они обладают различной активностью в отношении Грам(–) бактерий.
Цефалоспорины
Потенциальную активность в отношении Грам(–) бактерий оказывают ЦС III и IV поколений, включая ингибиторозащищенные формы. При этом они официально зарегистрированы для лечения пациентов с инфекциями костей и суставов, за исключением цефиксима, единственного препарата в форме для перорального приема среди ЦС III поколения. Применение цефиксима для проведения ступенчатой АБТ в травматологии-ортопедии значительно ограничивает плохая пенетрация в костную ткань, а также природная устойчивость к нему P. aeruginosa и некоторых представителей семейства Enterobacteriaceae . Поэтому эффективность данного препарата для амбулаторного лечения пациентов с инфекциями костей и суставов остается неизученной. В нашем исследовании мы также не проводили оценку доли резистентных к препарату штаммов Грам(–) бактерий.
Несмотря на заявленную активность цефтриаксона в отношении некоторых Грам(–) бактерий, в том числе представителей семейства Enterobactiaceae и A. baumannii , публикаций, посвященных его применению при ИАИ Грам(–) этиологии, мы не нашли. Вероятно, это связано с высоким уровнем резистентности к нему (до 90 % штаммов) A. baumannii и K. pneumoniae , а также природной устойчивостью P. aeruginosa . В нашем исследовании к 2020–2022 гг. 85 % штаммов K. pneumoniae были устойчивы к данному препарату [76,9–96,4].
В течение длительного времени основным показанием для назначения цефтазидима была инфекция, вызванная P. aeruginosa . По данным платформы ARMmap, доля резистентных к цефтазидиму штаммов P. aeruginosa , изолированных от пациентов с инфекцией костей и суставов, за 2002–2022 гг. составляет 33–39 %. Чувствительность K. pneumoniae и A. baumannii не определяют [38]. По нашим данным, устойчивость к цефтазидиму штаммов P. aeruginosa составляла в среднем 45,9 % без определенного тренда в течение всего периода наблюдения, что может быть связано с ограничением применения этого препарата для лечения пациентов с ОИ.
Спектр действия цефоперазона — это преимущественно Грам(–) бактерии, включая P. aeruginosa, что выгодно отличает его от цефтриаксона, при этом он хорошо проникает в костную ткань и синовиальную жидкость (см. табл. 1). Однако клинически более значимой является комбинация цефоперазона с ингибитором бета-лактамаз сульбактамом. Такая комбинация повышает антимикробную активность препарата, включая даже некоторые КП-резистентные штаммы A. baumannii, что позволяет рассматривать его в качестве препарата для таргетной эмпирической АБТ. По данным C. Rou-Zhen et al. эффек- тивность применения цефоперазона+[сульбактама] при лечении пациентов с инфекцией, вызванной Грам(–) бактериями, в ряде случаев превосходит успех применения не только незащищенных ЦС III поколения, но и даже карбапенемов. Возможно, это связано с более медленным развитием устойчивости на фоне снижения риска селекции резистентных штаммов [17].
По нашим данным, наибольшую активность антибиотик сохраняет в отношении P. aeruginosa , несколько меньшую в отношении A. baumannii и K. pneumoniae . Беспокойство вызывает выявленный статистически значимый тренд роста доли резистентных к цефоперазону+[сульбактаму] штаммов A. baumannii ( p = 0,027) и P. aeruginosa ( p = 0,010), при этом чувствительность к нему выше, чем для остальных ЦС и сопоставима с КП. Одной из серьезных побочных реакций, развивающихся на фоне применения цефоперазона+[сульбактама], является гипокоагуляция, что необходимо учитывать при назначении препарата, особенно пациентам пожилого возраста и длительным курсом [20].
Цефепим активен в отношении большинства Грам(–) микроорганизмов, за исключением Stenotrophomonas maltophilia . По данным платформы ARMmap, доля устойчивых к данному антибиотику штаммов представителей семейства Enterobacteriaceae , изолированных от пациентов с инфекцией костей и суставов, за 20 лет увеличилась с 43 % до 58 % [38]. По нашим данным, для K. pneumoniae резистентность к цефепиму была выше и составила 86,3 %, для P. aeruginosa — 49,1 %, не изменяясь существенно в течение всего периода наблюдения. Учитывая плохое проникновение в синовиальную жидкость (см. табл. 1) и относительно высокий уровень резистентности к нему Грам(–) бактерий, це-фепим не имеет зарегистрированных показаний, его практически не применяют для лечения пациентов с ОИ.
Карбапенемы
КП обладают самым широким спектром действия среди β -лактамных антибиотиков и в течение длительного времени являются антибиотиками выбора для лечения пациентов с инфекцией, вызванной Грам(–) бактериями — продуцентами β -лактамаз расширенного спектра (БЛРС). В перечне показаний к имипенему+[циластатину] фигурирует инфекция костей и суставов, вызванная только P. aeruginosa , а у меропенема такое показание отсутствует. Оба карбапенема широко применяют при лечении пациентов с ОИ, вызванной резистентными к ФХ и ЦС Грам(–) бактериями. Это обусловлено тем, что КП достигают достаточно высоких концентраций в костной ткани и синовиальной жидкости (см. табл. 1), позволяющих превысить МИК для большинства Грам(–) бактерий.
В последние годы крайне настораживающей выглядит тенденция к росту доли Грам(–) бактерий, демонстрирующих устойчивость к этим препаратам. По результатам мультицентрового исследования (2000–2015 гг.), у 91 пациента (72 %) с ИАИ были изолированы бактерии-продуценты БЛРС, а резистентность к КП зарегистрирована в 12 случаях (9 %) [7]. По данным платформы AMRmap, к меропенему резистентны 70 % штаммов A. baumannii , 25 % K. pneumoniae и 40 % P. aeruginosa , изолированных от пациентов с инфекцией костей и суставов за период 2012–2022 гг., причем для всех трех патогенов наблюдали выраженный рост резистентности по сравнению с периодом 2002–2012 гг. Аналогичная тенденция отмечена и для имипенема [38]. В нашем исследовании мы также наблюдали аналогичный статистически значимый рост доли резистентных штаммов K. pneumoniae ( p = 0,003) и P. aeruginosa ( p = 0,001) к имипенему, который отсутствовал для A. baumannii . При этом выявлен весьма интересный тренд на статистически значимое снижение доли резистентных штаммов A. baumannii к меропенему ( p = 0,037), который расходится с результатами зарубежных и отечественных авторов и, вероятно, является локальной находкой, не имеющей научной ценности.
Монобактамы
Единственный на сегодняшний день представитель группы, азтреонам, природно активен в отношении большинства существующих Грам(–) бактерий, в том числе продуцентов БЛРС, за исключением A. baumannii . Чувствительность к препарату, по данным платформы ARMmap, сохраняют 66,5 % штаммов Pseudomonas spp . и 38,5 % штаммов представителей семейства Enterobacteriaceae , изолированных от пациентов с инфекцией костей и суставов за период 2003–2022 гг., без какой-либо определенной динамики [38]. По результатам нашего исследования, чувствительными к азтреонаму были 52 % штаммов P. aeruginosa и 14,3 % K. pneumoniae . При этом уровень резистентности был стабильным в течение всего периода наблюдения.
Азтреонам создает в синовиальной жидкости концентрацию, сопоставимую с сывороточной, однако в костную ткань пенетрирует в пять раз меньше препарата (см. табл. 1). Систематический обзор A.K. Thabit et al. показал, что после болюсного введения нагрузочной дозы препарата его концентрация в губчатой ткани кости и синовиальной жидкости превышала концентрацию меропенема в 1,5 и 6,6 раза соответственно [16]. Однако у препарата отсутствует зарегистрированное показание для лечения пациентов с инфекцией костей и суставов, и его не применяют в рутинной клинической практике для лечения пациентов с ИАИ и остеомиелитом. Имеющиеся публикации посвящены оценке комбинированного применения азтреонама с цефтазидимом+[авибактамом] в случае, когда ОИ вызвана XDR штаммами Грам(–) бактерий. Исследователи рекомендуют одновременное проведение синхронных инфузий через разные порты катетера или через различные венозные доступы. Применение данной комбинации способствует охвату максимального перечня Грам(–) бактерий с экстремальной резистентностью и панрезистентностью даже при наличии устойчивости к каждому из них [24].
Прочие антибактериальные препараты резерва: аминогликозиды, фосфомицин, полимиксин В
Данные препараты не относят к препаратам выбора при лечении пациентов с ОИ, а применяют при наличии резистентности возбудителей к ФХ, β -лактамам и ко-тримоксазолу в качестве этиотропной АБТ.
Аминогликозиды — антибактериальные препараты, к которым природно чувствительны подавляющее большинство Грам(–) бактерий. На территории РФ для системной АБТ чаще всего применяют гентамицин и амикацин. Аминогликозиды хорошо накапливаются в тканях с активным кровоснабжением и гораздо хуже в костной ткани [16], поэтому для создания терапевтических концентраций кости и суставной жидкости необходимо применение высоких доз этих препаратов, что повышает риск развития нежелательных реакций (см. табл. 1), в первую очередь нефро- [25] и ототоксичности [26]. Поэтому аминогликозиды не нашли широкого применения для лечения пациентов с ОИ. По данным платформы ARMmap, к гентамицину были устойчивыми 76 % штаммов Acinetobacter spp . и 60 % штаммов K. pneumoniae , изолированных от пациентов с инфекцией костей и суставов за период 2012–2022 гг. [38]. В нашем исследовании получены идентичные результаты: 78,2 % штаммов A. baumannii были резистентны к гентамицину, при этом отмечен тренд на рост доли резистентных штаммов без статистической значимости.
Амикацин в сравнении с гентамицином демонстрирует несколько большую активность в отношении изученных штаммов. По данным платформы ARMmap, к амикацину были устойчивыми 33 % штаммов Pseudomonas spp ., 30 % K. pneumoniae и 84 % Acinetobacter spp ., изолированных от профильных пациентов за период 2012–2022 гг. с отрицательной динамикой по сравнению с периодом 2002–2012 гг. [38]. По нашим данным, уровень резистентности к амикацину для A. baumannii составил 78,1 %, P. aeruginosa — 35 % и K. pneumoniae — 52,5 %, что в целом сопоставимо с общероссийскими данными, однако конкретного тренда не выявлено.
Фосфомицин обладает активностью в отношении большого количества Грам(–) бактерий, в том числе представителей семейства Enterobacteriaceae , и некоторых штаммов P. aeruginosa , однако природно неактивен в отношении A. baumannii . Препарат характеризуется наличием выраженного синергидного действия при сочетании с бета-лактамами, ФХ или аминогликозидами в отношении широкого спектра Грам(–) аэробных бактерий. Фосфомицин хорошо проникает в костную ткань и имеет зарегистрированное показание, — лечение пациентов с инфекцией костей и суставов (см. табл. 1) [34].
В нашем центре средняя частота выделения резистентных к фосфомицину штаммов K. pneumoniae за 12 лет составила 22,4 %. Однако наличие какого-либо тренда установить не удалось ввиду малого числа наблюдений: чувствительность к данному антибиотику определяли по запросу врачей только для штаммов с экстремальной резистентностью. По данным платформы AMRmap, только 14 % штаммов представителей семейства Enterobacteriaceae , изолированных от пациентов с инфекцией костей и суставов, были устойчивы к фосфомицину, а для 35 % штаммов Pseudomonas spp . МПК фосфомицина составляла 64 мг/л [38] .
Фосфомицин для лечения пациентов с ОИ широко применяют во всем мире, однако его использование в монотерапии не рекомендуется из-за быстрого формирования резистентности и снижения эффективности при наличии большого количества бактериального инокулята, что характерно для инфекций костей и суставов [35]. Наличие выраженного синергизма комбинаций фосфомицина с колистином Е в экспериментах in vitro в отношении K. pneumoniae и P. aeruginosa в составе биопленок, а также с КП при лечении пациентов с инфекцией, вызванной трудной для эрадикации P. aeruginosa , является серьезным обоснованием применения фосфомицина в составе комбинированной терапии [35].
Полимиксин В активен в отношении исключительно Грам(–) микроорганизмов. Устойчивость является перекрестной с колистином (полимиксином Е), поэтому оценку чувствительности к полимиксину В традиционно оценивают по колистину. Резистентность к этому препарату Грам(–) бактерий в отдельных странах Южно-Восточной Азии и Средиземноморья достигает 10 %, однако в большинстве стран, в том числе и в РФ, полимиксин В сохраняет свою активность в отношении наиболее проблемных
Грам(–) бактерий, в том числе продуцентов различных карбапенемаз [29]. В нашем исследовании частота выделения резистентных к колистину штаммов выше и составляет для A. baumannii в среднем 11,4 %, для K. pneumoniae — 13,2 % и для P. Aeruginosa — 15,3 %, что обусловлено определением чувствительности к нему только для полирезистентных и панрезистентных штаммов. Значимой динамики уровня резистентности для A. baumannii и K. pneumoniae не установлено ввиду малого числа наблюдений.
Особенностью применения полимиксина В является высокая частота нежелательных реакций: почечная и мочевая дисфункция, острая почечная недостаточность и нейротоксичность. Препарат плохо проникает в костную ткань и синовиальную жидкость (см. табл. 1), но при этом обладает выраженной антибиопленочной активностью за счет воздействия на метаболически неактивные клетки в составе внутренних слоев биопленки. Однако такой эффект проявляется при местном применении полимиксина, при системном введении он существенно ниже, а повышенные дозы антибиотика ведут к увеличению частоты нежелательных реакций. Поэтому J. Lora-Tamayo et al. рекомендуют применять комбинацию колистина с другими активными в отношении Грам(–) бактерий антибиотиками: ЦС, КП и др. [30].
Клиническая эффективность применения колистина подтверждена результатами многоцентровых исследований. В многоцентровом исследовании A. Papadopoulos et al. (2000–2015 гг.) на фоне комбинированной терапии с колистином частота благоприятных исходов среди пациентов с ИАИ, вызванной ХRD-штаммами, в сравнении с MDR-штаммами бактерий составила соответственно 66,7 % и 39,1 % ( p = 0,018). Поэтому авторы рекомендовали применять колистин при отсутствии альтернативы [7]. В другом исследовании показано убедительное преимущество применения комбинации внутривенных инфузий бета-лактамов и полимиксина при лечении 44 пациентов с ИАИ, вызванной полире-зистентными Грам(–) микроорганизмами, при этом нежелательные реакции развились лишь в 10 % случаев и были полностью обратимыми [31].
К ограничениям исследования можно отнести его ретроспективный дизайн и локальный характер данных. Прогнозы резистентности микроорганизмов к антибактериальным препаратам требуют подтверждения в дальнейших исследованиях.
ЗАКЛЮЧЕНИЕ
Несмотря на негативную динамику увеличения доли резистентных к цефоперазону+[сульбактаму], меропенену и имипенему+циластатину штаммов ведущих Грам(–) бактерий, применение для тар-гетной эмпирической стартовой терапии защищенного цефалоспорина представляется более рациональным в виду меньшего риска селекции устойчивых к нему штаммов. Фторхинолоны, кар-бапенемы целесообразно применять только при доказанной к ним чувствительности. Полимиксин В и фосфомицин необходимо рассматривать как препараты резерва для лечения инфекции, вызванной устойчивыми к другим антибиотикам штаммами, и назначать только в составе комбинированной терапии. Аминогликозиды и незащищенные цефалоспорины в связи с особенностями фармакокинетики и высоким уровнем устойчивости являются альтернативой только при невозможности назначения более активных препаратов. Остается ограниченным перечень препаратов для перорального приема на амбулаторном этапе (фторхинолоны, ко-тримоксазол), необходимы дополнительные исследования оценки эффективности их применения при лечении пациентов с ИАИ, вызванной резистентными Грам(–) бактериями.


