Остеоинтеграция сетчатых конструкций никелида титана и репаративное костеобразование при их имплантации
Автор: Ирьянов Юрий Михайлович, Борзунов Дмитрий Юрьевич, Чернов Владимир Федорович, Чернов Александр Владимирович, Дюрягина Ольга Владимировна, Аксенов Дмитрий Иванович
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 4, 2014 года.
Бесплатный доступ
Цель. Изучить особенности остеоинтеграции сетчатых конструкций никелида титана и репаративное костеобразование в условиях их имплантации в дефект кости. Материал и методы. В эксперименте на крысах и собаках моделировали дефект большеберцовых костей и осуществляли введение имплантата из сетчатых конструкций никелида титана. Использовали методы рентгенографии, сканирующей электронной микроскопии и рентгеновского электронно-зондового микроанализа. Результаты. Установлено, что имплантат из никелида титана является биосовместимым и обладает остеокондуктивными свойствами, вокруг него образуется зона остеогенеза и ангиогенеза, формируется костный футляр. В ранние сроки происходит остеоинтеграция структур имплантата и органотипическое ремоделирование регенерата, дефект замещается пластинчатой костной тканью по типу первичного заживления костных ран. Заключение. Имплантат из сетчатых конструкций никелида титана является одним из наиболее оптимальных костнопластических материалов, а его применение представляется теоретически обоснованным и перспективным.
Имплантат, никелид титана, дефект кости, репаративный остеогенез
Короткий адрес: https://sciup.org/142121798
IDR: 142121798 | УДК: [669.295.5:
Текст научной статьи Остеоинтеграция сетчатых конструкций никелида титана и репаративное костеобразование при их имплантации
Для замещения дефектов костной ткани широко применяют различные имплантаты из материалов биологического и небиологического происхождения [3, 10]. «Золотым стандартом» считался аутотрансплантат из крыла подвздошной кости, обладающий остеоиндуктивными, остеокондуктивными и остеогенными свойствами. Однако применение ауто- и, особенно, аллоимплантатов может сопровождаться развитием ряда серьезных осложнений [1]. В настоящее время интенсивно развиваются новые медицинские технологии, связанные с применением имплантатов из никелида титана [2, 6, 14, 15]. Было показано, что при имплантации тонких сетчатых конструкций из отечественного никелида титана формируется полноценная плотная соединительная ткань, замещающая дефект мышечно – апоневротического слоя брюшной стенки. Отмечена хорошая приживаемость такого имплантата даже в условиях гнойной инфекции. Известно, что механические свойства сплавов на ос-
МАТЕРИАЛ
Эксперименты выполнены на 40 половозрелых крысах линии Wistar и 5 собаках с соблюдением «Правил проведения работ с использованием экспериментальных животных». С применением общей анестезии в проксимальной трети диафиза большеберцовой кости нове никеля и титана приближаются к механическим характеристикам костной ткани и являются биосовме-стимыми [6, 9, 11]. Вместе с тем, при использовании имплантатов на основе титана, выполненных в виде сплошного блока, установлен неоднозначный остеозамещающий эффект, что было показано в долгосрочных экспериментах на животных [5], а механическое восполнение дефекта кости с помощью биоинертных имплантатов малоперспективно. Более ценным представляется использование имплантатов, выполненных в виде каркасов с биоактивной наноструктурированной поверхностью. Развитие данного направления является актуальным, перспективным и требует дальнейших фундаментальных и прикладных исследований.
Цель работы. Изучить особенности остеоинтеграции сетчатых конструкций из никелида титана и репаративного костеобразования при замещении дефекта кости.
И МЕТОДЫ у животных с помощью фрезы при малых оборотах моделировали окончатый дефект. Непосредственно после операции в зону дефекта помещали стерильный имплантат, который изготавливали из биосовместимой никелидтитановой проволоки марки ТН-10 калибром
90 мкм. Имплантат представлял собой тонкие сетчатые конструкции с ячеями 0,2-0,3 мм [7, 8]. Физическая пористость имплантата, рассчитанная нами с использованием метода гидростатического взвешивания, составляла 70-75 %. Животным осуществляли рентгенологический контроль сразу после операции и после завершения эксперимента. Крыс выводили из эксперимента через 7, 14, и 30 суток после операции, собак – через 180 и 360 суток. Оперированные кости фиксировали в смеси, состоящей из 2 % раствора параформальдегида и глутаральдегида и 0,1 % раствора пикриновой кислоты на 0,1 М фосфатном буфере при рН 7,4, и заливали в аралдит. Аралдитовые блоки полировали и исследовали при помощи рентгеновского электронно-зондового микроанализатора INCA-200 Energy (OXFORD INSTRUMENTS, Англия) в характеристическом рентгеновском излучении кальция для выявления минерализованного матрикса и доказательства остеогенной дифференцировки клеток. Определяли содержание кальция и фосфора в костной ткани регенерата. Поверхность блоков протравливали в 2 % растворе этиолята натрия. Полученные коррозионные препараты напыляли сплавом платины и палладия, используя ионно-вакуумный напылитель IB6 (Eiko, Япония) при ионном токе 6 мА и межэлектродном напряжении 1.5 kV. Изучение объектов проводили в сканирующем электронном микроскопе JSM-840 (JEOL, Япония) в режиме регистрации вторичных и отраженных электронов при ускоряющем напряжении 20 kV. Захват и обработку видеоизображения осуществляли с использованием программно-аппаратного комплекса INCA-200 Energy (OXFORD INSTRUMENTS, Англия).
Результаты количественных исследований обрабатывали методами вариационной статистики. Значимость различий сравниваемых параметров рассчитывали с использованием t-критерия Стьюдента. Различия считали значимыми при уровне р < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рентгенограммах у всех животных после операции отмечается дефект метафиза большеберцовой кости с четкими контурами краев. В дефекте отчетливо выявляется имплантат. Сканирующая электронная микроскопия показала, что микрорельеф поверхности использованной для изготовления имплантата никелид-титановой нити характеризуется резко выраженной шероховатостью и наноструктурированностью, наличием множества поверхностных макро- и микропор неправильной формы, некоторые из которых имеют размеры менее 100 нм (рис. 1). Имплантат хорошо фиксировался в дефекте, благодаря адгезивности, сверхэластичности и хорошей смачиваемости материала. Результаты электронно-зондового микроанализа показали, что через 7 суток после операции вокруг никелидтитановых нитей имплантата располагаются многочисленные трабекулы новообразованной костной ткани, образующие обширные кальцифицированные участки (рис. 2, а). По данным сканирующей электронной микроскопии замещение дефекта осуществляется по типу первичного заживления костных ран с минимальным образованием грануляционной ткани. При этом формируется плотное остеоинтегративное соединение никелидтитано-вых нитей имплантата с костной тканью регенерата без образования фиброзной капсулы и хряща. Благодаря высокой биосовместимости никелидтитановых нитей в ранние сроки после операции на их поверхности отмечается адгезия остеогенных клеток, которые формируют толстые слои остеоида, образованные сетью тонких коллагеновых волокон и их пучков, ориентированных преимущественно в продольном, относительно структур имплантата, направлении (рис. 2, б). Остеоид вокруг имплантата образуют крупные функционально активные остеобласты, секретирующие коллаген и протеогликаны костного матрикса, о чем свидетельствует мелкобугристый тип их микрорельефа и процессы перицеллюлярного фибриллогенеза у клеточной поверхности. Прикрепление остеобластов к материалу структур имплантата осуществляется с помощью фокальных контактов цитоплазматических отростков, разветвляющихся на концах и образующих специализированные структуры – заякоривающие соединения. Характерным признаком кальцифицирующей активности остеобластов является наличие в зоне взаимодействия с поверхностью имплантата субклеточных образований – матриксных везикул, являющихся инициальными центрами минерализации. Количественные показатели минерализации в зоне остеоинтеграции имплантата и в костной ткани регенерата в дефекте кости у крыс через 7 суток после операции представлены в таблице 1.

Рис. 1. Микроархитектоника никелидтитановых нитей имплантата: а – пространственная организация нитей в имплантате; б – микрорельеф поверхности нити; сканирующая электронная микроскопия, изображение во вторичных электронах

Рис. 2. Регенерат в дефекте через 7 суток после операции: а – кальцифицированная костная ткань вокруг нитей имплантата, карта рентгеновского электронно-зондового микроанализа, изображение в характеристическом рентгеновском излучении кальция, ув. ×100; б – коллагеновые волокна остеоида на поверхности имплантата; сканирующая электронная микроскопия, изображение во вторичных электронах, ув. ×2200
Таблица 1
Содержание кальция, фосфора и серы в различных участках регенерата через 7 суток после операции, %, М±m
|
Исследованные участки |
Кальций (Са) |
Фосфор (Р) |
Са/Р |
Сера |
|
Зона остеоинтеграции |
2,40±0,111 |
1,80±0,121 |
1,33±0,051 |
0,47±0,021 |
|
Костная ткань регенерата |
7,94±0,4 |
5,06±0,21 |
1,59±0,07 |
0,14±0,01 |
Примечание. 1 – значимые изменения по сравнению с костной тканью регенерата.
Полученные данные свидетельствуют, что в зоне остеоинтеграции величина коэффициента Са/Р, отражающая качественный состав апатита, уменьшена по сравнению с костной тканью регенерата. Это указывает на наличие в этой области преимущественно аморфного фосфата кальция, что согласуется с литературными данными [4], в которых отмечается необходимость наличия поверхностного слоя аморфного гидроксиапатита для образования остеоинтегративного соединения. Повышенное содержание серы, химического маркера сульфатированных гликозаминогликанов, свидетельствует о высокой активности специфического биосинтеза в остеобластах, локализованных в этой области, направленного на образование, секрецию и накопление в матриксе сульфатированных гликозаминогликанов, играющих важную роль в формообразовательных процессах и обеспечении структурной организации коллагеновых макромолекул и архитектоники коллагеновых волокон в процессе фибриллогенеза [12, 13]. Благодаря высокой пористости имплантата ткани регенерата легко прорастают в его толщу. Установлено, что не только на поверхности имплантата, но и внутри него формируются многочисленные сосуды и трабекулы новообразованной костной ткани. Часто обнаруживаются остеоцитарные лакуны характерного строения, одной из стенок которых является поверхность имплантата. Развитие остеогенной дифференцировки клеток на поверхности и в толще имплантата доказывается наработкой ими специфического кальцифицированного матрикса. Репаративное костеобразование при этом осуществляется по типу прямого интрамембранного остеогенеза и распространяется по всему объему дефекта. Через 14 суток после операции вокруг структур имплантата и на их поверхности определяются зоны активного аппозиционного косте- образования. В регенерате наблюдается интенсивный неоангиогенез, фаза органогенеза и ремоделирования, о чем свидетельствует перестройка трабекул грубоволокнистой костной ткани в первичные остеонные структуры (остеоногенез). Область дефекта частично закрывается новообразованной пластинчатой костной тканью, имеющей признаки остеокластической резорбции. Кровеносные сосуды микроциркулятор-ного русла, остеогенные клетки и костные структуры не только прилежат к поверхности имплантата, но и врастают в него, что обеспечивает приобретение имплантатом не только остеокондуктивных, но и остео-индуктивных и остеогенных свойств. Через 30 суток после операции в дефекте кости формируется костный регенерат, образованный пластинчатой костной тканью, глубоко врастающий в сетчатые конструкции имплантата. Имплантат заполняется сосудами и периваскулярными остеогенными клетками, формирующими костную ткань по типу интерстициального остеогенеза. Первичные остеоны грубоволокнистой костной ткани замещаются органотипическими вторичными остеонами пластинчатой костной ткани. Эксперименты, выполненные на собаках, показали, что замещение дефекта кости осуществляется по типу первичного заживления костных ран (рис. 3, 4). Благодаря высокой биосовместимости имплантата характерным признаком репаративного костеобразования является полное отсутствие периостальной реакции. При этом дефект надкостницы замещается новообразованной плотной волокнистой соединительной тканью (рис. 3, б). Минеральный состав новообразованной костной ткани регенерата к концу эксперимента приближается к составу минеральной фазы зрелой костной ткани кортикального слоя неповрежденной большеберцовой кости.
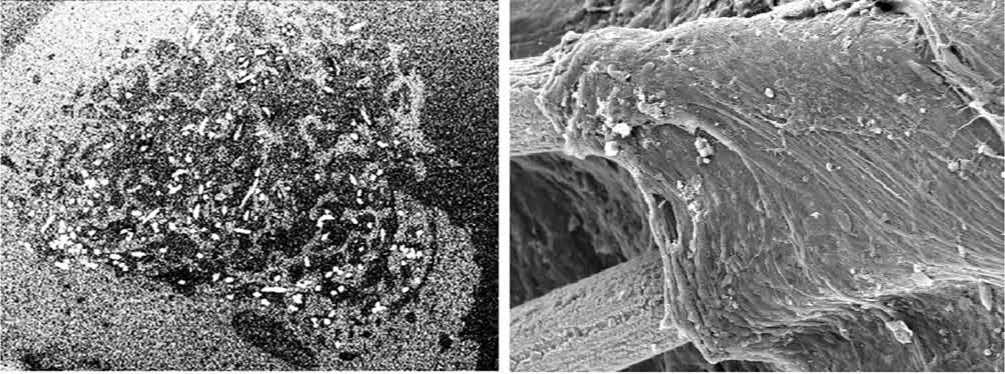
2mm 1 3 1 ЮОмкт 1 б
Рис. 3. Регенерат в дефекте метафиза большеберцовой кости собаки через 180 суток после операции: а - костная ткань, формирующаяся на сетчатом каркасе из никелидтитановых нитей; сканирующая электронная микроскопия полированной поверхности аралдитово-го блока, изображение в отраженных электронах, ув. × 30; б – новообразованная плотная волокнистая соединительная ткань в дефекте надкостницы; сканирующая электронная микроскопия, изображение во вторичных электронах, ув. × 600
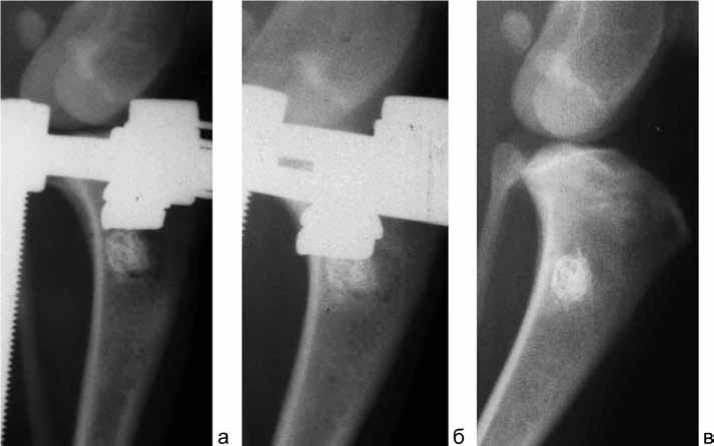
Рис. 4. Рентгенограммы большеберцовой кости собаки сразу после операции (а), через 14 (б) и 30 (в) суток после операции
ЗАКЛЮЧЕНИЕ
Таким образом, установлено, что никелидтитано-вые элементы имплантата обеспечивают аффинитет к костной ткани, врастание ее в трехмерную структуру имплантата и наиболее благоприятные условия для адгезии и функционирования периваскулярных клеток, что способствует экспрессии остеогенных факторов и остеогенной дифференцировке клеток, массовому накоплению минерализованного матрикса. Это активизирует остеогенез в предимплантационной зоне и позволяет сформировать остеоинтегративное соединение и замещение дефекта в наиболее ранние сроки. Имплантат из сетчатых конструкций никелида титана является не только эффективным остеокондуктором, обеспечивающим пролонгированную активизацию репаративного костеобразования, но благодаря про- растанию костной ткани, содержащей остеоиндукторы (факторы роста и костные морфогенетические белки), выделяющиеся при остеокластической резорбции, приобретает свойства остеогенности и остеоиндуктивности, что способствует трехмерному пространственному развитию костной ткани в дефекте. Простота технологии изготовления имплантата, относительная атравматичность оперативного вмешательства, отсутствие биологической реакции отторжения ставят исследованный имплантат в ряд наиболее оптимальных костнопластических материалов, а его применение представляется теоретически обоснованным и перспективным, особенно в условиях уменьшения индивидуального остеогенетического потенциала у пациентов зрелого и пожилого возраста.


