Острейшая стадия инфаркта миокарда: влияние блокады IF на изолированное сердце крыс
Автор: Купцова А.М., Бугров Р.К., Зиятдинова Н.И., Зефиров Т.Л.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 3, 2022 года.
Бесплатный доступ
Плотность If в кардиомиоцитах изменяется не только с возрастом, но и при патофизиологической гипертрофии, поэтому исследования патологических состояний на моделях экспериментальных животных позволяют детально изучить роль If в патофизиологических процессах, происходящих в сердце после инфаркта миокарда (ИМ). Цель - изучить влияние блокады If-токов на изолированное сердце крыс с моделью острейшего инфаркта миокарда (ОИМ) и ложнооперированных (ЛО) крыс. Материалы и методы. ИМ воспроизводили путем лигирования левой коронарной артерии. Исследование проводилось на изолированном по Лангендорфу сердце (ADInstruments). В период ОИМ изучали хронотропию, инотропию и ее временные характеристики, кровоснабжение сердца крыс. Результаты. Выявлено, что исходные значения силы сокращения и коронарного потока были достоверно ниже в группе с экспериментальной моделью ОИМ, различий в ЧСС и временных характеристиках силы сокращения не обнаружено. Блокада If (ZD7288, 10-9 М, 10-5 М) уменьшает силу сокращения и коронарный поток изолированного сердца в обеих экспериментальных группах, изменения более выражены в группе ЛО крыс. Блокада If (10-9 M) в группе ЛО крыс приводит к тахикардии, а в группе ОИМ - к брадикардии. ZD7288 (10-5 М) снижает ЧСС в обеих исследуемых группах, но в группе с ОИМ брадикардия была более выраженной. Возможно, полученная динамика выраженности эффектов связана с изменением плотности If в патологическом миокарде. Таким образом, очевидно, что токи If не только участвуют в регуляции различных функций сердца после ИМ, но и меняют свою роль на разных стадиях экспериментального инфаркта миокарда.
Токи, активируемые при гиперполяризации, экспериментальный инфаркт миокарда, изолированное сердце, крыса
Короткий адрес: https://sciup.org/14125349
IDR: 14125349 | УДК: 612.17 | DOI: 10.34014/2227-1848-2022-3-106-119
Текст научной статьи Острейшая стадия инфаркта миокарда: влияние блокады IF на изолированное сердце крыс
Введение. Ритмические циклы, такие как спонтанные и повторяющиеся паттерны возбуждения в возбудимых клетках, являются важными временными механизмами, которые регулируют различные биологические процессы. Неудивительно, что пейсмекерный ток, также известный как «забавный ток» (If) или ток, активируемый гиперполяризацией, был впервые описан в сердце [1], наиболее надежном ритмическом органе тела. Этот ток, позже также описанный в нервах, оказался опосредованным гиперполяризационно активируемыми ионными каналами, управляемыми циклическими нуклеотидами (HCN-каналы) [1]. HCN-каналы способствуют активности синусного узла и нейронов. В клетках синоатриального узла каналы отвечают за начальную фазу потенциала действия и, следовательно, регулируют скорость возбуждения. HCN-каналы модулируются внутриклеточными циклическими нуклеотидами, включая циклический аденозинмонофосфат (цАМФ). Активность каналов увеличивается в присутствии цАМФ и имеет решающее значение для ускорения частоты сердечных сокращений (ЧСС) при симпатической стимуляции [2]. В нервной системе HCN-каналы участвуют в возбудимости нейронов и сетевой активности [3]. Таким образом, с учетом многочисленных ролей HCN-каналов их дисфункция связана с целым рядом заболеваний [3], например с аритмиями, эпилепсией и невропатической болью, что делает их новыми мишенями для терапевтических исследований [3].
В экспериментальных исследованиях на лабораторных животных показано влияние неселективного блокатора If-токов ZD7288 на показатели работы сердечно-сосудистой системы. Выявлено, что блокада If-токов оказывала влияние как на ЧСС [4], так и на сократимость миокарда [5]. В изолированном сердце с хронической моделью инфаркта миокарда
(ИМ) положительный инотропный эффект возникает при аппликации ZD7288 в концентрациях 10-9 М и 10-7 М, а у здоровых животных положительный инотропный эффект наблюдается только при добавлении минимальной концентрации блокатора [6].
В последние годы в литературе появились данные, свидетельствующие о том, что дисфункциональные HCN-каналы, в частности HCN1 -канал, а также HCN2- и HCN4-каналы, могут играть патогенную роль при эпилепсии, что показано в экспериментальных исследованиях на животных моделях и у пациентов с эпилепсией. В центральной нервной системе изменение Ih-тока может предрасполагать к развитию нейродегенеративных заболеваний, таких как болезнь Паркинсона. Поскольку HCN-каналы широко экспрессируются в периферической нервной системе, их дисфункциональное поведение также может быть связано с патогенезом невропатической боли. С учетом фундаментальной роли HCN-каналов в регуляции спонтанной активности сердечных и нейрональных клеток изучение модуляции их функции в терапевтических целях может быть полезным для коррекции различных патологических состояний [7].
В литературе показано, что плотность If в кардиомиоцитах изменяется не только с возрастом, но и при патофизиологической гипертрофии [8], поэтому исследования патологических состояний на моделях экспериментальных животных позволяют детально изучить патофизиологические процессы, происходящие в миокарде при поражении коронарного русла.
В последние годы в связи с развитием общества, изменением окружающей среды и образа жизни человека увеличилась заболеваемость инфарктом миокарда. ИМ становится одной из основных причин смерти и инвалидности населения [9]. Как независимый фактор риска сердечно-сосудистых заболеваний увеличение ЧСС в покое вызывает смерть от острого инфаркта миокарда [10, 11]. На фоне ИМ происходит увеличение потребления кислорода миокардом, снижение перфузии коронарных артерий, что вызывает ишемию миокарда, рост количества некротических клеток миокарда, снижение сократимости миокарда.
В дальнейшем все это может вызывать ремоделирование миокарда и развитие сердечной недостаточности [12]. Таким образом, активный клинический контроль ЧСС в покое стал одним из наиболее важных методов лечения ИМ [12]. Хотя в-блокаторы используются для замедления ЧCC, такие эффекты, как уменьшение проводимости, снижение силы сокращения и артериального давления и др., а также различные противопоказания следует учитывать при клиническом применении этих препаратов [12].
Селективное снижение ЧСС путем ингибирования If-каналов является одним из современных методов лечения сердечно-сосудистых заболеваний. Так, недавно для клинического применения при лечении хронической сердечной недостаточности был одобрен блокатор HCN-каналов ивабрадин [3]. В инструкции по применению препарата, а также некоторыми исследователями указывается, что ивабрадин может специфически снижать синусовый ритм и замедлять ЧСС без дополнительных эффектов, таких как уменьшение силы сокращения и снижение артериального давления [2, 13]. Кроме того, процесс воздействия на ЧСС другими препаратами, такими как бета-блокаторы, более медленный, поскольку их дозировку необходимо увеличивать постепенно, в то время как ивабрадин позволяет быстрее и эффективнее осуществлять контроль ЧСС без ухудшения сердечной функции [14].
Ивабрадин связывается с каналом If синусового узла, подавляя ток If, уменьшая автономию синусового узла и замедляя ЧСС [1, 15]; замедление ЧСС может продлить диастолический период, увеличить снабжение миокарда кислородом и коронарную перфузию, увеличить сердечный выброс и улучшить сердечную функцию; ЧСС положительно коррелирует с объемом желудочков, а снижение ЧСС может снизить объемную нагрузку желудочков, уменьшить работу миокарда и потребление кислорода, а также улучшить толерантность к физической нагрузке [16, 17]. В то же время, несмотря на перечисленные преимущества, ивабрадин противопоказан для применения при остром инфаркте миокарда.
Цель исследования. Изучить влияние блокады If-токов на изолированное сердце крыс с моделью острейшего инфаркта миокарда и ложнооперированных крыс.
Материалы и методы. Эксперименты выполнены с соблюдением этических норм и правил обращения с лабораторными животными.
В работе использовали беспородных крыс обоего пола в возрасте 4 мес. Непосредственно перед операцией каждое животное взвешивалось. Средняя масса составила 200–250 г.
Крысы были разделены на две группы: 1-я (контроль, n=20) – ложнооперированные животные (ЛО); 2-я (n=20) – крысы с моделью острейшего инфаркта миокарда (ОИМ). Контрольная группа ложнооперированных животных была сформирована для исключения влияния факторов оперативного вмешательства на сердце на результаты исследования.
Методика воспроизведения инфаркта миокарда. Для воспроизведения инфаркта миокарда у экспериментальных животных использовалась классическая модель, разработанная Г. Селье.
Животных обезболивали с помощью эфирного наркоза, помещая под стеклянный колпак. Затем при помощи резиновых лент животное фиксировали на операционном столе. Во время подготовки к торакотомии могла потребоваться дополнительная анестезия. При необходимости над дыхательными путями крысы размещали пропитанный эфиром марлевый тампон. В ходе дальнейшего эксперимента наркоз не применяли.
Для улучшения видения операционного поля использовали ламповое освещение. С грудной клетки животного состригали шерсть, кожу обрабатывали дезинфицирующим раствором. На левой стороне грудной клетки крысы делали разрез кожи. С помощью рано-расширителей разводили в противоположные стороны грудные мышцы. Между V и VI ребрами тонкими ножницами производили поперечный разрез длиной около 15 мм. Теперь воздух поступал в грудную полость, дыхание становилось невозможным, но это не представляло серьезной угрозы для жизни экспериментального животного, поскольку наложение лигатуры занимало около 60–90 с. Манипулируя в операционной ране пинцетом, отводили в сторону легкое и приводили сердце в удобное положение. Затем путем активной компрессии грудной клетки с обеих сторон выводили сердце из грудной полости. Сердце удерживали за желудочки большим и указательным пальцами левой руки. Визуально находили переднюю ветвь левой коронарной артерии. С помощью атравматической иглы и нерассасывающейся нити (Prolene 6/0, Ethicon, США) накладывали лигатуру на 0,5–1 мм ниже ее выхода из-под ушка сердца и трехкратно перевязывали. О правильности наложения лигатуры на коронарную артерию свидетельствовали быстро развивающиеся тахикардия, аритмия и анемия миокарда в области лигатуры. Затем сердце возвращали в грудную полость. Мышцы сдвигали, на кожу накладывали сдавливающий пинцет, а пальцами рук производили надавливания на грудную клетку так, чтобы удалить скопившийся воздух и создать отрицательное давление в грудной полости. Затем кожу зашивали по-лигликолид-ко-лактидом 3/0 («Медтехника») и обрабатывали антисептическим препаратом аримидерм. Сразу после сдвигания мышц и кожи животное начинало самостоятельно дышать. Далее в течение 5 мин после ушивания кожи и начала восстановления дыхания ждали развития острейшей стадии инфаркта миокарда. При необходимости животное дополнительно анестезировали эфиром. Затем грудную клетку вскрывали и готовили препарат изолированного сердца.
Методика приготовления препарата изолированного сердца. Эксперименты ex vivo проводили на установке Лангендорфа (ADInst-ruments, Австралия). Изолированное сердце промывали в охлажденном до +4 °С растворе Кребса – Хензеляйте. Сердце за аорту лигировали на канюле и подавали оксигенированный (95 % О 2 и 5 % СО 2 ) раствор при постоянном гидростатическом давлении 75–80 мм рт. ст. и температуре 37 °С, которые поддерживались в ходе всего эксперимента. Сократительную активность изучали в изоволюмическом режиме с помощью датчика давления и латексного баллончика, заполненного водой и введенного в полость левого желудочка через разрез, сделанный между левым предсердием и левым желудочком. Конечно-диастолическое давление устанавливали на уровне 16–18 мм рт. ст.
Для диагностики развития ОИМ на изолированное сердце накладывали атравматические электроды и записывали электрограмму.
Исследуемые параметры работы изолированного сердца регистрировали и обрабатывали в программе LabChart Pro V8. В ходе эксперимента подсчитывали частоту сердечных сокращений (ЧСС, уд./мин), давление, развиваемое левым желудочком (ДРЛЖ, мм рт. ст.), максимальную скорость сокращения левого желудочка (dP/dt max , мм рт. ст./c), максимальную скорость расслабления левого желудочка (dP/dt min , мм рт. ст./c), длительность сокращения и расслабления левого желудочка (c), время цикла сокращения левого желудочка (c), коронарный поток (КП, мл/мин).
Статистическую обработку полученных результатов проводили в программе Microsoft Excel с использованием однофакторного дис- персионного анализа (ANOVA) и последующим применением апостериорных тестов (Т-тест) для связанных групп, а также использовали парный и непарный t-критерий Стьюдента. Данные представлены в виде среднего значения (М) и ошибки среднего (m). Достоверными считали значения при p<0,05.
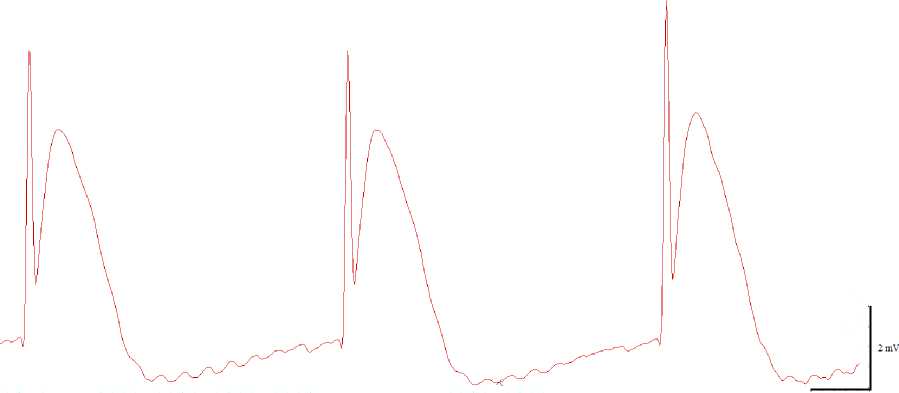
Результаты и обсуждение. Согласно данным литературы, ОИМ обычно продолжается от нескольких часов (от 1 до 3 ч) до 1–3 сут и характеризуется развитием повреждения кардиомиоцитов в результате острого нарушения коронарного кровообращения. ЭКГ регистрирует подъем сегмента зубца ST выше изолинии с дугой, обращенной выпуклостью кверху, в виде монофазной кривой, когда сегмент зубца ST сливается с положительным зубцом T [18].
В нашем исследовании на электрограмме изолированного сердца зафиксирована элевация зубца ST выше изолинии (рис. 1).
0.5 msec
Рис. 1. Нарушение сердечного ритма на электрограмме изолированного по Лангендорфу сердца с экспериментальной моделью острейшего инфаркта миокарда (оригинальная запись)
Fig. 1. Cardiac arrhythmia on the electrogram of a Langendorff-isolated heart with an experimental model of acute myocardial infarction (original record)
В группе ЛО животных исходное значение ДРЛЖ составило 89,4±6,4 мм рт. ст. В группе крыс с ОИМ исходное значение ДРЛЖ соста- вило 71±10,5 мм рт. ст. и было достоверно ниже, чем у ложнооперированных животных (p<0,05) (рис. 2).
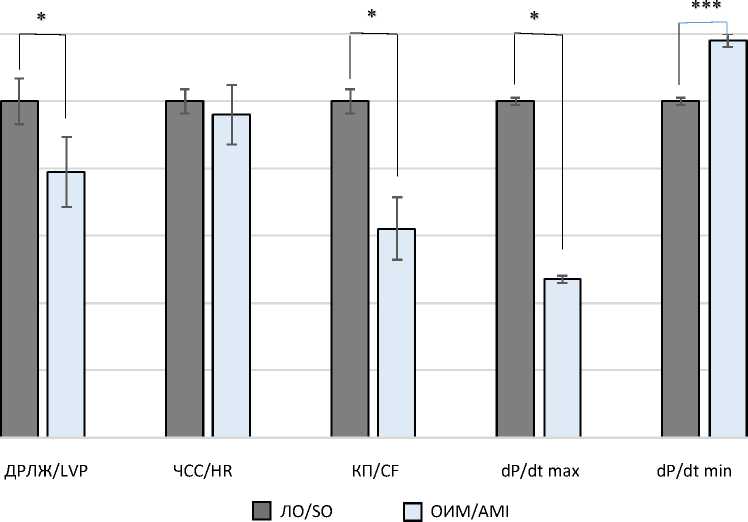
Рис. 2. Сравнение исходных значений ДРЛЖ, ЧСС, КП, dP/dt max и dP/dt min изолированного по Лангендорфу сердца ложнооперированных крыс и крыс с моделью острейшего инфаркта миокарда (различия достоверны по сравнению с группой ЛО: *– p<0,05, *** – p<0,001)
Fig. 2. Initial values of LVP, HR and CF, dP/dt max and dP/dt min of the Langendorff-isolated heart of sham-operated (SO) rats with a model of acute myocardial infarction (* – the differences are significant compared with the SO group (p<0.05);
*** – the differences are significant compared with the SO group (p<0.001))
Значения ЧСС у ложнооперированных крыс и у крыс с моделью ОИМ достоверно не различались: 233,4±3,5 и 224,8±8,8 уд./мин соответственно. Показатель КП изолированного сердца ЛО животных составил 11,7±3,7 мл/мин. В группе крыс с ОИМ он был достоверно ниже и составил 7,3±1,3 мл/мин (p<0,05) (рис. 2).
Максимальная скорость сокращения миокарда левого желудочка у ЛО составила 3691,3±349 мм рт. ст./с, в группе с ОИМ она была достоверно ниже – 1748,1±350 мм рт. ст./с (p<0,05) (рис. 2). Максимальная скорость расслабления миокарда левого желудочка у живот- ных с моделью ОИМ была достоверно выше, чем у ЛО крыс, на 18 % (p<0,001) (рис. 2).
Исходные значения показателя длительности сокращения левого желудочка в группе ЛО животных составляли 0,132±0,004 с, в группе с ОИМ – 0,133±0,007 с (рис. 3). Длительность расслабления миокарда левого желудочка в группе ЛО животных составляла 0,149±0,01 с, в группе ОИМ – 0,148±0,01 с (рис. 3). Длительность цикла сокращения миокарда левого желудочка в группе ЛО животных была равна 0,276±0,003 с, в группе ОИМ – 0,280±0,011 с (рис. 3). Достоверных различий между группами не обнаружено.
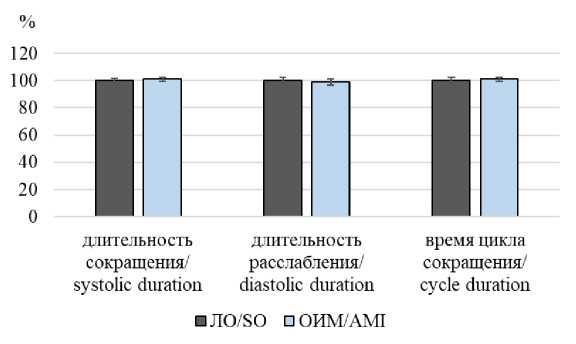
Рис. 3. Сравнение исходных значений времени сокращения, времени расслабления, времени цикла сокращения изолированного по Лангендорфу сердца ложнооперированных крыс и крыс с моделью острейшего инфаркта миокарда
Fig. 3. Initial values of systolic, diastolic, and cycle duration of the Langendorff-isolated heart of sham-operated rats with a model of acute myocardial infarction
Для изучения влияния блокады токов, активируемых при гиперполяризации, в перфузионный раствор добавляли антагонист ZD7288 в концентрациях 10-9 М и 10-5 М. Данные концентрации блокаторов выбраны на основе ранее проведенных исследований, выявивших влияние изучаемых токов на параметры изолированного сердца [19].
При добавлении в перфузионный раствор ZD7288 в концентрации 10-9 М ДРЛЖ в группе ЛО животных снижалось с 88,3±10,5
до 76,7±9,6 мм рт. ст. (p<0,01) к 10-й мин наблюдения. На заключительной минуте эксперимента ДРЛЖ составило 69,1±7,7 мм рт. ст. (p<0,01), т.е. уменьшилось на 22 %. В группе животных с экспериментальной моделью ОИМ ДРЛЖ при аппликации блокатора снижалось с 71±9,9 до 64,2±9 мм рт. ст. (p<0,01) на 5-й мин эксперимента. К 20-й мин экспериментальной записи значения ДРЛЖ снизились до 60,5±8,6 мм рт. ст. (p<0,05), т.е. на 15 % от исходных (рис. 4).
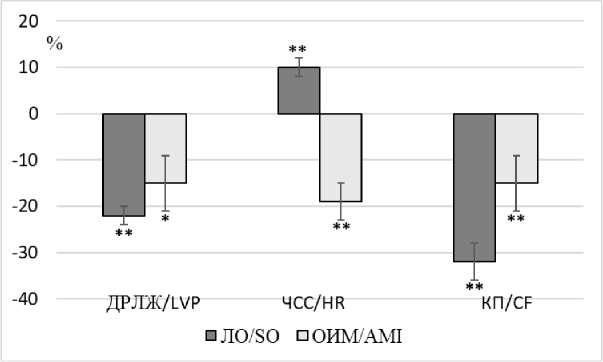
Рис. 4. Влияние ZD7288 (10-9 М) на показатели работы изолированного по Лангендорфу сердца (ДРЛЖ, ЧСС, КП) ложнооперированных крыс и крыс после моделирования ОИМ (ось ординат – показатели работы изолированного сердца, ось абсцисс – изменения по сравнению с исходными значениями (в %): * – р<0,05, ** – р<0,01)
Fig. 4. Effect of ZD7288 (10-9 M) on the Langendorff-isolated heart values (LVP, HR, CF) of sham-operated rats and rats after AMI simulation (Y-axis shows the isolated heart values; X-axis shows the changes compared with the baseline values (%): *p<0.05, **p<0.01)
Показатель dP/dt max в группе ЛО животных до добавления ZD7288 в перфузионный раствор составлял 3921,2±428 мм рт. ст./с, а после аппликации уменьшился до 3640,8±381,7 мм рт. ст./с (p<0.05) на 10-й мин наблюдения. К 20-й мин перфузии изолированного сердца данный показатель уменьшился до 3324,2±264,7 мм рт. ст./с (p<0,01) – на 15 %. При добавлении в перфузионный раствор блокатора If в группе ОИМ значения dP/dt max увеличились с 1870,1±402,4 до 2111,1±457,2 мм рт. ст./с (p<0,05) к 10-й мин эксперимента. На заключительной минуте наблюдения значения dP/dt max левого желудочка увеличились до 2186,9±412,3 мм рт. ст./с (p<0,01) – на 17 %.
Аппликация в перфузионный раствор ZD7288 увеличивала dP/dt min в группе ЛО животных на 16 % (p<0,01) от исходного. В экспериментальной группе с ОИМ данный показатель увеличивался на 15 % (p<0,05) от исходного.
Длительность сокращения миокарда левого желудочка у ЛО животных после аппликации ZD7288 уменьшилась на 6 %: с 0,127±0,005 до 0,120±0,004 с (p<0,01) к 5-й мин эксперимента. Далее длительность сокращения уменьшилась до 0,112±0,008 с (p<0,05). Снижение составило 12 %. В группе с моделью ОИМ изучаемый показатель снизился на 8 %: с 0,129±0,005 до 0,118±0,006 с (p<0,01) к заключительной минуте эксперимента (рис. 5).
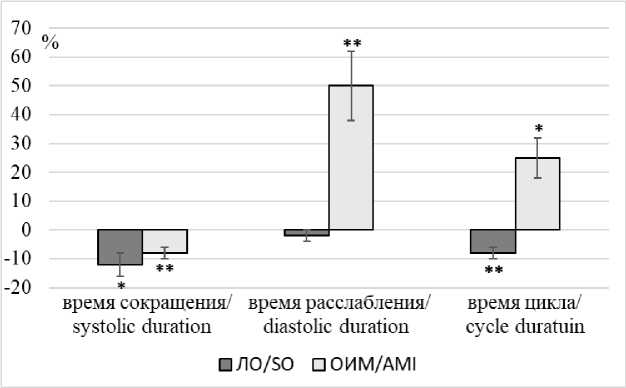
Рис. 5. Влияние ZD7288 (10-9 М) на временные характеристики сокращения изолированного по Лангендорфу сердца ложнооперированных крыс и крыс после моделирования ОИМ (ось ординат – показатели работы изолированного сердца, ось абсцисс – изменения по сравнению с исходными значениями (в %): * – р<0,05, ** – р<0,01)
Fig. 5. Effect of ZD7288 (10-9 M) on the temporal characteristics of contraction of the Langendorff-isolated heart in sham-operated rats and rats after AMI simulation (Y-axis shows the isolated heart values;
X-axis shows the changes compared with the baseline values (%): *p<0.05, **p<0.01)
Длительность расслабления миокарда левого желудочка при аппликации в перфузионный раствор блокатора If в группе ЛО животных уменьшилась с 0,131±0,006 до 0,124±0,003 с (p<0,05) на 5-й мин наблюдения. Далее показатель вернулся к исходному значению и не изменялся до конца эксперимента. В группе с моделью ОИМ длительность расслабления миокарда левого желудочка увеличивалась с 0,148±0,010 до 0,205±0,028 с (p<0,05) на
15-й мин эксперимента. На 20-й мин наблюдения длительность расслабления миокарда левого желудочка возросла до 0,222±0,025 с (p<0,01), увеличение составило 50 % (рис. 5).
Время цикла сокращения левого желудочка изолированного сердца ЛО животных при блокаде If уменьшалось с 0,251±0,004 до 0,231±0,008 с (p<0,01) к 20-й мин эксперимента, уменьшение составило 8 %. В группе с моделью ОИМ время цикла сокращения после блокады If увеличилось на 25 %: с 0,280±0,011 до 0,349±0,031 с (p<0,05) (рис. 5).
При добавлении в перфузионный раствор блокатора токов, активируемых при гиперполяризации, в концентрации 10-5 М ДРЛЖ в группе ЛО уменьшилось на 30 % от исходных значений: с 92,2±3,4 до 82,8±2,5 мм рт. ст. (p<0,01) к 10-й мин эксперимента. На заключительной минуте наблюдения ДРЛЖ уменьшилось до 64,5±5,7 мм рт. ст. (p<0,01). В экспериментальной группе с моделью ОИМ ДРЛЖ уменьшилось на 25 %: с 65±7,2 до 49,4±5,5 мм рт. ст. (p<0,05) на 15-й мин наблюдения. К заключительной минуте эксперимента ДРЛЖ уменьшилось до 48,7±5,4 мм рт. ст. (p<0,05) (рис. 6).
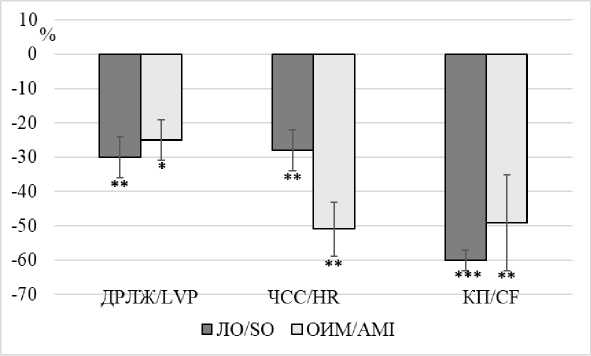
Рис. 6. Влияние ZD7288 (10-5 М) на показатели работы изолированного по Лангендорфу сердца ложнооперированных крыс и крыс после моделирования ОИМ (ось ординат - показатели работы изолированного сердца, ось абсцисс - изменения по сравнению с исходными значениями (в %): * - р<0,05, ** - р<0,01, *** - р<0,001)
Fig. 6. Effect of ZD7288 (10-5 M) on the Langendorff-isolated heart values (LVP, HR, CF) of sham-operated rats and rats after AMI simulation (Y-axis shows the isolated heart values; X-axis shows the changes compared with the baseline values (%): *p<0.05, **p<0.01, ***p<0.001)
ЧСС изолированного сердца ЛО животных после добавления блокатора увеличивалась на 10 %. С 1-й мин наблюдения ЧСС выросла с 241,9±2,6 до 260±2,1 уд./мин (p<0,01). Тахикардия наблюдалась до заключительной 20-й мин эксперимента, когда ЧСС составила 265,1±7,6 уд./мин (p<0,01). Блокада If в группе с ОИМ снижала ЧСС с 224,8±8,3 до 204,1±15,4 уд./мин (p<0,05) к 10-й мин. Брадикардия сохранялась до 20-й мин эксперимента, когда ЧСС снизилась до 182,7±13,2 уд./мин (p<0,01). Снижение составило 19 % (рис. 6).
Показатель КП изолированного сердца в группе ЛО животных уменьшался с 12,8±1,3 до 10,8±1,2 мл/мин (p<0,01) на 5-й мин. Снижение КП наблюдалось до окончания эксперимента и составляло к 20-й мин 8,7±1,1 мл/мин (p<0,01), т.е. показатель уменьшился на 32 %. В экспериментальной группе ОИМ КП уменьшился на 15 %: с 7,3±1,3 до 6,7±1,3 мл/мин (p<0,01) к
5-й мин наблюдения. К 20-й мин эксперимента значение КП составило 6,1±1,4 мл/мин (p<0,01) (рис. 6).
Добавление в перфузионный раствор блокатора ZD7288 (10-5 М) снижало dP/dt max в группе ЛО животных с 3270,7±274,8 до 2968,9±240,6 мм рт. ст./с (p<0,05) к 15-й мин наблюдения. На последней минуте эксперимента dP/dt max снизилась до 2678,5±247,6 мм рт. ст./с (p<0,01), т.е. на 18 %. В группе животных с моделью ОИМ dP/dt max увеличилась на 3 % на 1-й мин эксперимента: с 2309,9±404,1 до 2374,9±412,4 мм рт. ст./с (p<0,01). Далее наблюдали снижение изучаемого показателя до 1622,3±336,3 мм рт. ст./с (p<0,05) на последней 20-й мин эксперимента. Снижение dP/dt max составило 30 % от исходных значений.
После аппликации в перфузионный раствор блокатора If в группе ЛО животных dP/dtmin увеличилась на 25 % (p<0,01) от ис- ходного значения. В экспериментальной группе с моделью ОИМ увеличение dP/dtmin составило 31 % (p<0,05).
Аппликация ZD7288 в перфузионный раствор вызывала брадикардию в обеих изучаемых группах. В группе ЛО животных ЧСС уменьшилась с 216,7±10,7 до 167,3±25,6 уд./мин (p<0,05) к 10-й мин эксперимента, а затем до 157,2±21,1 уд./мин (p<0,01) на 20-й мин. Снижение ЧСС составило 28 % от исходного уровня. В группе животных с моделью ОИМ блокада If уменьшила ЧСС с 208,7±10,9 до 140,3±14,2 уд./мин (p<0,01) к 10-й мин эксперимента. К 20-й мин ЧСС продолжала снижаться до 102,9±8,6 уд./мин (p<0,01). Разница с исходными значениями составила 51 % (рис. 6).
Блокатор токов, активируемых при гиперполяризации, снижал КП изолированного сердца в экспериментальных группах. КП в группе ЛО животных уменьшался с 10±0,3 до 8,7±0,4 мл/мин (p<0,001) к 5-й мин наблюдения. К 20-й мин КП уменьшился до 4±0,2 мл/мин (p<0,001). Снижение КП составило 60 % от исходного уровня. В экспериментальной группе с моделью ОИМ КП уменьшился с 7,2±0,7 до 4,3±0,6 мл/мин (p<0,01) к 5-й мин наблюдения. Затем к 20-й мин КП уменьшился до
3,7±0,6 мл/мин (p<0,01). Снижения КП составило 49 % (рис. 6).
Блокада If вызывала снижение длительности сокращения миокарда левого желудочка в группе ЛО животных с 0,140±0,008 до 0,133±0,006 с (p<0,05) к 5-й мин эксперимента. К 20-й мин длительность сокращения уменьшилась до 0,117±0,004 с (p<0,05) (рис. 7). Уменьшение длительности сокращения составило 17 %. В группе с моделью ОИМ изучаемый показатель увеличился незначительно - на 5 %: с 0,134±0,011 до 0,142±0,006 с на 5-й мин. К заключительной (20-й мин) эксперимента длительность сокращения миокарда левого желудочка составила 0,141±0,003 с (рис. 7).
Длительность расслабления миокарда левого желудочка при аппликации в перфузионный раствор блокатора If в группе ЛО животных увеличивалась на 69 %. Изучаемый показатель вырос с 0,183±0,030 до 0,203±0,031 с (p<0,01) к 5-й мин наблюдения. Затем продолжал увеличиваться и к 20-й мин достигал 0,309±0,044 с (p<0,01). В группе с моделью ОИМ длительность расслабления миокарда левого желудочка увеличивалась на 170 %: с 0,180±0,028 до 0,424±0,077 с (p<0,05) к 15-й мин и до 0,485±0,075 с (p<0,05) на 20-й мин (рис. 7).
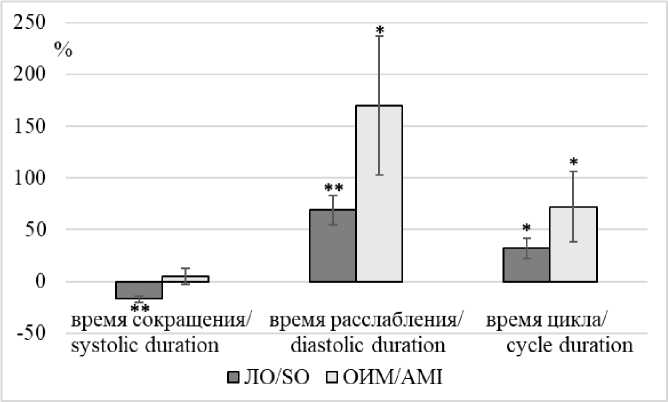
Рис. 7. Влияние ZD7288 (10-5 М) на временные характеристики сокращения изолированного по Лангендорфу сердца ложнооперированных крыс и крыс после моделирования ОИМ (ось ординат - показатели работы изолированного сердца, ось абсцисс - изменения по сравнению с исходными значениями (в %):* - р<0,05, ** - р<0,01)
Fig. 7. Effect of ZD7288 (10 - 5 M) on the temporal characteristics of contraction of the Langendorff-isolated heart of sham-operated rats and rats after AMI simulation (Y-axis shows the isolated heart values;
X-axis shows the changes compared with the baseline values (%): *p<0.05, **p<0.01)
Время цикла сокращения левого желудочка изолированного сердца ЛО животных при блокаде If увеличилось с 0,323±0,037 до 0,424±0,067 с (p<0,05) к 10-й мин наблюдения. Далее время цикла сокращения продолжало расти до 0,427±0,047 с (p<0.05) к заключительной 20-й мин эксперимента. Увеличение составило 32 %. В группе с моделью ОИМ время цикла сокращения после блокады If выросло на 72 %: с 0,324±0,036 до 0,557±0,068 с (p<0,05) к 20-й мин наблюдения (рис. 7).
Заключение. Проведенное исследование выявило, что исходные значения ДРЛЖ, dP/dt max , КП достоверно ниже в группе с экспериментальной моделью ОИМ, различий в ЧСС и временных характеристиках силы сокращения не обнаружено. Возможно, в первые минуты коронарной окклюзии происходит резкое угнетение сократительной функции сердечной мышцы из-за кислородного голодания, нарушения кровоснабжения, влияющего на энергетические ресурсы, чувствительность сердечной мышцы к ионам Ca2+, изменение скорости образования актомиозиновых мостиков и скорости расслабления миоцитов [20]. Однако, по-видимому, перечисленные изменения еще не отражаются на временных показателях сокращения миокарда.
Селективная блокада If (ZD7288, 10-9 М, 10-5 М) уменьшает ДРЛЖ и КП изолированного сердца в обеих экспериментальных группах. Однако в группе ЛО животных уменьшение ДРЛЖ и КП более выраженно по сравнению с группой крыс с моделью ОИМ. В проведенных ранее исследованиях на стадии хронического ИМ блокада If (10-9 М) вызывала положительный инотропный эффект, а максимальная концентрация If уменьшала силу сокращения [6]. На основании полученных дан- ных в экспериментальной модели ИМ у крыс можно сделать вывод, что роль If меняется: он ингибирует давление, развиваемое левым желудочком на начальной стадии ишемии, и усиливает силу сокращения в адаптационный период хронического ИМ. Аппликация ZD7288 оказывает разнонаправленное влияние на ЧСС изолированного сердца в исследуемых группах. Блокада If (10-9 M) в группе ЛО крыс приводит к тахикардии, а в группе ОИМ вызывает брадикардию. ZD7288 в концентрации 10-5 М урежает ЧСС в обеих исследуемых группах, но в группе крыс с ОИМ наблюдается более выраженная брадикардия. Аппликация блокатора (10-9 М, 10-5 М) в обеих исследуемых группах уменьшает время сокращения миокарда. В группе ЛО крыс изменение данного показателя более выражено, чем в группе с ОИМ. Время расслабления после блокады If (10-9 М) в группе ЛО животных не изменялось, а в группе с ОИМ увеличивалось. Аппликация ZD7288 в концентрации 10-5 М увеличивала время расслабления в обеих исследуемых группах, но в группе с ОИМ эффект был более выраженным. Возможно, полученная динамика выраженности эффектов связана с изменением плотности If в патологическом миокарде. Инверсия полученных эффектов может быть связана с участием данных токов в фазе реполяризации потенциала действия в рабочих кардиомиоцитах [21]. Таким образом, очевидно, что токи If не только участвуют в регуляции различных функций сердца после ИМ, но и меняют свою роль на разных стадиях экспериментального инфаркта миокарда.
В дальнейшем необходимо детальное исследование роли If в миокарде с различными патологиями, в т.ч. на разных стадиях развития инфаркта миокарда.
Работа выполнена за счет средств Программы стратегического академического лидерства Казанского (Приволжского) федерального университета (Приоритет-2030).
Список литературы Острейшая стадия инфаркта миокарда: влияние блокады IF на изолированное сердце крыс
- Shi S., WuX. Clinical research progress of ivabradine in cardiovascular disease. Chinese Circulation Journal. 2015; 30: 613-616.
- DiFrancesco D. Funny channels in the control of cardiac rhythm and mode of action of selective blocker. Pharmacol. Res. 2006; 53: 399-406.
- Sartiani L., Mannaioni G., Masi A., Romanelli M.N., Cerbai E. The Hyperpolarization-Activated Cyclic Nucleotide-Gated Channels: from Biophysics to Pharmacology of a Unique Family of Ion Channels. Pharmacol. Rev. 2017; 69: 354-395. DOI: https://doi.org/10.1124/pr.117.014035.
- Zefirov T.L., Ziyatdinova N.I., Zefirov A.L. Autonomic control of cardiac function involves modulation of hyperpolarization activated channels in vitro. Russ. J. Physiol. 2003; 89 (2): 154-160.
- Zefirov T.L., Gibina A.E., Sergejeva A.M., Ziyatdinova N.I., Zefirov A.L. Age-Related Peculiarities of Contractile Activity of Rat Myocardium during Blockade of Hyperpolarization-Activated Currents. Bull. Exp. Biol. Med. 2007; 144 (3): 273-275.
- BugrovR.K., Kuptsova A.M., KhabibrakhmanovI.I., Ziyatdinova N.I., Zefirov T.L. Influence of If-current blockade on rat heart contractility with a model of myocardial infarction. Archivos Venezolanos de Farmacología y Terapéutica. 2020; 37 (7): 817-821.
- Rivolta I., Binda A., Masi A., DiFrancesco J.C. Cardiac and neuronal HCN channelopathies. Pflugers Arch. 2020; 472 (7): 931-951. DOI: 10.1007/s00424-020-02384-3.
- Cerbai E., Pino R., Sartiani L., Mugelli A. Influence of postnatal-development on If occurrence and properties in neonatal rat ventricular myocytes. Cardiovascular Research. 1999; 42: 416-423.
- BoatengS., Sanborn T. Acute myocardial infarction. Dis. Mon. 2013; 59: 83-96.
- Ide T., Ohtani K., Higo T. Ivabradine for the Treatment of Cardiovascular Diseases. Circ. J. 2019; 83: 252-260.
- Sharashova E., Wilsgaard T., Mathiesen E.B. Resting heart rate predicts incident myocardial infarction, atrial fibrillation, ischaemic stroke and death in the general population: the Troms0 Study. J. Epidemiol. Community Health. 2016; 70: 902-909.
- Wang B., ZhangX., Chen J., Chen S., Chen Q., Yang S., Wang Q. Effectiveness and safety of ivabradine in the treatment of acute myocardial infarction: a systematic review and meta-analysis. Ann. Palliat. Med. 2021; 10 (4): 4523-4531. DOI: 10.21037/apm-21-563.
- Swedberg K., Komajda M., Böhm M., Borer J.S., Ford I., Dubost-Brama A., Lerebours G., Tavazzi L. Ivabradine and outcomes in chronic heart failure (SHIFT): a randomized placebo-controlled study. Lancet. 2010; 376: 875-885.
- Fang Y., Debunne M., Vercauteren M., Brakenhielm E., Richard V., Lallemand F., Henry J-P., Mulder P., Thuillez C. Heart rate reduction induced by the if current inhibitor ivabradine improves diastolic function and attenuates cardiac tissue hypoxia. J. Cardiovasc. Pharmacol. 2012; 59: 260-267.
- Li C., Jiang D. Study and progress of ivabradine in cardiovascular diseases. Advances in Cardiovascular Diseases. 2019; 40: 143-145.
- Ramirez-Carracedo R., Tesoro L., Hernandez I., Diez-Mata J., Botana L., Saura M., Sanmartin M., Za-morano J.L., Zaragoza C. Ivabradine-stimulated microvesicle release induces cardiac protection against acute myocardial infarction. Int. J. Mol. Sci. 2020; 21: 6566.
- Brown H., Dfirancesco D., Noble S. How does adrenaline accelerate the heart? Nature. 1979; 280: 235-236.
- Nikulina N.A., Dotsenko E.A., Nerovnya A.M., SalivonchikD.P., Platoshkin E.N., Nikolaeva N.V., Tish-kov S.P. Experimental myocardial infarction in rats: features of modeling and course within the first 48 hours after coronary artery ligation. Problems of health and ecology. 2020; 2 (64): 91-96.
- Купцова А.М., Зиятдинова Н.И., Фасхутдинов Л.И., Биктемирова Р.Г., Зефиров Т.Л. Влияние HCN-каналов на работу изолированного сердца взрослых крыс. Ученые записки Казанского университета. Сер. Естественные науки. 2018; 160 (4): 568-578.
- Катруха И.А. Тропониновый комплекс сердца человека. Структура и функции. Успехи биол. химии. 2013; 53: 149-194.
- Abramochkin D.V., Faskhutdinov L.I., Filatova T.S., Ziyatdinova N.I. Changes in Electrical Activity of Working Myocardium Under Condition of I-f Current Inhibition. Bull. Exp. Biol. Med. 2015; 158 (5): 600-603.


