Острое клеточное отторжение трансплантата почки у пациента африканского происхождения: клиническое наблюдение
Автор: Хубутия М.Ш., Александрова В.О., Балкаров А.Г., Виноградов В.Е., Загородникова Н.В., Сторожев Р.В., Шмарина Н.В., Боровкова Н.В., Дмитриев И.В.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Трансплантация органов и тканей
Статья в выпуске: 2 т.13, 2023 года.
Бесплатный доступ
Этническое происхождение реципиента относится к известным факторам, влияющим на исходы трансплантации почки. В статье представлен первый опыт трансплантации почки пациенту африканского происхождения в НИИ СП им. Н.В. Склифосовского.Материал и методы. Аллогенная трансплантация почечного трансплантата от посмертного донора была выполнена пациенту африканского происхождения мужского пола 60 лет с хронической болезнью почек 5 стадии в исходе гипертонического нефроангиосклероза.Результаты. Ранний послеоперационный период осложнился развитием острого клеточного отторжения трансплантата 1a-b степени по Banff. Проведена противокризовая терапия с некоторым положительным эффектом, однако в отдалённом послеоперационном периоде была отмечена утрата функции почечного трансплантата, и пациент был возвращён на заместительную почечную терапию программным гемодиализом.Заключение. Пациенты африканского происхождения склонны к повышенному риску неблагоприятных исходов вследствие иммунологических причин и нуждаются в более тщательном иммунологическом подборе донорского органа, усиленной схеме иммуносупрессивной терапии и внимательном наблюдении после трансплантации.
Трансплантация почки, пациент африканского происхождения, острый криз отторжения, утрата трансплантата почки
Короткий адрес: https://sciup.org/143180030
IDR: 143180030 | УДК: 616.61-089.843.168:616.155.32 | DOI: 10.20340/vmi-rvz.2023.2.TX.1
Текст научной статьи Острое клеточное отторжение трансплантата почки у пациента африканского происхождения: клиническое наблюдение
ОРИГИНАЛЬНАЯ СТАТЬЯ ORIGINAL ARTICLE УДК 616.61-089.843.168:616.155.32
Трансплантация почки является оптимальным методом заместительной почечной терапии для большинства пациентов. Это обусловлено значительным улучшением качества и продолжительности жизни по сравнению с пребыванием на диализе [1]. Происхождение реципиентов относится к реци-пиент-обусловленным факторам, статистически значимо влияющим на исходы трансплантации почки. Несмотря на появление новых иммуносупрессивных препаратов и совершенствование диагностики и лечения иммунологических осложнений, пациенты африканского происхождения по-прежнему представляют группу повышенного иммунологического риска [2, 3]. Так, у данной категории реципиентов статистически чаще отмечают развитие эпизодов острого и хронического отторжения, а также частоту утраты трансплантата почки [4, 5]. Численность населения африканского происхождения в России, по данным ряда авторов, варьирует от 40 000 до 70 000 человек, а ведущей причиной терминальной почечной недостаточности у таких пациентов является гипертонический нефроангиосклероз вследствие артериальной гипертензии [2]. В настоящий момент нет официальных данных по пациентам африканского происхождения в Российской Федерации, нуждающихся в заместительной почечной терапии и находящихся в листе ожидания на трансплантацию почки. Из более чем 2000 выполненных трансплантаций почек на базе ГБУЗ «НИИ скорой помощи им. Н.В. Склифосовского ДЗМ» в период с 2008 по 2022 г. только одна была выполнена пациенту африканского происхождения.
Материал и методы
Реципиент. Пациент Н., 1962 года рождения, с клиническим диагнозом: гипертоническая болезнь III стадии, степень 3, риск сердечно-сосудистых осложнений 4. Гипертонический нефроангиосклероз. Хроническая болезнь почек С5Д (заместительная почечная терапия программным гемодиализом с ноября 2020 г.). Нефрогенная суб-компенсированная анемия. Рак предстательной железы (морфологически – аденокарцинома), радикальная простатэктомия в 2021 г.
Анамнез заболевания. Из анамнеза известно, что в 2015 г. была впервые выявлена артериальная гипертензия, тогда же госпитализирован с гипертоническим кризом, отёком лёгких и двусторонней пневмонией. В стационаре проводили гипотензивную и диуретическую терапию. В дальнейшем находился под наблюдением кардиолога. С 2017 г. отметили появление протеинурии, постепенное нарастание уровня азотемии. В ноябре 2020 г. появилась одышка, слабость, некоррегируемия артериальная гипертензия, потеря веса до 10 кг. При госпитализации выявили гиперазотемию и по жизненным показаниями начали лечение программным гемодиализом. В январе
2021 г. имплантировали катетер Тенкхоффа и перевели пациента на перитонеальный диализ. В 2021 г. при обследовании диагностировали рак предстательной железы, провели радикальную простатэктомию, лучевую и химиотерапию не проводили. Отдалённый послеоперационный период осложнился развитием стриктуры уретры, хронической задержкой мочи. В марте 2021 г. в связи с развитием диализного перитонита и стойкого дефицита ультрафильтрации был переведён на лечение программным гемодиализом. 27.10.2021 г. пациент был поставлен в лист ожидания на аллотрансплантацию почки. Анти-HLA антитела до трансплантации по I, II классам – отрицательно, анти-MICA антитела – отрицательно. Типаж реципиента A*24, A*33; B*45; В*78, DRB1*03, DRB1*11.
Донор. Мужчина, возраст 60 лет, индекс массы тела 26,6 кг/м2. У пациента была констатирована смерть головного мозга в исходе острого нарушения мозгового кровообращения по геморрагическому типу. На момент эксплантации креатинин сыворотки крови 93 мкмоль/л, мочевина крови 4,2 ммоль/л. Типаж донора А*01, A*02; В*15, B*35; DRB1*11, DRB1*16.
Иммунологическая совместимость/несовместимость по антигенам системы HLA. Совместимость по антигенам I класса HLA – 0 антигенов, несовместимость – 4 антигена (100 %), совместимость по антигенам II класса HLA – 1 антиген (50 %), несовместимость – 1 антиген (50 %). Общая совместимость по антигенам – 1 антиген (16,7 %), общая несовместимость – 5 антигенов (83,3 %)
Операция. В связи с необратимостью основного заболевания и наличием совместимого почечного трансплантата 17.02.2022 г. выполнили аллогенную гетеротопическую трансплантацию почки от посмертного донора с установкой эпицистостомы.
Иммуносупрессивная терапия. Реципиент получал индукционную иммуносупрессивную терапию поликлональными антителами (антитимоцитарный глобулин, четыре введения, суммарная доза – 1,25 г). Трёхкомпонентная базисная иммуносупрессивная терапия включала такроли-мус пролонгированный, эверолимус и метилпреднизолон.
Особенности послеоперационного периода. Отметили первичную функцию трансплантата почки, немедленное восстановление водовыделительной функции, стабильное снижение показателей азотемии. На 4-е сутки уровень креатинина сыворотки крови составил 281 мкмоль/л, уровень мочевины крови – 15,3 ммоль/л. На 8-е сутки после трансплантации отметили нарастание показателей азотистых шлаков крови: креатинин сыворотки крови – 350 мкмоль/л, мочевина крови – 16,3 ммоль/л. При проведении ультразвукового исследования трансплантата было отмечено увеличение его размеров, признаки отёка паренхимы, резкое повышение индексов сосудистого сопротивления (Ri = 1,0).
Ситуация была расценена как острой – криз отторжения почечного аллотрансплантата (ПАТ). При оценке анти-HLA АТ отметили, что они находились в пределах референтных значений. Провели пульс-терапию глюкокортикостероидами (три введения, суммарная доза 1250 мг) – без эффекта. В связи с продолжающим нарастанием азотемии (креатинин сыворотки крови – 713 мкмоль/л, мочевина крови – 31 ммоль/л), с целью верификации диагноза на 15-е сутки после операции под ультразвуковым наведением выполнили пункционную биопсию ПАТ. Заключение гистологического исследования: острое клеточное отторжение трансплантата 1а-в. Провели противокризовую терапию поликлональными антилимфоцитарными антителами (человеческий иммуноглобулин лошадиный, 14 введений, суммарная доза – 5 г) с положительным эффектом: медленное стабильное снижение показателей креатинина сыворотки крови и мочевины крови: с 924 мкмоль/л и 31 ммоль/л на
18-е сутки после операции до 417 мкмоль/л и 18,6 ммоль/л на 32-е сутки после операции соответственно. В связи с отсутствием дальнейшего снижение показателей азотемии, на 42-е сутки после трансплантации выполнили повторную пункционную биопсию ПАТ. Результат гистологического исследования: острое клеточное отторжение 1а (плазмоклеточный вариант?), острый канальцевый некроз. В дальнейшем отметили снижение показателей азотемии, на 54-е сутки после трансплантации в стабильно-удовлетворительным состоянии пациент был переведён на амбулаторный этап лечения. На момент выписки уровень креатинина сыворотки крови составил 379 мкмоль/л, мочевины крови – 16 ммоль/л. Динамика креатинина сыворотки крови, мочевины крови, содержания анти-HLA антител, концентрации такролимуса и эверолимуса, а также содержания гемоглобина, лейкоцитов и тромбоцитов крови представлены на рисунке 1.
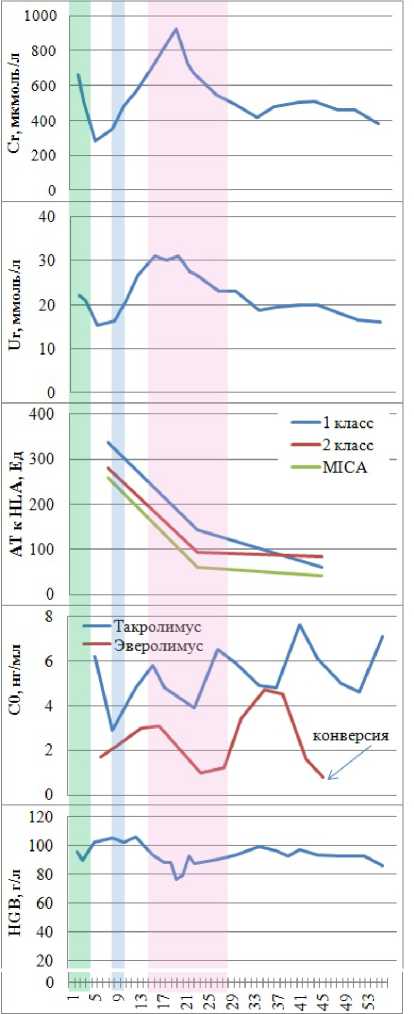
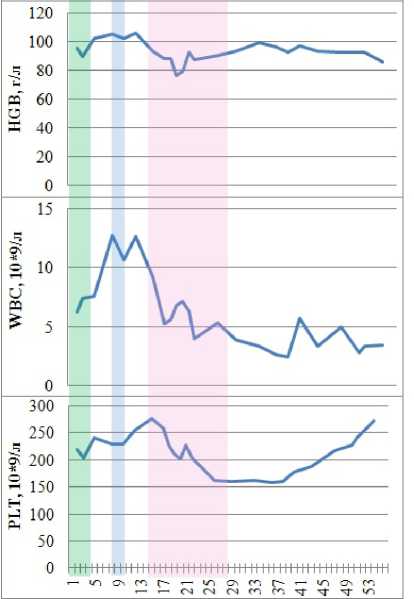
Рисунок 1. Диаграммы, отражающие динамику показателей креатинина сыворотки крови, мочевины крови, уровня анти-HLA антител, содержания гемоглобина, лейкоцитов и тромбоцитов крови: зелёным цветом отмечен период проведения индукционной иммуносупрессивной терапии поликлональными антителами; голубым цветом – период пульс-терапии кортикостероидами; розовым цветом – период противокризовой терапии поликлональными антителами (человеческий иммуноглобулин лошадиный); стрелкой отмечена дата конверсии с эверолимуса на препараты микофеноловой кислоты. По оси Х – дни от выполнения трансплантации
Figure 1. Diagrams showing the dynamics of blood serum creatinine, blood urea, anti-HLA antibody levels, hemoglobin, leukocytes and blood platelets: green color indicates the period of induction immunosuppressive therapy with polyclonal antibodies (human equine immunoglobulin); in blue – the period of pulse therapy with corticosteroids; in pink – the period of anti-crisis therapy with polyclonal antibodies (human equine immunoglobulin); the arrow indicates the date of conversion from evero-limus to mycophenolic acid preparations. On axis X - days from completion of transplantation
В дальнейшем пациент находился на амбулаторном наблюдении специалистов МГНЦ КГБ № 52. Через две недели после выписки пациента госпитализировали с острой задержкой мочи, острым пиелонефритом трансплантата. При поступлении уровень креатинина сыворотки крови – 723 мкмоль/л, мочевина крови – 27 ммоль/л. Проведенная антибактериальная терапия (цефепим+сульбактам, полимиксин В, тилорон) с положительным эффектом. При выписке креатинин сыворотки крови – 551 мкмоль/л, мочевина крови – 6 ммоль/л. В связи с сохраняющейся дисфункцией трансплантата и бесперспективностью в отношении восстановления функции почечного трансплантата в июне 2022 г. пациент был переведён на заместительную почечную терапию программным гемодиализом.
Заключение
Наше наблюдение показывает, что африканское происхождение, очевидно, повышает риск иммунологического конфликта после трансплантации и утрате функции трансплантата почки. Хотя африканское происхождение пациентов не является абсолютным противопоказанием к проведению трансплантации почки, однако такие пациенты нуждаются в более тщательном индивидуальном подборе донорского органа, в усиленной схеме иммуносупрессивной терапии и более тщательном мониторинге иммунологических показателей после трансплантации почки.
Список литературы Острое клеточное отторжение трансплантата почки у пациента африканского происхождения: клиническое наблюдение
- Knechtle SJ, Morris P. Kidney Transplantation - Principles and Practice: Expert Consult. 7th eds. Saunders; 2013.
- Arvelakis A, Lerner S, Wadhera V, Delaney V, Ames S, Benvenisty A, et al. Different outcomes after kidney transplantation between African Americans and Whites: A matter of income? A single-center study. Clin Transplant. 2019;33(11):e13725. PMID: 31585492.
- Schwartz JJ, Wilson S, Shi F, Elsouda D, Undre N, Kumar MSA. Prolonged-Release vs Immediate-Release Tacrolimus Capsules in Black vs White Kidney Transplant Patients: A Post Hoc Analysis of Phase III Data. Transplant Proc. 2018;50(10):3283-3295. PMID: 30577198.
- Feyssa E, Jones-Burton C, Ellison G, Philosophe B, Howell C. Racial/ethnic disparity in kidney transplantation outcomes: influence of donor and recipient characteristics. J Natl Med Assoc. 2009;101(2):111-115. PMID: 19378626.
- Wilkins LJ, Nyame YA, Gan V, Lin S, Greene DJ, Flechner SM et al. A Contemporary Analysis of Outcomes and Modifiable Risk Factors of Ethnic Disparities in Kidney Transplantation. J Natl Med Assoc. 2019;111(2):202-209. PMID: 30409716.


