Отдаленные результаты коронарного шунтирования у пациентов с тяжелым протяженным кальцинозом коронарных артерий
Автор: Пашаев Р.А., Петровский Д.В., Курбанов С.К., Латыпов Р.С., Васильев В.П., Ширяев А.А.
Журнал: Московский хирургический журнал @mossj
Рубрика: Сердечно-сосудистая хирургия
Статья в выпуске: 1 (87), 2024 года.
Бесплатный доступ
Введение. Пролонгированный дистальный кальциноз коронарных артерий (ККА) лимитирует проведение реваскуляризации миокарда и сопряжен с субоптимальными результатами хирургического лечения. Коронарное шунтирование (КШ) при ККА требует использования сложных коронарных реконструкций (СКР), включая коронарные эндартерэктомии (КЭАЭ), пролонгированные шунтпластики и анастомозы с артериями диаметром
Коронарное шунтирование, кальциноз коронарных артерий, сложные коронарные реконструкции
Короткий адрес: https://sciup.org/142240743
IDR: 142240743 | УДК: 616.12 | DOI: 10.17238/2072-3180-2024-1-46-54
Текст научной статьи Отдаленные результаты коронарного шунтирования у пациентов с тяжелым протяженным кальцинозом коронарных артерий
Известно, что наличие тяжелого кальциноза коронарных артерий (ККА) ограничивает выполнение чрескожных коронарных вмешательств (ЧКВ) и коронарного шунтирования (КШ); хирургическое лечение сопровождается периоперационными осложнениями [1]. Лимитирующее влияние коронарного кальциноза на выполнение ЧКВ состоит в том, что не всегда удается добиться адекватной баллонной дилатации коронарной артерии (КА). Баллонная дилатация может привести к разрыву КА в области ангиопластики или недораскрытию стента, а также к дистальной эмболии кальцинированными компонентами атеросклеротической бляшки [2]. Ограничение КШ заключается в невозможности формирования анастомозов в зоне кальцинозе, что в ряде случаев требует использования СКР, в том числе выполнения коронарной эндартерэктомии (КЭАЭ) и, как следствие, может приводить к высокому риску периоперационного инфаркта миокарда (ИМ).
В литературе отсутствуют крупные рандомизированные исследования, изучавшие результаты КШ у пациентов с ККА, поскольку тяжелый ККА является одним из критериев исключения в большинстве исследований, посвященных результатам реваскуляризации миокарда. Отсутствует общепринятая тактика реваскуляризации при выполнении КШ у данной группы пациентов. Наличие тяжелого пролонгированного ККА может явиться основной причиной отказа от формирования дистального анастомоза и выполнения неполной реваскуляриза- ции при КШ. В существующих исследованиях показано, что КШ дает возможность хирургу миновать кальцинированный участок эпикардиальной КА в случае локального поражения и выполнить анастомоз в дистальной трети [1, 3]. В случае вовлечения дистальной трети в распространенный ККА хирурги используют сложные коронарные реконструкции (СКР) [4]. Данные о КШ у группы пациентов с дистальным ККА при использовании СКР в отдалённом периоде после операции требуют изучения.
Материалы и методы
Проведено одноцентровое ретроспективное исследование включившее 610 пациентов, которым было выполнено изолированное КШ в период с 01.01.2017 по 01.01.2019 г. Критериями исключения явились: сердечная недостаточность (СН) с фракцией выброса менее 35 %, систолическое давление легочной артерии (СДЛА) более 55 мм рт. ст., клапанные пороки и аневризма левого желудочка, наличие тяжелых форм хронической почечной недостаточности (ХПН), хроническая обструктивная болезнь легких (ХОБЛ) ИМ давностью менее 1,5 месяцев. ККА подтверждался при ангиографической оценке КА, как рентген-позитивные образования в предполагаемом месте анастомоза в нативную фазу исследования. Группу исследования пациентов с ККА сформировали 121 пациент, а контрольную группу сформировали 489 пациент без ККА или с кальцинозом, но не в зоне планируемых анастомозов.
На предоперационном этапе по результатам коронарографии всем пациентам из группы ККА была выполнена мультиспи-ральная компьютерная томография (МСКТ) для более точной визуализации анатомии и локализации кальцинированных атеросклеротических бляшек КА (рис. 1). Протокол операции КШ не отличался в обеих группах. КШ было выполнено в условиях искусственного кровообращения (ИК) с применением холодовой кардиоплегии и применением операционного микроскопа. У всех пациентов в качестве шунта к передней нисходящей артерии (ПНА) использовали левую внутреннюю грудную артерию (ЛВГА) с соблюдением принципа полной реваскуляризации всех трех главных КА. После операции с первых суток антиагрегантная терапия проводилась ацетилсалициловой кислотой 100 мг. Пациентам, которым была выполнена эндартерэктомия хотя бы из одной целевой коронарной артерии, антиагрегантная терапия дополнялась применением гепарина с соблюдением целевых значений активированного времени свертывания (150–170), с последующим переходом на пероральный антикоагулянт варфарин на срок 6 месяцев после операции.
С целью минимизации систематических ошибок и обеспечения максимальной сопоставимости групп пациентов выполнили их компьютерное уравнивание методом псевдорандомизации (англ. Propensity score matching). Мы использовали контрольную группу с оценкой исходных параметров (ковариат), кодированных в конфаундеры, и включили в модель оценки индексов соответствия (англ. propensity score) наравне с исследуемой группой. При проведении псевдорандомизации мы использовали 13 ковариат, которые могли воздействовать на выбор метода и исходы операции. К ним отнесены: пол, возраст, индекс массы тела, сахарный диабет, артериальная гипертензия, фракция выброса левого желудочка (в %), постинфарктный кардиосклероз, ЧКВ в анамнезе, высокий показатель по шкале SYNTAX (> 32), нарушение мозгового кровообращения в анамнезе, мультифокальный атеросклероз, скорость клубочковой фильтрации, хроническая сердечная недостаточность (ХСН). Отбор контрольной группы выполнен на основе указанных характеристик по наиболее близким показателям склонности методом поиска ближайшего соседа 1:1, соответствующего заданному отрезку индекса соответствия. Целевым для достаточного сходства в парах мы считали программное значение индекса соответствия 0,1 (допуск соответствия). В результате после применения выбранного метода подбора пар отмечена эффективность устранения дисбаланса ковариат, получены сопоставимые по количеству группы пациентов (n = 115 для 1-й и 2-й групп)
При анализе результатов в отдаленном периоде 31 пациент был исключен из исследования по причине отказа от контрольного осмотра или отсутствия контактов. В остальных случаях выполнено анкетирование больных и/или их родственников (телефонный опрос, почтовый опрос) со сбором жалоб и анамнеза, анализом и интерпретацией данных предоставленной медицинской документации. Получены результаты у 97 исследуемых 1 группы (84,3 %) и 102 исследуемых (88,7 %) 2 группы. Медиана наблюдения составила 56 месяцев (51– 62).
Статистическую обработку данных выполняли с помощью программы SPSS Statistics 26 (IBM, Армонк, США). Перед началом анализа количественных данных проверяли их на нормальность распределения (асимметрия, критерий Колмогорова-Смирнова). При распределении, близком к нормальному, переменные представляли в виде среднего арифметического M и стандартного отклонения SD. При сравнении двух независимых групп использовали непараметрический критерий Манна-Уитни, для сравнения долей – критерий χ2 или точный критерий Фишера. С целью оценки времени до наступления любого из регистрируемых исходов использовали метод Каплана-Майера. Различия считали статистически значимыми при p <0,05.
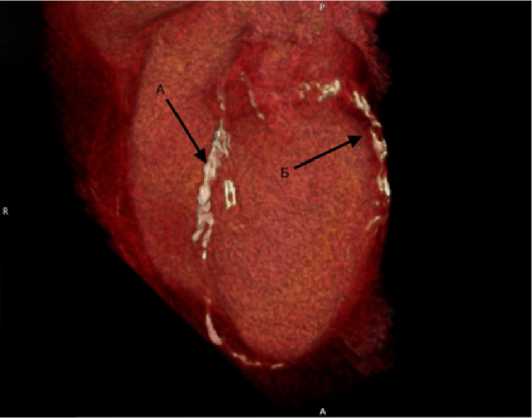
Рис. 1. Пример выраженного дистального кальциноза коронарных артерий. Компьютерная томография сердца, нативная фаза.
А – передняя нисходящая артерия, Б – артерия тупого края
Fig. 1. Example of severe extensive coronary artery calcinosis.
Cardiac computed tomography, precontrast phase. A – left anterior descending artery, В – obtuse marginal artery
Результаты
В обеих группах большинство пациентов представлены мужчинами (68,0 % и 67,6 %, соответственно, p=0,953), средний возраст составил 66,1±8,6 лет в группе 1 и 65,7±7,9 лет в группе 2. Различий по демографическим характеристикам не отмечено. Существенных различий по значению индекса массы тела не отмечено (28,2±3,5 и 28,2±4,0). Артериальная гипертензия была диагностирована у абсолютного большинства пациентов независимо от группы (87,6 % и 92,2 %). Осложненное течение ИБС с перенесенным ИМ в анамнезе отмечалось практически у половины исследуемых в двух группах (46,4 % против 46,1 %), средние значения ФВ ЛЖ были в пределах нормы в обеих группах (58,0±4,6 против 57,8±5,6), а встречаемость ХСН была редкой и находилась в пределах 10 % в обеих группах, что связано с исключением пациентов с низкой ФВ ЛЖ Частота перенесенного ранее ЧКВ несколько различалась и была выше в группе пациентов без ККА, статистически значимых различий не отмечено (22,7 % против 30,4 %). Тяжелое поражение по шкале Syntax (>32 баллов) отмечалось более чем у половины больных. Сопутствующая патология в виде сахарного диабета встречалась более чем в трети случаев в обеих группах (35,1 % против 33,3 %), схожие значения получены для встречаемости мультифокального атеросклероза (37,1 % против 34,3 %), функция почек была удовлетворительной в обеих группах. Исходная характеристика больных представлена в таблице 1.
Таблица 1
Исходные клинико-демографические характеристика
Table 1
Baseline clinical and demographics characteristics
|
Показатель /Indicator |
Группа 1 Group 1 (n=97) |
Группа 2 Group 2 (n=102) |
P |
|
Мужской пол, n (%)/Male, n (%) |
66 (68,0 %) |
69 (67,6 %) |
0,953 |
|
Возраст, M±SD (лет)/Average age, M±SD (years) |
66,1±8,6 |
65,7±7,9 |
0,708 |
|
Индекс массы тела, M±SD (кг/м^2)/Body mass index, M±SD (kg/m^2) |
28,2±3,5 |
28,2±4,0 |
0,970 |
|
Сахарный диабет, n (%)/ Diabetes mellitus |
34 (35,1 %) |
34 (33,3 %) |
0,798 |
|
Артериальная гипертензия, n (%)/Arterial hypertension, n (%) |
85 (87,6 %) |
94 (92,2 %) |
0,288 |
|
Фракция выброса левого желудочка, M±SD (%)/Left ventricle ejection fraction, M±SD (%) |
58,0±4,6 |
57,8±5,6 |
0,744 |
|
Инфаркт миокарда в анамнезе, n (%)/Previous myocardial infarction, n (%) |
45 (46,4 %) |
47 (46,1 %) |
0,965 |
|
Чрескожное коронарное вмешательство в анамнезе, n (%)/Previous percutaneous coronary intervention, n (%) |
22 (22,7 %) |
31 (30,4 %) |
0,219 |
|
Мультифокальный атеросклероз, n (%)/ Peripheral artery disease, n (%) |
36 (37,1 %) |
35 (34,3 %) |
0,680 |
|
Нарушение мозгового кровообращения, n (%)/Stroke history, n (%) |
9 (9,3 %) |
4 (3,9 %) |
0,126 |
|
Хроническая сердечная недостаточность, n (%)/ Congestive heart failure, n (%) |
11 (11,3 %) |
10 (9,8 %) |
0,724 |
|
Скорость клубочковой фильтрации, M±SD (мл/ мин)/Glomerular filtration rate, M±SD (ml/min) |
82,8±13,7 |
80,3±11,3 |
0,163 |
|
Syntax Score > 32, n (%) |
56 (57,7 %) |
52 (51,0 %) |
0,339 |
При анализе интраоперационных данных пациентов двух групп получены результаты, свидетельствующие в пользу более длительного хирургического лечения в группе больных с ККА со статистически значимым увеличением среднего индекса реваскуляризации миокарда (4,0±0,9 против 3,7±0,7, p=0,002) и выполнением СКР (43,3 % против 24,5 % p=0,005). Количество используемых аутоартериальных трансплантатов было сопоставимым (1,2±0,5 против 1,3±0,5, p=0,134), различия между количеством шунтов были достигнуты за счет аутовен (2,9±0,9 против 2,4±0,9, p=0,001). Результаты представлены в таблице 2.
Таблица 2
Интраоперационные показатели
Intraoperative data
Table 2
|
Показатель/Indicator |
Группа 1 Group 1 (n=97) |
Группа 2 Group 2 (n=102) |
P |
|
Средний индекс реваскуляризации, M±SD/Average index revascularization, M±SD |
4,0±0,9 |
3,7±0,7 |
0,002 |
|
Среднее количество аутоартериальных шунтов, M±SD/ Average number of arterial grafts, M±SD |
1,2±0,5 |
1,3±0,5 |
0,134 |
|
Среднее количество аутовенозных шунтов, M±SD/ Average number of autovenous grafts, M±SD |
2,9±0,9 |
2,4±0,9 |
0,001 |
|
Сложные коронарные реконструкции, n (%)/Complex coronary reconstructions, n (%) |
42 (43,3 %) |
25 (24,5 %) |
0,005 |
|
Ишемия миокарда, M±SD (мин)/Aortic cross-clamp time, M±SD (min) |
61,9±18,4 |
53,7±12,2 |
<0,001 |
|
Длительность искусственного кровообращения, M±SD (мин)/Duration of cardiopulmonary bypass M±SD (min) |
93,9±25,9 |
82,9±18,7 |
0,001 |
На госпитальном этапе диагностирован 1 случай перио-перационного ИМ у пациента из группы ККА, в контрольной группе данных за ИМ не получено. Частота возникновения ОНМК была идентична в обеих группах (1,0 % против 1,0 %). Статистически значимых различий по встречаемости сердечно-сосудистых событий не установлено, летальных исходов в обеих группах не зарегистрировано. Частота развития других госпитальных осложнений, в частности кровотечений, требующих рестернотомии, острой почечной недостаточности и выраженной дыхательной недостаточности, требующей продленной искусственной вентиляции легких, не различалась. Результаты представлены в таблице 3.
Таблица 3
Клинические результаты
Clinical outcomes
Table 3
|
Показатель /Indicator |
Группа 1 Group 1 (n=97) |
Группа 2 Group 2 (n=102) |
p |
|
Госпитальные результаты/In-hospital outcomes |
|||
|
Госпитальная смертность, n (%)/In-hospital mortality, n (%) |
0 |
0 |
1,0 |
|
Периоперационный инфаркт миокарда, n (%)/Perioperative myocardial infarction, n (%) |
1 (1,0 %) |
0 |
1,0 |
|
Периоперационное нарушение мозгового кровообращения, n (%)/Perioperative stroke, n (%) |
1 (1,0 %) |
1 (1,0 %) |
1,0 |
|
Рестернотомия, n (%)/ Resternotomy, n (%) |
2 (2,1 %) |
2 (2,3 %) |
0,692 |
|
Острая почечная недостаточность, n (%)/Acute renal failure, n (%) |
0 |
0 |
1,0 |
|
Пролонгированная искусственная вентиляция легких, n (%)/Prolonged mechanical ventilation, n (%) |
1 (1,0 %) |
1 (1,0 %) |
1,0 |
|
Длительность послеоперационного койко-дня, M±SD (сут)/Duration of postoperative period, M±SD (days) |
11,8±3,5 |
10,8±2,0 |
0,016 |
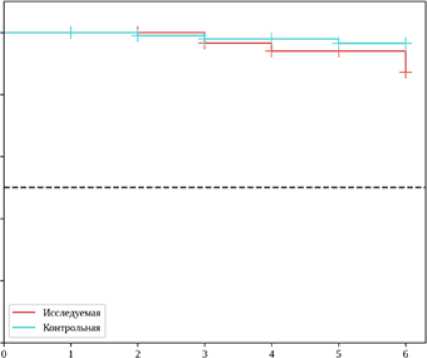
В отдаленном периоде медиана наблюдения составила 56 месяцев (51–62). Накопленная «свобода» от рецидива стенокардии в группе ККА была ниже и составила 71,7 % против 77,2 % в контрольной группе, при этом статистически значимых различий не достигнуто (p = 0,431). Накопленная выживаемость была сопоставима в двух группах (87,2 % против 96,5 %, p = 0,250). Результаты представлены на рисунках № 2, 3.
Обсуждение
Полная реваскуляризации миокарда у больных с ККА предполагает использование СКР: шунтпластик, КЭАЭ и анастомозов с артериями <1,5 мм. КЭАЭ является наиболее агрессивной из указанных методик, что выражается в деэн-дотелизации КА и повреждении субэндотелиальных слоев на относительно большом участке и может привести к тромбозу in situ [5]. В то же время адекватная антитромботическая терапия позволяет избежать тромбоза и развития ранних осложнений, что продемонстрировано в отдельных исследованиях [8–10]. В качестве альтернативы КЭАЭ менее травматичным и более безопасным методом реконструкций КА у данной группы больных является пролонгированная шунтпластика [9, 10]. Шунтпластика КА позволяет избежать повреждение интимы, что в свою очередь уменьшает риск развития тромбоза КА in situ и позволяет добиться долгосрочных положительных результатов реваскуляризации миокарда [11, 12]. В случае интактного участка КА при диаметре <1,5 мм, но >1,0 мм можно ограничится выполнением дистального анастомоза [13]. Однако использование анастомозов с артериями диаметра <1,5 мм и шунтпластики применимо при диффузном поражении КА, но не при тяжелом ККА с вовлечением дистального русла. В данной работе мы выполняли КЭАЭ только в том случае, когда не могли выполнить стандартный анастомоз или шунтпластику.
Согласно результатам субанализа исследования SYNTAX, опубликованный (2022 год), тяжелый ККА ухудшает прогноз больных вне зависимости от варианта реваскуляризации миокарда. Изучение влияния использования СКР у больных с ККА на отдаленный прогноз в исследовании не изучалось [14]. Схожие результаты получены в другом исследовании, где авторы выявили, что у пациентов, перенесших КШ, наличие ККА сопровождалось худшим прогнозом в течение года после операции [1]. C. Bourantas и соавт. продемонстрировали худшую 5-летнюю выживаемость у больных с ККА (17,1 % против 9,9 %, p < 0,001) [3]. В нашем исследовании мы получили существенно лучшие показатели 5-летней выживаемости у больных с ККА в сравнении с данными литературы. Вероятно, данные различия могут быть объяснены исключением из нашего исследования больных с тяжелой коморбидной и/или прогностически значимой патологией. Важным результатом нашей работы является сопостави- мая отдаленная выживаемость больных с ККА и без ККА, такие результаты получены впервые и ранее не описаны в литературе. Мы считаем, что детализация распространенности ККА у больных с тяжелым поражением, готовность и опыт хирурга к использованию СКР, использование микрохирургической техники позволяют выбрать оптимальную стратегию хирургического лечения и получить результаты, схожие со стандартным вмешательством.
10O
---- №слсдүгмлі --- КОІП|Ю»ИМ


Длительность тыбікиениа (вьикмыгыостъі. мес
Исследуемая
Нібмадгмий 97 94 87 73 66 14 0
1|гнпрмрс*амо 0 3 10 21 26 78 91
Событий 0 0 0 3 5 5 6
Котгтрамыая
ІІгиърнрошмо 0 5 II 18 28 8099
Собыпеі 0 0 1 2 2 33

Длительность тыбікңгнка (ргцмд*іи гтенокфднм)
Исслгдугмм
Нлбицатіій 97
Цжпрырошію 0
Событий 0
Контра тькм
Цл<пр<ро«лік> 0
Событий 0
9*87
3.7
Рис. 3. Анализ Каплана-Мейера по выживаемости. По оси абсцисс указана длительность наблюдения в годах. По оси ординат указана встречаемость события (выживаемость) в процентах Fig. 3. Kaplan-Meier curve for survival. X-axis indicates follow-up duration in years. Y-axis indicates incidence of event (survival) in percentage
5II
Заключение
Рис. 2. Анализ Каплана-Мейера по «свободе» от рецидива стенокардии.
По оси абсцисс указана длительность наблюдения в годах. По оси ординат указана встречаемость события (выживаемость) в процентах
Fig. 2. Kaplan-Meier curve for freedom from angina recurrence.
X-axis indicates follow-up duration in years. Y-axis indicates incidence of event (angina recurrence) in percentage
В большинстве работ, не указывается локализация и распространенность кальцинированного поражения в дистальном русле КА, что, по нашему мнению, является ключевым фактором, ограничивающим интерпретацию и экстраполирование данных литературы. В подавляющем большинстве работ, оценка тяжести ККА проводилась на основании КАГ в нативную фазу исследования как рент-генконтрастные затемнения по контуру артерии. Следует отметить, что КАГ не всегда демонстрирует анатомию кальцинированного поражения КА, а в некоторых случаях вообще может не визуализироваться, что свою очередь может повлиять на тактику оперативного вмешательства [3, 15]. В нашей работе всем пациентам была выполнена МСКТ-коронарография для более детального анализа кальциноза коронарного русла и определения тактики КШ на дооперационном этапе.
КШ у больных с ККА может быть выполнено с достижением удовлетворительных отдаленных результатов при использовании СКР и микрохирургической техники. Использование дополнительных методов визуализации КА, в частности МСКТ коронарографии с детализацией распространенности кальциноза позволяет выбрать оптимальную тактику хирургического вмешательства на предоперационном этапе.
Унификация определения ККА у пациентов, направляемых на КШ, использование дополнительных методов визуализации кальциноза и особенностей использования различных СКР представляется важной и необходимой перспективой для будущих исследований.
Список литературы Отдаленные результаты коронарного шунтирования у пациентов с тяжелым протяженным кальцинозом коронарных артерий
- Ertelt K., Généreux P., Mintz G.S., Reiss G.R., Kirtane A.J., Madhavan M.V., Fahy M., Williams M.R., Brener S.J., Mehran R., Stone G.W. Impact of the severity of coronary artery calcification on clinical events in patients undergoing Triage Strategy Trial). Am J Cardiol, 2013, № 112(11), pp. 1730-1737 https://doi.org/s://doi:10.1016/j.amjcard.2013.07.038
- Bangalore S., Vlachos H.A., Selzer F., Wilensky R.L., Kip K.E., Williams D.O., Faxon D.P. Percutaneous coronary intervention of moderate to severe calcified coronary lesions: insights from the National Heart, Lung,and Blood Institute Dynamic Registry. Catheter Cardiovasc Interv., 2011, № 77(1), pp. 22-28. https://doi.org/s://doi:10.1002/ccd.22613
- Bourantas C.V., Zhang Y.J., Garg S., Mack M., Dawkins K.D., Kappetein A.P., Mohr F.W., Colombo A., Holmes D.R., Ståhle E., Feldman T., Morice M.C., de Vries T., Morel M.A., Serruys P.W. Prognostic implications of severe coronary calcification in patients undergoing coronary artery bypass surgery: an analysis of the SYNTAX study. Catheter Cardiovasc Interv., 2015, № 85(2), pp. 199-206. https://doi.org/s://doi:10.1002/ccd.25545
- Акчурин Р.С., Ширяев А.А., Галяутдинов Д.М., Васильев В.П., Курбанов С.К., Андреев А.В., Зайковский В.Ю., Майоров Г.Б. Годичные результаты коронарного шунтирования у пациентов с кальцинозом целевых коронарных артерий. Патология кровообращения и кардиохирургия, 2022. № 26(1). С. 55-65. https://doi.org/10.21688/1681-3472-2022-1-55-65
- Wang J., Gu C., Yu W.., Gao M, Yu Y. Short- and Long-Term Patient Outcomes from Combined Coronary Endarterectomy and Coronary Artery Bypass Grafting: A Meta-Analysis of 63,730 Patients (PRISMA). Medicine (Baltimore), 2015, № 94(41), pр. 1-16. https://doi.org/s://doi:10.1097/MD.0000000000001781
- Tiemuerniyazi X., Yan H., Song Y., Nan Y., Xu F., Feng W. Mid-term outcomes of coronary endarterectomy combined with coronary artery bypass grafting. Interact Cardiovasc Thorac Surg., 2021, № 32(2), pp. 188-195. https://doi.org/s://doi:10.1093/icvts/ivaa252
- Myers P.O., Tabata M., Shekar P.S., Couper G.S., Khalpey Z.I., Aranki S.F. Extensive endarterectomy and reconstruction of the left anterior descending artery: early and late outcomes. J Thorac Cardiovasc Surg., 2012, № 143(6), pp. 1336-1340. https://doi.org/s://doi:10.1016/j.jtcvs.2011.08.058
- Nishigawa K., Fukui T., Yamazaki M., Takanashi S. Ten-Year Experience of Coronary Endarterectomy for the Diffusely Diseased Left Anterior Descending Artery. The Annals of Thoracic Surgery, 2017, № 103 (3), pp. 710-716. https://doi.org/10.1016/j.athoracsur.2016.11.028
- Prabhu A.D., Thazhkuni I.E., Rajendran S., Thamaran R.A., Vellachamy K.A., Vettath M.P. Mammary artery patch reconstruction of left anterior descending coronary artery. Asian Cardiovasc Thorac Ann, 2008, № 16(4), pp. 313-317. https://doi.org/s://doi:10.1177/021849230801600412
- Белаш С.А., Барбухатти К.О. Реконструктивные операции при диффузном коронарном атеросклерозе без эндартерэктомии. Инновационная медицина Кубани, 2019. № 3 (15). С. 53-61. https://doi.org/10.35401/2500-0268-2019-15-3-53-61
- Чарчян Э.Р., Герасимов А.Н., Скворцов А.А., Хачатрян З.Р., Пюмпюлян А.Г., Исаев Р.М., Белов Ю.В. Аортокоронарное шунтирование в сочетании с коронарной эндартерэктомией и шунтпластикой: есть ли различия в раннем послеоперационном периоде? Кардиология и сердечно-сосудистая хирургия, 2018. № 11(5). С. 53-59. https://doi.org/10.17116/kardio20181105153
- Qiu Z., Chen X., Jiang Y., Wang L., Xu M., Huang F., Shi H., Zhang C. Comparison of off-pump and on-pump coronary endarterectomy for patients with diffusely diseased coronary arteries: early and midterm outcome. J Cardiothorac Surg, 2014, № 9(186), pp. 1-8. https://doi.org/s://doi:10.1186/s13019-014-0186-5
- Maureira P., Vanhuyse F., Lekehal M., Tran N., Carteaux J.P., Villemot J.P. Left main coronary disease treated by direct surgical angioplasty: long-term results. Ann Thorac Surg, 2010, № 89(4), pp. 1151-1157. https://doi.org/s://doi:10.1016/j.athoracsur.2009.12.071
- Kawashima H., Serruys P.W., Hara H., Ono M., Gao C., Wang R., Garg S., Sharif F., de Winter R.J., Mack M.J., Holmes D.R., Morice M.C., Kappetein A.P., Thuijs D.J.F.M., Milojevic M., Noack T., Mohr F.W., Davierwala P.M., Onuma Y. SYNTAX Extended Survival Investigators. 10-Year All-Cause Mortality Following Percutaneous or Surgical Revascularization in Patients with Heavy Calcification. JACC Cardiovasc Interv, 2022, № 15(2), pp. 193-204. https://doi.org/s://doi:10.1016/j.jcin.2021.10.026
- Harling L., Sepehripour A.H., Ashrafian H., Lane T., Jarral O., Chikwe J., Dion R.A., Athanasiou T. Surgical patch angioplasty of the left main coronary artery. Eur J Cardiothorac Surg, 2012, № 42(4), pp. 719-727. https://doi.org/s://doi:10.1093/ejcts/ezs324


