Отдаленные результаты радиойодтерапии больных раком щитовидной железы с метастазами в легкие и cредостение
Автор: Подольхова Н.В., Дроздовский Б.Я., Гарбузов П.И., Родичев А.А., Тимохина О.В., Иконников А.И., Гусева Т.Н., Доброва Г.С.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 4 (20), 2006 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/14054341
IDR: 14054341
Текст статьи Отдаленные результаты радиойодтерапии больных раком щитовидной железы с метастазами в легкие и cредостение
Медицинский радиологический научный центр РАМН, г. Обнинск
На долю рака щитовидной железы (РЩЖ) приходится 0,4–2 % [3, 9] всех злокачественных опухолей. За последние 10 лет заболеваемость РЩЖ значительно увеличилась [2, 7]. Отдаленные метастазы у больных РЩЖ наблюдаются в 7,1–17 % случаев [3, 9, 11, 13]. Чаще областями отдаленного метастазирования являются легкие – от 4,4 до 15 % [12, 14]. Согласно данным, приведенным в отечественной и зарубежной литературе, 5- и 10-летняя выживаемость больных дифференцированным раком щитовидной железы (ДРЩЖ) с метастазами в легкие, получивших курсы радиойодтерапии (РЙТ), составляет 50–92,6 % и 42–86 %, а при сочетанном поражении легких и лимфоузлов средостения – 88 % и 72 % соответственно [1, 4, 8, 10, 14]. Применение 131I занимает ведущее место в лечении отдаленных метастазов РЩЖ. Изотоп 131I распадается с испусканием β-частиц, обладающих терапевтическим эффектом, и γ-квантов, которые позволяют оценивать результаты лечения методами сцинтиграфии. Методика радиойодтерапии (РЙТ) основана на механизме активного накопления 131I клетками дифференцированной опухоли щитовидной железы, что позволяет достичь высоких поглощенных доз при минимальной лучевой нагрузке на окружающие ткани [6, 10]. Задачами радиойодтерапии являются: лечение ранее выявленных отдаленных метастатических очагов, воздействие на опухолевую ткань при нерадикальных операциях, девитализация ткани ЩЖ после хирургического лечения, что позволяет снизить риск местных рецидивов и использовать уровень ТГ как опухолевого маркера, диагностика ранее не выявленных метастатических очагов.
Проведение РЙТ возможно после хирургического удаления щитовидной железы (проведении тотальной или окотототальной тиреоидэктомии) и регионарных метастазов, при гипотиреиодном состоянии пациента [3, 5, 6, 10, 12].
Материал и методы
Нами проведен ретроспективный анализ результатов РЙТ 126 больных с метастазами РЩЖ в легкие и средостение, находивщихся на лечении в отделении радиохирургического лечения открытыми радионуклидами МРНЦ РАМН с 1986 по 2000 г. Группу больных составили 91 женщина и 35 мужчин. Возраст пациентов на момент лечения колебался от 18 до 69 лет, большая часть больных находилась в возрасте от 40 до 65 лет. Папиллярный РЩЖ установлен у 76 (60,3 %) человек, фолликулярный – у 43 (34,1 %), медуллярный – у 2 (1,6 %), низкодифференцированный – у 5 (4 %). Изолированное поражение легких мы наблюдали у 87 (69,1 %) больных, поражение средостения – у 11 (8,7 %), сочетанное поражение легких и средостения – у 28 (22,2 %) человек. Метастазы в легкие выявлены одновременно с установлением диагноза РЩЖ у 48 (41,7 %) больных, у 33 (28,7 %) – в течение 1–5 лет, у 34 (29,6%) – через 5 лет после установления диагноза. Чаще всего, в 49,6 % случаев, легочные метастазы были представлены очагами средних размеров (1–1,5 см). Рентгенонегативные метастазы (выявляемые при сцинтиграфии) встречались в 4,3 %, мелкоочаговые (до 1 см) – в 16,4 %, крупноочаговые (более 1,5 см) – в 29,7 %.
В основном пациенты поступали в клинику уже после однократного или многократного оперативного лечения. Многим больным до и после РЙТ проводилось комбинированное лечение. Первично оперированы в МРНЦ РАМН – 24 пациента, 12 больных, пролеченных по месту жительства, повторно оперированы в нашем отделении. Распространенность первичной опухоли по международной классификации рTNM (5-е издание, принятое Международным Противораковым Комитетом, 1993 г.) удалось установить у 83 больных (65,9 %). Большинство из этих пациентов имели опухоль, относящуюся к категории Т4, – 43 человека, Т3 – 29 больных, Т2 – 9, и лишь у двух пациентов опухоль квалифицировалась как Т1 . Поражение регионарных лимфатических узлов наблюдалось у 101 (80,2 %) больного.
Отмена L-тироксина пациентам осуществлялась за 20 дней до госпитализации. Уровень тиреотропного гормона перед лечением у исследуемых больных колебался от 1 до 165 (норма 0,25–4,0) mlU/ml. Титр тиреоглобулина был повышен у всех больных, от 15 до 5648 IU/ml. Первично всем пациентам per os в виде раствора NaI вводилась аблативная активность 131I – 70 мКи. После введения препарата пациентов помещали в палаты, оборудованные автономной вентиляцией и канализацией. Супрессивную гормональную терапию возобновляли через 48–72 ч. При снижении мощности дозы излучения до 3 мкЗв/ч на расстоянии 1 метра от пациента больных выводили из «активных» палат, чаще на 3–4-е сут после лечения, и проводили сцинтиграфию всего тела на установке Sophy – camera DSX с целью выявления очагов гиперфиксации радиофармпрепарата (РФП), оценки эффективности и результатов лечения. Повторные курсы РЙТ проводили через 3–6 мес, активностью 1–1,5 мКи 131I на кг массы.
Лечение проводилось до полного исчезновения накопления РФП в очагах, рентгенологических признаков заболевания и нормализации уровня тиреоглобулина в сыворотке крови. Контрольное обследование, включающее в себя общеклиническое обследование, ультрозвуковое исследование шеи, определение тиреоглобулина и введение диагностической активности 131I (5–10 мКи), с последующей сцинтиграфией всего тела проводилось всем пациентам после лечения с интервалом 1–2 года.
Полный эффект лечения определялся при отсутствии ультразвуковых признаков местного и регионарного рецидива, при отсутствии патологических образований на рентгенограмме легких, физиологическом распределении изотопа при сцинтиграфии и нормализации уровня тиреоглобулина. Неполный эффект лечения или стабилизация определялись, если при наличии местного и регионарного рецидива размеры опухолевого очага уменьшались, размеры метастазов в легких уменьшались или стабилизировались и титр тиреоглобулина снижался. Отсутствие эффекта или прогрессирование заболевания расценивалось при рецидиве опухоли на шее, увеличении в размерах метастатических очагов в легких и/или средостения и/или появлении выпота в плевральной полости, при росте уровня тиреоглобулина в сыворотке крови.
Результаты и обсуждение
Показатели 5- и 10-летней выживаемости исследуемой группы пациентов составили 95,1 и 79,3 %. Полного эффекта лечения за 5-летний период лечения и наблюдения удалось достичь – у 59 (46,8 %) больных, стабилизации или частичного эффекта лечения – у 35 (27,8 %), прогрессирование отмечено – у 29 (23,0 %) пациентов. За 10 лет – у 66 (71,7 %), у 1 (1,1 %) и у 6 (6,5 %) больных соответственно (таблица).
Таблица
Отдаленная эффективность РЙТ (%)
|
Эффективность РЙТ |
Год наблюдения |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
Выздоровление |
4,8 |
8,7 |
26,2 |
41,3 |
46,8 |
59,9 |
66,7 |
71,2 |
71,7 |
71,7 |
|
Стабилизация |
80,9 |
76,2 |
62,7 |
38,9 |
27,8 |
17,6 |
8,1 |
3,2 |
1,1 |
1,1 |
|
Прогрессирование |
14,3 |
15,1 |
11,1 |
18,2 |
23 |
17,6 |
12,1 |
7,5 |
6,5 |
6,5 |
|
Смертность |
- |
- |
- |
1,6 |
2,4 |
4,9 |
13,1 |
18,1 |
20,7 |
20,7 |
Осложнения РЙТ в виде лучевого пневмонита после введения 130 мКи 131I и пневмосклероза после суммарного введения 290 мКи 131I отмечены у 2 пациентов с множественными поражениями легких. Все больные с изолированным поражением средостения достигли полного эффекта лечения, 5- и 10-летняя выживаемость составила 100 %. Полного эффекта при РЙТ у больных РЩЖ с изолированным поражением легких удалось добиться у 48 (55,2 %) пациентов (рис. 1). Пяти- и десятилетняя выживаемость этой категории больных составляет 95,4 и 86,4 %. У больных с сочетанным поражением легких и средостения полный эффект удалось достичь у 12 (42,9 %) пациентов, соответственно 5- и 10летняя выживаемость составила 92,9 и 71,4 %. При сравнении эффективности РЙТ в группах больных с изолированным поражением легких и с поражением легких и средостения на 5-м году лечения и наблюдения достоверных различий не получено, на 10-м – эффективность РЙТ у больных РЩЖ с метастазами в легкие была достоверно выше, чем у больных с метастазами в легкие и средостение (р<0,05).
Эффективность РЙТ была достоверно выше в группах больных с рентгенонегативными и мелкоочаговыми метастазами в сравнении с эффективностью лечения в группе больных с крупноочаговым поражением легких. При сравнении показателей эффективности РЙТ и выживаемости в группах больных папиллярным и фолликуллярным РЩЖ достоверных отличий не получено, полный эффект терапии за пять лет лечения и наблюдения получен у 51,35 % больных папиллярным РЩЖ, за десять – у 77,36 %, у больных фолликуллярным раком – в 44,19 % и 78,13 % случаев соответственно. Показатели 5- и 10-летней выживаемости у больных папиллярным РЩЖ составили 97,37 % и 82,22 %, у больных фолликулляр-ным РЩЖ – 97,67 % и 85,71 % соответственно. У больных низкодифференцированным раком эффективность РЙТ значительно ниже, только у 20 % больных удалось добиться полного эффекта лечения. При медуллярном РЩЖ применение терапии 131I не показано.
Эффективность РЙТ со статистической достоверностью зависела от процента накопления 131I в метастатических очагах при первых введе- ниях терапевтических активностей. Так, полный эффект терапии наблюдался у 25,00 % больных с отсутствием или очень слабым накоплением РФП и у 55,56 % больных с накоплением йода в метастазах 5 и более процентов от СВТ. Различие в эффективности терапии у этих групп больных статистически достоверно (р<0,05). Эффективность РЙТ зависела от уровня тиреоидных гормонов перед лечением. Полный эффект терапии отмечен у 35,71 % больных с низким уровнем тиреотропного гормона (ТТГ<30µIU/ml) и у 74,00 % с высоким (ТТГ>-30µIU/ml). Таким образом, эффективность РЙТ в группе больных с высоким тиреотропным гормоном перед лечением значительно выше в сравнении с группой больных с низким уровнем тиреотропина (р<0,02). Возраст пациентов также существенно влиял на эффективность терапии и прогноз заболевания, наилучших результатов РЙТ удалось достичь у больных молодого возраста.
Таким образом, анализ полученных данных показал высокую эффективность РЙТ у больных ДРЩЖ с метастазами в легкие и средостение, цифры выживаемости у больных в нашем исследовании превышают аналогичные показатели, приведенные в мировой литературе. Данные работы свидетельствуют о необходимости проведения РЙТ, по указанной выше методике, всем больным ДРЩЖ и низкодифференцированным раком ЩЖ с метастазами в легкие и средостение. Эффективность РЙТ и выживаемость больных РЩЖ с метастазами в средостение выше, чем эффективность РЙТ у больных с метастазами в легкие или средостение и легкие. Результаты лечения значительно лучше у больных с рентгенонегативными и мелкоочаговыми метастазами. Наиболее эффективно применение 131I у больных РЩЖ с высоким накоплением этого РФП в метастатических очагах. На эффективность лечения и прогноз заболевания оказывает влияние уровень тиреотропного гормона перед терапией, у больных с уровнем ТТГ выше 30 µ IU/ ml. удалось достичь лучших результатов РЙТ. У больных молодого возраста эффективность терапии выше в сравнении с эффективностью лечения в других возрастных группах.
Рекомендуется следующий протокол комбинированного лечения больных ДРЩЖ с метастазами в средостение и/или легкие:
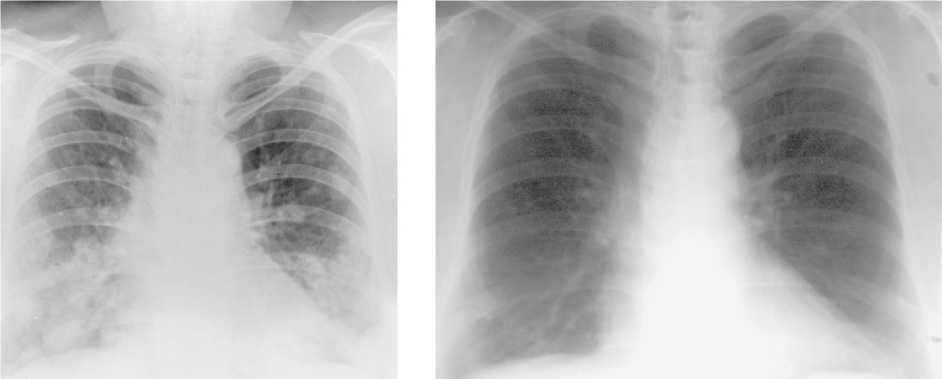
Рис. 1. Рентгенограммы органов грудной клетки больной П., с диагнозом РЩЖ с метастазами в легкие, T4N1aM1. До лечения (слева) определяются множественные крупноочаговые метастазы в средних и нижних отделах легких. После проведения 8 курсов РЙТ суммарной активностью 710 мКи 131I (справа) – метастазы в легких отсутствуют
-
1) первый этап лечения – хирургический (тиреоидэктомия, дополненная, при необходимости, вмешательством на регионарном лим-фоколлекторе),
-
2) через 3–4 нед введение аблятивной активности 131I , из расчета 1 мКи /кг, с последующей сцинтиграфией всего тела,
-
3) через 2 сут после РЙТ – L-тироксин в супрессивной дозе,
-
4) проведение курсов РЙТ с интервалом 3–6 мес, активностью 1–1,5 мКи /кг 131I, на фоне отмены L-тироксина,
-
5) после достижения полного эффекта РЙТ проведение больному контрольного обследования 1 раз в год в течение 3 лет, включающего сцинтиграфию всего тела после введения 5 мКи 131I, на фоне отмены L-тироксина, рентгенологическое исследование легких, УЗИ шеи, определение уровня ТГ и АТ к ТГ. При выявлении на контрольном обследовании рентгенологических признаков заболевания и/или роста уровня ТГ и/или накопления РФП при сцинтиграфии – возобновление курсов РЙТ.
Все пациенты, получавшие курсы РЙТ в МРНЦ РАМН и достигшие выздоровления, остаются под диспансерным наблюдением в отделении радиохирургического лечения открытыми радионуклидами, часть больных со стабилизацией метастатического процесса и прогрессированием заболевания продолжают терапию в МРНЦ, у многих из них отмечена положительная динамика, что по завершении их лечения позволит увеличить число выздоровевших больных.


