Отдалённые результаты операции «замороженный хобот слона»: 10-летний опыт центра
Автор: Чарчян Э.Р., Брешенков Д.Г., Чакал Д.А., Генс А.П., Степаненко А.Б., Абугов С.А., Белов Ю.В.
Журнал: Московский хирургический журнал @mossj
Рубрика: Сердечно-сосудистая хирургия
Статья в выпуске: 3 (93), 2025 года.
Бесплатный доступ
Введение. Операция «замороженный хобот слона» (ЗХС) – широко используемый метод при лечении распространенных. форм заболеваний грудной аорты. Несмотря на популярность, доступность методики и значительные преимущества над менее радикальными операциями, сохраняется высокий риск дистальных аортальных осложнений, требующих повторных вмешательств. Цель. Оценить ранние и отдаленные результаты операции ЗХС, частоту и структуру повторных вмешательств, а также факторы риска, ассоциированные с реинтервенциями. Материалы и методы. Проведено ретроспективное одноцентровое обсервационное когортное исследование 347 пациентов, оперированных с использованием методики ЗХС с 2014 по 2025 год. Использовались различные гибридные протезы, включая новый отечественный расслоение специфический гибридный протез «Мягкий хобот слона». Анализ выживаемости и факторов риска выполнен с использованием методов Каплана-Мейера и многофакторного логистического регрессионного анализа. Результаты. Средний возраст пациентов составил 52,8±11,5 года, 71 % – мужчины. Десятилетняя выживаемость составила 78 %. Повторные вмешательства потребовались у 13,5 % пациентов, из них 11,2 % – дистальные реинтервенции, 1,7 % – проксимальные. Основной причиной внеплановых реинтервенций (n=19, 5,5 %) являлось отрицательное ремоделирование, которое в 58 % случаев развивалось на фоне новой дистальной стент-графт-индуцированной фенестрации (ДСИФ), тогда как плановые этапные вмешательства потребовались в 20 случаях (5,7 %). Плановые открытые вмешательства сопровождались более высокой 7-летней выживаемостью (90 %) по сравнению с эндоваскулярными (60 %). Наличие синдрома дисплазии соединительной ткани было независимым предиктором риска повторных вмешательств (HR 4,11; p=0,002). Заключение. Операция ЗХС остаётся золотым стандартом в лечении распространенных заболеваний грудной аорты, обеспечивая высокую выживаемость в отдаленном периоде. Исследование показало, что открытая хирургия после ЗХС обеспечивает лучшие долгосрочные результаты в сравнении эндоваскулярными вмешательствами. Пациенты с дисплазией соединительной ткани требуют динамичного МСКТ-контроля. Оптимизация хирургической стратегии и активное послеоперационное наблюдение остаются ключевыми факторами успешного лечения и профилактики поздних осложнений.
Гибридная хирургия, стент-графт, гибридный протез, расслоение аорты, аневризма аорты
Короткий адрес: https://sciup.org/142245630
IDR: 142245630 | УДК: 616.132-007.64 | DOI: 10.17238/2072-3180-2025-3-56-67
Текст научной статьи Отдалённые результаты операции «замороженный хобот слона»: 10-летний опыт центра
Операция «замороженный хобот слона» (ЗХС), предложенная Kato еще в 1995 году, является одной из ключевых и популярных методик в хирургии расслоения аорты [1]. Основная идея этой методики заключается в одномоментной коррекции распространенной патологии дуги и нисходящего отдела [2]. За последние десятилетия операция ЗХС стала золотым стандартом при лечении как острых, так и хронических расслоений аорты А и В типа по Стэнфорду, а также торакоабдоминальных аневризм аорты (ТААА). Несмотря на неоспоримые преимущества методики, в виде индукции тромбоза ложного канала (ЛК) на уровне стент-графта и потенциальное положительное ремоделирование (ПР), связанное с этим, сохраняется риск дистальных аортальных событий, требующих повторного вмешательства. В ряде публикаций сообщается о высокой частоте реинтервенций на дистальной аорте, достигающей 60–80% в течение первых 5 лет наблюдения [3–5]. Этот факт ставит под сомнение предполагаемую универсальность подхода «ЗХС при расслоении – один этап» и требует более тщательной оценки долгосрочных результатов [6].
Целью настоящего исследования стало определение результатов операции ЗХС, частоты и структуры проксимальных и дистальных повторных вмешательств, а также выявление факторов риска, ассоциированных с реинтервенциями.
Материалы и методы
Проведено ретроспективное одноцентровое обсервационное когортное исследование, включившее пациентов, перенёсших операцию ЗХС в ГНЦ ФГБНУ «РНЦХ им. акад. Б.В. Петровского» в период с 2014 по 2025 год. В исследование были включены 347 пациентов, независимо от этиологии патологии (острое/ хроническое расслоение аорты А и В типа, аневризма, shaggy aorta и др.). Все вмешательства выполнялись с использованием гибридных протезов, включая Thoraflex Hybrid (Vascutek, Шотландия), E-Vita Open Plus (Jotec, Германия), «Мягкий хобот слона» (МедИнж, Пенза, Россия), Braile (Braile, Бразилия), Valiant Thoracic (Medtronic, США). Исследование “Ретроспективный анализ результатов гибридной хирургии грудной аорты аорты (Гибрид-Р)” одобрено локальным этическим комитетом 24.01.2025 (протокол заседания ЛЭК № 1 от 24.01.2025).
Критерии включения:
– выполнение операции ЗХС;
– возраст старше 18 лет;
-
– наличие доступных клинических данных и контрольных МСКТ минимум через 6 месяцев после операции;
– возможность использования нескольких типов гибридных протезов на основании оценки анатомических и клинических данных.
Критерии исключения:
-
– отказ от участия в исследовании.
Хирургическая техника
До 2014 года в нашем центре применялась преимущественно гибридная методика, получивший название «русский гибрид», включающая классическую технику «хобот слона» с последующим этапом ЭЛАГА. С 2014 года в нашем центре впервые в РФ начато активное использование современных фабричных гибридных протезов: первыми имплантированными изделиями стали Thoraflex Hybrid и E-Vita Open Plus. Начиная с 2019 года, в нашей практике внедрён и активно используется отечественный расслоение-специфический гибридный протез – «Мягкий хобот слона» (МедИнж, Пенза, Россия). Концепция этого гибридного протеза аорты основана на прогрессивном снижении радиальной жёсткости за счёт постепенного уменьшения толщины нитино-ловых колец. Дистальное кольцо имеет Z-образную форму ни-тинолового кольца и снижает жёсткость на 50 % по сравнению с первым кольцом. Кроме того, дистальный край снабжён сосудистым безнитиноловым сегментом длиной 2 см с девятью платиновыми рентгенконтрастными метками. Такая конструкция предотвращает жесткое давление на интиму и, тем самым, снижает риск развития новой дистальной стент-графт-индуцированной фенестрации (ДСИФ). Важным дополнением является общая длина протеза (200 мм) и отсутствие шовного кольца, что позволяет безопасно имплантировать его ниже уровня Th8 и эффективно закрывать возможные дистальные фенестрации, что положительно влияет на ремоделирование аорты [3, 7–9].
Пациенты были разделены на группы в зависимости от типа реинтервенции (эндоваскулярное лечение аневризм грудной аорты (ЭЛАГА) или открытая хирургия, а также в зависимости от этапного или экстренного характера вмешательств. Повторные вмешательства классифицировались как дистальные (ЭЛАГА, протезирование TAA, протезирование брюшной аорты (БА) и др.) и проксимальные (рестернотомия, репротезирование дуги).
Для оценки выживаемости и свободы от повторных вмешательств использовался анализ по методу Каплана-Мейера с использованием лог-рангового теста для сравнения кривых. Факторы риска, ассоциированные с повторными вмешательствами, определялись с помощью многофакторного логистического регрессионного анализа с расчётом отношения шансов (ОШ) и 95 % доверительных интервалов (ДИ).
Результаты
В исследование были включены 347 пациентов, перенёсших операцию ЗХС в период с 2014 по 2025 гг. Средний возраст когорты составил 52,8 ± 11,5 лет, преобладали пациенты мужского пола (71 %). Расслоение аорты А типа по Стэнфорду было показанием к операции у 58,7 % пациентов, в основном в хронической стадии (41,6 %). Расслоение аорты В типа по Стэнфорду встречалось реже (21,3 %), и также преимущественно в хронической стадии (78,4 %). Большая половина когорты пациентов была оперирована с использованием расслоение-специфического гибридного протеза аорты «Мягкий хобот слона» (МедИнж, Пенза, Россия). Повторные вмешательства на аорте выполнялись в 47 случаях (13,5 %) пациентов, а дисплазия соединительной ткани была верифицирована у 11 % пациентов (табл. 1).
Таблица 1
Предоперационная характеристика пациентов
Preoperative patients characteristics
Table 1
|
Характеристика Characteristic |
N, Me (Q1; Q3), Mean (SD) |
|
Возраст, лет Age, years |
52,8 (11,5) |
|
Мужской пол, n (%) Male sex, n (%) |
247 (71,1) |
|
Индекс массы тела, кг/м2 Body mass index, kg/m² |
28,25 (4,5) |
|
Аневризма торакоабдоминальной аорты, n (%) Thoracoabdominal aortic aneurysm, n (%) |
62 (17,8) |
|
Shaggy аорта, n (%) |
7 (2) |
|
Расслоение аорты А типа по Стэнфорду, n(%) Stanford Type A aortic dissection, n (%) |
204 (58,7) |
|
- Острая стадия, n (%) Acute phase, n (%) |
70 (34,3) |
|
- Подострая стадия, n (%) Subacute phase, n (%) |
49 (24) |
|
- Хроническая стадия, n (%) Chronic phase, n (%) |
85 (41,6) |
Продолжение Таблицы 1
|
Расслоение аорты В типа по Стэнфорду, n (%) Stanford Type B aortic dissection, n (%)
Acute phase, n (%)
Subacute phase, n (%)
Chronic phase, n (%) |
74 (21,3) 3 (4) 13 (17,5) 58 (78,4) |
|
Тип гибридного протеза аорты, n Type of hybrid aortic prosthesis, n
Stent-graft “Soft Elephant Trunk”, n (%)
|
52 (17) 21 (10,6) 2 (0,5) 247 (66) 25 (8,3) |
|
Повторные вмешательство на аорте, n (%) Redo aortic repair |
47 (13,5) |
|
Наследственная дисплазия соединительной ткани, n (%) Hereditary connective tissue disorder, n (%)
Marfan syndrome, n (%)
|
38 (10,9) 21 (55,3) 2 (5,2) 1 (0,3) 1 (0,3) 13 (34,2) |
|
Артериальная гипертензия, n (%) Hypertension, n (%) |
286 (82,4) |
|
Ишемическая болезнь сердца, n (%) Coronary artery disease, n (%) |
65 (18,7) |
|
Фракция выброса, % Ejection fraction, % |
59,5 (7,5) |
|
ОНМК в анамнезе, n (%) History of stroke, n (%) |
33 (9,5) |
|
Хроническая обструктивная болезнь лёгких, n (%) Chronic obstructive pulmonary disease, n (%) |
21 (6) |
|
Сахарный диабет, n (%) Diabetes mellitus, n (%) |
17 (4,8) |
|
Фибрилляция предсердий, n (%) Atrial fibrillation, n (%) |
36 (10,4) |
|
Хроническая болезнь почек, n (%) Chronic kidney disease, n (%) |
80 (23) |
*ОНМК – острое нарушение мозгового кровообращения, Me – median, SD – standard deviation
Классический вариант гибридной операции по «замороженный хобот слона» с использованием гибридного протеза выполнялся в превалирующем количестве случаев (83,2 %), тогда как гибридные подходы с применением ЭЛАГА были реализованы в 16,8 % случаев и являются на данном этапе историческим вариантом, и в настоящее время не используются. Средний диаметр гибридного протеза составил 28 (26; 30) мм, а длина имплантируемой части 150 (140; 180) мм. Протезирование дуги чаще проводилась с применением многобраншевых протезов (55 %), в то время как имплантация ветвей на единой площадке – в 45 % случаев. Для артериальной канюляции чаще всего использовалась правая подключичная артерия (65 %), также в примерно одинаковой частоте использовались ОБА, аорта и ОСА в зависимости от анатомии расслоения аорты. Мини-инвазивное вмешательство с использованием министернотомии выполнялось у 5,4 % пациентов. Средняя продолжительность искусственного кровообращения (ИК) составила 160 (134; 192) мин, ишемии миокарда (ИМ) – 94 (77; 118) мин, циркуляторного ареста (ЦА) – 32 (28; 39) мин при стандартной температуре 28 °C. Средний объем интраоперационной кровопотери в среднем составил 1000 (700; 1500) мл. Частота ре-эксплораций по поводу кровотечения – 6,3 %. В послеоперационном периоде параплегия зафиксирована в 0,5 % случаев, парапарез – в 3,7 % из которых более 50 % восстановилось в госпитальном периоде, ОНМК – 4 %. Средняя длительность ИВЛ составила 9 (7; 13) часов, пребывания в ОРИТ – 2 (1; 4) суток, а госпитализация – 10 (8; 14) суток. Госпитальная летальность составила 4,3 %. Средний срок наблюдения составил 60 месяцев (34,3–85,8 мес.) (табл. 2). Отдаленная выживаемость через 10-лет после операции составила 78 %.
Таблица 2
Ранние результаты операций
Overall results
Table 2
|
Характеристика Characteristic |
N (%), Me (Q1; Q3), Mean (SD) |
|
Тип гибридной операции: Type of hybrid repair:
Frozen Elephant Trunk, n (%)
|
322 (92,7) 25 (7,2) |
|
Размер протеза, мм Prosthesis size, mm |
28 (26; 30) |
|
Длина эндоваскулярной части, мм Endovascular part length, mm |
150 (140; 180) |
Продолжение Таблицы 2
|
Реконструкция брахиоцефальных ветвей, n (%) Branches repair, n (%)
Island technique, n (%)
Selective repair, n (%) |
156 (45) 191 (55) |
|
Артериальная канюляция, n (%): Arterial cannulation site, n (%)
Aorta, n (%)
Femoral artery, n (%)
Right subclavian artery, n (%)
Innominate artery, n (%)
Common carotid artery, n (%) |
60 (17,3) 20 (5,8) 227 (65) 10 (2,8) 30 (8,6) |
|
Сочетанные операции, n (%): Concomitant procedures, n (%)
Mitral valve repair, n (%)
Tricuspid valve repair, n (%)
Coronary artery bypass grafting, n (%) |
28 (8) 10 (2,8) 58 (16,7) |
|
Время ИК, мин Cardiopulmonary bypass time, min |
160 (134; 192) |
|
Время пережатия аорты, мин Aortic cross-clump time, min |
94 (77; 118) |
|
Время циркуляторного ареста, мин Circulatory arrest time, min |
32 (28; 39) |
|
Температура, °С Temperature, °C |
28 (28; 28) |
|
Кровопотеря, мл Blood loss, ml |
1,000 (700; 1500) |
|
Мини-стернотомия, n (%) Mini-sternotomy, n (%) |
19 (5,4) |
|
Ре-эксплорация по причине кровотечения, n (%) Re-exploration for bleeding, n (%) |
22 (6,3) |
|
Параплегия, n (%) Paraplegia, n (%) |
2 (0,5) |
|
Парапарез, n (%) Paraparesis, n (%) |
13 (3,7) |
|
Время ИВЛ, ч Ventilation time, h |
9 (7; 13) |
|
Время в ОРИТ, сутки ICU stay, days |
2 (1; 4) |
|
Время в стационаре, сутки Hospital stay, days |
10 (8; 14) |
|
Срок наблюдения, мес. Follow-up duration, months |
60 (34,3–85,8) |
|
ОНМК, n (%) Stroke, n (%) |
14 (4) |
|
Госпитальная летальность, n (%) Hospital mortality, n (%) |
15 (4,3) |
|
Отдаленная 10-летняя выживаемость, % Ten-year survival, % |
78 |
*ИВЛ – искусственная вентиляция лёгких, ИК – искусственное кровообращение, ОБА – общая бедренная артерия, ОНМК – острое нарушение мозгового кровообращения, ОРИТ – отделение реанимации и интенсивной терапии, ОСА – общая сонная артерия, ЦА – циркуляторный арест, ЧЗДА – частичная замена дуги аорты, ЭЛАГА – эндопротезирование нисходящей грудной аорты, Me – median, SD – standard deviation, TEVAR – thoracic endovascular aortic repair.
Проксимальные и дистальные реоперации
Повторные вмешательства на проксимальной аорте проводились реже (всего у 6 пациентов, что составило 1,7 %), при этом госпитальная летальность составила, а отдаленная 50 %, что еще раз подчеркивает как техническую сложность реинтервенций в этом сегменте, так и тяжелый соматический статус пациентов (табл. 3). В 1-ом случае у пациента на 3-й месяц после операции развилась аорто-пищеводная фистула в области дистального анастомоза аорты с гибридным протезом, что потребовало радикального удаления протеза корня, дуги и НГА с асцендо-абдоминальное шунтирование гомографтом (рис. 1).
Плановые (этапные) реоперации потребовались 20 пациентам (5,8 %), тогда как внеплановые вмешательства – 25 (7,2 %) Характеристика плановых и экстренных вмешательств в зависимости от сегмента представлены на рисунке 2.
Дистальные реоперации встречались в 39 случаев – 11,2 % (рис. 3). В этой подгруппе у 20 пациентов (5,7 % из общей когорты) вмешательства несли плановый этапный характер. В 8 случаях (40 %) выполнено открытое протезирование то-е ракоабдоминальной аорты (TAA), в 10 (50 %) – ЭЛАГА, в 2 (10 %) – протезирование брюшной аорты. Отрицательное ремоделирование, как причина повторной операции, зафиксировано у 19 пациентов (5,4 % из общей когорты). У 11 из них (58 %) развитие этого осложнения произошло на фоне формирования ДСИФ, что вновь подчёркивает важную роль этого механизма в прогрессии аневризматической болезни и отрицательного ремоделирования заболевания. В этой группе открытая реконструкция TAA была проведена у 10 пациентов (53 %). Таким образом, почти каждая вторая операция на тора- коабдоминальном сегменте проводилась при наличии новой ДСИФ, особенно у пациентов с дисплазией соединительной ткани.
Таблица 3
Проксимальные реоперации после операции ЗХС
Proximal reoperations after Frozen Elephant Trunk procedure
Table 3
|
Причина Cause |
N |
Реоперация Reoperation |
Летальность Mortality |
|
Ложная аневризма в области проксимального анастомоза протезо-коронарного шунта False aneurysm at the site of proximal anastomosis of prosthetic-coronary bypass graft |
3 |
|
2 живы 2 alive 1 лет. исход через 3 года 1 death after 3 years |
|
Дегенерация двустворчатого аортального клапана Aortic valve replacement due to degeneration of a bicuspid aortic valve |
1 |
Протезирование аортального клапана Aortic valve replacement |
Жива Alive |
|
Ложная аневризма ВА и корня аорты на фоне инфекции протеза аорты False aneurysm of the ascending aorta and aortic root due to aortic graft infection |
1 |
Репротезирование гомографтом + омен-топластика Redo aortic arch replacement using homograft |
Госпитальная летальность In-hospital mortality |
|
Аорто-пищеводный свищ (инфекция протеза аорты) Aorto-esophageal fistula (infected prosthetic graft of the aortic arch) |
1 |
Асцендо-абдоминальное шунтирование гомографтом Ascending-to-abdominal aorta bypass using homograft |
Летальность через 5 мес Death after 5 months |
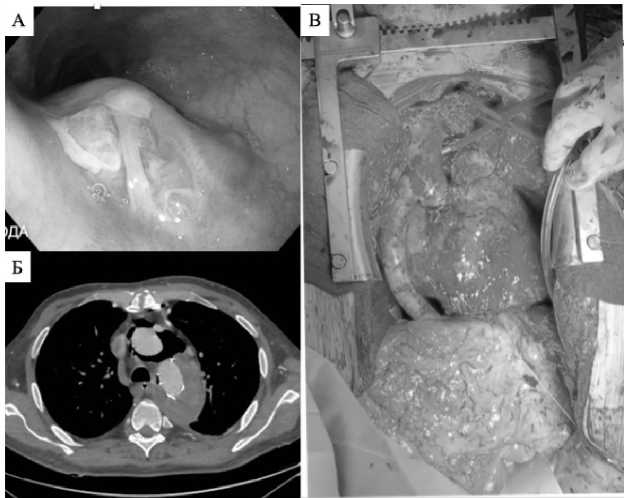
Рис. 1. Случай инфекции гибридного протеза у пациента после ЗХС с образованием аорто-пищеводной фистулы. А – аорто-пищеводный свищ; Б – МСКТ-диагностика инфекции протеза дуги аорты – парапротезный газ; В – выполненное асцендо-абдоминальное шунтирование гомографтом Fig. 1. Case of FET infection with aorto-esophageal fistula. A – aorto-esophageal fistula; B – CT infection view– paraprothetic gas; C – ascending-to-abdominal aortic bypass using homograft
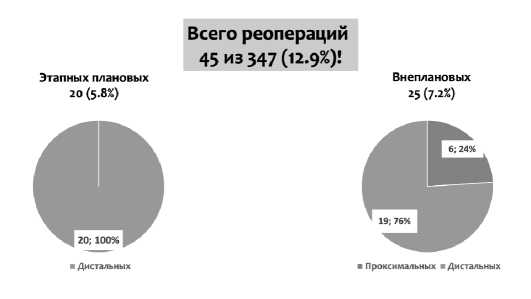
Рис. 2. Диаграмма распределения реопераций после ЗХС
Fig. 2 . Distribution of reoperations after FET
Всего 39 случаев - 11.2%

Рис. 3. Характеристика распределения повторных дистальных реопераций. ПБА – протезирование брюшной аорты, ТАА – торакоабдоминальный отдел аорты, ЭЛАГА – эндоваскулярное лечение аневризмы грудной аорты Fig. 3. Characteristics of the distal aortic reoperations. PBA – abdominal aortic prosthetics, TAA – thoracoabdominal aorta, ELAGA – endovascular treatment of thoracic aortic aneurysm
Таким образом отрытое протезирование дистальной аорты перенесло 20 пациентов (18 с протезированием ТААА и 2 пациента с протезированием брюшной аорты). Наши данные показали хорошие ранние и отдаленные результаты открытой хирургии после ЗХС (табл. 4). Это подчёркивает более благоприятный прогноз у пациентов, перенесших плановые открытые вмешательства, особенно при наличии дисплазии соединительной ткани.
При сравнении отдаленных результатов после различных типов реинтервенций 7-летняя выживаемость после ЭЛАГА составила (60 %), тогда как после открытого вмешательства (90 %). Кумулятивная функция риска также показала более высокий риск летального исхода после ЭЛАГА в качестве реинтервенции – 50 % через 7 лет (рис. 4).
Анализ выживаемости в зависимости от характера вмешательства (плановое, внеплановое) показал отсутствие значимых различий среди пациентов, перенёсших плановые (7-летняя выживаемость составила 80 %) и экстренные повторные вмешательства (с отрицательным ремоделированием аорты 7-летняя выживаемость – 75 %). Кумулятивный риск летальности был выше в подгруппе с плановыми вмешательствами, особенно в первые 3 года наблюдения, что подчёркивает неблагоприятный прогноз, связанный с синдромом мега-аорты (рис. 5).
Таблица 4
Результаты открытой хирургии дистальной аорты после ЗХС
Table 4
Results of open thoracoabdominal surgery of the distal aorta after FET
|
Характеристика Characteristic |
N, Me (Q1; Q3), Mean (SD) |
% |
|
Этапные операции, n Staged procedures, n |
10 |
52,6 |
|
ДСИФ, n dSINE, n |
6 |
31,6 |
|
Время до реоперации, мес. Time to reoperation, months |
14 (11; 22) |
|
|
Протезирование ТАА Extent II, n TAA replacement Extent II, n |
2 |
10,5 |
|
Протезирование ТАА Extent III, n TAA replacement Extent III, n |
15 |
78,9 |
|
Протезирование брюшной аорты, n Abdominal aortic replacement, n |
2 |
10,5 |
|
Методика Crawford, n Crawford technique, n |
6 |
31,6 |
|
Методика Coselli, n Coselli technique, n |
4 |
21,1 |
|
Метод «кнопки» , n Button technique, n |
7 |
36,8 |
|
Бифуркационнное аорто-подвздошное протезирование, n Bifurcated aorto-iliac prosthetic repair, n |
11 |
57,9 |
|
Кровопотеря, мл Blood loss, ml |
1100 (1000; 1450) |
|
|
Окклюзия баллоном, n Balloon occlusion, n |
2 |
10,5 |
|
Висцеральная перфузия, n Visceral perfusion, n |
16 |
84,2 |
|
День в ОРИТ, день ICU stay, days |
1 (1; 2,5) |
|
|
Госпитальная летальность, n Hospital mortality, n |
0 |
0 |
|
Острое почечное повреждение, n Acute kidney injury, n |
3 |
15,8 |
|
Временный диализ, n Temporary dialysis, n |
1 |
5,3 |
|
Дыхательная недостаточность, n Respiratory failure , n |
2 |
10,5 |
|
Параплегия, n Paraplegia, n |
0 |
0 |
|
Парапарез, n Paraparesis, n |
1 |
5,3 |
|
Ре-эксплорация по причине кровотечения, n Re-exploration for bleeding, n |
1 |
5,3 |
|
Парез кишечника, n Intestinal paresis, n |
0 |
0 |
|
Реоперации после, n Reoperations after, n |
0 |
0 |
|
Отдаленная летальность, n Late mortality, n |
1 |
5,3 |
|
Койко-день в стационаре, дней Hospital stay, days |
12,21 (2,3) |
|
|
Время наблюдения после, мес. Follow-up after reoperation, months |
35,42 (27,6) |
*ДСИФ – дистальная стент-графт-индуцированная фенестрация, ОРИТ – от-С деление реанимации и интенсивной терапии, ТАА – торакоабдоминальный отдел аорты, dSINE – distal stent-graft induced new entry, ICU – intensive care unit, Me – median, SD – standard deviation
Анализ факторов риска реопераций
Проведение многофакторного анализа позволило выделить независимые предикторы повторных вмешательств (табл. 5). Наличие СТД является наиболее значимым предиктором: у пациентов с СТД риск повторного вмешательства был выше в 4 раза как в однофакторной (HR = 4,20; 95% ДИ: 2,02–8,72; p<0,001), так и в многофакторной модели (HR = 4,11; 95% ДИ: 1,69–10,01; p=0,002). Повторная операция на аорте в анамнезе также ассоциировалась с повышенным риском (HR = 2,81; 95% ДИ: 1,34–5,91; p=0,006), однако в многофакторном анализе достигала лишь тренда к значимости (HR = 2,39; p=0,063). Такие переменные, как стадия расслоения, пол и возраст, не показали статистически значимого влияния на риск реопераций
Результаты нашего 10-летнего опыта выполнения операции ЗХС подтверждают её эффективность как метода радикального одномоментного лечения сложных распространенных форм расслоения и аневризм грудной аорты [10–12]. Тем не менее, несмотря на высокую общую выживаемость (более 75 % на 10-летнем интервале), частота дистальных осложнений, включая отрицательное ремоделирование и развитие ДСИФ, остаётся значимой проблемой и требует дальнейшего совершенствования подходов к лечению и наблюдению за данной когортой пациентов.
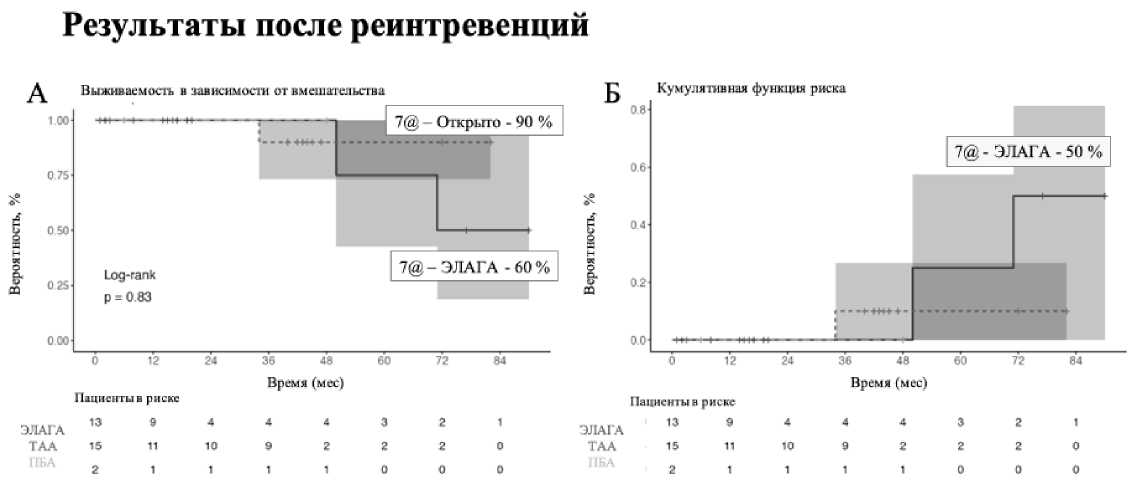
Рис. 4. Выживаемость после реопераций в зависимости от типа вмешательства. А – Отдаленная выживаемость в зависимости от типа вмешательств; Б – Кумулятивная функция риска летального исхода после реинтервенций. ПБА – протезирование брюшной аорты, ТАА – торакоабдоминальная аорта, ЭЛАГА – эндоваскулярное лечения аневризмы грудной аорты
Fig. 4. Follow survival after reoperations depending on the type of reintervention. A – Follow up survival depending on the type of intervention; B – Cumulative risk function of death after reinterventions. PBA – abdominal aortic prosthetics, TAA – thoracoabdominal aorta, ELAGA – endovascular treatment of thoracic aortic aneurysm
Результаты после реинтревенций
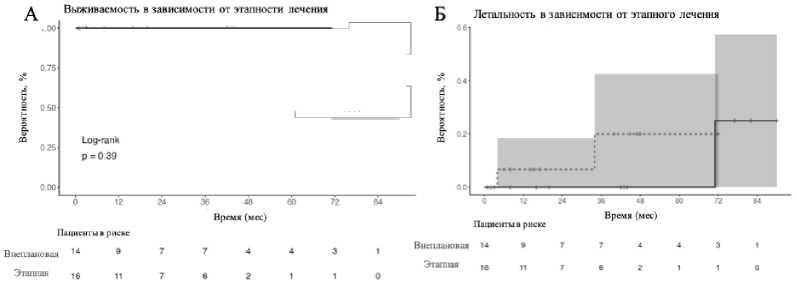
Рис. 5. Выживаемость после реопераций в зависимости от характера вмешательства. А – Отдаленная выживаемость в зависимости от характера вмешательств; Б – Кумулятивная функция риска летального исхода после реинтервенций
Fig. 5. Survival after reoperations depending on the staging of the intervention. A – Long-term survival depending on the staging of interventions; B – Cumulative hazard function of mortality after reinterventions

Таблица 5
Анализ факторов риска реопераций на аорте после ЗХС
Table 5
Risk factor analysis for aortic reoperations after FET procedure
|
Фактор риска Risk factor |
Сумма Total |
HR (однофакторный) HR (univariable) |
HR (многофакторный) HR (multivariable) |
|
|
Соединительно-тканная дисплазия, n (%) Connective tissue disorder, n (%) |
НЕТ NO |
211 (86,5) |
– |
– |
|
ДА, n (%) YES, n (%) |
33 (13,5) |
4.20 (2,02–8,72, p<0,001) ** |
4,11 (1,69–10,01, p=0,002) ** |
|
|
Повторная операция на аорте, n (%) Previous aortic surgery, n (%) |
НЕТ NO |
205 (84) |
– |
– |
|
ДА YES |
39 (16) |
2.81 (1,34–5,91, p=0,006) * |
2,39 (0,96–5,97, p=0,063) * |
|
|
Аневризмa, n (%) Aneurysm, n (%) |
52 (21,3) |
– |
– |
|
|
Стадия расслоения, n (%) Dissection phase, n (%) |
Острая Acute |
55 (22,5) |
0,65 (0,18–2,30, p=0,5) |
0,89 (0,23–3,46, p=0,867) |
|
Подострая Subacute |
41 (16,8) |
1.53 (0,52–4,44, p=0,438) |
1,84 (0,59–5,8, p=0,296) |
|
|
Хроническая Chronic, |
96 (39,3) |
1,03 (0,39–2,76, p=0,947) |
0,65 (0,23–1,83, p=0,418) |
|
|
Пол, n (%) Sex, n (%) |
Женский Female |
72 (29,5) |
– |
– |
|
Мужской Male |
172 (70,5) |
1,8 (0,69–4,70, p=0,233) |
2,16 (0,78–6,02, p=0,139) |
|
|
Возраст, лет Age, years |
Mean (SD) |
53,8 (12,5) |
0,98 (0,96–1,01, p=0,188) |
1,01 (0,98–1,05, p=0,418) |
*HR – hazard ratio, SD – standard deviation
Обсуждение
Анализ подгрупп показал, что около 13,5 % пациентов потребовали повторного вмешательства, причём почти половина из них – по поводу отрицательного ремоделирования дистальной аорты. Как видно на представленных графиках Каплана-Мейера (рис. 5), при сравнении плановых и внеплановых повторных вмешательств не выявлено статистически значимых различий в долгосрочной выживаемости (лог-ранк, p = 0,39). Однако при оценке типа повторного вмешательства было отмечено увеличение риска летального исхода в группе эндоваскулярных повторных операций, которые сопровождались более низкой 7-летней выживаемостью (60 % против 90 %). Современная стратегия этапного лечения, особенно с применением открытых реконструкций торакоабдоминального сегмента, позволяет добиться высокой выживаемости и минимальной летальности [13]. Несмотря на более высокий интраоперационный риск при открытом протезировании, открытые вмешательства обеспечивают стабильный результат, особенно у пациентов с СТД и пациентов молодого возраста. Это подчёркивает необходимость персонализированного подхода при выборе метода повторного лечения.
Отрицательное ремоделирование и ДСИФ, как показал наш анализ, нередко развиваются в течение первых 2–3 лет наблюдения, особенно у пациентов с СТД и при использовании неспецифических для расслоения гибридных протезов аорты. Основные работы, представленные в современной литературе, также подчёркивают роль дистальной механической травмы интимы как основного триггера поздних осложнений [8, 14, 15].
Внедрение в клиническую практику принципиально новых расслоение-специфических гибридных протезов с мягким дистальным концом, в частности, отечественного гибридного протеза «Мягкого хобота слона», позволяет снижать риск возникновения ДСИФ и тем самым отрицательного ремоделирования, как это продемонстрировано и в нашем исследовании. Тем не менее, даже при использовании этих протезов у ряда пациентов высокого риска сохраняется необходимость в дистальных реинтервенциях, что требует активного послеоперационного мониторинга.
Заключение
Операция ЗХС остаётся золотым стандартом в лечении распространенных заболеваний грудной аорты, обеспечивая высокую выживаемость в отдаленном периоде. Однако дистальные осложнения, включая отрицательное ремоделирование и ДСИФ, сохраняют свою актуальность и требуют активного изучения. Результатом данной работы стали следующие тезисы: 1) операция ЗХС имеет удовлетворительные ранние и отдаленные результаты, и может активно применяться в опытных центра у пациентов со сложной патологией дуги и НГА, 2) использование расслоение-специфических стент- графтов снижает частоту ДСИФ, 3) открытые вмешательства при повторных операциях обеспечивают лучшие долгосрочные результаты по сравнению с эндоваскулярными методами, 4) пациенты с СТД требуют особо тщательного наблюдения и раннего этапного вмешательства, 5) Ключевыми факторами успешного лечения и профилактики поздних осложнений являются индивидуализированный подход к выбору протеза, оптимизация хирургической стратегии и активное послеоперационное наблюдение.
Оптимизация хирургической стратегии, индивидуализация выбора протеза и активное послеоперационное наблюдение остаются ключевыми факторами успешного лечения и профилактики поздних осложнений после ЗХС.


