Отдельные клинико-биологические особенности злокачественных опухолей головного мозга у детей
Автор: Моргун А.В., Черепанов С.М., Малютин О.А., Борисова М.В., Таранушенко Т.Е., Салмина А.Б.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 (49), 2012 года.
Бесплатный доступ
При изучении прогностического значения маркеров апоптоза, пролиферации и химиорезистентности при опухолях ЦНС у детей оценивали динамическое изменение этих показателей после химиотерапии. Установлена значимость экспрессии Р-гликопротеина и показателя пролиферации (Ki-67) в прогнозе опухолей ЦНС. Обнаружены гендерные отличия при развитии химиорезистентности опухолей. Обозначена возрастная группа с высокими показателями маркера пролиферации при отсутствии отличий по половому признаку.
Злокачественные опухоли головного мозга, детская онкология, прогноз течения заболевания
Короткий адрес: https://sciup.org/14056179
IDR: 14056179 | УДК: 616.831-006.6-053-036
Текст научной статьи Отдельные клинико-биологические особенности злокачественных опухолей головного мозга у детей
В последние десятилетия отмечается тенденция роста заболеваемости злокачественными заболеваниями как в целом в популяции, так и у детей. В России уровень онкологической заболеваемости детского населения составляет 9,5–15 на 100000 [1]. Опухоли центральной нервной системы (ЦНС) в детском возрасте являются одними из самых частых злокачественных новообразований, они занимают 2-е ранговое место после лейкозов. Несмотря на возросшую радикальность удаления опухолей головного мозга (ОГМ) и достижения в разработке новых более эффективных химиопрепаратов, частота рецидивов ОГМ у детей остается достаточно высокой – 7–35 % [10].
В настоящее время информация о прогностической значимости различных молекул, экспрессирующихся при опухолевой прогрессии, весьма противоречива [5]. Предполагается, что одним из значимых прогностических маркеров может являться уровень апоптоза в опухолевой ткани, так как низкий уровень спонтанного или индуцированного апоптоза опухолевых клеток является основой прогрессирования опухоли [11]. Другим прогностическим маркером опухолевой прогрессии может быть показатель пролиферации. Есть работы, показывающие связь между уровнем апоптоза, показателями пролиферации и степенью злокачественности опухолей головного мозга [7]. Особое место в развитии рецидивов и метастазов отводится химиорезистентности, которую предлагается учитывать как важный прогностический фактор. Одним из важнейших механизмов химиорезистентности опухолевой клетки является гиперэкспрессия белков, ответственных за экструзию цитостатиков из клетки, например Р-гликопротеина (Pgp).
В настоящее время результаты исследований по рассматриваемой проблеме не имеют единой интерпретации, большинство опубликованных работ носят преимущественно эксперименталь- ный характер, а публикации, посвященные оценке состояния апоптоза, пролиферации и химиорезистентности при опухолях центральной нервной системы у детей с их оценкой на фоне химиотерапии, практически отсутствуют.
Цель исследования – изучить молекулярные механизмы опухолевой прогрессии (эффективность апоптоза, пролиферативная активность, экспрессия маркера лекарственной устойчивости) при опухолях головного мозга у детей.
Материал и методы
Объект исследования – 37 пациентов Красноярской краевой детской больницы, которые находись в онкогематологическом отделении с морфологически верифицированным диагнозом: опухоль головного мозга. Средний возраст больных – 9,9 ± 0,7 года. Все опухоли носили злокачественный характер: астроцитомы – 22, медуллобластомы – 8, глиобластомы – 7. Всем больным был выполнен диагностический стандарт, включающий в себя: сбор анамнеза, физикальный осмотр, клинический анализ крови, общий анализ мочи, биохимический анализ крови, КТ головного мозга в аксиальной проекции с контрастом до и после оперативного лечения, МРТ в 3 проекциях. Химиотерапия осуществлялась по стандартным протоколам (М-2000, HIT91\HIT2000 для медуллобластом, лучевая терапии параллельно с темозоломидом, PCV в лечении злокачественных глиом, также использовалась схема введения винкристина на фоне лучевой терапии). Течение расценивалось как неблагоприятное при рецидиве опухоли, смерти пациента, развитии метастазов. Изучались препараты опухолевой ткани, полученные интраоперационно до и после химиотерапии.
Для регистрации апоптоза клеток головного мозга использовался метод TUNEL (Apoptag Direct Detection kit, Immunotech, France) согласно протоколу производителя в депарафинизированных срезах. Подсчитывалось общее количество TUNEL+ клеток не менее чем в 20 полях зрения (×900) с последующим расчетом апоптозного индекса (АИ) (АИ – доля TUNEL+ клеток, выраженная в процентах от общего количества клеток). За низкий уровень апоптоза принимались значения от 0 до 5 %, умеренный – от 5,1 до 10 %, АИ выше 10,1 % расценивался как высокий. Определение экспрессии антигенов Ki-67 (показатель пролиферативной активности) и Р-гликопротеина (маркер лекарственной устойчивости) проводилось двойным непрямым методом иммуноферментного окрашивания. Для определения Ki-67 использовались первичные моноклональные антитела MIB-1 (DAKO, Дания). Антителами для Р-гликопротеина были первичные мышиные антитела JSB1 (No-vocastra, Англия). В качестве вторичных антител использовались ФИТЦ-меченые антимышиные моноклональные антитела. Иммуногистохимические исследования проводились по стандартной методике в депарафинизированных срезах. Для каждого образца готовился негативный контроль. Образцы опухоли расценивались как отрицательные при отсутствии окраски. Для определения выраженности пролиферативной активности рассчитывался пролиферативный индекс (ПИ – доля Ki-67+ клеток, выраженная в процентах от общего количества клеток) Положительные результаты для Р-гликопротеина ранжировались следующим образом: слабое окрашивание менее 10 % клеток – низкая экспрессия, слабое окрашивание более 10 % – умеренная, сильно выраженное окрашивание более 10 % – выраженная. На основании результатов окраски повышенным уровнем считались образцы с умеренной и выраженной окраской.
Для статистического анализа результатов использовался точный критерий Фишера, критерий Уилкоксона, кривая Kaplan–Meier и логранговый критерий. Расчеты проводились с помощью программы StatPlus 2005, Primer of Biostatics, версия 4.03.
Результаты и обсуждение
Из 37 человек с опухолями головного мозга, вошедших в исследование, мальчиков 25 (67,6 %), девочек 12 (32,4 %). Манифестация заболевания наступала у большинства детей данной группы в возрасте 11–17 лет – 19 из 37 пациентов (51,4 %). При изучении локализации опухолевого процесса установлено, что преимущественной областью поражения был мозжечок – в 40,5 % случаев и полушария мозга – в 27 %, реже опухоль располагалась в лобной (18,9 %) и височной (13,5 %) долях. Ведущими клиническими симптомокомплексами, сопутствующими злокачественным новообразованиям мозга, были цефалгия (70,3 %), астенический синдром (70,3 %), неврологические проявления (51,3 %), зрительные нарушения (10,8 %). Указанные проявления по частоте встречаемости соответствуют литературным данным [2–4].
На следующем этапе работы исследовались молекулярные маркеры опухолевой прогрессии в образцах злокачественной ткани и проводилось сопоставление полученных результатов с особенностями клинического течения болезни, с результатами лечения и исходами заболевания пациентов c онкологическими заболеваниями головного мозга. Установлено отсутствие гендерных и возрастных отличий в уровнях апоптоза (таблица). При оценке исходных значений апоптотической активности отмечена некоторая тенденция к увеличению данного показателя у умерших детей. Наряду с этим имеются достоверно более высокие значения АИ у детей с метастазированием и прогрессированием опухолей головного мозга (р<0,05). На фоне проведенного лечения зарегистрировано увеличение АИ, что отмечают и другие авторы [6, 9]. Не обнаружено статистически значимых различий уровня запрограммированной клеточной гибели у выживших и умерших детей, при сохранении тенденции к более высокой выраженности апоптоза у умерших детей. Важно отметить, что у детей с метастазами до и после терапии уровень апоптоза был значительно выше, чем у детей без метастазирования опухоли. Высокие значения АИ являются фактором развития неблагоприятных исходов, что противоречит общепринятому мнению об ассоциации высоких значений апоптоза с благоприятными исходами опухолей головного мозга [8].
Исследования исходной выраженности экспрессии Ki-67 в образцах опухолей головного мозга не обнаружили гендерных и возрастных различий пролиферативной активности у детей с данной патологией (таблица). Однако отмечается тенденция к более высоким значениям указанного параметра в подгруппах умерших мальчиков и при метастазировании опухоли. На фоне проведенной терапии установлено изменение пролиферативной активности в опухолевой ткани со снижением ПИ в возрастной группе 11–17 лет. Важно, что высокая пролиферативная активность наблюдается у умерших детей по сравнению с выжившими пациентами и в случаях метастазирования опухоли (р<0,05). На фоне терапии в подгруппе умерших детей и при метастазирующих опухолях ПИ не имел существенной динамики и был высоким. В ходе работы нами установлено влияние экспрессии антигена Ki-67 на длительность бессобытийной выживаемости (рис. 1): при высоком уровне пролиферативной активности время бессобытийной выживаемости было короче, чем при низких значениях ПИ (р<0,05).
При анализе особенностей лекарственной устойчивости у детей с ОГМ выявлено наличие гендерных различий (р<0,05) исходных показателей экспрессии Р-гликопротеина (таблица). Для пациентов мужского пола характерна низкая, а для женского пола – высокая экспрессия исследуемого антигена. Установлено достоверное (р<0,05) преобладание экспрессии Pgp в подгруппе умерших детей. Отмечена тенденция к повышению указанного параметра при метастазировании опухоли.
Таблица
|
Группы больных |
АИ |
ПИ |
Pgp |
|||
|
До терапии |
После терапии |
До терапии |
После терапии |
До терапии |
После терапии |
|
|
Мальчики |
17,3 ± 3 |
18,4 ± 3,2 |
12,2 ± 2,5 |
8,3 ± 1,9* |
9,5 ± 1,3 # |
9,8 ± 1,4 # |
|
Девочки |
13,5 ± 4,2 |
15 ± 3,8* |
6,3 ± 0,7 |
4,1 ± 0,9* |
15 ± 1,9 # |
15,3 ± 2,3 # |
|
Все дети |
16,6 ± 2,4 |
17,9 ± 2,5* |
10 ± 1,7 |
6,9 ± 1,3* |
11,3 ± 1,1 |
11,6 ± 1,3 |
|
3–6 лет |
13,2 ± 3,5 |
14,9 ± 3,9 |
11,1 ± 3,8 |
7,5 ± 3,1* |
13 ± 2,1 |
12 ± 2,4 |
|
7–10 лет |
16,8 ± 6,3 |
18,6 ± 6,4* |
6 ± 1,1 |
5 ± 1,4 |
7,2 ± 2 |
7,2 ± 1,6 |
|
11–17 лет |
18,2 ± 3,7 |
19,5 ± 3,4 |
10,7 ± 2,3 |
7,2 ± 1,8* |
11,7 ± 1,5 |
12,7 ± 1,8 |
|
0–10 лет |
15,1 ± 3,3 |
17,1 ± 3,6 |
9,3 ± 2,5 |
6,6 ± 2,1 |
10,9 ± 1,6 |
10,3 ± 1,7 |
|
Живые |
13,7 ± 3,2 |
14 ± 3,5 |
6,2 ± 0,7 |
7,1 ± 1 # |
10,5 ± 1,1 # |
10,6 ± 1,2 # |
|
Умершие |
18,1 ± 3,2 |
19,9 ± 3,4 |
13,6 ± 6,7 |
13,6 ± 1,6 # |
20,7 ± 3,2 # |
22,3 ± 3,5 # |
|
Метастазы |
27 ± 3,7 # |
28,5 ± 3,8 |
15,8 ± 5,5 |
17,8 ± 5,9 # |
15,6 ± 5,5 |
17,8 ± 6 |
|
Без метастазов |
15,4 ± 2,7 # |
17,1 ± 2,9* |
9,4 ± 1,7 |
6,8 ± 1,4 # * |
10,8 ± 1 |
10,8 ± 1,2 |
Примечание: * – различия статистически значимы между показателями в одной подгруппе до и после терапии (р<0,05); # – различия статистически значимы между подгруппами: мальчики/девочки; живые/умершие; с метастазами/без метастазов (р<0,05).
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2012. №1 (49)
Иммуногистохимическое исследование образцов опухолей головного мозга (М ± δ)
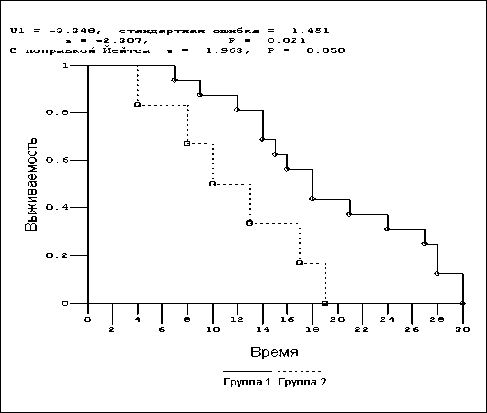
Рис. 1. Показатели бессобытийной выживаемости детей с опухолями головного мозга в зависимости от уровня пролиферации опухолевых клеток. Примечание: группа 1 – опухоли с низким уровнем пролиферации; группа 2 – опухоли с высоким уровнем пролиферации
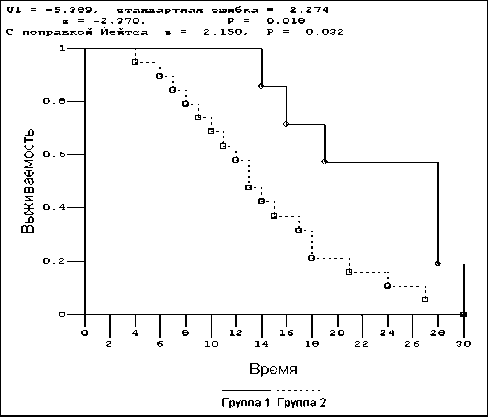
Рис. 2. Показатели бессобытийной выживаемости детей с опухолями головного мозга в зависимости от уровня экспрессии Pgp в опухолевых клетках.
Примечание: группа 1 – опухоли с низким уровнем экспрессии Pgp; группа 2 – опухоли с высоким уровнем экспрессии Pgp
Изменения экспрессии Pgp на фоне химиотерапии отсутствовали во всех рассматриваемых подгруппах с сохранением указанных выше тенденций и умеренным повышением экспрессии Рgp в подгруппах умерших, а также при метастазировании опухолей. Мы доказали влияние уровня экспрессии Рgp на длительность бессобытийной выживаемости (рис. 2). Для высокой экспрессии Р-гликопротеина характерно более короткое время бессобытийной выживаемости (p<0,05).
Заключение
Результаты исследования опухолевого материала до начала химиотерапии показали увеличенные значения АИ при метастазах опухоли, отсутствие гендерных и возрастных различий в выраженности апоптоза и пролиферативной активности, высокую экспрессию Р-гликопротеина у девочек и умерших детей со злокачественными новообразованиями головного мозга. На фоне лечения отмечено отсутствие динамики Р-гликопротеина, увеличение апоптотического индекса (преимущественно у девочек и в возрастной подгруппе 7–10 лет), снижение пролиферативной активности во всех рассматриваемых подгруппах при более высоких значениях указанного показателя у умерших детей и при метастазировании опухоли. Представленные данные выявили прямую взаимосвязь выражен- ности апоптоза с частотой метастазирования, причастность пролиферативной активности опухоли к бессобытийной выживаемости детей в возрастных подгруппах 3–6 лет и 11–17 лет, а также отсутствие динамики маркера лекарственной устойчивости на фоне терапии при установленном влиянии экспрессии Pgp на выживаемость пациентов со злокачественными новообразованиями головного мозга.


