Отказ от курения после постановки диагноза рака легкого улучшает прогноз заболевания
Автор: Заридзе Давид Г., Мукерия Ануш Ф., Шаньгина Оксана В., Стилиди Иван С.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 3 т.11, 2021 года.
Бесплатный доступ
Представленное клинико-эпидемиологическое исследование - первое в мире крупное проспективное исследование, в котором изучался эффект отказа от курения после постановки диагноза рака легкого (РЛ) на прогноз. Прослеживание 517 пациентов с НМКРЛ в течение 7 лет в среднем показало, что продолжение курения после постановки диагноза - очень серьезный негативный прогностический фактор. В то же время отказ от курения улучшает общую выживаемость (ОВ) и выживаемость без прогрессирования (ВБП) на 22,6 месяцев и снижает специфическую онкологическую смертность на 22,8 месяцев; также отмечено снижение риска смертности от всех причин на 33 %, риска прогрессирования - на 30 % и риска специфической онкологической смертности - на 25%. В нашей когорте почти 60% больных после постановки диагноза продолжали курить. Среди них имела место предотвратимая избыточная смертность, которая в результате сократила им жизнь на 2 года. Полученный в нашей работе положительный эффект отказа от курения после постановки диагноза значительно превосходит «значимую пользу» (meaningful benefit) - достижение медианы улучшения общей выживаемости в пределах 2,5-6 месяцев для противоопухолевых препаратов, предложенную Американским обществом клинических онкологов (ASCO). Более того, из исследования следует, что польза отказа от курения после постановки диагноза РЛ, как минимум, равнозначна, или превосходит значимые результаты, полученные в клинических исследованиях эффективности инновационных методов лечения РЛ. Мы надеемся, что результаты нашего исследования будут способствовать включению отказа от курения в клинические рекомендации по лечению НМРЛ и других онкологических заболеваний. Программа лечения онкологических больных должна включать научно обоснованные методы отказа от курения, представленные в виде «Клинических рекомендаций по отказу от курения для онкологических больных». Лечение табакокурения у пациентов с онкологическим диагнозом экономически выгодно для системы здравоохранения, особенно по сравнению с другими методами лечения. И, наоборот, продолжение курения после диагноза значительно увеличивает траты на лечение. Внедрение в практику лечения больных с диагнозом РЛ рекомендаций по отказу от курения и лечению никотиновой зависимости на 30-35 % улучшит показатель общей смертности у более 60 000 больных РЛ, диагностируемых ежегодно в России. Очевидна клиническая ценность этого метода, с доказанной высокой эффективностью в улучшении продолжительности жизни больных, а в конечном итоге - снижении смертности от рака в России.
Рак легкого, нмкрл, прогноз, выживаемость, смертность, отказ от курения
Короткий адрес: https://sciup.org/140290745
IDR: 140290745 | DOI: 10.18027/2224-5057-2021-11-3-15-22
Текст научной статьи Отказ от курения после постановки диагноза рака легкого улучшает прогноз заболевания
Доминирующей причиной высокой смертности от злокачественных новообразований (ЗНО) в мире и России являются формы рака, вызванные курением. Почти 25% случаев смерти от ЗНО приходится на рак легкого (РЛ). В 2019 году в России раком легкого заболели 60 113 мужчин и женщин, умерли от этой патологии 50 046 человек [1].
Несмотря на то, что заболеваемость и смертность от РЛ снижается практически во всех развитых странах, РЛ — это ведущая причина онкологической смертности в мире. Cтандартизованный показатель смертности от РЛ среди мужчин снизился на 47%, с 73,3/100 000 населения в 1993 году до 38,9/100 000 населения в 2019 году [2]. В то же время популяционная 5-летняя выживаемость больных
РЛ остается без изменений в течение нескольких десятилетий и не превышает, по данным США, 21%. Высок процент (57%) больных, которым диагноз рака легкого ставится на стадии распространённого процесса. Однако нужно отметить, что 5-летняя выживаемость больных локализованной формой рака легкого также не очень высока (59%), это говорит о том, что скрининг РЛ с использованием низкодозовой компьютерной томографии вряд ли приведёт к радикальному улучшению показателей выживаемости [3].
Несмотря на имеющиеся обширные научные данные в области табачного канцерогенеза и эффективности профилактики табакокурения, наши знания о влиянии курения на выживаемость и прогноз онкологических больных, на риск прогрессирования заболевания и эффективность лечения пока недостаточны [4]. Информация об отрицательном влиянии продолжения курения после постановки диагноза на прогноз и выживаемость онкологических больных и лиц, переживших это заболевание, появились почти 40 лет назад. Однако эти данные были впервые официально озвучены главным санитарным врачом США в 2014 году в Белом доме в докладе «Последствия курения для здоровья — 50 лет прогресса» [5]. В докладе представлены результаты исследований, свидетельствующие о негативном влиянии курения после постановки диагноза на общую и онкологическую выживаемость, смертность от всех причин, риск прогрессирования заболевания, развития вторых опухолей, эффективность лечения, резистентность к лечению и его возможную токсичность и осложнения.
В 2019 году нами был представлен обзор литературы [6], в который вошли статьи, опубликованные после 2014 года, т. е. после представления доклада главного санитарного врача США [5]. Из обзора можно сделать вывод, что курение, скорее всего, влияет на прогноз заболевания. Тем не менее, эти данные лимитированы и получены, в основном, в результате ретроспективных исследований, в которых статус курения пациентов фиксировался только на момент постановки диагноза или проведения лечения, без дальнейшего прослеживания. Кроме того, небольшое количество опубликованных проспективных исследований характеризуются ограниченным количеством участников и коротким сроком последующего наблюдения.
В отделе эпидемиологии НМИЦ онкологии им. Н.Н. Блохина совместно с Международным агентством по изучению рака (МАИР) было выполнено проспективное клинико-эпидемиологическое исследование, которое является одним из компонентов совместного международного многоцентрового проекта по изучению молекулярно-эпидемиологических маркеров рака легкого, которое проводится с 2007 года по настоящее время.
Формирование когорты
Российская часть проекта насчитывает 1 970 больных с впервые установленным и подтвержденным диагнозом РЛ на ранних стадиях (I, II, IIIА ст.), которые находились на лечении в 2007–2016 гг. в торакальных отделениях НМИЦ онкологии им. Н. Н. Блохина и ГКОБ № 1 г. Москвы. Все включенные в исследование пациенты сразу после госпитализации и подписания формы согласия на участие в проекте и до начала проведения какого-либо лечения были проинтервьюированы прошедшим соответствующую подготовку персоналом по единой стандартной специально разработанной анкете. Анкета состояла из нескольких разделов и включала вопросы, касающиеся основных антропометрических данных, социально-экономических характеристик, медицинского и семейного анамнеза, питания, а также известных и предполагаемых факторов риска РЛ. Большое внимание при опросе уделялось статусу курения пациента на протяжении всей жизни до момента постановки диагноза и госпитализации с учетом возраста начала и прекращения курения, типа табачных изделий, любых изменений привычек и интенсивности курения и др. Статус курения определялся следующими категориями: «никогда не курившие», «когда-либо курившие» и «курящие в настоящее время». К «курящим в настоящее время» относились те больные, кто выкуривал хотя бы одну сигарету в день на протяжении года до постановки диагноза.
Прослеживание
Для прослеживания из всей когорты были выделены 1240 больных РЛ, проживающих в Москве и Московской области, с различным статусом курения. Прослеживание было начато в 2012 году и проводится по настоящее время, т. е. длительность всего периода наблюдения за больными составляет от 5 до 9 лет с рекордной медианой прослеживания, равной 7 годам. С участниками прослеживания или с членами их семей, а при необходимости и с лечащими врачами через 1 год после выписки из стационара и проведенного лечения осуществлялся первый контакт/опрос, а затем регулярно, раз в год, по телефону или лично, при посещении пациентом клиники, для получения актуальной информации. По результатам опроса каждый год заполняется индивидуальная «Форма прослеживания». Информация для «Формы прослеживания» содержит данные о пациенте за период, прошедший после постановки диагноза/лечения или предыдущего контакта/опроса, и состоит из следующих разделов: клиническое течение заболевания (ремиссия, прогрессирование, вторая опухоль и др.), лечение, в случае смерти — ее причина, статус курения и любые его изменения (отказ, возобновление, изменение интенсивности). Вопрос о статусе курения задавался всем участникам прослеживания каждый раз при осуществлении контакта независимо от того, являлся ли он курильщиком на момент постановки диагноза. Никогда не курившим больным и отказавшимся от этой привычки за год и ранее до постановки диагноза вопрос о курении после задавался для того, чтобы не пропустить случаи начала курения или его возобновления после длительного перерыва. У тех же пациентов, которые курили на момент постановки диагноза, при ежегодном прослеживании интервьюер получал подробную информацию за период, прошедший после последнего контакта, о статусе курения на момент опроса. В случае отказа от курения или возобновления курения уточнялась дата события, при продолжении курения — количество выкуриваемых в день/неделю сигарет и какие-либо другие возможные изменения привычки, если таковые имели место.
Для анализа влияния статуса курения после постановки диагноза на прогноз больных с диагнозом РЛ из 1240 прослеживаемых больных критериям отбора соответствовали
722 человека, куривших на момент постановки диагноза. Из этой группы затем были исключены 205 больных из-за отсутствия полноценных данных о статусе курения после постановки диагноза, так как они все скончались до 2012 года, т. е. до начала прослеживания. Таким образом, в окончательный анализ влияния отказа от курения на прогноз вошли 517 пациентов с немелкоклеточным раком легкого (НМКРЛ), курящие на момент постановки диагноза и активно прослеживаемые (рис. 1). В процессе прослеживания они были подразделены на две группы: «продолжающие курить после постановки диагноза» и «отказавшиеся от курения после постановки диагноза».

Рисунок 1. Схема дизайна исследования
Статистический анализ
Для оценки общей выживаемости (ОВ) и выживаемости без прогрессирования (ВБП) использовались регрессионные модели пропорциональных рисков Кокса. Регрессионные модели конкурирующих рисков Грея, рассматривающие смерть от других причин как альтернативный исход, были использованы для оценки кумулятивной специфической для РЛ смертности среди участников исследования, бросивших курить, по сравнению с продолжающими курить. Во всех моделях время начала наблюдения отсчитывалось от даты постановки диагноза рака. Для оценки вероятности общей выживаемости и рисков смерти от всех причин дата смерти устанавливалась как конец наблюдения, а дата последнего контакта — как дата для цензурирования участников исследования, которые были живы при последнем контакте (7 июня 2020 года). Для оценки выживаемости без прогрессирования дата первого из следующих событий — смерть от любой из причин и смерть от прогрессирования — определяла конец времени наблюдения. Для пациентов, которые были живы в момент последнего контакта и не имели подтвержденных данных о прогрессировании, дата последнего контакта определяла время цензурирования. Для оценки вероятности специфической для РЛ смерти дата смерти от РЛ определяла конец наблюдения, т. е. наступление события. Дата смерти от иных причин определяла время наступления конкурирующих событий. Для пациентов, которые были живы во время последнего контакта, дата контакта определяла время наступления цензурированного события.
Многовариантная модель была скорректирована по переменным, характеризующим включённых в исследование пациентов, а именно по полу, возрасту, образованию, индексу массы тела, наличию хронических болезней, потреблению алкоголя, кумулятивному количеству сигарет, выкуриваемых к моменту постановки диагноза РЛ, гистологической формы опухоли, стадии опухолевого процесса, хирургическому лечению, химиотерапии, лучевой терапии и году постановки диагноза. Более детальное описания статистических методов и применяемых при анализе статистических пакетов и программного обеспечение дано в online Appendix статьи [7].
Результаты
В анализе влияния статуса курения после постановки диагноза на прогноз больных с диагнозом НМРЛ на ранних стадиях приняли участие 517 больных, которые активно прослеживались в среднем 7 лет; 220 больных (42,5%) сообщили об отказе от курения после постановки диагноза, 8 из них затем возобновили курение, и 297 (57,4%)
Таблица 1. Выживаемость больных с диагнозом НМРЛ (I, II–IIIА стадии) в зависимости от статуса курения после постановки диагноза
|
Продолжали курить |
Бросили курить |
P |
|
|
Больные НМРЛ, число (%) |
297 (57,4) |
220 (42,5) |
|
|
Общая выживаемость (ОВ) |
0,001 |
||
|
Медиана ОВ, лет |
4,8 |
6,6 |
|
|
Выживаемость 3-х летняя (95% ДИ), % |
66,2 (62,3–70,8) |
74,5 (69,1–79,3) |
|
|
Выживаемость 5-летняя (95 ДИ), % |
48,6 (44,3–55,2) |
60,6 (53,6–67,1) |
|
|
Выживаемость без прогрессирования (ВБП) |
0,004 |
||
|
Медиана ВБП, лет |
3,9 |
5,7 |
|
|
ВБП, 3-летняя (95%ДИ), % |
58,3 (53,7–63,5) |
67,2 (60,9–72,7) |
|
|
ВБП, 5-летняя (95% ДИ) % |
43,8 (38,1–48,9) |
54,4 (46,7–61,5) |
|
|
Смертность от НМРЛ |
0,040 |
||
|
Медиана смертности от НМРЛ, лет |
6,0 |
7,9 |
|
|
Смертность от НМРЛ, 3 летняя (95% ДИ), % |
30,1 (25,1–34,4) |
23,7 (17,2–27,1) |
|
|
Смертность от НМКРЛ, 5 летняя (95% CI), % |
43,5 (38,5–50,0) |
35,0 (27,3–41,7) |
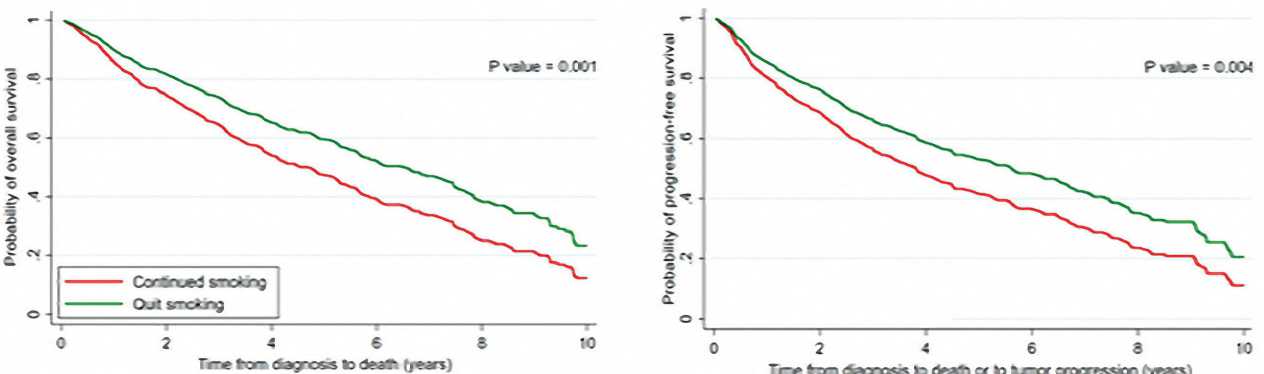
Рисунок 2. Общая выживаемость и выживаемость без прогрессирования больных НМРЛ в зависимости от статуса курения после постановки диагноза
продолжали курить. Эти группы были однородными и не отличались ни по демографическим характеристикам, ни по клиническим признакам и ни по переменным образа жизни [7]. Из 220 пациентов, отказавшихся от курения, 157 (71,3%) сделали это сразу же после постановки диагноза и до начала проведения какого-либо лечения, 33 (15%) — после начала лечения, но в течение первого года после постановки диагноза, 30 (13,6%) — позже, чем через год после постановки диагноза.
Медиана общей выживаемости (ОВ) больных, включенных в исследование, составила 5,2 года, 3-х и 5-ти летней выживаемости — 65,1% и 50,9%, соответственно. Скорректированная медиана ОВ на 21,6 месяцев была выше у пациентов, которые отказались от курения по сравнению
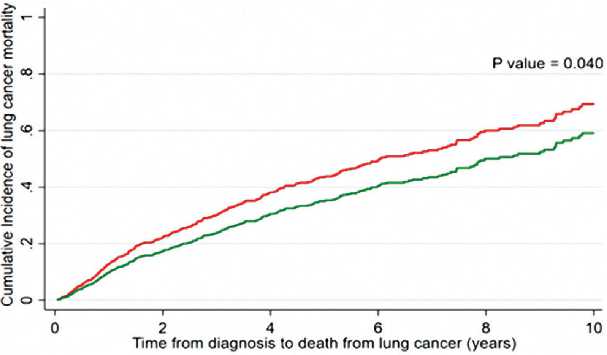
Рисунок 3. Смертность от НМРЛ (специфическая для НМРЛ смертность) в зависимости от статуса курения после диагноза рака.
Таблица 2. Риск смерти и прогрессирования заболевания и специфической для НМКРЛ смерти в зависимости от статуса курения после постановки диагноза
Отказ от курения после постановки диагноза ассоциировался с пониженным риском смертности от всех причин (ОР =0,67, 95% ДИ 0,53–0,85), риском прогрессирования (ОР =0,70, 95% ДИ 0,56–0,89) и риском смерти от НМКРЛ (ОР = 0,75, 95% ДИ 0,58–0,98) (табл. 2, рис. 3). Протективный эффект отказа от курения не отличался в группах пациентов: с ранними и более поздними стадиями РЛ, выкуривающих большее или меньшее количество сигарет, получавших и не получавших химио-и радиотерапию. Снижение риска смерти от всех причин в результате отказа от курения у больных, не получавших (ОР =0,74; 95% ДИ 0,55–0,98) и получавших химиотерапию (ОР =0,56; 95% ДИ 0,34–0,92), статистически не отличались (P =0,74). Также не отмечено статистически значимой разницы (P =0,86) в специфической смертности от РЛ между больными, не получавшими (ОР =0,81; 0,59–1, 12) и получавшими химиотерапию (ОР =0,62; 95 % ДИ 0,37–1,03). Не отмечено статистически достоверной разницы между влиянием отказа от курения и риском смертности от всех причин (p =0,71) и специ-фичеcкой для РЛ смертности (P =0,26) в зависимости от проведения лучевой терапии. ОР смертности от всех причин был равен 0,65 (95% ДИ 0,49–0,95) у больных, не получавших радиотерапию, и 0,69 (95% ДИ 0,42–1,13) — у получавших радиотерапию. Риск специфической для РЛ смертности у больных, не получавших и получавших лучевую терапию равен 0,68 (95%ДИ 0,49–0,95) и 0,89 (95%ДИ 0,54–1,47), соответственно.
Время отказа от курения после постановки диагноза не повлияло на результаты. Так, статистически достоверное снижение риска смерти от всех причин (ОР =0,68, 95% ДИ 0,53–0,87), риска прогрессирования заболевания (ОР =0,72, 95% ДИ 0,56–0,92), и риска смерти от РЛ (ОР =0,77, 95% ДИ 0,59–1,02) отмечено у пациентов, которые отказались от курения в первые три месяца после постановки диагноза по сравнению с продолжавшими курить.
Обсуждение
Представленное клинико-эпидемиологическое исследование — первое в мире крупное проспективное исследование, в котором изучался эффект отказа от курения после постановки диагноза на дальнейший прогноз РЛ. Прослеживание когорты, включавшей 517 пациентов с НМКРЛ в течение 7 лет в среднем показало, что продолжение курения после постановки диагноза — очень серьезный негативный прогностический фактор. В то же время, отказ от курения улучшает ОВ и ВБП на 22,6 месяцев и специфическую онкологическую смертность на 22,8 месяцев; снижает на 33% риск смертности от всех причин, на 30% — риск прогрессирования и на 25% — риск специфической онкологической смертности. Почти 60% больных в нашем исследовании после постановки диагноза продолжали курить, и, соответственно, среди них имела место предотвратимая избыточная смертность, которая, в результате, сократила им жизнь почти на 2 года.
Механизм отрицательного влияния продолжения курения после постановки диагноза недостаточно изучен. Однако на основании имеющихся данных можно утверждать, что табачный дым и содержащиеся в нем канцерогенные вещества способствуют повреждению генетического аппарата клетки, мутациям, иммуносупрессии, повышению резистентности к противоопухолевой терапии и росту и распространению опухоли [8].
Учитывая высокую частоту курения среди больных РЛ, проблема курения онкологических больных после постановки диагноза имеет огромное значение. В США около 50% пациентов с онкологическим диагнозом курили к моменту постановки диагноза, а 20–33% продолжают курить во время и после лечения. Частота курения после постановки диагноза выше среди пациентов с табакозависимыми опухолями по сравнению с опухолями другой этиологии [9–11]. Согласно данным главного санитарного врача США, менее половины врачей-онкологов в стране рекомендуют своим пациентам отказаться от курения, причем большинство из них не предоставляет необходимой информации о том, как это сделать [5]. Поэтому многие онкологические пациенты не осознают степень вреда, связанного с продолжением курения после постановки диагноза. Они считают, что для них уже поздно бросать курить. Сведений о том, как часто лечащие врачи в России информируют онкологических больных об отрицательном влиянии курения на прогноз, мотивируют/помогают в отказе от курения, у нас нет, и, скорее всего, ситуация в нашей стране не лучше, чем в США. В то же время, очевидно, что пациенты имеют право знать о негативных последствиях для них при продолжении курения, а врачи должны быть ответственны за предоставление им необходимой информации [12].
Полученный в нашей работе положительный эффект отказа от курения после постановки диагноза значительно превосходит «значимую пользу» — достижение медианы улучшения общей выживаемости в пределах 2,5–6 месяцев для противоопухолевых препаратов, предложенную Американским обществом клинических онкологов (ASCO) [13]. Более того, из исследования следует, что польза отказа от курения после постановки диагноза РЛ, как минимум, равнозначна или превосходит значимые результаты, полученные в клинических исследованиях эффективности инновационных методов [14–16].
В мире насчитываются миллионы бывших онкологических больных, т. е. лиц, находящихся в ремиссии или полностью излеченных от рака (cancer survivors). В России — около 4 миллионов онкологических пациентов (контингент), которые считаются излеченными от рака, т. е. живут после постановки диагноза более 5 лет или продолжают лечиться [17]. В связи с этим вопрос о потенциальном воздействии продолжения курения на здоровье онкологических больных и лиц, перенесших это заболевание, весьма актуален.
Несмотря на результаты рандомизированных клинических исследований инновационных противоопухолевых препаратов (ингибиторов иммунных точек), указывающие на их эффективность как при ранних, так и распространенных формах НМКРЛ [18,19], и, что в США их применение на практике уже привело к некоторому улучшению популяционной выживаемости больных РЛ, сохраняется необходимость дальнейшего улучшения показателей прогноза РЛ [3]. В этом направлении отказ от курения после постановки диагноза может сыграть важную роль как в улучшении показателей прогноза вообще, так и, возможно, для корректировки методов применения (в частности, дозирования) противоопухолевых препаратов.
Мы надеемся, что результаты нашего исследования будут способствовать включению отказа от курения в клинические рекомендации по лечению РЛ и других онкологических заболеваний. Программа лечения онкологических больных должна включать научно обоснованные методы отказа от курения, представленные в виде «Клинических рекомендаций по отказу от курения для онкологических больных». В них должны рассматриваться все варианты борьбы с никотиновой и табачной зависимостью: применение никотинзаместительной терапии (НЗТ) и других методов лекарственного лечения, консультирование психотерапевтом, а также возможный переход на использование альтернативных средств доставки никотина для той категории больных, которым сложно отказаться от курения и которых не удовлетворяет эффективность НЗТ. Статус курения больного РЛ, включенного в клиническое исследование, должен учитываться при анализе эффективности препарата, так как он может значительно повлиять на результаты
Лечение табакокурения у пациентов с онкологическим диагнозом экономически выгодно для системы здравоохранения, особенно по сравнению с другими методами лечения. И, наоборот, продолжение курения после диагноза значительно увеличивает траты на лечение [20]. Внедрение в практику лечения больных с диагнозом РЛ рекомендаций по отказу от курения и лечению никотиновой зависимости на 30–35% снизит показатель смертности у 60 000 больных РЛ, диагностируемых ежегодно в России. Очевидна клиническая ценность этого метода с доказанной высокой эффективностью в улучшении продолжительности жизни больных, а в конечном итоге — снижении смертности от рака в России
Список литературы Отказ от курения после постановки диагноза рака легкого улучшает прогноз заболевания
- Состояние онкологической помощи населению России в 2019 году. Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. — М.: МНИОИ им. П.А. Герцена — филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2020.
- Заридзе Д.Г., Каприн А.Д., Стилиди И.С. Динамика заболеваемости и смертности от злокачественных новообразовваний в России. Вопросы онкологии. 2018; 64: 578-591.
- Siegel RL, Miller KD, Fuchs HE, et al. Cancer statistics, 2021. CA Cancer J Clin. 2021; 71:7-33.
- Заридзе Д.Г. Табак - основная причина рака. М.: ИМА-ПРЕСС, 2012. 208 с.
- Surgeon General Report on Smoking and Health: 50-years of Progress. Available from: https://www.surgeongeneral. gov/library/reports/50-years-of-progress/full-report.pdf.
- Заридзе Д.Г., Мукерия А.М. Влияние курения на прогноз заболевания у онкологических больных. Вопросы онкологии. 2019; 65(3): 321-329.
- Sheikh M, Mukeriya A, Shangina O, Brennan P, Zaridze D. Postdiagnosis Smoking Cessation and Reduced Risk for Lung Cancer Progression and Mortality: A Prospective Cohort Study. Ann Intern Med. 2021;174:1232-1239.
- Gemine R, Lewis K. Smoking cessation with lung cancer: not too little, never too late! European Medical Journal. 20 October 2016. Available from: www.emjreviews.com/respiratory/article/smoking-cessation-with-lung-cancer-not-too-little-never-too-late/ .
- Sterba KR, Garrett-Mayer E, Carpenter MJ, Tooze JA, Hatcher JL, Sullivan C, et al. Smoking status and symptom burden in surgical head and neck cancer patients. Laryngoscope. 2017;127:127-133.
- Ehrenzeller MF, Mayer DK, Goldstein A. Smoking Prevalence and Management Among Cancer Survivors. Oncol Nurs Forum. 2018;45:55-68.
- Jassem J. Tobacco smoking after diagnosis of cancer: clinical aspects. Transl Lung Cancer Res. 2019;8(Suppl 1):S50-S58.
- Dresler C, Warren GW, Arenberg D, Yang P, Steliga MA, Cummings KM, et al. «Teachable Moment» Interventions in Lung Cancer: Why Action Matters. J Thorac Oncol. 2018;13:603-605.
- Ellis LM, Bernstein DS, Voest EE, Berlin JD, Sargent D, Cortazar P, et al. American Society of Clinical Oncology perspective: Raising the bar for clinical trials by defining clinically meaningful outcomes. J Clin Oncol. 2014;32:1277-80.
- Borghaei H, Paz-Ares L, Horn L, Spigel DR, Steins M, Ready NE, et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non-Small-Cell Lung Cancer. N Engl J Med. 2015;373:1627-39.
- Borghaei H, Langer CJ, Paz-Ares L, Rodriguez-Abreu D, Halmos B, Garassino MC, et al. Pembrolizumab plus chemotherapy versus chemotherapy alone in patients with advanced non-small cell lung cancer without tumor PD-L1 expression: A pooled analysis of 3 randomized controlled trials. Cancer. 2020;126:4867-4877.
- Hellmann MD, Paz-Ares L, Bernabe Caro R, Zurawski B, Kim SW, Carcereny Costa E, et al. Nivolumab plus Ipilim-umab in Advanced Non-Small-Cell Lung Cancer. N Engl J Med. 2019;381:2020-2031.
- Состояние онкологической помощи населению России в 2018 году. Под редакцией А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М., МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2019.
- Nagasaka M, Gadgeel SM. Role of chemotherapy and targeted therapy in early-stage non-small cell lung cancer. Expert Rev Anticancer Ther. 2018;18(1):63-70.
- Owen D, Chaft JE. Immunotherapy in surgically resectable non-small cell lung cancer. J Thorac Dis. 2018;10(Suppl
- Rigotti NA. Treating Tobacco Smoking After the Diagnosis of Lung Cancer: It's Not Too Late and a Call to Action. Ann Intern Med. 2021 174:1317-1318.


