Отклик химических связей никеля на растягивающие деформации кристалла Ni-пиридиндикарбоксамида
Автор: Юрченко А.С., Матвейчук Ю.В., Барташевич Е.В.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 2 т.16, 2024 года.
Бесплатный доступ
Выполнено теоретическое исследование податливости координационных и нековалентных связей при моделировании одноосных механических деформаций кристаллической структуры дихлорида бис (2-N,6-N-дибутилпиридин-2,6-дикарбоксамид)-никеля (II). Для этого методом Хартри - Фока с тремя полуэмпирическими поправками для описания слабых взаимодействий атомов (поправка на дисперсионные взаимодействия Гримме D3, поправка ошибки суперпозиции базисного набора по схеме противовеса для пар атомов gCP и поправка эффектов неполноты ближнего действия базисного набора SRB) при использовании квантово-химических расчетов с периодическими граничными условиями были смоделированы растягивающие деформации кристаллической структуры вдоль кристаллографических осей. Сделан вывод о высокой устойчивости геометрических характеристик координационного комплекса к нарастающим деформациям. Анализ длин связей и двугранных углов внутри металлокомплекса показал их незначительные изменения во всем диапазоне растягивающих деформаций, в частности, изменение длины связи составило 4,3 % для N…Ni…N и 5,4 % для Ni…O. С помощью анализа характеристик конформационного состояния 2-N,6-N-дибутилпиридин-2,6-дикарбоксамидного фрагмента, а именно двугранных углов и межатомных расстояний, обнаружен эффект распрямления одного из N-бутильных фрагментов при большом (7-8 Å) растяжении элементарной ячейки, что подтверждает гипотезу об их напряженном скрученном конформационном состоянии, реализующимся под влиянием кристаллического окружения. При этом зафиксировано появление полости и трещины на последних шагах растяжения (8-10 Å), что вызывается сдвигами соседних металлокомплексов друг относительно друга и влияет на позиции хлорид-анионов. Примечательно, что полости и трещины образуются безотносительно оси, вдоль которой моделируется растяжение кристалла. Это указывает на то, что кристалл должен проявлять не эластичные свойства, а скорее хрупкость.
Ni-пиридинкарбоксамид, тест виртуального растяжения, растягивающие деформации, координационные связи ni, нековалентные взаимодействия
Короткий адрес: https://sciup.org/147244627
IDR: 147244627 | УДК: 541.6+54.03 | DOI: 10.14529/chem240215
Текст научной статьи Отклик химических связей никеля на растягивающие деформации кристалла Ni-пиридиндикарбоксамида
Использование многомасштабного моделирования в материаловедении позволяет приблизиться к пониманию природы как физико-химических, так и функциональных свойств материалов, заполняя пробелы на стыке этих самостоятельных областей знаний. Важно отметить, что необходимый функционал материалам с дефектами придают физико-химические процессы, происходящие в многокомпонентных материалах, таких как бетоны, волокнистые композиты и высокомолекулярные системы сложного состава. Понимание природы явлений, происходящих на границе раздела фаз и приводящих к появлению повреждённых зон, а также выявление ключевых причин, ответственных за феномен самовосстановления материалов в области повреждения, имеют важное фундаментальное значение и высокую актуальность. Большим вызовом является стыковка методов и подходов в физической химии, материаловедении и механике, позволяющих решать данные проблемы на разных уровнях, что само по себе является актуальной методологической задачей. Понимание структурных изменений, происходящих на атомно-молекулярном уровне, может обеспечить компьютерное моделирование, позволяющее сформировать объективные гипотезы и уточнить важную химическую информацию.
В последние годы в материаловедении началась эпоха разработок и использования синтетических материалов, одними из которых являются самовосстанавливающиеся материалы. Особен- ностью таких систем является возвращение их структурной основы в исходное состояние после воздействия на них различных внешних нагрузок и напряжений [1]. Преимущество таких систем заключается в возможности их применения в качестве электроизоляционных и теплоизоляционных материалов с улучшенными механическими свойствами [2]. В настоящее время известно несколько подходов к созданию самовосстанавливающихся материалов, обладающих диэлектрическими и эластомерными свойствами. Например, полимер на основе полиметилвинилсилоксана с хорошей диэлектрической проницаемостью и самостоятельным восстановлением после деформации [3] был синтезирован в одну стадию. Другой исследовательской группой был описан [4] способ получения самовосстанавливающихся материалов на основе силиконовой губки, имеющей поры и пропитанной силиконовым маслом. При электрическом пробое или механическом повреждении материала масло заполняет пустоты в губке, восстанавливая структуру. Губка удерживает масло и обеспечивает стабильность системы. Также известны самовосстанавливаю-щиеся полимеры, содержащие небольшое количество групп с ковалентно связанными фрагментами, несущими заряд. В работе [5] был представлен такой иономер, который в самых различных случаях проявлял свойства «самозалечивания». Кроме иономеров, хорошую восстанавливающую способность показывают и материалы, молекулы которых связаны друг с другом водородными связями [6, 7]. Так, каучуки, цепочки которых связаны водородными связями [8], показали хорошие результаты самовосстановления после растяжения до нескольких сотен процентов. При этом способность к самовосстановлению может сохраняться большое количество раз. Другим примером может служить супрамолекулярный полимерный композит [9], в который вводили оксид графена; эффект самовосстановления авторы также связывают с формированием нековалентных связей. Кроме вышеперечисленного, существует объяснение этого эффекта за счет формирования п-стэкинга [10].
В целом можно сказать, что одним из способов применения технологии самовосстанавли-вающихся материалов является использование полимеров. Существуют полимеры на основе силиконов [11], которые сшиваются координационными комплексами. Такие материалы сочетают в себе высокую растяжимость, высокую диэлектрическую прочность и автономное самовосстановление. Одним из перспективных полимеров для создания самовосстанавливающихся материалов является полидиметилсилоксан (PDMS) [12, 13]. Было обнаружено [14], что материалы на основе ПДМС проявляют подходящие механические свойства, высокую подвижность цепей, которые и обеспечивают свойства самовосстановления. Одним из интересных типов этого полимера являются полидиметилсилоксаны с координационными сшивками различными металлами. Ранее исследовательской группой Бао [15] был получен первый металлполимерный комплекс на основе полидиметилсилоксана и солей железа (II) и цинка. Другая исследовательская группа разработала самовосстанавливающиеся материалы на основе полисилоксанов и солей никеля (II) [16], а позже [17] синтезировала металлполимерный комплекс с кобальтом (II). Теоретическое исследование электронных свойств комплекса бис (2-N,6-N-дибутилпиридин-2,6-дикарбоксамид)-никеля (II) ранее было проведено в газофазном молекулярном приближении [16].
Ранее было показано [18-20], что использование квантово-химических и молекулярнодинамических методов моделирования при сочетании с методами глобальной минимизации энергии кристаллической решетки служит низко затратным и мощным инструментом в предсказании свойств кристаллической структуры. Эффективным методом изучения механических откликов кристаллов на одноосные деформации показал себя виртуальный тест растяжения кристаллов, предложенный в работе [21], опирающийся на расчёты геометрии деформированной кристаллической ячейки с использованием программы CRYSTAL [22]. С его помощью были идентифицированы как хрупкие, эластичные или пластичные полиморфные модификации 4-бромофенил-4-бромбензоата, показано соответствие их свойств экспериментально наблюдаемым [23], а также объяснены различающиеся механические свойства трёх полиморфных модификаций 6-хлор-2,4-динитроанилина [24]. Также с помощью этого метода была проверена возможность восстановления исходной структуры кристалла при моделировании снятия фиксированной деформации [24]. Кроме того, тест растяжения позволяет различить эластическое и пластическое поведение кристаллов, что невозможно при расчёте статического тензора жёсткости.
В нашей работе были поставлены следующие задачи.
-
– Применить виртуальный тест растяжения для исследования механического поведения кристаллов дихлорида бис (2-N,6-N-дибутилпиридин-2,6-дикарбоксамид)-никеля (II).
-
– Проверить наличие признаков эластичности (способности восстановления структуры после нагрузки), пластичности и хрупкости при моделировании деформаций этого кристалла вдоль кристаллографических осей.
-
– Выявить особенности отклика координационных связей N…Ni…N и других нековалентных взаимодействий на внешние деформации, определяющие механическое поведение кристалла.
Экспериментальная часть
Для моделирования деформаций кристаллов дихлорида бис (2-N,6-N-дибутилпиридин-2,6-дикарбоксамид)-никеля (II) была использована кристаллическая структура с рефкодом KABRUE [16] из базы CSD, имеющая пространственную группу P 21/ n . Виртуальный тест растяжения кристаллической структуры проводился по следующему алгоритму. Для моделирования деформации растяжения мы взяли предварительно полностью оптимизированную (опция FULLOPT), равновесную структуру, увеличили один кристаллографический параметр на 1 Å и зафиксировали его при следующей оптимизации. После оптимизации величина этого параметра еще раз увеличивалась на 1 Å, и проводилась новая оптимизация структуры. Такую пошаговую операцию повторили десять раз, до удлинения кристалла по одной из осей на 10 Å. Применялся уровень расчёта HF3c/MINIX, то есть композитный метод Хартри – Фока с тремя полуэмпириче-скими поправками для слабых нековалентных взаимодействий атомов. Этот метод включает в себя расчёт полной энергии системы по Хартри – Фоку с оптимизированным под этот метод базисным набором MINIX, в программе CRYSTAL17 [22], со следующими поправками [25]. Во-первых, применяется поправка на дисперсионные взаимодействия Гримме по схеме коррекции D3, что позволяет более точно оценить энергию слабых взаимодействий. Во-вторых, это поправка ошибки суперпозиции базисного набора по схеме противовеса для пар атомов gCP, которая особенно хорошо уменьшает эту ошибку для небольших базисных наборов, таких как MINIX. В-третьих, это поправка SRB для устранения ошибки ближнего действия базисного набора, которая возникает при использовании небольших базисных наборов и завышает значения длины ковалентных связей. Для выявления нековалентных взаимодействий в исследуемой кристаллической структуре проводился квантово-топологический анализ электронной плотности с помощью модуля TOPOND [26] программы CRYSTAL17. Критерием наличия водородной или координационной связи между атомами здесь было наличие критической точки электронной плотности (3,–1) согласно [27], для которой определялась величина электронной плотности ρ(r bcp ). При поиске равновесной геометрии использовались опции CRYDEF и FIXDEF для фиксации определенной деформации кристалла по трём осям а, b, c, по-отдельности для каждой, при сохранении пространственной группы и операторов симметрии. Данные опции позволяют проводить оптимизацию координат атомов и параметров кристаллической ячейки, когда один из параметров сохраняется постоянным при оптимизации. После проведения теста растяжения строились зависимости изменения объёма и полной энергии кристаллографической ячейки от величины роста каждого параметра, с анализом изменения структурных особенностей полученных кристаллических форм.
Обсуждение результатов
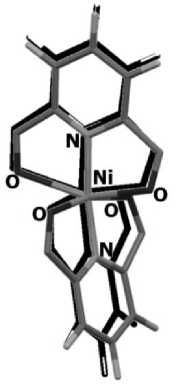
В кристалле дихлорида бис (2-N,6-N-дибутилпиридин-2,6-дикарбоксамид)-никеля (II) (реф-код KABRUE [16] в базе CSD) 6 координационных связей Ni...N и Ni…O, которые образуют основание квадратной бипирамиды, атомы N находятся в её вершинах (рис. 1). Согласно квантовотопологическому анализу электронной плотности с помощью TOPOND [26], в кристаллической ячейке обнаружены 8 нековалентных связей, среди которых 6 водородных связей H...Cl– и 2 водородные связи H...O. Данные о значениях ρ(r bcp ) для исследованных связей приведены на рис. 2. Из рисунка видно, что самыми прочными являются координационные связи N…Ni…N и Ni…O, самыми слабыми являются водородные связи H...O.
Связи атома Ni в кристалле, согласно их поведению при растяжении, можно разделить на две подгруппы. К первой подгруппе относятся связи никеля с азотом, N1…Ni…N2, ориентация которых относительно близка к направлению оси а; ко второй – связи никеля с кислородом, в частности связь Ni...O1, направление которой наиболее близко к ориентации оси b, Ni...O2, образующая наименьший угол с направлением оси а, Ni...O3 и Ni...O4, ориентация которых относительно близка к направлению оси с.
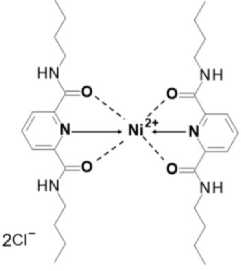
Рис. 1. Структурная формула дихлорида бис (2-N, 6-N-дибутилпиридин-2,6-дикарбоксамид)-никеля (II)
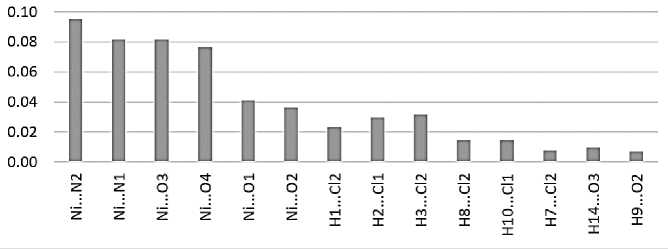
Рис. 2. Величина электронной плотности (ат. ед.) в критических точках (3,–1) для координационных и нековалентных связей
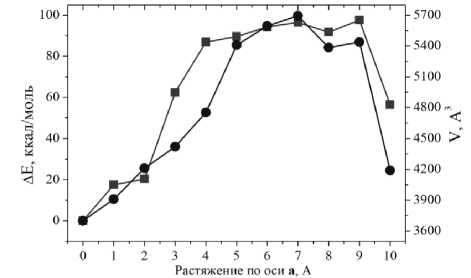
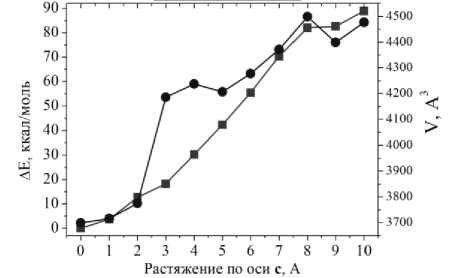
Виртуальный тест растяжения кристаллической формы вдоль кристаллографической оси а показал (рис. 3a) резкий рост изменения полной энергии структуры в расчёте на ячейку ΔE относительно энергии равновесной структуры, при растяжении на 3 Å. Затем в диапазоне растяжения 4…8 Å наблюдаются минимальные изменения энергии, что можно объяснить образованием трещины вдоль оси b вокруг позиции хлорид-аниона. Кроме того, при растяжении структуры на 5 А образуется вторая трещина, вдоль оси а, которая зарастает при растяжении на 9 Å, и это отражается в резком понижении величины ΔE.
а)
b)
c)
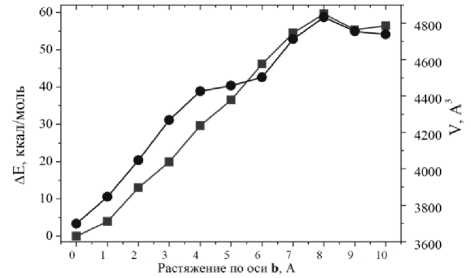
Рис. 3. Изменение энергии элементарной ячейки относительно равновесной структуры ΔE (ккал/моль) и объема элементарной ячейки V (Å3) при виртуальном тесте растяжения вдоль кристаллографических осей a, b и c

При растяжении вдоль оси а на первых шагах наблюдаются осцилляции длины среди обеих выделенных групп связей Ni...N и Ni...O (рис. 4a, b). Поскольку направление связей в фрагменте N1…Ni…N2 наиболее близко к направлению деформации, то для них характерны изменения длины с появлением локального максимума при растяжении структуры на 3 Å. Можно заметить, что поведение этих двух связей симбатно, но при растяжении на 1 Å длина Ni...N 2 изменяется больше (на 2,4 %), а при растяжении на 3 Å, наоборот, Ni...N1 имеет большую амплитуду относительного изменения длины (на 4,3 %). Такое же поведение можно заметить и для изменения связей Ni...O 3 и Ni...O 4 . Сначала атом Ni смещается в сторону O 3 , затем наоборот, в сторону O 4 . Заметим, что данные связи ориентированы ближе к направлению оси с , но несмотря на это, мы наблюдаем значительные осцилляции их длин при растяжении вдоль оси а . Более длинные связи Ni...O 1 и Ni...O 2 , относящиеся ко второй подгруппе, имеют идентичное друг другу поведение при растяжении вдоль оси а . Поскольку направление связи Ni...O 2 близко к направлению деформации, то можно наблюдать немного большую амплитуду осцилляций, чем у связи Ni...O1, направление которой близко к ориентации оси b . Что касается нековалентных связей, водородные связи H 3 ...Cl 2 (атом водорода принадлежит аминогруппе), H 8 ...Cl 2 , H 9 ...O 2 (атомы водорода принадлежат пиридиновому циклу) увеличивают свою длину при растяжении структуры, несмотря на различную ориентацию по отношению к направлению оси деформации. По причине уменьшения трещины на последних шагах растяжения, нековалентные связи H 2 ...Cl 1 , H 3 ...Cl 2 имеют длину меньшую, чем в равновесной структуре.
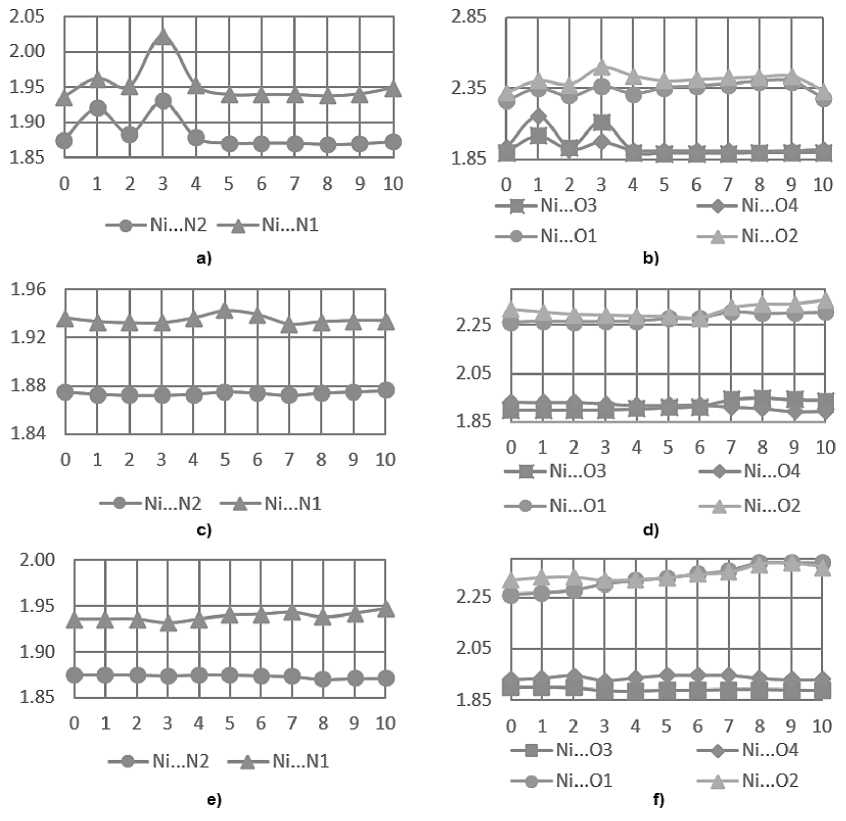
Рис. 4. Изменение длины связей (Å) при моделировании растягивающих деформаций кристалла: a) Ni…N вдоль оси a; b) Ni...O вдоль оси а; c) Ni…N вдоль оси b; d) Ni...O вдоль оси b; e) Ni…N вдоль оси c; f) Ni...O вдоль оси c.
По оси абсцисс – шаги растягивающих деформаций
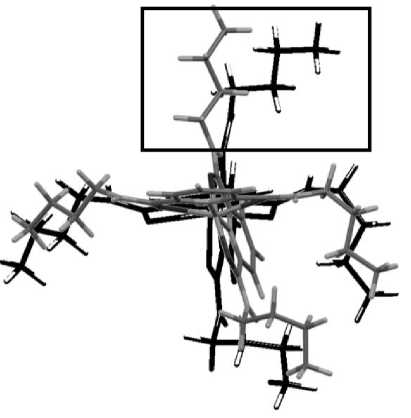
При растяжении кристалла вдоль оси b можно заметить симбатное поведение как объема ячейки, V, так и изменения энергии, ΔE: обе величины растут (см. рис. 3b). При данном типе растяжения также происходит постепенное образование трещины вдоль оси а , что становится заметным при растяжении на 7 Å; при растяжении структуры на 7 Å вдоль оси b также образуется трещина. В данном случае при дальнейших шагах растяжения не происходит зарастания трещин, они не уменьшаются, а, наоборот, увеличиваются в своих размерах. При растяжении элементарной ячейки конформационное состояние большинства N-бутиламиновых фрагментов изменяется не сильно. Однако один из таких фрагментов существенно распрямляется за счет своего расположения рядом с формирующейся полостью, которая расширяется при растяжении вдоль осей a и b (рис. 5а). Это следует из анализа изменения двугранных углов N-бутильного фрагмента: в случае растяжения по осям а и b двугранный угол С(O)–N–C–C увеличился максимум на ~40 градусов, что говорит о распрямлении фрагмента. При растяжении вдоль оси с выпрямление N-бутильных фрагментов не обнаруживается, поскольку изменения двугранных улов малы и величины изменений менее 10 градусов. Эти наблюдения подтверждаются анализом двугранных углов между метиленовыми звеньями бутильных групп. Анализ изменения при растяжении ячейки расстояний от атома азота до атома углерода концевой метильной группы N-бутиламиновых фрагментов подтвердил, что это расстояние заметно изменяется также только для одного из них, расстояние при растяжении вдоль оси b увеличилось максимум на 26 %, что говорит о возможном распрямлении фрагмента. При растяжении вдоль оси с такого распрямления не наблюдается, поскольку расстояние увеличивается менее чем на 1 %.
При растяжении вдоль оси b для связей Ni...N1 и Ni...N2 наблюдаются минимальные изменения длины (см. рис. 4c), поскольку их направление максимально отклонено от направления оси деформации. Аналогичное поведение можно заметить и для связей Ni...O3 и Ni...O4 по этой же причине. По-другому ведут себя связи Ni...O1 и Ni...O2. Мы наблюдаем минимальные изменения длины на шагах растяжения до 6 Å. Затем эти связи проявляют различное поведение: связь Ni...O 3 удлиняется и ослабевает, а связь Ni...O 4 , наоборот, укорачивается, усиливаясь. Однако при этом октаэдр по грани O3...Ni...O4 не изменяется, что можно связать со смещением атома никеля (рис. 5b). Водородные связи при растяжении удлиняются, а связь H 14 ...O 3 перестает существовать при очень большом растяжении на 8 Å, что вызывает образование трещины.
а) b)
Рис. 5. Смещение молекул в кристалле относительно равновесной структуры (чёрный) при растяжении на 7 Å (серый): а) распрямление N-бутильного фрагмента при растяжении вдоль оси b (на рисунке выделен); b) изменение комплекса Ni при растяжении вдоль оси b
При растяжении кристалла вдоль оси с наблюдаются различные тренды изменения объема и энергии ячейки (см. рис. 3c). В то время как изменение энергии ΔE монотонно возрастает, тренд объема проявляет различные осцилляции. Такое поведение можно связать с постепенным образованием пустоты, переходящей в трещину, в месте нахождения ионов хлорида в кристалле. При растяжении структуры на 3 Å эта полость резко увеличивается в размерах, а затем рост происходит более монотонно. При растяжении на 8 Å хлорид-анионы достаточно далеко отходят друг от друга, увеличивая объём трещины.
При растяжении вдоль оси с связи Ni...N1 и Ni...N2 так же, как и при растяжении вдоль оси b , изменяются незначительно (см. рис. 4e), что можно связать с большим углом между этими связями и осью деформации. Стоит отметить, что поведение связей Ni...O3 и Ni...O4: несмотря на их ориентацию, близкую к направлению оси с , длина Ni...O3 и Ni...O4 практически не изменяется.
Отличное поведение при таком же растяжении проявляет вторая подгруппа связей: связи Ni...O 1 и Ni...O 2 удлиняются, при этом и грань октаэдра вдоль данных связей увеличивается. При растяжении на 8 Å хлорид-анионы достаточно далеко отходят друг от друга, расширяя место для трещины. Поэтому такие связи, как H 2 ...Cl 1 и H 9 ...O 2 , перестают наблюдаться при увеличении деформации, поскольку ориентация данных связей наиболее близка к оси деформации. Кроме того, связевые пути H7...Cl2 и H14...O3 также перестают наблюдаться, несмотря на то, что эти взаимодействия не ориентированы вдоль направления растяжения. Такое поведение, возможно, связано с тем, что образуется полость, которая впоследствии переходит в трещину.
Выводы
По результатам анализа геометрических параметров и квантово-топологических характеристик электронной плотности, можно сделать следующие выводы о влиянии растягивающих деформаций на координационные связи атома Ni в кристалле дихлорида бис (2-N,6-N-дибутилпиридин-2,6-дикарбоксамид)-никеля (II).
Во-первых, координационные связи N…Ni…N и Ni...O претерпевают незначительные изменения в диапазоне приложенных деформаций вплоть до невероятно высоких растяжений ячейки на 10 Å вдоль каждой оси, специально смоделированных с большим запасом. На конечных шагах растяжения наблюдается образование полостей или трещин, при этом N-бутильные фрагменты остаются без изменений, кроме одного, расположенного рядом с формирующейся трещиной. На последних шагах координационное ядро пиридиндикарбоксамидного комплекса Ni(II) также остается в малоизмененном состоянии относительно равновесной структуры. Связи N…Ni…N наибольшим образом претерпевают изменения при растяжении вдоль оси а , что согласуется с тем, что направление данных связей близко к направлению оси деформации. Однако такие деформации ячейки не вызывают значимых изменений координационного ядра в целом, а максимальное относительное изменение длины связей составляет всего 4,3 %. Поэтому данные изменения можно отнести к незначительным для возможности разрушения комплекса.
Во-вторых, небольшие изменения связей Ni...O внутри комплекса происходят на первых шагах растяжения, до 3–5 Å. При этом, несмотря на разную ориентацию этих связей, они изменяются при деформации по всем осям, в особенности при растяжении вдоль оси а , которая ориентирована скорее ортогонально к ним. При этом изменение длины связей Ni...O часто происходит за счет смещения позиции атома Ni, основание бипирамиды и суммарные расстояния O 1 ...Ni...O 2 и O 3 ...Ni...O 4 изменяются мало, максимальное относительное изменение составило 5,4 %.
В-третьих, можно отметить, что растяжение кристалла вдоль осей элементарной ячейки приводит к образованию полостей и трещин безотносительно выбора оси растяжения, в основном в областях расположения хлорид-анионов, что указывает на проявление скорее хрупких, чем эластичных свойств кристалла пиридиндикарбоксамидного комплекса никеля.
Список литературы Отклик химических связей никеля на растягивающие деформации кристалла Ni-пиридиндикарбоксамида
- Utrera-Barrios S., Verdejo R., Lopez-Manchado M.A. et al. // Mater. Horiz. 2020. V. 7. P. 2882. DOI: 10.1039/D0MH00535E.
- Song T., Jiang B., Li Y. et al. // ES Mater. Manuf. 2021. V. 14. P. 1. DOI: 10.30919/esmm5f465.
- Dünki S.J., Ko Y.S., Nüesch F.A. et al. // Adv. Funct. Materials. 2015. V. 15, No. 16. P. 2467. DOI: 10.1002/adfm.201500077.
- Hunt S., McKay T.G., Anderson I.A. // Appl. Phys. Lett. 2014. V. 104, No. 11. P. 113701. DOI: 10.1063/1.4869294.
- Varley R.J., van der Zwaag S. // Acta Mater. 2008. V. 56, No. 19. P. 5737. DOI: 10.1016/j.actamat.2008.08.008.
- Zhang A., Yang L., Lin L. // J. Appl. Polym. Sci. 2013. V. 129, No. 5. P. 2435. DOI: 10.1002/app.38832.
- Tazawa S., Shimojima A., Maeda T. et al // J. Appl. Polym. Sci. 2018. V. 135, No. 24. P. 45419. DOI: 10.1002/app.45419.
- Cordier P., Tournilhac F., Soulie-Ziakovic C. et al. // Nature. 2008. V. 451, No. 19. P. 977. DOI: 10.1038/nature06669.
- Gadwai I. // Marcomol. 2020. V. 1, No. 1. P. 18. DOI: 10.3390/macromol1010003.
- Burattini S., Greenland B.M., Merino D.H. et al. // J. Am. Chem. Soc. 2010. V. 132, No. 34. P. 12051. DOI: 10.1021/ja104446r.
- Li C.-H., Wang Ch., Keplinger C. et al. // Nat. Chem. 2016. V. 8, No. 6. P. 618. DOI: 10.1038/nchem.2492.
- Cazacu M., Dascalu M., Stiubiani G.-T. et al. // Rev. Chem. Eng. 2022. V. 39, No. 6. P. 941. DOI: 10.1515/revce-2021-0089.
- Miroshnichenko A.S. Neplockh V., Mukhin I.S. et al. // Materials. 2022. V. 15, No. 24. P. 8731. DOI: 10.3390/ma15248731.
- Deriabin K.V., Filippova S.S., Islamova R.M. // Boimimetics. 2023. V. 8, No. 3. P. 286. DOI: 10.3390/biomimetics8030286.
- Rao Y.-L., Chortos A., Pfattner R. et al. // J. Am. Chem. Soc. 2016. V. 138, No. 18. P. 6020. DOI: 10.1021/jacs.6b02428.
- Deriabin K.V., Ignatova N.A., Kirichenko S.O. et al. // Polymer. 2020. V. 212. P. 123119. DOI: 10.1016/j.polymer.2020.123119.
- Deriabin K.V., Ignatova N.A., Kirichenko S.O. et al. // Organometallics. 2021. V. 40, No. 15. P. 2750. DOI: 10.1021/acs.organomet.1c00392.
- Reilly A.M., Cooper R.I., Adjiman C.S. et al. // Acta Crystallogr., Sect. B: Struct. Sci., Cryst. Eng. Mater. 2016. V. 72, No. 4. P. 439. DOI: 10.1107/S2052520616007447.
- Bardwell D.A., Adjiman C.S., Arnautova Y.A. et al. // Acta Crystallogr., Sect. B: Struct. Sci., Cryst. Eng. Mater. 2011. V. 67, No. 6. P. 535. DOI: 10.1107/S0108768111042868.
- Pejov L., Panda M.L., Moriwaki T. et al. // J. Am. Chem. Soc. 2017. V. 139, No. 6. P. 2318. DOI: 10.1021/jacs.6b11212.
- Masunov A.E., Wiratmo M., Dyakov A.A. et al // Cryst. Growth Des. 2020. V. 20, No. 9. P. 6093. DOI: 10.1021/acs.cgd.0c00798.
- Dovesi R., Erba A., Orlando R. et al. // WIREs Comput. Mol. Sci. 2018. V. 8, No. 4. P. 1360. DOI: 10.1002/wcms.1360.
- Masunov A.E., Wiratmo M., Dyakov A.A. et al // Cryst. Growth Des. 2022. V. 22. P. 4546. DOI: 10.1021/acs.cgd.2c00449.
- Matveichuk Y.V., Yurchenko A.S., Masunov A.E. et al. // Cryst. Growth Des. 2022. V. 22. P. 6472. DOI: 10.1021/acs.cgd.2c00692.
- Sure R., Grimme S. // J. Comput. Chem. 2013. V. 34, No. 19. P. 1672. DOI: 10.1002/jcc.23317.
- Gatti C., Casassa S. TOPOND14 User’s Manual. Milano: CNR-ISTM of Milano, 2013. 53 p.
- Bader R.F.W. Atoms in molecules: a quantum theory. Oxford: Clarendon Press, 1994. 438 p.


