Открытая легочная эмболэктомия в лечении послеоперационной тромбоэмболии легочной артерии
Автор: Медведев А.П., Мухин А.С., Максимов А.Л., Вапаев К.Б., Журко А.С.
Журнал: Московский хирургический журнал @mossj
Рубрика: Сердечно-сосудистая хирургия
Статья в выпуске: 1 (79), 2022 года.
Бесплатный доступ
Введение. Проблема лечения пациентов с послеоперационной тромбоэмболией легочной артерии довольно актуальна и в настоящее время, не смотря на значительное улучшение ведения пациентов данной патологией.Цель: оценить безопасность и эффективность открытой эмболэктомии в лечении послеоперационной тромбоэмболии легочных артерий.Материалы и методы. Проведен ретроспективный анализ историй болезни 40 пациентов, которым с 2010 по 2020 гг. выполнена открытая эмболэктомия из легочных артерий в условиях искусственного кровообращения по поводу послеоперационной ТЭЛА высокого и промежуточно высокого риска ранней смерти. Изучали летальность, гемодинамические показатели по данным трансторакальной эхокардиографии (ЭхоКГ), послеоперационные осложнения и длительность пребывания больных в стационаре.Результаты. Оперированы 40 больных с 2 летальными исходами (5 %). Средний возраст пациентов составлял 53,7±8,5 лет, 23 человека были женского пола. Индекс PESI в среднем составлял 106,2±27,3 баллов, давление в легочной артерии - 47,7±8,19 мм рт. ст., индекс Миллера - 28,4±3,21 балла. После операции давление в легочной артерии снизилось в среднем до 32,9±6,38 мм рт. ст. Длительность нахождения в отделении реанимации составила в среднем 1,77±0,78 дней, продолжительность ИВЛ - 849,3±404,34 мин. Среднее время пребывания в больнице составляло 13,4±3,43 дня.Заключение. Открытая хирургическая эмболэктомия является эффективным и безопасным методом лечения послеоперационной ТЭЛА высокого и промежуточно высокого риска смерти.
Послеоперационная тромбоэмболия легочной артерии, открытая эмболэктомия из легочной артерии, послеоперационные осложнения
Короткий адрес: https://sciup.org/142234537
IDR: 142234537 | УДК: 616.131-005.6/.7-08-036.4
Текст научной статьи Открытая легочная эмболэктомия в лечении послеоперационной тромбоэмболии легочной артерии
Тромбоэмболия легочной артерии (ТЭЛА) на сегодняшний день остается значимой социальной и медицинской проблемой, несмотря на существенный эффект от внедрения в повседневную практику современных методов диагностики, профилактики и лечения. В эпидемиологических исследованиях годовые показатели заболеваемости ТЭЛА варьируют от 39 до 115 на 100 000 населения [13]. Хирургическое вмешательство увеличивает риск ТЭЛА в пять раз, которая является одной из основных причин смерти оперированных пациентов, занимая третье место в структуре летальности [11].
По данным многих исследователей частота венозных тром-бэмболических осложнений в послеоперационном периоде за последние 20 лет не изменилась [11]. Известно, что ТЭЛА чаще встречается после крупных операций: в 7–30 % после ортопедических вмешательств [9], в 0,33–6,6 % в абдоминальной хирургии [4], в 0,3–4,1 % в гинекологической практике [5], в 0,9–1,1 % после урологических операций [3]. Летальность при данном осложнении остается крайне высокой и в среднем достигает 31%, а при массивной ТЭЛА – 60 % [3]. По данным патологоанатомических исследований массивная ТЭЛА обнаруживается у каждого 10 умершего в хирургических стационарах [1]. Учитывая, что в мире проводится около 310 млн. оперативных вмешательств [8], а в Российской Федерации выполняют более 10 млн. операций в год [2], легко представить масштаб и актуальность данной проблемы. Ранняя диагностика и оптимальный выбор патогенетически обоснованного метода лечения, направленного на восстановление легочного кровотока, уменьшение легочной гипертензии и дисфункции правого желудочка, а также на прекращение дальнейшего тромбообразования, являются залогом успешного лечения данного контингента больных. Вместе с тем, перспектива эффективного лечения массивной послеоперацион-
K.B. Vapaev*,
ной ТЭЛА многими хирургами воспринимается скептически, что отражает низкую частоту использования наиболее современных и эффективных методов лечения послеоперационной ТЭЛА.
Цель исследования – оценить безопасность и эффективность открытой эмболэктомии в лечении послеоперационной тромбоэмболии легочных артерий.
Материалы и методы
Изучены результаты лечения 40 пациентов с послеоперационной ТЭЛА, которым выполнялась открытая эмболэктомия из легочных артерий в условиях искусственного кровообращения в ГБУЗ НО «Специализированная кардиохирургическая клиническая больница им. академика Б.А. Королева» с 2010 по 2020 гг. В исследуемой группе больных преобладали женщины (23 – 57,5 %), мужчин было 17 (40,8 %). Возраст обследованных варьировал от 25 до 73 лет, составляя в среднем 53,7±8,5 лет (табл. 1). Все пациенты были переведены из других стационаров города и области. В день возникновения ТЭЛА доставлены в стационар и оперированы 11 больных, 7 человек переведены и оперированы после неэффективной тромболитической терапии (ТЛТ), 22 пациента переведены и оперированы в связи с прогрессирующей правожелудочковой недостаточностью на фоне проводимой противотромботической терапии. Временной интервал от возникновения клинических симптомов заболевания до поступления в нашу клинику в среднем составлял 19,1 ± 11,86 дня. Показаниями к операции считали: ТЭЛА высокого риска с нарушением гемодинамики (в том числе клиническая смерть с успешной сердечно-легочной реанимацией), неэффективность ТЛТ, прогрессирующую правожелудочковую недостаточность при центральном поражении легочных артерий. Эмболия легочных артерий у 16 больных (40 %) возникла после общехирургических операций, у 4 (10
%) – после гинекологических, у 7 (17,5 %) – после нейрохирургических, у 5 (12,5 %) – после урологических, у 8 (20 %) – после травматологических операций.
Таблица 1
Распределение пациентов по возрасту
Table 1
Distribution of patients by age
|
Возраст, лет/ Age, years |
18–44 |
45–59 |
60–74 |
М±Sd |
Всего: (Total) |
|
|
Количество пациентов/ Number of patients |
n |
8 |
19 |
13 |
53,7±8,5 |
40 |
|
% |
20 |
47,5 |
32,5 |
- |
100,0 |
|
Факторами риска ТЭЛА и фоном развития, кроме оперативного вмешательства, были: ожирение у 16 больных (40 %), онкологические заболевания – у 8 (20 %), патология вен нижних конечности – у 18 (45 %). Для определения источника острой ТЭЛА выполняли ультразвуковое триплексное сканирование вен нижних конечностей и малого таза, по результатам которого у 29 больных (72,5 %) диагностирован тромбоз глубоких вен нижних конечностей.
Таблица 2
Динамика показателей (частота дыхательных движений, частота сердечных сокращений) до и после лечения
Table 2
Dynamics of indicators (respiratory rate, heart rate) before and after treatment
|
Параметр (Indicators) |
До лечения/ before treatment |
После лечения/ after treatment |
|
Частота дыхательных дви-жений/мин/ Respiratory rate/min |
23,6 ± 2,8 |
17,8 ± 0,4* |
|
Частота сердечных сокра-щений/мин/ Heart rate/min |
96,2 ± 10,3 |
78,7 ± 4,9* |
Примечание – * уровень статистической значимости p <0,05; критерий Уилкоксона.
Note – * level of statistical significance p <0.05; Wilcoxon criterion.
Baseline parameters of transthoracic echocardiography
При поступлении у всех больных (100 %) была одышка в покое, у 28 (78 %) – тахикардия (табл. 2), у 18 (45 %) – кашель. Боль в грудной клетке отмечали 28 пациентов
(78 %), кровохарканье было у 3 больных (7,5 %). Индекс оценки тяжести ТЭЛА по шкале PESI составлял 106,2±27,3 балла. По данным анализа крови у всех пациентов был повышен D-dimer и отмечен подъем уровня тропонинов. Также у 8 больных (20 %) зафиксирован лейкоцитоз, у 11 (27,5%) – анемия, у 23 (57,5 %) – тромбоцитопения менее 200000/мкл.
Всем пациентам выполнена трансторакальная эхокардиография результаты которой позволили оценить характер гемодинамических нарушений в малом круге кровообращения (рис. 1–4, табл. 3).
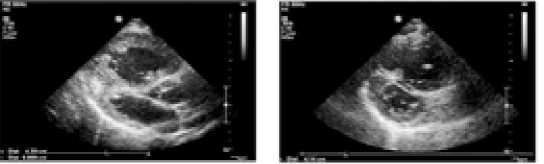
Рис. 2. Вдавливание базального отделе при ЛГ МЖП в полость
ЛЖ в диастолу при ЛГ
Fig. 2. Indentation of the basal part of the LV (interventricular septum) into the LV cavity (left ventricle) into the diastole in LH (pulmonary hypertension)
Рис. 1. Дилатация и гипертрофия ПЖ Fig. 1. Dilation and hypertrophy of the pancreas (right ventricle) in LH (pulmonary hypertension)
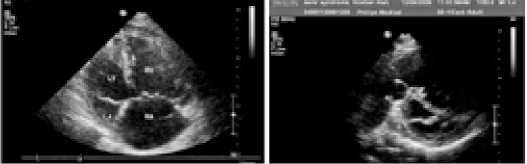
Рис. 4. Дилатация ствола ЛА при ЛГ
Fig. 4. Dilation of the trunk of the LA (pulmonary artery) in LH (pulmonary hypertension)
Рис. 3. Дилатация ПП и ПЖ и доминирование правых отделов сердца над левыми из четырехкамерной верхушечной позиции при ЛГ Fig. 3. Dilation of PP (right atrium) and RV (right ventricle) and the dominance of the right parts of the heart over the left from the four-chamber apical position in
LH (pulmonary hypertension)
МСКТ-ангиографию выполняли на ангиографической установке Toshiba Medical Systems Infinix VS-I (рис. 5). У одного пациента в связи с клинической смертью и успешной реанимацией МСКТ-ангиография не выполнялась, пациент оперирован после проведения трансторакальной ЭхоКГ с визуализацией тромбоэмболов в стволе и главных ветвях легочной артерии.
По результатам ангиографического исследования легочных артерий индекс Миллера составил 28,4±3,21 балла. По риску ранней смерти 10 больных (25 %) имели высокий риск, 30 (75 %) – промежуточно высокий.
Таблица 3
Исходные показатели трансторакальной ЭхоКГ
Table 3
Baseline parameters of transthoracic echocardiography
|
Показатели/ Indicators |
Значение, (Value) М±Sd |
|
Вертикальный размер правого предсердия, см/ Vertical size of the right atrium, cm |
5,1±0,67 |
|
Поперечный размер правого предсердия, см/ Transverse size of the right atrium, cm |
4,39±0,57 |
|
Конечный диастолический размер правого желудочка, см/ The final diastolic size of the right ventricle, cm |
3,9±0,29 |
|
Фракция выброса левого желудочка, %/ Left ventricular ejection fraction, % |
59,4±5,92 |
|
Диаметр ствола легочной артерии, см/ Diameter of the trunk of the pulmonary artery, cm |
3,1±0,59 |
|
Среднее давление в легочной артерии, мм. рт.ст./ Mean pressure in the pulmonary artery, mmHg |
47,7±8,19 |
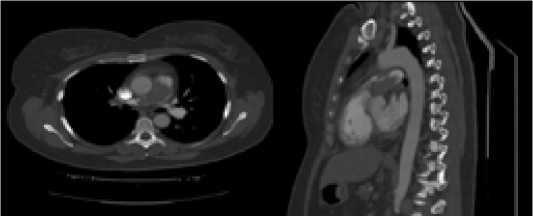
А Б
Рис. 5. МСКТ-ангиопульмонография: локализован субтотальный дефект наполнения ствола ЛА на протяжении 6 см. (А – MPR реконструкция в аксиальной плоскости; Б – MPR; MIP, реконструкции в сагиттальной плоскости) Fig 5. MCT-angiopulmonography: a subtotal defect of filling of the trunk of the aircraft was localized for 6 cm. (A – MPR reconstruction in the axial plane; B – MPR; MIP, reconstruction in the sagittal plane)
Всем пациентам была выполнена открытая легочная эмболэктомия в условиях искусственного кровообращения (ИК). Среднее время операции и ИК составило соответственно 138,9±24,02 (диапазон 90–200 мин) и 28,85±6,87 (диапазон
16–48 мин) мин. У одного пациента произошла клиническая смерть во время транспортировки в нашу клинику, после эффективной сердечно-легочной реанимации больной экстренно оперирован с восстановлением адекватного легочного кровотока. Основные акценты операции представлены на рисунках 6, 7. У 38 больных (95 %) операция выполнялась на работающем сердце без пережатия аорты и введения кардиологического раствора. Эмболэктомия осуществлялась через разрезы легочных артерий. Количество и локализация разрезов на легочной артерии зависели от анатомического расположения тромбоэмболов.
Статистическая обработка данных проводилась с использованием программы SPSS Statistics 26. Принадлежность выборок к нормальному распределению определяли с помощью критерия Шапиро-Уилка. В качестве предварительного статистического метода применяли критерий Уилкоксона (уровень значимости p<0,05), различия считали статистически значимыми при р≤0,01 (после пересчета на число сравнений). Результаты представляли в виде М±Sd (где М – среднее значение, Sd – стандартное отклонение).
Результаты
На госпитальном этапе умерли два пациента (летальность составила 5 %), показатель госпитальной выживаемости составил 95 %. В обоих случаях причиной смерти явилось прогрессирование полиорганной (в т.ч. сердечной) недостаточности. Следует отметить, что умершие были представлены пациентами высокого риска ранней смерти с поздним выполнением оперативного вмешательства. Среди не летальных осложнений наблюдалась умеренная поли-органная недостаточность с преобладанием дыхательной и сердечнососудистой, а также энцефалопатия, пароксизмальная форма фибрилляции предсердий, экссудативный перикардит, которые были купированы к моменту выписки. Длительность нахождения в отделении реанимации составила в среднем 1,77±0,78 дней, продолжительность ИВЛ – 849,3±404,34 мин.

А Б
Рис. 6. (А, Б). Удаление массивного тромбэмбола из ствола легочной артерии
Fig. 6. (A, B). Removal of a massive thrombembolus from the trunk of the pulmonary artery

А Б
Р ис. 7. (А, Б). Удаленные тробэмболы из легочных артерии
Fig. 7. (A, B). Removed thrombembolus from the pulmonary artery
Таблица 4
Динамика эхокардиографических показателей в послеоперационном периоде
Table 4
Dynamics of echocardiographic parameters in the postoperative period
|
Показатель трансторакальной ЭхоКГ/ Transthoracic echocardiogram |
Значение (Value) М±Sd |
|
|
1 сутки (1 day) |
Перед выпиской (Before discharge) |
|
|
Вертикальный размер правого предсердия, см/ Vertical size of the right atrium, cm |
4,1±0,46 |
3,6±0,52* |
|
Поперечный размер правого предсердия, см/ Transverse size of the right atrium, cm |
3,9±0,61 |
3,2±0,48* |
|
Конечный диастолический размер правого желудочка, см/ The final diastolic size of the right ventricle, cm |
2,9±0,31 |
2,6±0,23* |
|
Среднее давление в легочной артерии, мм. рт.ст./ Mean pulmonary artery pressure, mmHg |
35,2±8,12 |
32,9±6,38* |
Примечание *сравнение внутри группы до и после лечения, уровень статистической значимости p <0,05 (критерий Уилкоксона).
Note *comparison within the group before and after treatment, the level of statistical significance p <0.05 (Wilcoxon criterion).
Регресс клинических проявлений острой ТЭЛА, нормализация параметров анализа крови наблюдали в раннем послеоперационном периоде у всех больных. Результаты трансторакальной ЭхоКГ в послеоперационном периоде позволили оценить гемодинамическую эффективность от проводимой открытой эмболэктомии. Так, было отмечено значительное снижение легочной гипертензии, явлений правожелудочковой недостаточности (табл. 4). Пациенты были выписаны в удовлетворительном состоянии, длительность стационарного этапа лечения составила в среднем 13,4±3,43 дней.
Как видно из таблицы 4, исходно по данным ЭхоКГ имело место увеличение средних размеров правых отделов сердца, которые достоверно уменьшились в раннем послеоперационном периоде. Также установлено достоверно значимое снижение средних значений среднего давления в легочной артерии, улучшение диастолической функции правого желудка.
Обсуждение
Главными целями лечения острой послеоперационной ТЭЛА являются: спасение жизни пациента, нормализация перфузии легких и предотвращение хронической тромбоэмболической легочной гипертензии [1]. Успешное решение этих задач способно изменить неблагоприятный прогноз заболевания, повысить выживаемость и обеспечить приемлемый уровень качества жизни. Сегодня в арсенале практикующих врачей имеются следующие «агрессивные» методы восстановления кровотока по легочным артериям: во-первых, это ТЛТ как «золотой стандарт» реперфузии, во-вторых, хирургическая эмболэктомия из легочных артерий, в-третьих, эндоваскулярные методы лечения. Важно понимать, что ТЛТ противопоказана при ранней послеоперационной ТЭЛА из-за высокого риска кровотечения, и в доступной литературе имеются лишь единичные сообщения о ее успешном использовании.
При наличии противопоказаний к применению тромболитических препаратов и тяжелого соматического состояния послеоперационных больных считаем логичным улучшение легочной гемодинамики путем фрагментации эмболов. Частичное катетерное разрушение эмбола помогает перевести центральный тип поражения ЛА в периферический, при котором из-за разницы суммарного объема сосудов частично восстанавливается кровоток, снижается давление в легочной артерии и нагрузка на правые отделы сердца, а также ускоряется аутолизис более мелких фрагментов эмболов. В тоже время, риск формирования хронической легочной гипертензии из-за окклюзии мелких ветвей легочной артерии ставит этот вид вмешательства в ряд жизнеспасающих, но паллиативных операций [3].
Ввиду того, что ТЛТ после операций противопоказана, а использование эндоваскулярных методов лечения не всегда возможно и часто сопровождается послеоперационными осложнениями, альтернативой этим методам остается открытая легочная эмболэктомия. В нашей клинике больным с послеоперационной ТЭЛА выполняется открытая тромбэмболэктомия из главных и долевых легочных артерий в условиях нормотермии на работающем сердце без пережатия аорты, за исключением случаев эмболии «в ходу» и коррекции сопутствующей интракардиальной патологии. Точная топическая диагностика локализации тромбэмболов позволяет быстро и эффективно восстановить легочный кровоток и обеспечить благоприятный исход лечения с летальностью 5 % [1]. В современных рекомендациях основным показанием к выполнению открытой эмболэктомии считается массивная ТЭЛА с выраженными гемодинамическими нарушениями. При этом у данных больных демонстрируется высокий уровень смертности, который достигает 50 % [6, 7, 10]. Учитывая тяжесть состояния оперируемых, эта высокая летальность может быть оправдана, но требует дальнейшего изучения и оптимизации хирургической тактики.
Стандартная сердечно-легочная реанимация способствует фрагментации тромбэмбола и его смещению в дистальные отделы легочного артериального русла, что, в свою очередь, ведет к снижению давления в правом желудочке и восстановлению сердечной деятельности. В дальнейшем стойкая нормализация сердечной деятельности будет завесить от скорейшего и адекватного восстановления кровотока в малом круге кровообращения путем применения «агрессивных» методов лечения – ТЛТ или открытой эмболэктомии.
В этом исследовании мы стремились показать эффективность и безопасность хирургической эмболэктомии в лечении послеоперационной ТЭЛА высокого и промежуточно высокого риска ранней смерти. Госпитальная выживаемость в группе исследуемых больных составила 95 %. Среди пациентов промежуточно высокого риска ранней смерти летальных исходов не было.
Выводы
-
1. Открытая легочная эмболэктомия является операцией выбора у пациентов с послеоперационной тромбоэмболией легочной артерии.
-
2. Этот вид хирургического вмешательства сопровождается достаточно низкой летальностью (~ 5 %), быстрым снижением давления в легочной артерии, стабилизацией системной гемодинамики и нормализацией функции правого желудочка.
-
3. Хирургическая легочная эмболэктомия – высоко эффективная процедура для спасения пациентов, находящихся в критическом состоянии из-за тромбоэмболии легочной артерии, развившейся в послеоперационном периоде.
Список литературы Открытая легочная эмболэктомия в лечении послеоперационной тромбоэмболии легочной артерии
- Медведев А.П., Максимов А.Л., Немирова С.В., Хоменко А.М., Козина М.Б., Пичугин В.В., Демарин О.И., Трофимов Н.А. Острая массивная тромбоэмболия легочных артерий: показания и результаты хирургического лечения. Клин. мед., 2019. № 97(10). С. 698–704. http://dx.doi.org/10.34651/0023-2149-2019-97-10-698-704
- Основные показатели здравоохранения РФ. 2018. Доступно по: https://minzdrav.gov.ru/ministry/61/22/stranitsa-979/statisticheskie-iinformatsionnye-materialy/statisticheskiy-sbornik-2018-god. Ссылка активна на 30 сентября 2020г.
- Хоменко А.М., Кузьменко Е.А., Пичугин В.В., Медведев А.П. Эндоваскулярная механическая фрагментация тромбоэмболов при лечении критической тромбоэмболии легочной артерии у пациентов с острым нарушением мозгового кровообращения по геморрагическому типу. Журнал СТМ, 2020. Т. 12. № 1. С. 72–78. http://dx.doi.org/10.17691/stm2020.12.1.09
- Todoran T.M., Giri J., Barnes G.D., Rosovsky R.P., Chang Y., Jaff M.R. et al. Treatment of submassive and massive pulmonary embolism: a clinical practice survey from the second annual meeting of the Pulmonary Embolism Response Team Consortium. J Thromb Thrombolysis, 2018, № 46(1), рр. 39–49.
- Van der Pol L.M., Tromeur C., Bistervels I.M. et al. An algorithm adapted to pregnancy YEARS for the diagnosis of suspected pulmonary embolism. N Engl J Med., 2019, № 380, р. 1139.
- Kalra Р., Bajaj Н., Ather С. et al. Mortality outcomes for surgical pulmonary embolectomy for high-risk pulmonary embolism: a comprehensive meta-analysis. J Am Coll Cardiol, 2016, № 67, р. 2249.
- Rajat K., Navkaranbir S. B., Pankaj A. Surgical Embolectomy for Acute Pulmonary Embolism: Systematic Review and Comprehensive Meta-Analyses. Ann Thorac Surg., 2017, Mar; № 103 (3), рр. 982–990. http://dx.doi.org/10.1016/j.athoracsur.2016.11.016.
- Raskob G., Angchaisuksiri P., Blanco A. et. al. Thrombosis: a major contributor to the global disease burden. Journal Arteriosclerosis, Thrombosis, and Vascular Biology, 2014, Vol. 12, № 11, рр. 2363–2371. http://dx.doi.org/10.1161/ATVBAHA.114.304488
- Barnal A.G., Fanola C., Bartos J.A. Management of PE, 2020. Available at: https://www.acc.org/latestincardiology/articles/2020/01/27/07/42/management-of-pe. Accessed 04/08/, 2020
- Sadiq I., Goldhaber S. Z., Liu P. Y., Piazza G. Risk factors for major bleeding in the SEATTLE II trial. Vasc. Med., 2017, Vol. 22, № 1, рр. 44–50.
- Temgoua M.N., Tochie J.N., Noubiap J.J. et al. Global incidence and case fatality rate of pulmonary embolism following major surgery: a protocol for a systematic review and meta-analysis of cohort studies. Syst Rev., 2017, № 6, р. 240. https://doi.org/10.1186/s13643-017-0647-8
- Tehreem A., Bouwman R.A., Grigoras I. et al. Global patient outcomes after elective surgery: prospective cohort study in 27 low-, middleand high-income countries. British Journal of Anaesthesia, 2016, Vol. 117, № 5, рр. 601–609. http://dx.doi.org/10.1093/bja/aew316
- Giri J., Sista A.K., Weinberg I., Kearon C., Kumbhani D.J., Desai N.D., et al. Interventional therapies for acute pulmonary embolism: current status and principles for the development of novel evidence: a scientific statement From the American Heart Association. Circulation, 2019, №140(20), рр. 774–801.


