«Открытый живот» в лечении вторичного перитонита и абдоминального сепсиса: лимитирующие факторы
Автор: Щеголев А.А., Товмасян Р.С., Маркаров А.Э., Чевокин А.Ю., Васильев М.В., Плотников В.В., Мурадян Т.Г.
Журнал: Московский хирургический журнал @mossj
Рубрика: Абдоминальная хирургия
Статья в выпуске: 2 (92), 2025 года.
Бесплатный доступ
Введение. Несмотря на отсутствие исследований с высоким уровнем доказательности относительно эффективности вакуумной лапаростомии при тяжёлых формах вторичного перитонита, в настоящее время в практической хирургии накоплен значительный опыт применения данной хирургической стратегии, а имеющиеся результаты дают возможность проанализировать возможные противопоказания и факторы риска применения данной методики. Цель исследования. Детализировать противопоказания к вакуум-ассистированной лапаростомии при хирургическом лечении вторичного перитонита, осложнённого абдоминальным сепсисом. Материалы и методы исследования. Изучены результаты лечения 84 больных абдоминальным сепсисом, в лечении которых применялись вакуум-ассистированные лапаростомы (ВАЛС). У всех больных абдоминальный сепсис был следствием вторичного перитонита, источником которого были дефекты различных отделов желудочно-кишечного тракта (ЖКТ). У подавляющего большинства больных (85,7 %) на момент стартового хирургического вмешательства был диагностирован септический шок, абсолютное большинство больных (81 %) были оперированы позже 24 часов от момента заболевания. Изучена корреляция результатов лечения в зависимости от исходной локализации источника перитонита. Результаты лечения. Общая летальность в исследовании составила 38 %. В группе больных с локализацией источника перитонита в тонкой кишке летальность составила 52,8 %. В группе больных с источником перитонита в других отделах ЖКТ летальность составила 27 %. Разница летальности в группах была достоверной (р<0,05). Успешность первичного фасциального закрытия (ПФЗ) также достоверно отличалась в группах (31,3 % против 82,5 %, р<0,05). Заключение. Есть основания полагать, что при наличии ушитых зон или участков десерозации тонкой кишки при вторичном перитоните необходимо либо вовсе отказаться от использования ВАЛС, либо использовать редуцированные варианты вакуумных повязок, в которых предусмотрено воздействие отрицательного давления только в пределах лапаротомной раны с изоляцией зоны отрицательного давления от свободной брюшной полости синтетическими протезами, фиксированными к фасциальным краям раны.
Абдоминальный сепсис, вакуум-ассистированная лапаростома, «замороженный» живот, кишечные свищи, «открытый живот», перитонит, фасциальное закрытие живота
Короткий адрес: https://sciup.org/142244466
IDR: 142244466 | УДК: 616.381-002 | DOI: 10.17238/2072-3180-2025-2-27-33
Текст научной статьи «Открытый живот» в лечении вторичного перитонита и абдоминального сепсиса: лимитирующие факторы
За последние несколько лет в литературе сформировалось довольно устойчивое понятие так называемого «открытого живота» (ОЖ), которое подразумевает использование различных вариантов вакуум-ассистированных лапаростом (ВАЛС) при внутрибрюшных катастрофах. Не вызывает сомнения основное показание к ОЖ: максимально эффективное снижение внутрибрюшного давления в случаях интраабдоминальной гипертензии (ИАГ) и абдоминального компартмент - синдрома (АКС). Большинство авторов также едины во мнении относительно ВАЛС в качестве оптимального способа временного закрытия живота в случаях damage-control (DC) и необходимости second-look (SL) релапаротомий [1 - 2].
Что касается применения ОЖ конкретно при абдоминальном сепсисе (АС), то в настоящее время, достоверных результатов, свидетельствующих о снижении летальности при АС с применением данной стратегии в больших выборках, пока не получено [3–7].
С другой стороны, прослеживается тенденция, отчетливо сформировавшаяся за последние несколько лет: акцент востребованности стратегии ОЖ при внутрибрюшных катастрофах смещается от травмы к АС. За последние 5 лет, количество публикаций по использованию стратегии ОЖ при травме резко снизилось, а при АС, наоборот, значительно возросло [8]. На наш взгляд, это связано с двумя причинами: рутинным освоением навыков рестриктивного типа интенсивной терапии при тяжёлой травме и снижением количества лапаротомий, в целом. Более того, применение ОЖ при травме в настоящее время в наибольшей степени связано с повреждением полых органов (контроль контаминации и инфекции, в отличие от контроля кровотечения при травме паренхиматозных органов и сосудов). Что касается показаний к ОЖ при АС, то здесь наблюдается постепенное смещение акцентов от «местных» критериев в брюшной полости к параметрам общего состояния пациента. В этом смысле показания к ОЖ при АС в настоящее время, в основном, ассоциируются с септическим шоком (SCIAS - severe complicated intra-abdominal sepsis) [9-11].
Материалы и методы
В работе проанализированы результаты лечения 84 больных абдоминальным сепсисом, в лечении которых применялась стратегия «открытого живота». Все больные проходили лечение в университетской хирургической клинике РНИМУ имени Н. И. Пирогова (руководитель клиники и заведующий кафедрой - д. м. н. профессор Щеголев А. А.) на базе городской клинической больницы имени Ф.И. Иноземцева ДЗ г. Москвы
(главный врач - Маркаров А. Э.) в период с 2016 по 2023 гг. Этиологически у всех больных АС был следствием вторичного перитонита, источником которого были дефекты различных отделов желудочно-кишечного тракта (ЖКТ). Пациенты были рандомизированы по полу, возрасту, сопутствующей патологии, тяжести перитонита (Мангеймский индекс перитонита - МИП) и степени органной недостаточности на момент стартовой операции, определяемой по шкале SOFA. Средний возраст больных составил 63,8±11,5 лет; гендерное деление: 40 мужчин, 44 женщин.
Критериями включения в исследование были: наличие абдоминального сепсиса по критериям протокола Сепсис-3 и использование ВАЛС. Критерий исключения был только один – смерть в течение 48 часов от момента поступления в стационар.
У подавляющего большинства больных на момент стартового хирургического вмешательства был диагностирован септический шок (72 больных – 85,7 % от общего числа наблюдений). Также у подавляющего числа больных стартовая операция была выполнена в срок более 24 часов от момента манифестации перитонита (68 больных – 81 %). Среднее значение МИП в общей группе составило 33,45±2,45. Среднее значение SOFA на момент стартовой операции в общей группе составило 3,98±1,56.
Решение об использовании ВАЛС в каждом конкретном случае принималось оперирующим хирургом лично, либо в ходе интраоперационного консилиума с руководителем хирургической клиники. Показаниями для выбора стратегии ОЖ были: септический шок, в том числе сокращённая лапаротомия из-за нестабильной гемодинамики, высокий риск развития абдоминального компартмент-синдрома (АКС), необходимость повторной оценки жизнеспособности кишечника и восстановления непрерывности желудочно-кишечного тракта, флегмона лапаротомной раны.
Стратегия ОЖ предусматривала наложение ВАЛС во время стартового хирургического вмешательства в традиционном исполнении с широкой инкорпорацией компонентов вакуумной повязки в брюшную полость без фасциальной тяги. Сразу после стабилизации состояния больного и достижения устойчивого хирургического контроля источника перитонита переходили к модификациям ВАЛС с фасциальным вытяжением посредством эластомеров и синтетических сеток под контролем внутрибрюшного давления (ВБД) либо выполнялось одномоментное полноценное фасциальное ушивание лапаротомной раны наглухо.
Конечной целью стратегии ОЖ всегда было стремление к первичному фасциальному закрытию живота. Удовлетворительным результатом считалось также кожное закрытие лапаротомной раны.
Неудовлетворительными результатами считали:
-
1. Летальный исход
-
2. «Замороженный живот» ( тип 3 по классификации Бьорк )
-
3. Кишечные свищи ( тип 4 по классификации Бьорк )
Целью данной работы было изучение эффективности лечения абдоминального сепсиса с использованием стратегии ОЖ в целом и выявление тех факторов риска, которые в наибольшей степени коррелировали с неудовлетворительными результатами лечения.
По данным литературы общеизвестны главные факторы, которые достоверно коррелируют с неудовлетворительными результатами лечения тяжелых форм вторичного перитонита и АС. Таковыми являются: наличие или отсутствие септического шока, давность перитонита более 24 часов от момента стартовой операции, локализация источника перитонита в ЖКТ.
Поскольку в настоящую работу исходно вошли пациенты с самыми тяжелыми характеристиками вторичного (перфорационного) перитонита и абдоминального сепсиса, а именно: подавляющее большинство пациентов находились в септическом шоке и были оперированы позднее 24 часов от начала перитонита, то наши основные усилия были направлены на выявление других отрицательных прогностических критериев выживаемости. В частности, в работе изучена зависимость результатов лечения вторичного перитонита и АС с использованием стратегии ОЖ в зависимости от локализации (уровня) источника перитонита в желудочно-кишечном тракте.
Исходя их поставленных целей выбран следующий дизайн исследования. В таблице 1 приведено распределение больных по первичному источнику перитонита.
Таблица 1
Первичный источник перитонита
The source of peritonitis
Table 1
|
Локализация источника перитонита Localization of the source of peritonitis |
Количество больных (n) Quantity of patients (n) |
|
|
Первичные операции Primary operations |
||
|
Желудок и 12-перстная кишка Stomach and duodenum |
4 |
|
|
Тонкая кишка Small bowel |
26 |
|
|
Ободочная кишка Large bowel |
Опухолевые Neoplastic |
18 |
|
Неопухолевые Non-cancerous |
8 |
|
|
Послеоперационные перитониты Postoperative peritonitis |
||
|
Желудок и 12-перстная кишка Stomach and duodenum |
2 |
|
Продолжение Таблицы 1
|
Тонкая кишка Small bowel |
10 |
|
Ободочная кишка Large bowel |
16 |
|
Всего: Total: |
84 |
На промежуточных этапах исследования была обнаружена отчётливая корреляция неудовлетворительных результатов с локализацией источника перитонита в тонкой кишке. Для проверки данной гипотезы все больные, вошедшие в исследование, были разделены на 2 группы по первичной локализации источника перитонит:
-
I. Тонкая кишка - 36 больных
-
II. Другие отделы ЖКТ - 48 больных
Группы были однородны по полу возрасту, давности перитонита, тяжести перитонита по МИП и органной недостаточности по SOFA.
Далее в каждой группе были исследована частота каждого из основных критериев неудовлетворительных результатов лечения (летальность, частота развития «замороженного живота», кишечные свищи типа Бьорк 4). В качестве критерия хорошего результата лечения изучена частота первичного фасциального закрытия в каждой группе.
Дизайн исследования: ретроспективное рандомизированное клиническое.
Результаты
Общая летальность в исследовании составила 38 % (32 пациента). В I группе (источник перитонита в тонкой кишке) летальность составила 19 больных (52,8 %), во II группе (больные с источником перитонита НЕ в тонкой кишке) летальность составила 13 больных (27 %). Разница летальности в группах была достоверной (р<0,05).
Попытка первичного фасциального закрытия (ПФЗ) предпринята у 56 пациентов. При этом успешность ПФЗ в целом в исследовании составила 71,4 % (40 больных). Успешность ПФЗ в I группе составила 5 из 16 наблюдений (31,3 %). Аналогичный показатель во II группе - составил 33 из 40 больных (82,5 %). Разница результатов в группах достоверна (р<0,05).
Частота развития «замороженного живота» в исследовании составила 3,57 % (3 случая). При этом все 3 случая развития «замороженного живота» отмечались в I группе (8,3 %), в этой же группе отмечено 2 случая формирования кишечных свищей типа Бьорк 4 (5,6 %). Любопытно, что во II группе случаев «замороженного живота» и кишечных свищей типа Бьорк 4 не отмечено (0 %). Разница результатов по данному показателю в группах недостоверна (р > 0,05). Сравнительные результаты лечения в группах представлены на рисунке 1.
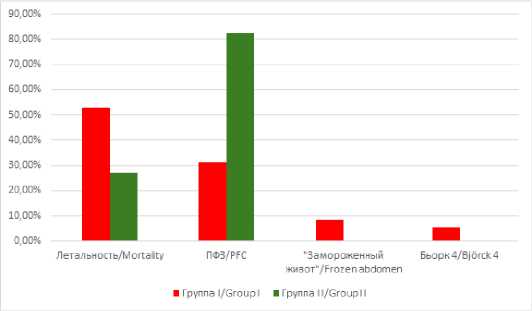
Рис. 1. Результаты лечения
Fig. 1. Treatment results
Обсуждение
С одной стороны, полученные результаты созвучны результатам наиболее известных исследований по стратификации тяжёлых форм перитонита, осложненных абдоминальным сепсисом, в которых выявлен повышенный риск летального исхода, связанный с локализацией источника перитонита в тонкой кишке. Это, безусловно, широко известное исследование «WISS Study», посвященное валидации шкалы тяжести сепсиса всемирного общества неотложных хирургов (SSS WSES) и нисколько не теряющий своей актуальности уже более 30 лет Мангеймский индекс перитонита [12, 13]. В первой системе пункт валидации, посвященный тонкой кишке как источнику перитонита, оценивается максимально высоко (3 балла), во второй — внеободочным источникам перитонита присвоен также высокий балл (4 балла) в отношении летального исхода.
С другой стороны, наше исследование интересно тем, что в него вошли больные с исключительно тяжёлыми формами перитонита неаппендикулярного генеза: практически у всех больных отмечался септический шок и хирургическое вмешательство было выполнено после 24 часов с начала перитонита. Это так называемая категория больных, которая в зарубежной литературе описывается термином SCIAS (severe complicated intraabdominal infections, COOL-trial) [2]. В нашей работе получен сопоставимый с данными литературы уровень общей летальности (38 %), но выявленные результаты свидетельствуют о наличии повышенного риска летального исхода при локализации источника перитонита в тонкой кишке, несмотря на использование методики ОЖ.
Эти результаты могут свидетельствовать о следующем. Методика ОЖ за счет декомпрессивного и форсированного деконтаминационного эффекта довольно успешно справляется с перитонитами нетонкокишечной этиологии, поскольку при локализации дефекта в ободочной кишке проблемная зона кишечника может быть относительно безболезненно и эффективно «выключена» обструктивным стомированием.
Что же может быть лимитирующим патогенетическим фактором меньшей эффективности ВАЛС при локализации дефекта в тонкой кишке? На наш взгляд, имеют значение 2 фактора.
Во-первых, при локализации дефекта в тонкой кишке традиционное исполнение ВАЛС не может вывести этот участок из-под опасного влияния вакуума, а попытка «выключить» дефект тонкой кишки посредством высокой илеостомии зачастую непродуктивна и сопряжена с высоким риском некор-регируемых патофизиологических последствий.
Во-вторых, в условиях септического шока и «капиллярной утечки» стенка тонкой кишки в наибольшей степени страдает из-за дисциркуляции и нарушения спланхнического кровотока в условиях так называемого энтерального дистресс-синдрома. Вкупе с анатомической особенностью наибольшего предлежания петель тонкой кишки к лапаротомной ране это создает тупиковую ситуацию с применением вакуума: с одной стороны нужна декомпрессия и форсированная деконтаминация брюшной полости, с другой стороны - использование вакуума становится крайне опасным в условиях отека, «мацерации» и дисциркуляции кишечной стенки с наличием ушитых дефектов или десерозаций. Попытки ряда авторов для этих целей использовать большой сальник в качестве изолирующей про-тективной субстанции от негативного влияния вакуума, на наш взгляд, малопродуктивны, хотя сколько-нибудь доказательных суждений на это счёт по известным причинам в настоящее время быть не может.
Что может быть перспективным решением вышеизложенных проблем, связанных с поражением тонкой кишки? Мы полагаем, что перспективным направлением дальнейшего поиска хирургических решений лечения абдоминального сепсиса и септического шока в стадии «капиллярной утечки» и значимого висцерального отека помимо успехов интенсивной терапии может быть смещение акцентов в сторону редуцированных вариантов ВАЛС, которые не предусматривают широкую инкорпорацию компонентов в брюшную полость и ограничиваются зоной отрицательного давления исключительно в лапаротомной ране. Эти варианты ВАЛС в качестве висцеральной защитной субстанции в дне раны должны иметь композитный сетчатый протез нужного размера для обеспечения ключевых задач: декомпрессии брюшной полости за счет обеспечения адекватного диастаза мышечно-фасциальных краев и одновременной дозированной фасциальной тяги в лапаротомной ране. В за- висимости от особенностей клинического случая и наличия или отсутствия слабых мест ЖКТ данный протез может быть перфорированным и неперфорированным.
Выводы
-
1. Во всех случаях интраабдоминальных катастроф с ушитым источником перитонита в тонкой кишке, а также с наличием потенциальных зон «слабости» стенки тонкой кишки имеется обоснованный риск применения ВАЛС в традиционном исполнении.
-
2. Наличие таких условий в брюшной полости требует либо полного отказа от использования вакуумной лапаростомы, либо поиска компромиссных технических решений, предусматривающих полную изоляцию ушитых или десерозированных участков тонкой кишки от зоны воздействия отрицательного давления
-
3. Редуцированные варианты ВАЛС, предусматривающие использование отрицательного давления лишь в пределах ла-паротомной раны с отграничением брюшной полости синтетическим протезом, фиксированным к фасциальным краям раны, по-видимому, могут быть перспективным вариантом временного закрытия живота у данной категории больных.


