OТО-IVM - метод сохранения фертильности пациенткам с опухолевым поражением яичников
Автор: Лавринович О.Е., Татищева Ю.А., Берлев И.В., Яковлева М.Г., Карицкий А.П., Калугина А.С.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 4 т.23, 2024 года.
Бесплатный доступ
Введение. Все большее число пациенток репродуктивного возраста сталкивается с онкологическим заболеванием и высоко заинтересованы в сохранении фертильности. Улучшаются показатели выживаемости онкологических пациентов. Совершенствуются методы репродуктивных технологий, позволяющие сохранить способность деторождения. Реабилитация с целью обеспечения удовлетворительного качества жизни приобретает новый смысл, а с развитием новых технологий изменяется и уровень возможной помощи. В настоящее время реабилитационные мероприятия для онкологических пациенток репродуктивного возраста, несомненно, должны включать все возможные меры по сохранению и восстановлению фертильности. Цель исследования - сохранение фертильности пациенток с опухолевым поражением яичников. Материал и методы. После овариоэктомии яичники транспортировали в лабораторию эмбриологии, где проводили извлечение ооцит-кумулюсных комплексов и их последующее дозревание методом OTO-IVM (Ovarian tissue oocyte in vitro maturation). Полученные зрелые ооциты (метафаза II) криоконсервировали методом витрификации или, при наличии партнера, оплодотворяли методом ИКСИ (интрацитоплазматической инъекции сперматозоида), эмбрионы культивировали до стадии бластоцисты и также криоконсервировали методом витрификации. Криоконсервированные ооциты и эмбрионы могут быть использованы после излечения онкологического заболевания в программах вспомогательных репродуктивных технологий.
Онкофертильность, сохранение фертильности, созревание ооцитов in vitro, oto-ivm, опухолевое поражение яичников, овариоэктомия
Короткий адрес: https://sciup.org/140307094
IDR: 140307094 | УДК: 618.11-006-089.87 | DOI: 10.21294/1814-4861-2024-23-4-96-107
Текст научной статьи OТО-IVM - метод сохранения фертильности пациенткам с опухолевым поражением яичников
Число онкологических больных репродуктивного возраста за последние десятилетия равномерно увеличивается по всем нозологиям. По оценкам National Institutes of Health, в 2023 г. 4,4 % впервые выявленных случаев злокачественных заболеваний пришлось на возраст от 15 до 39 лет [1]. Частота новых случаев рака у молодых людей растет в среднем на 0,3 % каждый год, но показатели выживаемости с 2008 г. ежегодно улучшаются на 1 % благодаря снижению общей смертности [2].
Достижения в области терапии злокачественных опухолей, особенно темпы внедрения в клиническую практику новых противоопухолевых препаратов, привели к значительному улучшению показателей выживаемости пациентов. Около 85,8 % подростков и молодых людей с диагнозом рак проживут более 5 лет после постановки первичного диагноза, при этом относительная выживаемость онкологических пациентов молодого возраста среди всех нозологических форм в целом составляет
81,1 %, для мужчин – 76,7 %, для женщин – 84,1 % [3, 4].
В 2006 г. Национальный институт рака (NCI) при поддержке Фонда LIVESTRONG организовал Группу по изучению научных исследований, посвященных раку молодых людей в возрасте от 15 до 39 лет, которых выделил в особую категорию онкологических больных из-за уникальных проблем, как группу высокого приоритета ввиду молодости и хороших шансов на выздоровление, а также проблем, с которыми они сталкиваются на протяжении болезни и дальнейшей жизни [5–7].
Уровень заболеваемости всеми видами рака у женщин на 38,3 % выше, чем у мужчин (52,32 vs 37,82 на 100 000), что является большой социальной проблемой, так как последние десятилетия отмечается тенденция к поздним беременностям и родам [8]. Более 75 % молодых женщин с онкологическим диагнозом, у которых еще не было родов, хотели бы иметь детей после лечения, а пациентки, которые уже рожали, хотят сделать это снова [9].
При этом агрессивность специального лечения (химиотерапия, лучевая терапия и хирургическая кастрация) приводит к повреждению гонад и к снижению показателей рождаемости на 30–50 % [10, 11]. Наличие проблем с фертильностью увеличивает вероятность возникновения депрессии, что серьезно влияет на физическое и эмоциональное благополучие больных, а также на общее качество жизни. Серьезность репродуктивных проблем прямо пропорционально связана с риском развития депрессии [7, 12–17].
Исходя из вышеизложенного, онкологические пациентки репродуктивного возраста с высоким риском потери фертильности должны иметь доступ к эффективным методам вспомогательных репродуктивных технологий, основанных на онкологической безопасности. В первую очередь при выявлении онкологического заболевания должна быть рассмотрена возможность выполнения органосохраняющего лечения. При определенных условиях это выполнимо при ранних стадиях эпителиального рака яичников, а также при пограничных и герминогенных опухолях яичников. Но даже в этих случаях шанс сохранить фертильность реализуется далеко не всегда. Разнообразие гистологических форм и клинических проявлений злокачественных новообразований яичников велико, поэтому возможность выполнения органосохраняющего лечения для больных репродуктивного возраста, заинтересованных в сохранении детородной функции, должна рассматриваться индивидуально [18–21].
Основным и наиболее результативным методом сохранения фертильности у женщин в репродуктивном возрасте является криоконсервация яйцеклеток и/или эмбрионов. Предпочтение отдается проведению стимуляции овуляции с целью получения зрелых яйцеклеток (на стадии метафазы II) и их криоконсервации методом витрификации или, при наличии партнера, оплодотворения и получения эмбрионов [22]. Также успешно используется метод криоконсервации кортикального слоя яичников с целью последующей ортотопической трансплантации ткани для восстановления фертильности, который представляется в настоящее время единственной стратегией сохранения фертильности для девочек препубертатного возраста и молодых женщин, которые не могут отложить начало лечения или не хотят вступать в протокол овариальной стимуляции. С 2019 г. метод не является экспериментальным [23].
Реже используется метод IVM (In vitro maturation), представляющий собой получение в ходе трансвагинальной пункции незрелых ооцитов и их последующее дозревание in vitro. Получив свое начало еще в 30– 40-х годах прошлого столетия, когда впервые удалось из незрелого ооцита получить зрелый, способный к оплодотворению, в настоящее время эта методика используется как альтерна- тивный вариант сохранения фертильности, когда проведение стимуляции овуляции невозможно или сопряжено с осложнениями, например с развитием синдрома гиперстимуляции яичников. Метод ценен, так как позволяет отказаться от стимуляции овуляции гонадотропинами, быстро реализуется, но имеет более низкие показатели получения зрелых ооцитов и их оплодотворения [24].
Все вышеперечисленные методы подразумевают возможность выполнения трансвагинальной пункции фолликулов и отсутствие опухолевого поражения яичников. Но при наличии противопоказаний для пункции фолликулов, которыми являются: дессиминация опухоли по брюшной полости (канцероматоз), опухолевое поражение яичников, локализация опухоли в зоне пункции фолликулов, инфильтрация параметриев, крестцово-маточных связок, опухоль шейки матки, влагалища более 4 см и другие, до настоящего момента нет достаточно эффективного метода сохранения фертильности [25]. Единственно возможным методом сохранения фертильности в таких случаях может быть метод OTO-IVM (Ovarian tissue oocyte in vitro maturation), в основе которого лежит получение незрелых ооцитов из ткани яичника, удаленного при хирургическом лечении, с их последующим дозреванием в условиях in vitro [26, 27].
Протоколы OTO-IVM для лечения бесплодия и сохранения фертильности до настоящего времени не имеют стандартизации, отличаются применением или отказом от праймирования (использование препаратов ФСГ и ХГЧ перед пункцией), способом пунктирования фолликулов, условиями транспортировки ткани из операционной в лабораторию и другими параметрами. При этом метод имеет высокий потенциал к применению, как единственно возможный для получения и криоконсервации биологического материала у онкологических пациенток, когда использование других методов невозможно [28].
Большинство научных публикаций посвящено реализации метода OTO-IVM из неизмененной ткани яичника. Созревание in vitro (IVM) яйцеклеток, полученных ex vivo из ткани яичника (OTO-IVM), проводится одновременно с криоконсервацией ткани яичника (OTC) и обсуждается как дополнительный источник зрелых яйцеклеток с целью повышения шансов на рождение ребенка.
В 2020 г. опубликованы результаты ретроспективного когортного исследования, в котором пациенткам с целью сохранения фертильности была выполнена односторонняя овариотомия для криоконсервации кортекса. При этом дополнительным методом сохранения фертильности послужил метод OTO-IVM из резецированной ткани яичника. У 64 пациенток проведена витрификация яйцеклеток (6,7 ± 6,3 яйцеклетки на пациентку). У 13 пациенток проведено оплодотворение дозревших до стадии метафазы II яйцеклеток мето- дом ИКСИ (Интрацитоплазматическая инъекция сперматозоида (ICSI – Intra Cytoplasmic Sperm Injection)), при этом у каждой пациентки получено и витрифицировано 2,0 ± 2,0 эмбриона. Для 2 пациенток расконсервированы ооциты с процентом успешной разморозки 86 и 60 % соответственно, а коэффициент живорождения на одну пациентку после ОТО-IVM, ИКСИ и переноса эмбрионов составил 43 % [29].
A. Kedem et al. [30] опубликовали результаты сохранения фертильности у 119 онкологических больных различных нозологических форм в период с 2007 по 2015 г. Авторы представили сравнительные результаты оценки эффективности 2 способов забора ооцитов перед началом онкологического лечения: сбор ооцитов (OPU) с предварительным введением препаратов ФСГ в течение 3 дней, с последующей трансвагинальной аспирацией под ультразвуковым контролем перед лапароскопическим забором ткани яичника и сбор ооцитов из ткани яичника (OTO), извлеченных во время подготовка корковой ткани яичника к замораживанию. Проведено сравнение эффективности получения ооцитов при трансвагинальной пункции, которая составила 100 %, по сравнению с забором на лабораторном этапе при подготовке ткани к криоконсервации, где ооциты получены в 50 % случаев. Эмбрионы, полученные путем OTO-IVM, успешно расконсервированы в 100 %. Несмотря на значительно более низкую эффективность метода OTO-IVM, авторы подчеркивают его ценность, так как он не требует введения гормональных препаратов, синхронизации действий специалистов различных профилей и может быть реализован как дополнительный метод, повышающий эффективность программ сохранения фертильности онкологических больных [30]. Ученые из Южной Кореи в 2016 г. опубликовали результаты исследования, посвященного сохранению фертильности пациенток с гинекологическими злокачественными опухолями. При этом во время операции незрелые ооциты извлекались из макроскопически не измененной ткани яичника (ex vivo) с целью культивирования для дозревания в течение 48 ч. Эффективность созревания ооцитов составила 67,9 %, что значительно ниже, чем при трансвагинальной пункции [31]. Потенциальное применение созревания яйцеклеток in vitro (IVM) в качестве альтернативы экстракорпоральному оплодотворению (ЭКО) яйцеклетами, созревшими in vivo, вызывает все больший интерес. Однако отчет о клинических случаях и небольших когортных исследованиях демонстрирует относительно низкую частоту оплодотворения ооцитов при OTO-IVM – 35,2 %, по сравнению с ооцитами, созревающими in vivo и получаемыми при обычной стимуляции яичников, которая составляет до 65 %. Ретроспективный обзор эффективности OTO-IVM свидетельствует о 5 живорождениях в результате переносов эмбрионов. В 2 случаях это были злокачественные опухоли яичников [32]. Сохранение фертильности при раке яичников является самой сложной проблемой, когда нужно соблюсти баланс между порой отчаянным желанием пациентки иметь детей и соблюдением онкологической безопасности. В настоящее время метод OTO-IVM, несмотря на экспериментальность и неотработанный алгоритм реализации, является бесценным, позволяющим дать надежду на рождение ребенка женщинам репродуктивного возраста с поражением яичников первичной опухолью (злокачественные эпителиальные, неэпителиальные, пограничные опухоли яичников) или метастатическим поражением яичников при раке молочной железы, толстой кишки, аденокарциноме шейки матки, лейкозе, нейробластоме и др. [33, 34]. Одним из крайне важных аспектов успешного сохранения яйцеклеток для их дозревания, последующего успешного оплодотворения и развития эмбриона являются условия транспортировки яичника от операционной до лаборатории, где яйцеклетки будут извлечены. Множество исследований подтверждают повреждающее влияние низких температур на веретено деления ооцита. Показано, что охлаждение до 0 °С на 10 мин полностью и необратимо разрушает веретено деления ооцита [35].
Еще в 2014 г. были представлены данные о первой успешной беременности и родах пациентки 21 года со злокачественной опухолью яичника (микропапиллярная серозная карцинома яичника высокой степени дифференцировки) из яйцеклетки, полученной из пораженного опухолью яичника, дозревшей и оплодотворенной in vitro [36]. M. Bourg et al. [37] провели ретроспективное исследование в период с мая 2017 г. по ноябрь 2021 г. с применением метода OTO-IVM для сохранения фертильности. В исследование включено 20 пациенток, из них 15 – с онкологическими диагнозами. Авторы обнаружили, что при органическом поражения яичника опухолью число извлеченных яйцеклеток составило 4,1 ± 6,3 vs 17,4 ± 12,0 при отсутствии такового (р=0,003), количество витрифицированных зрелых ооцитов составило 1,1 ± 2,2 vs 5,8 ± 5,3 соответственно (р=0,03).
Цель исследования – сохранение фертильности пациенток с опухолевым поражением яичников.
Материал и методы
В период с 2021 по 2024 г. в когортное одноцентровое описательное исследование включено 15 пациенток в возрасте 16–38 лет (средний возраст – 28,9 года), получивших лечение в ФГБУ «НМИЦ онкологии им Н.Н. Петрова» Минздрава РФ по поводу опухолевого поражения репродуктивных органов. Тактика лечения обсуждалась на онкологическом консилиуме, где принималось решение о необходимом объеме хирургического лечения в соответствии с клинической ситуацией (таблица): 10 пациенток были со злокачественными опухолями яичников,
Таблица /Table
Основные характеристики включенных в исследование пациентог и результаты реализации метода ОТО-IVM
Characteristics of the patients included in the study and the results of implementing of OTO-IVM method
|
№ |
ед co О m |
Q 1—< о СЛ О a a s co О CT |
Гистологическое исследование (ТNM)/ Histological conclusion |
Объем хирургического лечения/ Extent of surgery |
О H s £ ° в ° 9 о Ш w CT й О СТ О 8 О К |
Й 'о ч & и " СО СТ £ 8 ^ § М п & СТ a S ° « О ч |
й .о га 45 ед (U 45 |
-- га es м о и СТ о о о О О О S ч |
о S СТ 45 1 <5 а Рн ГД i ^ ?! 03 О сл СТ о а о on С £ |
СО w о ^ a £ О 0J о ;^ $ 2 >> $ я ° Я О ° а s ° 9 СЛ И aj |
|
1 |
38 |
С56 |
Пограничные эндометриоидные опухоли обоих яичников/ Borderline endometrioid tumors of both ovaries (р)T1с2N0M0 |
Аднексэктомия с обеих сторон, сохранение матки (органосохраняющее) с хирургическим стадированием/ Bilateral salpingo–oophorecto-my, uterine preservation with surgical staging |
0 |
– |
0 |
– |
0|0 |
|
|
2 |
37 |
С53 |
Аденокарцинома Grade II шейки матки кишечного типа/ Cervical adenocarcinoma Grade II, intestinal type (pT1b1N0M0) |
Радикальный хирургический объем/ Radical surgical treatment |
40 |
34 |
6 |
– |
6/0 |
|
|
3 |
21 |
С18.4 |
Перстневидно–клеточный рак поперечной ободочной кишки/ Cricoid–cell carcinoma of the transverse colon (p)T4aN1bM1 (mts в яичники)/ (p)T4aN1bM1 (mts to ovaries) |
Радикальный хирургический объем/ Radical surgical treatment |
11 |
7 |
3 |
– |
3/0 |
|
|
4 |
27 |
С56 |
Эндометриоидная карцинома яичника low grade/ Ovarian low–grade endometrioid carcinoma (p)T1c2N0M0 |
Сохранение матки, удаление яичников, хирургическое стадирование/ Uterine preservation, salpingo– oophorectomy, surgical staging |
20 |
13 |
5 |
4 |
0/1 (BL2ВВ) |
|
|
5 |
27 |
С56 |
Серозная карцинома яичника low grade/ Ovarian serous low–grade carcinoma (р)T3bN0M0 |
Сохранение матки, удаление яичников, хирургическое стадирование/ Uterine preservation, salpingo– oophorectomy, surgical staging |
4 |
4 |
1 |
– |
1/0 |
|
|
6 |
20 |
С56 |
Герминогенная опухоль яичника – 100 % опухоль желточного мешка/ Germ cell tumor of the ovary – 100 % yolk sac tumor (р)T3cN0M0) |
Сохранение матки, удаление яичников, хирургическое стадирование/ Uterine preservation, salpingo– oophorectomy, surgical staging |
11 |
8 |
3 |
– |
3/0 |
|
|
7 |
16 |
С56 |
Герминогенная опухоль яичника – 100 % опухоль желточного мешка/ Germ cell tumor of the ovary – 100 % yolk sac tumor (p)T1c2N0M0 |
Сальпингоовариоэктомия слева, резекция правого яичника, сохранение матки; хирургическое стадирование/ Salpingooophorectomy on the left, resection of the right ovary, uterine preservation, surgical staging |
32 |
18 |
10 |
– |
10/0 |
|
|
8 |
37 |
С56 |
Серозная карцинома яичника high grade/ Ovarian serous high–grade carcinoma (р)T1с1N1M0 BRCA1(+) |
Радикальный хирургический объем/ Radical surgical treatment |
6 |
3 |
0 |
– |
0/0 |
Окончание таблицы /End of Table
Примечание: таблица составлена авторами.
Note: created by the authors.
из них у 5 удалены яичники с двух сторон, четырем выполнялось хирургическое лечение с высоким риском критического снижения овариального резерва; 3 пациентки со злокачественной опухолью шейки матки, которым выполнена радикальная операция с удалением яичников из-за риска метастатического поражения; 1 пациентка с умереннодифференцированной эндометриоидной аденокарциномой эндометрия, когда сохранение матки невозможно, но был сохранен один яичник с целью профилактики преждевременной менопаузы; 1 пациентка с метастазом в яичники рака поперечно-ободочной кишки, которая была высоко заинтересована в попытке сохранения биологического материала.
Во всех клинических случаях было принято решение об удалении или резекции яичников, что приводило либо к кастрации, либо к значимому снижению овариального резерва. Лечащим врачом пациентки направлялись на консультацию к онко-репродуктологу, где обсуждалась индивидуальная тактика сохранения фертильности и принималось решение о реализации метода. В большинстве случаев метод OTO-IVM был единственно доступным методом получения биологического материала или дополнительным методом сохранения фертильности, обеспечивающим криоконсервацию ооцитов или эмбрионов.
Яичники получали при овариоэктомии во время хирургического лечения в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова». Извлеченный яичник помещали в стерильный контейнер со средой, содержащей HEPES буфер и нагретой до 37 °С (Flashing Medium, Origio). Контейнер размещали в транспортном боксе, поддерживающем температуру 37 °С. Транспортировка осуществлялась в максимально короткие сроки и занимала от 45 до 75 мин. Получение ооцитов и их дальнейшее культивирование проводились в эмбриологической лаборатории клиники репродукции «Скайферт».
При выделении ооцит-кумулюсных комплексов все манипуляции проводили в среде, содержащей HEPES и нагретой до 37 °С (Flashing Medium, Origio) в ламинарном шкафу на нагреваемой поверхности. Яичник перемещали в чашку Петри диаметром 100 мм, осматривали на наличие антральных фолликулов (рис. 1)
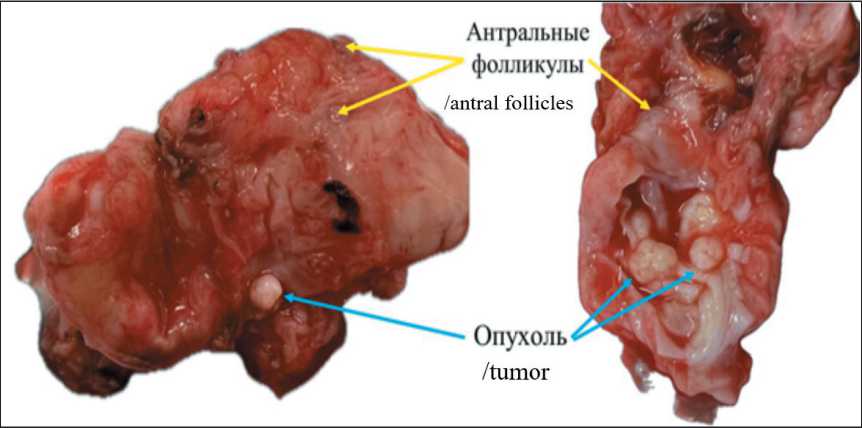
Рис. 1. Яичник, пораженный серозной пограничной опухолью, с выходом на поверхность капсулы. Примечания: желтыми стрелками отмечены антральные фолликулы, синими стрелками – опухоль; фотография с подписями выполнена авторами Fig. 1. Ovarian serous borderline tumor with access to the surface of the capsule
Notes: yellow arrows indicate antral follicles, blue arrows indicate tumor; created by the authors
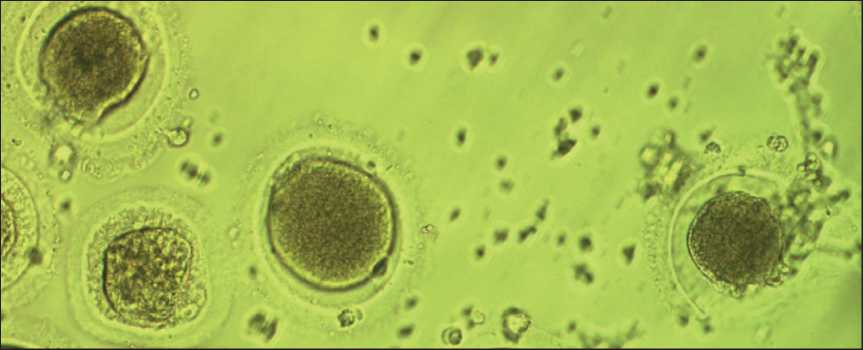
Рис. 2. Микрофото. Ооциты в процессе деградации (инвертированный микроскоп, ×200). Примечание: микрофото выполнено авторами
Fig. 2. Microphoto. Oocytes in the process of degradation (inverted microscope at ×200 magnification). Note: created by the authors
Наличие фолликулов в пораженном опухолью яичнике определяется степенью распространения опухоли в структурах яичника. Все видимые фолликулы пунктировали иглой 19G с помощью шприца объемом 2 мл. Полученную фолликулярную жидкость выпускали в чашку Петри диаметром 35 мм со средой Flashing Medium, Origio, нагретой до 37 °С. Чашку с фолликулярной жидкостью просматривали под бинокулярной лупой, обнаруженные ооцит-кумулюсные комплексы (ОКК) извлекали капилляром (диаметр 300 мкм), переносили в подготовленную заранее чашку со средой для культивирования под маслом (GTL, Mineral oil, Vitrolife), чашку помещали в трехгазовый планшетный инкубатор (PLANER, Origio). После аспирации всех видимых фолликулов яичник разрезали на две половины, каждую из них переносили в отдельную чашку со средой. Далее проводили продольные надрезы стерильным лезвием, ткань промывали последовательно в нескольких чашках со средой, после чего каждую чашку просматривали на наличие ОКК, при обнаружении их извлекали, как описано выше. По завершении ткань яичника помещали в стерильный контейнер с раствором формалина и возвращали в НМИЦ онкологии им. Н.Н. Петрова для гистологического исследования.
Собранные ооцит-кумулюсные комплексы оценивали под инвертированным микроскопом при ×200. Фиксировали общее количество и число деградированных ооцитов (если таковые присутствовали) в протоколе культивирования. К деградированным относили ооциты в процессе атрезии, с фрагментированной цитоплазмой, а также пустые зоны пеллюцида без цитоплазмы. Такие ооциты не использовали для дальнейшего культивирования (рис. 2)
Остальные ОКК переносили в среду IVM (In Vitro Maturation Media Kit, Sage), предварительно инкубированную под маслом при 37 °С в течение 4–8 ч в трехгазовом инкубаторе (PLANER, Origio). Для культивирования использовали 4-луночные планшеты (Nunc). В среду предварительно добавляли гормоны – ФСГ 0,75М Е/мл и ЛГ 0,75 МЕ/мл в соответствии с прилагаемым к набору сред протоколом. ОКК разделяли на 4 лунки планшета, не более 10 в одной лунке. Культивирование проводили также в трехгазовом инкубаторе (PLANER, Origio). Осмотр ОКК проводили через 30 ч культивирования под инвертированным микроскопом при ×200. При обнаружении ооцитов на стадии метафазы II (наличие полярного тельца) ооциты извлекали из лунки капилляром (диаметр 175–200 мкм), переносили в подготовленную заранее чашку со средой для культивирования под маслом (GTL, Mineral oil, Vitrolife), где пипетировали капилляром 150 мкм для удаления остатков кумулюсных клеток с ооцита. Зрелые ооциты использовали в программах сохранения фертильности (пункт 4). Остальные ОКК продолжали инкубировать еще 18 ч (общее время инкубации 48 ч). По истечении этого
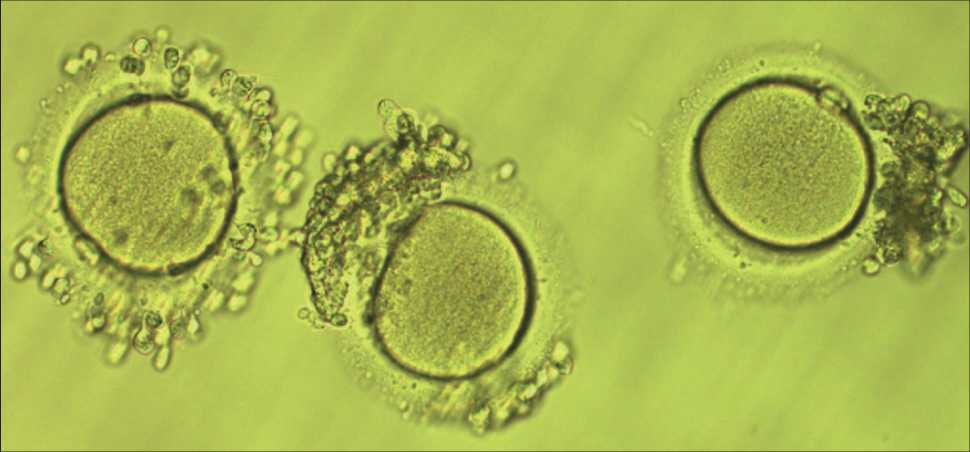
Рис. 3. Микрофото. Ооциты метафаза II, с остатками экспандированного кумулюса (после дозревания), пригодные для криоконсервации или оплодотворения (инвертированный микроскоп, ×200). Примечание: микрофото выполнено авторами Fig. 3. Microphoto. Metaphase II oocytes, with remnants of expanded cumulus (after maturation), suitable for cryopreservation or fertilization (inverted microscope at ×200 magnification). Note: created by the authors времени все ОКК переносили в чашку со средой для культивирования под маслом (GTL, Mineral oil, Vitrolife), где пипетировали капилляром 150 мкм для удаления остатков кумулюсных клеток. Ооциты оценивали под инвертированным микроскопом при 200-кратном увеличении, фиксировали стадию развития ооцита в протоколе культивирования: М2 (метафаза II, зрелый ооцит), М1 (метафаза I), GV (зародышевый пузырек) или деградация.
В зависимости от семейного статуса и желания пациенток ооциты (рис. 3) либо криокон-сервировали методом витрификации (набор для витрификации ооцитов и эмбрионов Kitazato), либо оплодотворяли спермой партнера (донора спермы) методом ИКСИ независимо от параметров спермограммы, поскольку ооциты после дозревания не имеют достаточно кумулюсных клеток, необходимых для связывания сперматозоидов. Эмбрионы культивировали в одношаговой среде (GTL, Vitrolife) в планшетном трехгазовом инкубаторе (PLANER, Origio) до стадии бластоцисты (5 или 6 дня развития), а затем криоконсервировали методом витрификации (набор для витрификации ооцитов и эмбрионов Kitazato).
При статистической обработке материала использовались методы описательной статистики. Качественные данные указывались при помощи абсолютных и относительных (доля от общего числа объектов в %) значений. В связи с небольшим размером выборки и отсутствием задачи оценки статистического вывода методы аналитической статистики не применялись (95 % доверительный интервал, разница пропорций, оценка гипотез и т.д.).
Результаты
В результате реализации метода OTO-IVM у 13 из 15 пациенток был криоконсервирован биологический материал: 5 эмбрионов и 45 ооцитов. Всего было извлечено 218 ОКК, из них ооцитов с деградацией – 65 (29,8 %), ОКК, пригодных для дозревания, – 153 (70,2 %). Через 36 или 48 ч у 13 пациенток дозрели 65 ооцитов, что составило 42,5 % от ооцитов без признаков деградации.
У 11 пациенток, включенных в исследование, извлечение ОКК было выполнено из пораженного опухолью яичника. Получено 149 ооцитов, из них ооцитов с признаками деградации – 50 (33,6 %). Остальные 99 (66,4 %) ОКК были удовлетворительного качества, после проведения дозревания стадии метафазы II достигли 49 (49,5 %) ооцитов.
Оплодотворены спермой половых партнеров 20 ооцитов трех пациенток. Было получено 14 зигот, частота оплодотворения составила 70 %. После культивации получено и криоконсервировано 5 эмбрионов хорошего качества, что составило 35,7 % от общего количества зигот.
На рис. 4 представлены яичники пациентки 24 лет с диагнозом: Пограничные серозные опухоли яичников с фокусами микропапиллярного строения IB стадии (рT1bN0M0)) с двусторонним поражением пограничной опухолью, подлежащие OTO-IVM. Выполнено хирургическое вмешательство в объеме: лапаротомия, двусторонняя резекция яичников, резекция большого сальника, мультифокальная биопсия брюшины. В результате OTO-IVM извлечено 16 ооцитов, 10 ооцитов без признаков деградации, 5 криоконсервировано.
У двух пациенток, 34 и 33 лет, с HPV-ассоциированной инвазивной аденокарциномой шейки матки перед госпитализацией для радикальной операции была проведена стимуляция овуляции и криоконсервировано 12 и 9 зрелых ооцитов. Из-за достоверно не известных рисков транзиторной гиперэстрогении в обоих случаях на протяжении всего курса введения гонадотропинов назначался с профилактической целью прием ингибитора ароматазы (Летрозол, в суточной дозировке 5 мг). Ввиду высокой заинтересованности пациенток в сохранении фертильности, с целью повышения шансов на репродуктивную реализацию выполнен интраоперационный забор удаленных яичников для OTO-IVM. Из яичников удалось извлечь 8 и 7 (n=15) ооцитов соответственно, из которых 5 были деградированными, а 10 подлежали дозреванию, криоконсервировать удалось 5 и 2 ооцита соответственно. Пациентки были проинформированы
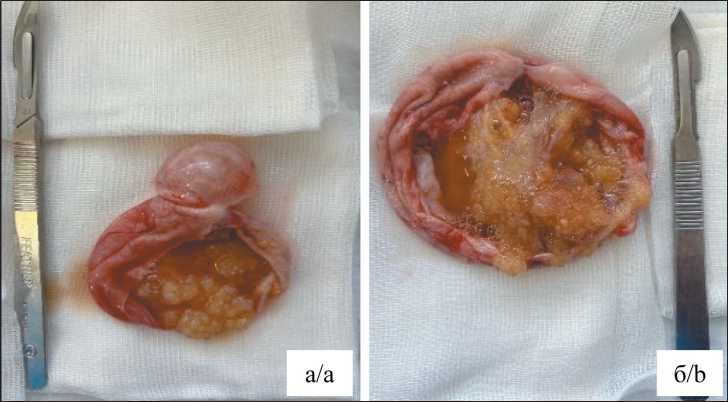
Рис. 4. Удаленные яичники, пораженные пограничной опухолью: a – образование правого яичника, размерами 61×51×90 мм;
б – образование левого яичника, размерами 100×77×96 мм. Примечание: фотографии выполнены авторами
Fig.4. Borderline ovarian tumor (original drawing): a – the right ovary 61×51×90 mm; b – the left ovary 100×77×96 mm. Note: created by the authors
и понимали, что репродуктивная реализация возможна только после достижения стойкой ремиссии с помощью услуг суррогатного материнства.
Из 15 онкологических больных в 9 (60 %) клинических случаях успешно реализовано применение OTO-IVM как единственно возможного метода сохранения фертильности; в 4 (26,7 %) случаях, когда выполнялись различные варианты органосохраняющего хирургического лечения с сохранением части или целого яичника, метод OTO-IVM использовался как дополнительный метод сохранения фертильности, с целью криоконсервации репродуктивных клеток, как подстраховка в случае критического послеоперационного снижения овариального резерва или интраоперационной смены плана хирургического вмешательства на радикальный объем; в 2 случаях метод дополнил криконсервацию ооцитов, полученных в результате стимуляции овуляции, тем самым повысив шансы на получение хорошего эмбриона и достижение беременности.
В исследование были включены 3 пациентки старшего репродуктивного возраста ввиду их крайней заинтересованности в попытке получить биологический материал, которые расценивали этот метод как единственную доступную возможность сохранения фертильности. У 2 из них не удалось получить материал, пригодный для криоконсервации: в одном случае, у пациентки 38 лет, причиной неудачи послужило интраоперационное коагуляционное повреждение ткани при удалении части яичника, фолликулы в представленной ткани отсутствовали; во втором случае, у пациентки 37 лет с наличием BRCA1-мутации, извлечено 6 ооцитов, 3 были подвергнуты дозреванию, но пригодных для криоконсервации ооцитов не получено. Для одной из пациенток неудача реализации метода определила принятие факта необходимости использования донорских ооцитов, в результате чего родился здоровый мальчик. Одна пациентка с распространенным раком поперечно-ободочной кишки погибла из-за прогрессирования основного заболевания.
Обсуждение
При наличии опухолевого поражения яичника OTO-IVM может являться единственным доступным методом для сохранения фертильности, поскольку стимуляция яичников, трансвагинальная пункция фолликулов или аутотрансплантация ткани криоконсервированного ранее яичника противопоказаны из-за риска контаминации опухолевыми клетками. Метод OTO-IVM следует включать в стратегию неотложной репродуктивной помощи у женщин при наличии противопоказаний к стимуляции яичников.
Обсуждение ценности OTO-IVM как альтернативного метода сохранения фертильности осуществлялось на заседании конференции Европейского общества репродукции человека и эмбриологии (ESHRE – European Society of Human Reproduction and Embryology) в 2021 г., где возраст и показатели овариального резерва могут являться предикторами эффективности, аналогично другим вариантам сохранения фертильности. Предложены критерии отбора пациенток: возраст ≤38 лет и уровень анти-мюллерова гормона ≥0,5 нг/мл [38]. Из 3 пациенток старшего репродуктивного возраста, включенных в исследование, у двух материал для криоконсервации не получен. Но это был единственно доступный метод сохранения фертильности, в реализации которого они были заинтересованы.
В нашем исследовании процент извлечения ооцитов, пригодных для дозревания, – 70,2 % в общей группе, куда включены 4 случая OTO-IVM при не поврежденных опухолью яичниках и 11 случаев при поврежденных опухолью яичниках. В группе пациенток с пораженным опухолью яичником количество извлеченных недеградированных ооцитов составило 66,4 %, при этом процент дозревания ооцитов был несколько выше, чем в общей группе, – 49,2 vs 42,5 %. По всей видимости, наличие опухоли несколько снижает количество удовлетворительного качества ооцитов и процент деградированных половых клеток в данном случае выше (33,6 vs 29,8 %), но не оказывает влияния на способность к дозреванию и оплодотворению. Несомненно, для более весомых заключений требуется набор большего количества пациентов в исследование.
В литературе представлены противоречивые результаты исследований, посвященных влиянию температурного режима и времени транспортировки ткани яичника на показатели успешности, обсуждается совершенствование методов извлечения и дозревания ооцитов. Во многом результативность криоконсервации биологического материала определяется уровнем квалификации лабораторного персонала, являясь достаточно трудоемким, требует хорошего оснащения и высокого качества профессионального взаимодействия репродуктивных и онкологических клиник.
Список литературы OТО-IVM - метод сохранения фертильности пациенткам с опухолевым поражением яичников
- Nierengarten M.B. Annual report to the nation on the status of cancer. Cancer. 2023; 129(1): 8. https://doi.org/10.1002/cncr.34586.
- Burgers V.W.G., van der Graaf W.T.A., van der Meer D.J., Mc Cabe M.G., Rijneveld A.W., van den Bent M.J., Husson O. Adolescents and Young Adults Living With an Uncertain or Poor Cancer Prognosis: The “New” Lost Tribe. J Natl Compr Canc Netw. 2021; 19(3): 240-6. https://doi.org/10.6004/jnccn.2020.7696.
- Close A.G., Dreyzin A., Miller K.D., Seynnaeve B.K.N., Rapkin L.B. Adolescent and young adult oncology-past, present, and future. CA Cancer J Clin. 2019; 69(6): 485-96. https://doi.org/10.3322/caac.21585.
- Smith A.W., Seibel N.L., Lewis D.R., Albritton K.H., Blair D.F., Blanke C.D., Bleyer W.A., Freyer D.R., Geiger A.M., Hayes-Lattin B., Tricoli J.V., Wagner L.I., Zebrack B.J. Next steps for adolescent and young adult oncology workshop: An update on progress and recommendations for the future. Cancer. 2016; 122(7): 988-99. https://doi.org/10.1002/cncr.29870.
- Beckjord E.B., Reynolds K.A., van Londen G.J., Burns R., Singh R., Arvey S.R., Nutt S.A., Rechis R. Population-level trends in posttreatment cancer survivors’ concerns and associated receipt of care: results from the 2006 and 2010 LIVESTRONG surveys. J Psychosoc Oncol. 2014; 32(2): 125-51. https://doi.org/10.1080/07347332.2013.874004.
- van der Meer D.J., Karim-Kos H.E., van der Mark M., Aben K.K.H., Bijlsma R.M., Rijneveld A.W., van der Graaf W.T.A., Husson O. Incidence, Survival, and Mortality Trends of Cancers Diagnosed in Adolescents and Young Adults (15-39 Years): A Population-Based Study in The Netherlands 1990-2016. Cancers (Basel). 2020; 12(11). https://doi.org/10.3390/cancers12113421.
- Janssen S.H.M., van der Graaf W.T.A., van der Meer D.J., MantenHorst E., Husson O. Adolescent and Young Adult (AYA) Cancer Survivorship Practices: An Overview. Cancers (Basel). 2021; 13(19). https://doi.org/10.3390/cancers13194847.
- You L., Lv Z., Li C., Ye W., Zhou Y., Jin J., Han Q. Worldwide cancer statistics of adolescents and young adults in 2019: a systematic analysis of the Global Burden of Disease Study 2019. ESMO Open. 2021; 6(5). https://doi.org/10.1016/j.esmoop.2021.100255.
- Geue K., Richter D., Schmidt R., Sender A., Siedentopf F., Brähler E., Stöbel-Richter Y. The desire for children and fertility issues among young German cancer survivors. J Adolesc Health. 2014; 54(5): 527-35. https://doi.org/10.1016/j.jadohealth.2013.10.005.
- Jayasinghe Y.L., Wallace W.H.B., Anderson R.A. Ovarian function, fertility and reproductive lifespan in cancer patients. Expert Rev Endocrinol Metab. 2018; 13(3): 125-36. https://doi.org/10.1080/17446651.2018.1455498.
- Xie J., Sun Q., Duan Y., Cheng Q., Luo X., Zhou Y., Liu X., Xiao P., Cheng A.S.K. Reproductive concerns among adolescent and young adult cancer survivors: A scoping review of current research situations. Cancer Med. 2022; 11(18): 3508-17. https://doi.org/10.1002/cam4.4708.
- Gorman J.R., Su H.I., Roberts S.C., Dominick S.A., Malcarne V.L. Experiencing reproductive concerns as a female cancer survivor is associated with depression. Cancer. 2015; 121(6): 935-42. https://doi.org/10.1002/cncr.29133.
- Dong Y., Yue Z., Zhuang H., Zhang C., Fang Y., Jiang G. The experiences of reproductive concerns in cancer survivors: A systematic review and meta-synthesis of qualitative studies. Cancer Med. 2023; 12(24): 22224-51. https://doi.org/10.1002/cam4.6531.
- Carr A.L., Roberts, S., Bonnell L.N., Kolva E. Existential distress and meaning making among female breast cancer patients with cancerrelated fertility concerns. Palliative and Supportive Care. 2023; 21(2): 196-204. https://doi.org/10.1017/S1478951522001675.
- Benedict C., Thom B., Friedman D.N., Diotallevi D., Pottenger E.M., Raghunathan N.J., Kelvin J.F. Young adult female cancer survivors’ unmet information needs and reproductive concerns contribute to decisional conflict regarding posttreatment fertility preservation. Cancer. 2016; 122(13): 2101-9. https://doi.org/10.1002/cncr.29917.
- Bártolo A., Neves M., Carvalho B., Reis S., Valério E., Santos I.M., Monteiro S. Fertility under uncertainty: exploring differences in fertilityrelated concerns and psychosocial aspects between breast cancer survivors and non-cancer infertile women. Breast Cancer. 2020; 27(6): 1177-86. https://doi.org/10.1007/s12282-020-01124-w.
- Kim S., Kim S.W., Han S.J., Lee S., Park H.T., Song J.Y., Kim T. Molecular Mechanism and Prevention Strategy of Chemotherapy- and Radiotherapy-Induced Ovarian Damage. Int J Mol Sci. 2021; 22(14). https://doi.org/10.3390/ijms22147484.
- Canlorbe G., Chabbert-Buffet N., Uzan C. Fertility-Sparing Surgery for Ovarian Cancer. J Clin Med. 2021; 10(18). https://doi.org/10.3390/jcm10184235.
- National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines) Ovarian Cancer Including Fallopian Tube Cancer and Primary Peritoneal Cancer Version 2.2019 NCCN Guidelines for Patients. National Comprehensive Cancer Network; Washington, DC, USA: 2019.
- Ray-Coquard I., Morice P., Lorusso D., Prat J., Oaknin A., Pautier P., Colombo N.; ESMO Guidelines Committee. Non-epithelial ovarian cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2018; 29(s4): 1-18. https://doi.org/10.1093/annonc/mdy001.
- Bourdel N., Huchon C., Abdel Wahab C., Azaïs H., Bendifallah S., Bolze P.A., Brun J.L., Canlorbe G., Chauvet P., Chereau E., Courbiere B., De La Motte Rouge T., Devouassoux-Shisheboran M., Eymerit-Morin C., Fauvet R., Gauroy E., Gauthier T., Grynberg M., Koskas M., Larouzee E., Lecointre L., Levêque J., Margueritte F., D’argent Mathieu E., NyangohTimoh K., Ouldamer L., Raad J., Raimond E., Ramanah R., Rolland L., Rousset P., Rousset-Jablonski C., Thomassin-Naggara I., Uzan C., Zilliox M., Daraï E. Borderline ovarian tumors: French guidelines from the CNGOF. Part 2. Surgical management, follow-up, hormone replacement therapy, fertility management and preservation. J Gynecol Obstet Hum Reprod. 2021; 50(1). https://doi.org/10.1016/j.jogoh.2020.101966.
- Lambertini M., Peccatori F.A., Demeestere I., Amant F., Wyns C., Stukenborg J.B., Paluch-Shimon S., Halaska M.J., Uzan C., Meissner J., von Wolff M., Anderson R.A., Jordan K.; ESMO Guidelines Committee. Fertility preservation and post-treatment pregnancies in post-pubertal cancer patients: ESMO Clinical Practice Guidelines†. Ann Oncol. 2020; 31(12): 1664-78. https://doi.org/10.1016/j.annonc.2020.09.006.
- Practice Committee of the American Society for Reproductive Medicine. Electronic address: asrm@asrm.org. Fertility preservation in patients undergoing gonadotoxic therapy or gonadectomy: a committee opinion. Fertil Steril. 2019; 112(6): 1022-33. https://doi.org/10.1016/j.fertnstert.2019.09.013.
- Martinez F.; International Society for Fertility Preservation-ESHRE-ASRM Expert Working Group. Update on fertility preservation from the Barcelona International Society for Fertility Preservation-ESHRE-ASRM 2015 expert meeting: indications, results and future perspectives. Fertil Steril. 2017; 108(3): 407-15. https://doi.org/10.1016/j.fertnstert.2017.05.024.
- Zinov'eva O.V., Lavrinovich O.E., Karitskii A.P., Kotiv Kh.B. Pravovye aspekty sokhraneniya fertil'nosti onkologicheskikh bol'nykh. SPb., 2022. 56 s.
- Di Tucci C., Galati G., Mattei G., Chinè A., Fracassi A., Muzii L. Fertility after Cancer: Risks and Successes. Cancers (Basel). 2022; 14(10): 2500. https://doi.org/10.3390/cancers14102500.
- ESHRE Guideline Group on Female Fertility Preservation; Anderson R.A., Amant F., Braat D., D’Angelo A., Chuva de Sousa Lopes S.M., Demeestere I., Dwek S., Frith L., Lambertini M., Maslin C., Moura-Ramos M., Nogueira D., Rodriguez-Wallberg K., Vermeulen N. ESHRE guideline: female fertility preservation. Hum Reprod Open. 2020. https://doi.org/10.1093/hropen/hoaa052.
- Walls M.L., Douglas K., Ryan J.P., Tan J., Hart R. In-vitro maturation and cryopreservation of oocytes at the time of oophorectomy. Gynecol Oncol Rep. 2015; 13: 79-81. https://doi.org/10.1016/j.gore.2015.07.007.
- Segers I., Bardhi E., Mateizel I., Van Moer E., Schots R., Verheyen G., Tournaye H., De Vos M. Live births following fertility preservation using in-vitro maturation of ovarian tissue oocytes. Hum Reprod. 2020; 35(9): 2026-36. https://doi.org/10.1093/humrep/deaa175.
- Kedem A., Yerushalmi G.M., Brengauz M., Raanani H., Orvieto R., Hourvitz A., Meirow D. Outcome of immature oocytes collection of 119 cancer patients during ovarian tissue harvesting for fertility preservation. J Assist Reprod Genet. 2018; 35(5): 851-6. https://doi.org/10.1007/s10815-018-1153-1.
- Park C.W., Lee S.H., Yang K.M., Lee I.H., Lim K.T., Lee K.H., Kim T.J. Cryopreservation of in vitro matured oocytes after ex vivo oocyte retrieval from gynecologic cancer patients undergoing radical surgery. Clin Exp Reprod Med. 2016; 43(2): 119-25. https://doi.org/10.5653/cerm.2016.43.2.119.
- De Roo C., Tilleman K. In Vitro Maturation of Oocytes Retrieved from Ovarian Tissue: Outcomes from Current Approaches and Future Perspectives. J Clin Med. 2021; 10(20). https://doi.org/10.3390/jcm10204680.
- von Wolff M., Sänger N., Liebenthron J. Is Ovarian Tissue Cryopreservation and Transplantation Still Experimental? It Is a Matter of Female Age and Type of Cancer. J Clin Oncol. 2018; 36(33). https://doi.org/10.1200/JCO.18.00425.
- Bunyaeva E.S., Kirillova A.O., Nazarenko T.A., Dzhanashvili L.G., Gadzhimagomedova K.K., Khabas G.N., Biryukova A.M., Gavisova A.A. Pokazaniya i effektivnost' tekhnologii polucheniya nezrelykh ootsit-kumulyusnykh kompleksov iz tkani yaichnika s posleduyushchim ikh dozrevaniem in vitro. Akusherstvo i ginekologiya. 2022; (6): 75-82. https://doi.org/10.18565/aig.2022.6.75-82.
- Zenzes M.T., Bielecki R., Casper R.F., Leibo S.P. Effects of chilling to 0 degrees C on the morphology of meiotic spindles in human metaphase II oocytes. Fertil Steril. 2001; 75(4): 769-77. https://doi.org/10.1016/s0015-0282- (00)01800-8.
- Wang W.H., Meng L., Hackett R.J., Odenbourg R., Keefe D.L. Limited recovery of meiotic spindles in living human oocytes after coolingrewarming observed using polarized light microscopy. Hum Reprod. 2001; 16(11): 2374-8. https://doi.org/10.1093/humrep/16.11.2374.
- Prasath E.B., Chan M.L., Wong W.H., Lim C.J., Tharmalingam M.D., Hendricks M., Loh S.F., Chia Y.N. First pregnancy and live birth resulting from cryopreserved embryos obtained from in vitro matured oocytes after oophorectomy in an ovarian cancer patient. Hum Reprod. 2014; 29(2): 276-8. https://doi.org/10.1093/humrep/det420.
- Bourg M., Moreau J., Carles M., Cadoret F., Lesourd F., Tournier A., Léandri R.D., Gatimel N. Is in vitro maturation of oocytes retrieved ex vivo from ovarian tissue an effective fertility preservation technique in the presence of organic ovarian cysts? Eur J Obstet Gynecol Reprod Biol. 2023; 281: 87-91. https://doi.org/10.1016/j.ejogrb.2022.12.025.
- Massarotti C., Kohlhepp F., Liperis G., Ammar O.F., Mincheva M.N., Ali Z.E., Amorim C.A., Anderson R., Fraire-Zamora J.J. #ESHREjc report: Is OTO-IVM the future fertility preservation alternative for urgent cancer patients? Hum Reprod. 2021; 36(9): 2631-3. https://doi.org/10.1093/humrep/deab180.


