Отсутствие взаимодействия тамоксифена с ASP351 и PHE404 эстрогенового рецептора может приводить к раку эндометрия
Автор: Шкиль Д.О., Алашеев А.Ю., Асаинов Д.Т., Петерсен Е.В., Максимов Ф.Е.
Журнал: Труды Московского физико-технического института @trudy-mipt
Рубрика: Информатика и управление
Статья в выпуске: 4 (64) т.16, 2024 года.
Бесплатный доступ
Рак молочной железы остается наиболее распространенным видом рака среди женщин, и в значительном числе случаев его прогрессирование обусловлено влиянием эстрогеновых рецепторов. Тамоксифен, являясь селективным модулятором эстрогеновых рецепторов, широко используется в адъювантной терапии, особенно у женщин в пременопаузе. Однако его применение связано с повышенным риском рака эндометрия, что ограничивает его применение. В этом исследовании были проведены молекулярные динамические моделирования комплексов тамоксифена и ралоксифена с эстрогеновым рецептором альфа. Анализ был сосредоточен на взаимодействиях с критическими аминокислотными остатками в активном центре рецептора. Результаты показывают, что ослабленное связывание тамоксифена с этими остатками может лежать в основе его связи с ER-зависимым раком эндометрия.
Рак груди, эстрогеновый рецептор, тамоксифен, рак эндометрия, молекулярная динамика
Короткий адрес: https://sciup.org/142243839
IDR: 142243839 | УДК: 577.32,
Текст научной статьи Отсутствие взаимодействия тамоксифена с ASP351 и PHE404 эстрогенового рецептора может приводить к раку эндометрия
Рак молочной железы — наиболее распространённое онкологическое заболевание среди женщин в мире и второе по частоте среди всех видов рака, включая мужчин. Это также ведущая причина смертности от рака среди женщин [1]. Примерно 70-80% случаев рака молочной железы связаны с положительным статусом гормональных рецепторов [2], таких
-
(с) Шкиль Д. О., Алашеев А.Ю., Асаинов Д. Т., Петерсен Е.В., Максимов Ф.Е., 2024
-
(с) Федеральное государственное автономное образовательное учреждение высшего образования «Московский физико-технический институт (пациопальпый исследовательский университет)», 2024
-
2. Результаты и обсуждение
как рецепторы эстрогена и прогестерона, которые стимулируют рост опухолевых клеток под воздействием стероидных гормонов [3]. Адъювантная антигормональная терапия гормонозависимого рака молочной железы включает три подхода: блокаду эстрогеновых рецепторов с использованием избирательных модуляторов рецепторов эстрогена (например, тамоксифена или торемифена); деградацию рецепторов через препараты, такие как фул-вестрант или элацестрант; и ингибирование синтеза эстрогенов при помощи ингибиторов ароматазы, таких как анастрозол и летрозол [4] (рис. 1). У женщин в пременопаузе стандартом первой линии терапии является тамоксифен [5], в то время как в постменопаузе предпочтение отдают ингибиторам ароматазы [6]. Эти подходы имеют свои особенности. Тамоксифен, будучи избирательным модулятором эстрогеновых рецепторов, действует как антагонист в тканях груди, но стимулирует рецепторы в костях, эндометрии и других органах. У женщин в постменопаузе это может повышать риск развития рака эндометрия [7], поэтому он чаще используется у пациенток в пременопаузе [6]. Ингибиторы ароматазы, подавляя синтез эстрогенов, лишают раковые клетки стимула к росту, что приводит к их гибели. Однако дефицит эстрогенов может способствовать развитию остеопороза [9]. Тем не менее ингибиторы ароматазы доказали эффективность в снижении риска рецидива у женщин в постменопаузе [8]. Пациентки могли бы получить преимущество от костнозащитных свойств модуляторов рецепторов эстрогена, если бы такие препараты были безопасны для эндометрия [10]. Изучались альтернативные модуляторы с целью улучшения профиля безопасности. Ралоксифен снижает риск тромбоэмболий и катаракты по сравнению с тамоксифеном, обеспечивая аналогичное снижение риска инвазивного рака молочной железы у женщин в постменопаузе с высоким риском. Однако вероятность неинвазивного рака при этом несколько выше [11]. Также отмечено значительное снижение частоты рака эндометрия [11].
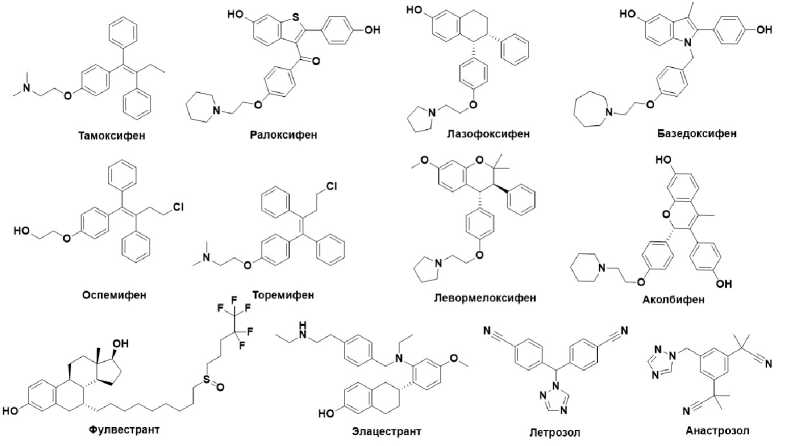
Рис. 1. Адъювантная антигормональная терапия гормопозависимого рака молочной железы
Лазофоксифен доказал эффективность в снижении риска переломов, сердечнососудистых заболеваний и рака молочной железы, но сопровождался повышенным риском тромбоэмболий [12]. Его влияние на эндометрий было сопоставимо с плацебо [12]. Базедоксифен имеет аналогичный профиль безопасности, снижая частоту остеопороза и рака молочной железы без увеличения риска рака эндометрия [13]. Оспемифен также безопасен для эндометрия у женщин в постменопаузе [14]. Торемифен, модифицированный аналог тамоксифена, применяется для лечения метастатического рака молочной железы (одобрен только в США), но, как и тамоксифен, увеличивает риск рака эндометрия [15]. Различия в профилях безопасности модуляторов, вероятно, связаны с их хи- мической структурой и особенностями взаимодействия с рецепторами в различных тканях. В рамках исследования выполнены молекулярно-динамические симуляции комплексов 4-гидрокситамоксифена (активный метаболит тамоксифена) и ралоксифена с рецептором эстрогена альфа. Целью работы было выявление возможных причин развития рака эндометрия путем анализа структурных особенностей этих молекул.
Для 4-гидрокситамоксифена характерен значительный вклад водородных связей с Glu353, а также заметное взаимодействие с Thr347 (рис. 2). Связывание с Asp351 присутствует, однако выражено слабо и имеет преимущественно ионный характер. Важно отметить существенный вклад гидрофобных взаимодействий с Phe404, Met388 и Leu525, что подчеркивает их роль в стабилизации комплекса.
Protein-Ligand Contacts
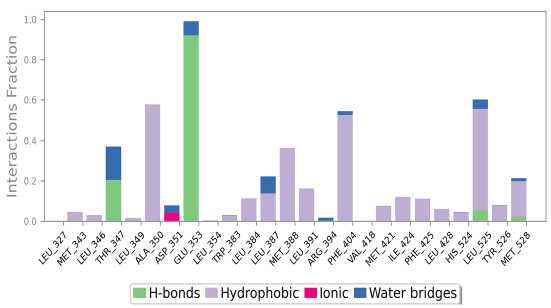
Рис. 2. Профиль белок-лигандного взаимодействия для эстрогенового рецептора и 4-гидрокситамоксифена (PDB ID:2JFD)
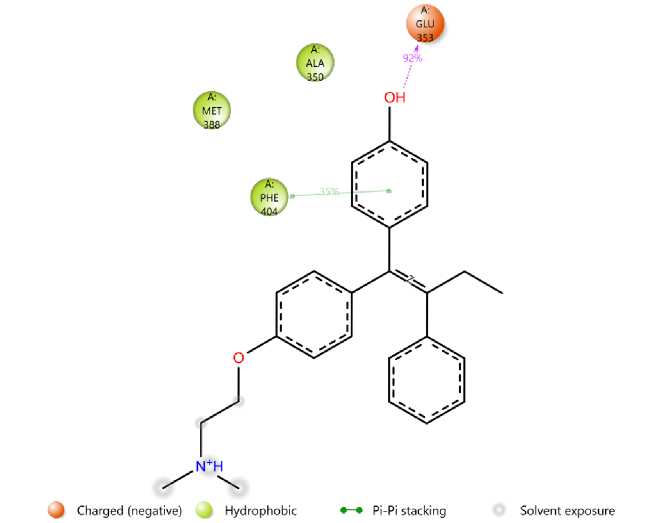
Рис. 3. Основное окружение 4-гидрокситамоксифена внутри эстрогенового рецептора
При анализе взаимодействий 4-гидрокситамоксифена с учетом только тех контактов, которые сохраняются в течение не менее 30% траектории, становится очевидным, что основными являются взаимодействия с Glu353 и Phe404 (рис. 3). Остаток Glu353 образует устойчивую водородную связь с гидроксильной группой тамоксифена, что способствует стабилизации лиганда в активном центре. Взаимодействие с Phe404 осуществляется за счет тг-тг стекинга между ароматическим кольцом Phe404 и одним из колец трифенилэтиле- нового ядра 4-гидрокситамоксифена, что играет ключевую ролв в обеспечении прочного и специфичного связывания. Аминогруппа 4-гидрокситамоксифена, находящаяся вблизи Asp351, по-видимому, не образует прочных контактов с этим остатком, что может быть связано с отсутствием благоприятных условий для устойчивого ионного взаимодействия.
Protein-Ligand Contacts
H-bonds Hydrophobic I Ionic I Water bridges I Halogen bonds
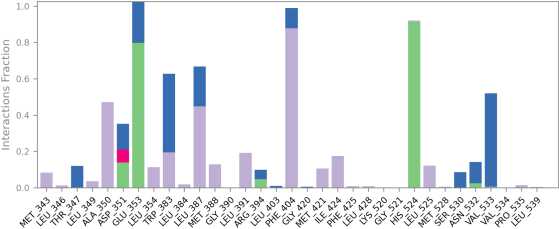
Рис. 4. Профиль белок-лигандного взаимодействия для эстрогенового рецептора и ралоксифена (PDB ID:7KBS)
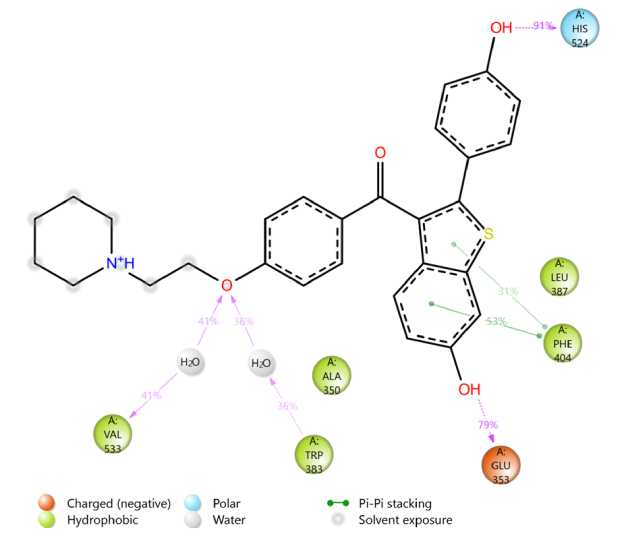
Рис. 5. Основное окружение ралоксифена внутри эстрогенового рецептора
Для ралоксифена, согласно полученным данным, основными взаимодействиями с белком являются водородные связи и гидрофобные взаимодействия (рис. 4). Остаток Glu353 формирует стабильную водородную связь с гидроксильной группой ралоксифена, что подчеркивает его важность в стабилизации комплекса. Значительный вклад также наблюдается со стороны His524, который формирует прочные водородные связи с молекулой лиганда, что способствует усилению связывания. Phe404 демонстрирует существенное гидрофобное взаимодействие с ароматической частью ралоксифена, что подтверждает его роль в стабилизации лиганда за счет я-я стекинга. В то же время остаток Asp351 демонстрирует устойчивую связь смешанного характера. Кроме того, важным вкладом являются водные мостики, которые наблюдаются для Leu387 и Phe404, что дополнительно стабилизирует структуру комплекса. Гидрофобные взаимодействия с остатками, такими как Leu525 и Met388, усиливают взаимодействие с гидрофобными частями ралоксифена. Таким образом, взаимодействия с Glu353, His524, Asp351 и Phe404 являются ключевыми для стабилизации комплекса ралоксифена с белком, дополняемыми гидрофобными контактами и водивши мостиками.
На рисунке 5 представлено окружение ралоксифена в комплексе с рецептором. Ключевыми взаимодействиями являются водородная связв с Glu353, образуемая гидроксильной группой ралоксифена, которая играет важнейшую роль в стабилизации лиганда в активном центре белка, и водородная связь с His524 — уникальный фармакофор ралоксифена, отсутствующий у 4-гидрокситамоксифена. Эта связь является одним из наиболее стабильных контактов, обеспечивающих дополнительную фиксацию лиганда. Гидрофобные взаимодействия с Phe404 и Leu387 значительно укрепляют комплекс за счет взаимодействий с ароматической системой ралоксифена, при этом тг-тг стекинг с Phe404 дополнительно усиливает эти гидрофобные взаимодействия, подчеркивая ключевую роль данного остатка.
Комплексы рецептор-лиганд были извлечены из базы данных белковых структур RCSB PDB и предварительно обработаны в соответствии со стандартными протоколами. Для подготовки систем к молекулярно-динамическому моделированию (МД) комплексы были сольватированы с использованием модуля System Builder программного пакета Desmond. Каждая система была помещена в прямоугольную периодическую ячейку, заполненную молекулами воды модели TIP3P, с границами, отстоящими на 12 А от ближайших атомов белка. Для воспроизведения физиологических условий и обеспечения нейтральности заряда системы были добавлены ионы натрия и хлорида до концентрации 0,145 М. Перед основным этапом моделирования производилась минимизация энергии и короткие релаксационные прогоны МД, чтобы устранить стерические столкновения и стабилизировать системы. Эти этапы проводились в соответствии с протоколами по умолчанию Desmond. Моделирование каждой системы проводилось в течение 50 наносекунд с шагом интегрирования 2 фемтосекунды. Координаты атомов сохранялись каждые 2 пикосекунды для последующего анализа траекторий.
Для ралоксифена и 4-гидрокситамоксифена ключевой контакт с Glu353 играет важнейшую роль в стабилизации комплекса. Однако у ралоксифена дополнительно наблюдается устойчивая связь с His524, которая также может усиливать антагонистический эффект. Пока не ясно, является ли эта связь отличительной чертой хемотипа ралоксифена или же она напрямую связана с антагонистической активностью. В случае Asp351 и Phe404 у 4-гидрокситамоксифена эти взаимодействия также присутствуют, но в слабой степени, в то время как у ралоксифена они значительно усилены. Это приводит нас к гипотезе, что недостаточная степень взаимодействия с Asp351 и Phe404 может быть связана с развитием рака эндометрия при использовании 4-гидрокситамоксифена. Таким образом, более детальное изучение механизма связывания и специфичности этих взаимодействий может пролить свет на различия в активности двух соединений. В дальнейшем планируется продолжить изучение селективных модуляторов эстрогеновых рецепторов с целью сбора статистики, чтобы оценить, насколько значимыми являются различия во взаимодействиях с ключевыми аминокислотными остатками, и их влияние на антагонистическую активность.
Работа выполнена при поддержке Минобрнауки РФ, проект № 1024081900029-8.
Список литературы Отсутствие взаимодействия тамоксифена с ASP351 и PHE404 эстрогенового рецептора может приводить к раку эндометрия
- WHO International Agency for Research on Cancer. https://gco.iarc.fr/en.
- Joe B.N. Clinical Features, Diagnosis, and Staging of Newly Diagnosed Breast Cancer. URL: https://www.uptodate.com/contents/clinical-features-diagnosis-and-stagingof-newly-diagnosed-breast-cancer.
- Anderson W.F., Chatterjee N., Ershler W.B., Brawley O.W. Estrogen Receptor Breast Cancer Phenotypes in the Surveillance, Epidemiology, and End Results Database // Breast Cancer Research and Treatment. 2002. V. 76. P. 27–36. DOI:10.1023/A:1020299707510.
- Trayes K.P., Cokenakes S.E.H. Breast Cancer Treatment // American Family Physician. 2021. V. 104. P. 171–178.
- Fisher B., Costantino J.P., Wickerham D.L., Cecchini R.S., Cronin W.M., Robidoux A., Bevers T.B., Kavanah M.T., Atkins J.N., Margolese R.G., et al. Tamoxifen for the Prevention of Breast Cancer: Current Status of the National Surgical Adjuvant Breast and Bowel Project P-1 Study // Journal of the National Cancer Institute. 2005. V. 97. P. 1652–1662. DOI:10.1093/jnci/dji372.
- Buzdar A.U., Hortobagyi G. Update on Endocrine Therapy for Breast Cancer // Clinical Cancer Research. 1998. V. 4. P. 527–534.
- Maximov P.Y., Lee T.M., Jordan V.C. The Discovery and Development of Selective Estrogen Receptor Modulators (SERMs) for Clinical Practice // Current Clinical Pharmacology. 2013. V. 8. P. 135–155. DOI:0.2174/1574884711308020006.
- Aromatase Inhibitors versus Tamoxifen in Early Breast Cancer: Patient-Level Meta-Analysis of the Randomised Trials. The Lancet // 2015. V. 386. P. 1341–1352. DOI:10.1016/S0140-6736(15)61074-1.
- Tseng O.L., Spinelli J.J., Gotay C.C., Ho W.Y., McBride M.L., Dawes M.G. Aromatase Inhibitors Are Associated with a Higher Fracture Risk than Tamoxifen: A Systematic Review and Meta-Analysis // Therapeutic Advances in Musculoskeletal Disease. 2018. V. 10. P. 71–90. DOI:10.1177/1759720X18759291.
- Jordan V.C. SERMs: Meeting the Promise of Multifunctional Medicines // Journal of the National Cancer Institute. 2007. V. 99. P. 350–356. DOI:10.1093/jnci/djk062.
- Vogel V.G. Effects of Tamoxifen vs Raloxifene on the Risk of Developing Invasive Breast Cancer and Other Disease Outcomes: The NSABP Study of Tamoxifen and Raloxifene (STAR) P-2 Trial // JAMA. 2006. V. 295. P. 2727. DOI:10.1001/jama.295.23.joc60074.
- Cummings S.R., Ensrud K., Delmas P.D., LaCroix A.Z., Vukicevic S., Reid D.M., Goldstein S., Sriram U., Lee A., Thompson J. [ et al.]. Lasofoxifene in Postmenopausal Women with Osteoporosis // New England Journal of Medicine. 2010. V. 362. P. 686–696. DOI:10.1056/NEJMoa0808692.
- Archer D.F., Pinkerton J.V., Utian W.H., Menegoci J.C., de Villiers T.J., Yuen C.K., Levine A.B., Chines A.A., Constantine G.D. Bazedoxifene, a Selective Estrogen Receptor Modulator // Menopause. 2009. V. 16. P. 1109–1115. DOI:10.1097/gme.0b013e3181a818db.
- Constantine G.D., Goldstein S.R., Archer D.F. Endometrial Safety of Ospemifene // Menopause. 2015. V. 22. P. 36–43. DOI:0.1097/GME.0000000000000275.
- Zhou W.-B., Ding Q., Chen L., Liu X.-A., Wang S. Toremifene Is an Effective and Safe Alternative to Tamoxifen in Adjuvant Endocrine Therapy for Breast Cancer: Results of Four Randomized Trials // Breast Cancer Research and Treatment. 2011. V. 128. P. 625–631. DOI:10.1007/s10549-011-1556-5.


