Овуляторная функция крыс в условиях блокады мелатониновых рецепторов
Автор: Жукова Оксана Валентиновна, Обухова Елена Сергеевна, Хижкин Евгений Александрович, Тышдык Маргарита Леонидовна, Виноградова Ирина Анатольевна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Физико-химическая биология
Статья в выпуске: 8 (153), 2015 года.
Бесплатный доступ
Исследована возрастная динамика эстральной функции самок крыс, находящихся с рождения в условиях стандартного освещения и получающих с пятимесячного возраста ежедневно 5 дней в неделю вместе с питьевой водой в ночное время блокатор мелатониновых рецепторов - лузиндол (N-Acetyl-2-benzyl-tryptamine) в концентрации 10 мг/л. В возрасте три, шесть, девять, двенадцать и пятнадцать месяцев у животных ежедневно в течение двух недель брали влагалищные мазки и проводили цитологическое исследование с оценкой длительности эстрального цикла и соотношения фаз овуляторного цикла. Рассчитывали относительное число коротких, средних и длинных циклов; процентное соотношение фаз эстрального цикла; относительное число животных с иррегулярными циклами. В результате зафиксировано уменьшение количества коротких и увеличение количества длинных эстральных циклов через один месяц применения лузиндола. Установлено, что в условиях блокады мелатониновых рецепторов наблюдалось появление преждевременных возрастных изменений эстральной функции у самок крыс: достоверное уменьшение количества регулярных циклов и появление иррегулярных эстральных циклов (с 6-месячного возраста); более раннее увеличение продолжительности овуляторного цикла (с 9-месячного возраста). По всей видимости, блокада мелатониновых рецепторов могла привести к усилению секреции гонадолиберинов и гонадотропинов, в результате чего активация роста и развития фолликулов в яичниках способствовала более длительному выделению эстрогенов и изменению фаз овуляторного цикла. Несмотря на различные механизмы развития недостаточности мелатонинергической системы - снижение выработки мелатонина (при воздействии постоянного освещения) или блокада мелатониновых рецепторов (при применении лузиндола) - эффекты действия на овуляторную функцию схожи. При фармакологической блокаде мелатониновых рецепторов не было зафиксировано ни одного животного с синдромом персистирующего эструса, что косвенно указывает на наличие безрецепторной гормональной регуляции мелатонина через систему половых гормонов.
Крысы, лузиндол, эстральный цикл
Короткий адрес: https://sciup.org/14751008
IDR: 14751008 | УДК: 612.4.018+577.345
Текст научной статьи Овуляторная функция крыс в условиях блокады мелатониновых рецепторов
Репродуктивная функция самок млекопитающих находится под контролем гипоталамуса, регуляторная деятельность которого осуществляется посредством гормона мелатонина [1]. Основной эффект мелатонина заключается в торможении секреции тропных гормонов передней доли гипофиза и в модифицирующем влиянии на нейросекреторную активность гипоталамуса. Независимо от того, активно животное днем или ночью, максимальный уровень мелатонина наблюдается всегда во время темновой фазы естественного или искусственно созданного цикла чередования дня и ночи [11].
Известно, что введение лузиндола – антагониста мелатониновых рецепторов МТ1 и МТ2 значительно ослабляет эффекты экзогенного и эндогенного мелатонина [14], [16], [17]. Исходя из этого представляется интересным изучение функционирования репродуктивной системы самок млекопитающих в условиях угнетения мелатониновых сигнальных механизмов.
Целью данного исследования явилось изучение эстрального цикла самок крыс в условиях блокады мелатониновых рецепторов лузиндолом.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования были проведены на 40 самках крыс Вистар собственной разводки, первоначально полученных из питомника лабораторных животных «Пущино» (научно-производственное подразделение Филиала Института биооргани-ческой химии им. академиков М. М. Шемякина и Ю. А. Овчинникова, Московская область). Животных содержали при температуре воздуха в помещении 22 ± 2 °С в клетках размером 40 × 60 × 20 см по 10 особей в каждой с обеспыленной подстилкой из древесной стружки. В помещении были соблюдены условия стандартного чередующегося режима освещения (12 ч. свет, 12 ч. темнота LD): люминесцентные лампы (освещенность 750 лк на уровне клеток) освещали помещение в течение 12 дневных часов, на ночь (12 ч.) свет отключали; окна в помещении отсутствовали.
Все крысы получали гранулированный корм (ГОСТ Р 50258-92 «Комбикорма полнорационные для лабораторных животных. Технические условия»: содержание протеина более 25 %, жиров 6–12 %, кальция и фосфора 1–1,4 %, лизина и метионина 0,7–1,5 %, микроэлементов и витаминов 3–4 %) и отстоянную водопроводную воду без ограничения.
Работа была выполнена с соблюдением международных принципов Хельсинкской декларации о гуманном отношении к животным, прин- ципов гуманности, изложенных в директиве Европейского Сообщества (2010/63/ЕU), «Био-этических правил проведения исследований на человеке и животных», «Правил проведения работ с использованием экспериментальных животных», «Санитарно-эпидемиологических требований к устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев)», «Руководства по лабораторным животным и альтернативным моделям в биомедицинских технологиях» [12], [13].
В пятимесячном возрасте самки крыс были рандомизированно (по весу) разделены на две группы. Животные первой группы (n = 20; LD + luz) получали ежедневно 5 дней в неделю с питьевой водой в ночное время с 20:00 до 08:00 лузиндол (N-Acetyl-2-benzyl-tryptamine) фирмы «Bachem AG» (Швейцария) в концентрации 10 мг/л. Поилки, в которых находился лузиндол, были изготовлены из темного непрозрачного полимерного материала. Свежий раствор препарата готовили ежедневно. Вторая группа (n = 20; LD) в ночное время получала питьевую воду в том же объеме и явилась контрольной.
В возрасте три, шесть, девять, двенадцать и пятнадцать месяцев у животных ежедневно в течение двух недель брали влагалищные мазки для изучения эстральной функции. У грызунов содержимое влагалища в зависимости от фазы овуляторного цикла имело различный состав, который можно определить при микроскопировании. Весь овуляторный цикл крысы делился на следующие стадии: 1) диэструс, или стадия покоя; 2) проэструс, или стадия подготовки к течке; 3) эструс, или стадия течки; 4) метаэструс, или стадия после течки. В соответствии с данными фазами изменялся состав содержимого влагалища. Мазки готовили по общепринятой методике из влагалищного содержимого, полученного утром в одно и то же время посредством введения во влагалище крыс ватного тампона. Свежеприготовленные мазки без фиксации и окраски изучали под бинокулярным микроскопом при увеличении в 70 раз (об. 10, ок. 7) с опущенным конденсором микроскопа. Результаты исследования вагинального содержимого фиксировали в журнале. Проводили оценку следующих параметров: длительность эстрального цикла; соотношение фаз овуляторного цикла; относительное число коротких, средних и длинных циклов; процентное соотношение фаз эстрального цикла; относительное число животных с иррегулярными циклами [9].
Статистическую обработку цифрового материала проводили с использованием общеприня- тых методов вариационной статистики в среде программы EXCEL. Достоверность результатов оценивали по непараметрическому U-критерию Уилкоксона – Манна – Уитни и методом χ2. Достоверно различающимися признавали значения при р < 0,01 и р < 0,05; при 0,05 < р < 0,1 различия между средними имели тенденцию к достоверности [8].
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ОБСУЖДЕНИЕ
В физиологических условиях к возрасту 15–18 месяцев у крыс появляются признаки старения репродуктивной системы: короткие эстральные циклы исчезают, преобладают длинные овуляторные циклы (более 7 дней), снижается количество регулярных циклов, появляются иррегулярные циклы [3], [7].
В ходе наших исследований установлено, что в контрольной группе короткие циклы сохранялись и в зрелом возрасте, хотя их количество с возрастом достоверно снижалось с 54 % в 6 месяцев до 12 % к 15-месячному возрасту, причем уже в возрасте одного года количество коротких эстральных циклов было достоверно меньше (p < 0,05). На втором году жизни у самок контроля преобладали циклы средней продолжительности (достоверное увеличение наблюдали также с 12-месячного возраста). В опытной группе установлена аналогичная закономерность, но при этом через месяц приема лузиндола доля коротких циклов достоверно уменьшилась по сравнению с группой контроля и в возрасте 6 месяцев составила всего 14 %, а в 15-месячном возрасте короткие эстральные циклы у крыс дан- ной группы отсутствовали. Начиная с 6-месячного возраста в группе животных, получавших лузиндол, достоверно преобладали средние эстральные циклы. Различия исследуемых показателей контрольной и опытной групп начиная с возраста 6 месяцев являются достоверными (p < 0,05) (таблица). В возрасте одного года у самок, получавших лузиндол, преобладали эстральные циклы с длительностью более 7 дней, в дальнейшем происходило перераспределение эстральных циклов разной длительности за счет появления иррегулярных овуляторных циклов. Доля длинных циклов с 6-месячного возраста в группе LD + luz была достоверно выше по сравнению с опытной группой. К 15-месячному возрасту данный показатель возрос до 29 % в группе контроля и до 42 % в группе, получавшей лузин-дол. Установленные различия также являются достоверными (p < 0,05). Полученные результаты свидетельствуют о более быстром старении репродуктивной системы крыс, подвергавшихся блокаде мелатониновых рецепторов при действии лузиндола.
В трехмесячном возрасте длительность эстрального цикла у самок крыс составляла 3,7 ± 1,1 дня. В контрольной группе зафиксировано достоверное увеличение средней продолжительности овуляторного цикла к 12-месячному возрасту – 5,2 ± 1,2 дня (p < 0,05). В опытной группе длительность эстрального цикла уже в возрасте 6 месяцев была достоверно больше по сравнению с параметром, полученным в возрасте 3 месяцев, и составляла 5,9 ± 1,5 дня (p < 0,05). В последующие возрастные периоды данный
Возрастная динамика показателей эстральной функции у крыс
|
Возраст, мес. |
Средняя продолжительность эстрального цикла, дни |
Количество эстральных циклов разной длительности, % |
Соотношение фаз овуляторного цикла, % |
Число исследованных эстральных циклов, % |
||||
|
Короткие |
Средние |
Длинные |
Эструсы |
Диэструсы |
Нормальные циклы |
Иррегулярные циклы |
||
Стандартное освещение (LD)
|
6 |
4,8±1,4 |
54 в |
43 в |
3 в |
37 |
63 |
100 |
0 |
|
9 |
4,9±1,9 |
47 в |
43 в |
10 б, в |
58 б |
42 б |
93 в |
3 в |
|
12 |
5,2±1,2 а |
28 б, в |
64 б, в |
8 в |
55 б |
45 б |
89 б, в |
11 б, в |
|
15 |
6,1±1,5 а |
12 б, в |
59 б |
29 б, в |
45 |
55 |
81 б, в |
19 б, в |
Стандартное освещение + лузиндол (LD + luz)
|
6 |
5,9 ± 1,5 а |
14 в |
68 в |
18 в |
32 |
68 |
97 |
3 |
|
9 |
6,6 ± 2,0 а |
9 в |
64 в |
27 в |
64 б |
36 б |
88 б, в |
12 б, в |
|
12 |
7,2 ± 1,8 а |
7 в |
39 б, в |
54 б, в |
56 б |
44 б |
69 б, в |
31 б, в |
|
15 |
7,3 ± 1,8 а |
0 б, в |
58 |
42 б, в |
41 |
59 |
67 б, в |
33 б, в |
Примечание . а р < 0,05 – различия в группе с показателем в трехмесячном возрасте достоверны (критерий Уилкоксо-на – Манна – Уитни); б р < 0,05 – различия в группе с показателем в шестимесячном возрасте достоверны (метод χ2); в р < 0,05 – различия с показателем в группе LD в соответствующем месяце достоверны (метод χ2).
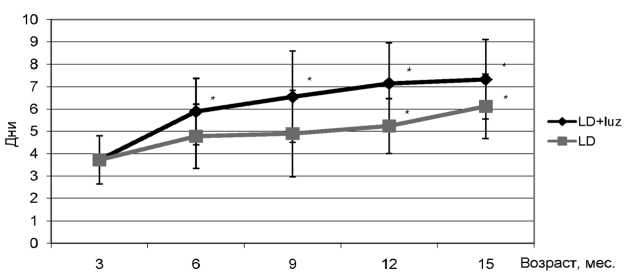
Рис. 1. Продолжительность эстрального цикла у самок крыс. р < 0,05 – различия в группе с показателем в трехмесячном возрасте достоверны (критерий Уилкоксона – Манна – Уитни); LD – стандартное освещение; LD + luz – лузиндол
показатель достоверно увеличивался до 7,3 ± 1,8 дня в возрасте 15 месяцев (рис. 1). В предыдущих исследованиях показано достоверное удлинение эстрального цикла с 8-месячного возраста у крыс-самок, находящихся в период прогрессивного роста в условиях естественной повышенной освещенности (белые ночи) или в условиях постоянного искусственного освещения [5], [6], [7]. Содержание животных в условиях постоянного или естественного освещения в период белых ночей приводило к нарушению работы шишковидной железы и угнетению продукции и секреции мелатонина – основного гормона эпифиза [1], что являлось причиной ранних возрастных изменений в репродуктивной системе крыс. В нашей работе применение лузиндола, блокирующего мелатониновые рецепторы, соответствовало эффектам, возникающим при физиологической эпифизэктомии, приводящей к угнетению выработки мелатонина. В других исследованиях показано, что искусственное увеличение продолжительности светового периода в течение дня даже на 2–4 часа, при котором не происходило достаточной секреции мелатонина, приводило у грызунов к увеличению продолжительности эстрального цикла, а в некоторых случаях – к его нарушению. Если воздействие света на крыс увеличить до 24 часов в сутки, у большинства из них в короткие сроки развивался синдром персистирующего (постоянного) эструса [2], [3]. В наших исследованиях применение лузиндола приводило у крыс-самок к более раннему увеличению средней продолжительности овуляторного цикла с возраста 9 месяцев, таким образом, показатели, полученные при помощи фармакологической блокады мелатониновых рецепторов, соответствовали параметрам при так называемой физиологической пинеалэктомии, которая достигается постоянным освещением животных [5], [6], [7].
При изучении соотношения фаз овуляторных циклов установлена тенденция к уменьшению доли диэструсов и увеличению доли эструсов с возрастом в обеих группах (см. табл.). У крыс группы LD доля диэструсов в 6 месяцев составила 63 %, в 15 месяцев – 55 %, у крыс группы LD + luz аналогичный показатель равнялся 68 % в возрасте 6 месяцев и 59 % в возрасте 15 месяцев. Соответственно, доля эструсов у крыс-самок контрольной группы в 6-месячном возрасте составляла 37 %, а у крыс-самок опытной группы – 32 %. С возрастом в контрольной группе количество эструсов изменялось незначительно, в то время как в опытной группе количество эструсов увеличилось в два раза в возрасте 9 месяцев, затем уменьшилось к 15 месяцам и составило 41 % от общего количества фаз овуляторного цикла. Достоверных различий данных показателей между группами не установлено.
С возрастом у животных было зафиксировано появление иррегулярных циклов. В группе контроля данный показатель впервые был отмечен в 9 месяцев и составил 3 % от общего количества. Достоверное увеличение доли иррегулярных циклов наблюдалось с 12-месячного возраста. В опытной группе данный показатель зафиксирован раньше – в возрасте 6 месяцев. Достоверное увеличение доли иррегулярных циклов отмечено с 9 месяцев. В 15 месяцев у животных опытной группы зафиксировано максимальное количество иррегулярных циклов – 33 %, у животных контрольной группы – 19 %. Достоверные различия между группами наблюдались с возраста 9 месяцев (рис. 2). В исследованиях Д. А. Батурина, И. Н. Алимовой и др. у мышей HER-2/neu, содержавшихся с 2 месяцев при постоянном освещении, в возрасте 9 месяцев иррегулярные циклы обнаруживали у 76 % самок, в то время как у животных, содержавшихся в стандартном режиме, у 50 % самок [4]. В других исследованиях при содержании крыс в условиях постоянного и характерного для Карелии естественного освещения с периодом белых ночей отмечено появление иррегулярных циклов в молодом (5-месячном) возрасте. К 23-месячному возрасту количество иррегу-
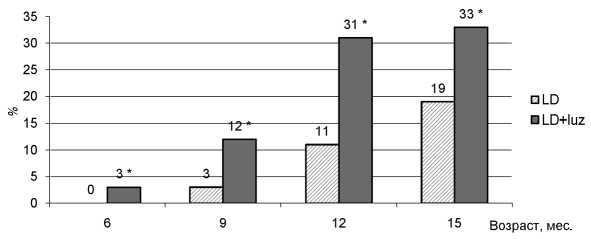
Рис. 2. Количество иррегулярных циклов (%) у самок крыс. * р < 0,05 – различия с показателем в группе LD в соответствующем месяце достоверны (метод χ 2 ). Обозначения, как на рис. 1
лярных циклов у животных этих групп возросло до 80 и 64 % соответственно [5]. По данным Д. В. Клочкова и Д. К. Беляева, продолжительное освещение с 2-месячного возраста крыс Вистар в течение 1, 2 или 6 месяцев приводило к появлению персистирующего эструса у 24, 61 и 100 % животных соответственно [10]. В другом исследовании у 100 % крыс Вистар отмечали постоянный эструс при содержании с 4-месячного возраста в течение 3 месяцев в условиях постоянного освещения [15]. В отличие от данных экспериментов в наших исследованиях не установлено наличие персистирующего эструса в опытной группе, что косвенно указывает на различие в ответах репродуктивной системы на снижение выработки мелатонина или блокаду мелатониновых рецепторов.
ЗАКЛЮЧЕНИЕ
Таким образом, в ходе десятимесячного исследования эстральной функции крыс-самок, получающих с возраста 5 месяцев лузиндол, выявлены ранние возрастные изменения репродуктивной системы по сравнению с группой контроля. У крыс опытной группы зафиксировано достоверное более раннее увеличение продолжительности овуляторного цикла с 9-месячного возраста, снижение количества регулярных циклов, появление иррегулярных циклов, уменьшение количества коротких и увеличение количества длинных эстральных циклов через 1 месяц приема лузиндола. Вероятно, применение лузиндола, результатом действия которого является блокада мелатониновых рецепторов, приводило к более выраженным возрастным изменениям репродуктивной системы. По всей видимости, блокада мелатониновых рецепторов, находящихся в гипофизе и гипоталамусе, могла привести к усилению секреции гонадолиберинов и гонадотропинов, в результате чего активация роста и развития фолликулов в яичниках способствовала более длительному выделению эстрогенов и изменению фаз овуляторного цикла. Несмотря на различные механизмы развития недостаточности мелатонинергической системы (снижение выработки мелатонина при воздействии постоянного освещения [5], [6], [7] и блокада мелатониновых рецепторов при применении лузиндола), эффекты действия на овуляторную функцию схожи: нарушения, возникающие в работе репродуктивной системы, характеризуются более быстрыми возрастными изменениями эстрального цикла. При фармакологической блокаде мелатониновых рецепторов не зафиксировано ни одного животного с синдромом персистирующего эструса, что косвенно указывает на наличие безрецепторной гормональной регуляции мелатонина через систему половых гормонов.
* Работа выполнена в рамках Программы стратегического развития ПетрГУ на 2012–2016 гг. «Университетский комплекс ПетрГУ в научно-образовательном пространстве Европейского Севера: стратегия инновационного развития», «УМНИК – 2013» и гранта РФФИ № 15-34-50841.
RATS’ OVULATORY FUNCTION UNDER MELATONIN RECEPTORS’ BLOCKADE
Список литературы Овуляторная функция крыс в условиях блокады мелатониновых рецепторов
- Анисимов В. Н. Молекулярные и физиологические механизмы старения: В 2 т. 2-е изд., перераб. и доп. СПб.: Наука, 2008. Т. 1. 468 с.
- Анисимов В. Н., Айламазян Э. К., Батурин Д. А. Световой режим, ановуляция и риск злокачественных новообразований женской репродуктивной системы: механизмы связи и профилактика//Журнал акушерства и женских болезней. 2003. Т. 52. № 2. С. 47-57.
- Анисимов В. Н., Батурин Д. А., Айламазян Э. К. Эпифиз, свет и рак молочной железы//Вопросы онкологии. 2002. Т. 48. № 4-5. С. 524-535.
- Батурин Д. А., Алимова И. Н., Попович И. Г, Анисимов В. Н., Забежинский М. А., Яшин А. И., Семенченко А. В. Влияние световой депривации на показатели гомеостаза, продолжительность жизни и развитие спонтанных опухолей у трансгенных мышей HER-2/neu//Вопросы онкологии. 2004. Т. 50. № 3. С. 332-338.
- Виноградова И. А., Чернова И. В. Влияние светового режима на возрастную динамику эстральной функции и уровня пролактина в сыворотке крови у крыс//Успехи геронтологии. 2006. № 19. С. 60-65.
- Виноградова И. А., Чернова И. В. Световые режимы и овуляторная функция у крыс в онтогенезе//Российский физиологический журнал. 2007. Т. 93. № 1. С. 90-98.
- Гайдин И. В., Баранова Ю. П., Виноградова И. А. Влияние продолжительности светового дня в условиях Карелии на показатели эстральной функции у самок крыс//Ученые записки Петрозаводского государственного университета. 2011. № 6 (119). С. 45-49.
- Зайцев В. М., Лифляндский В. Г., Маринкин В. И. Прикладная медицинская статистика. СПб., 2006. 432 с.
- Кабак Я. М. Практикум по эндокринологии. Основные методики экспериментально-эндокринологических исследований. М.: Изд-во МГУ, 1968. 153 с.
- Клочков Д.В., Беляев Д. К. Эффект постоянного освещения на репродуктивную функцию крыс//Онтогенез. 1977. Т. 8. № 5. С. 487-496.
- Мелатонин: теория и практика/А. Ю. Беспятых ; Под ред. С. И. Рапопорта, В. А. Голиченкова. М.: Медпрактика, 2009. 99 с.
- Руководство по лабораторным животным и альтернативным моделям в биомедицинских исследованиях/Под ред. Н. Н. Каркищенко, С. В. Грачева. М.: Профиль, 2010. 358 с.
- Этическая экспертиза биомедицинских исследований: Практические рекомендации/Под ред. Ю. Б. Белоусова. М.: Российское общество клинических исследований, 2005. 156 с.
- Drobnik J., Owczarek K., Piera L., Tosik D., Olczak S., Ciosek J., Hrabec E. Melatonin-induced augmentation of collagen deposition in cultures of fibroblasts and myofibroblasts is blocked by luzindole -A melatonin membrane receptors inhibitor//Pharmcological reports. 2013. Vol. 65. № 3. P. 642-649.
- Prata Lima M. F., Baracat E. C., Simones M. J. Effects of melatonin on the ovarian response to pinealectomy or continuous light in female rats: similarity with polycystic ovary syndrome//Brazil. J. Med. Biol. Res. 2004. Vol. 37. P. 987-995.
- Soares J. M., Masana M. I., Ersahin C., Dubocovich M. L. Functional melatonin receptors in rat ovaries at various stages of the estrous cycle//J. Pharmacol. Exp. Ther. 2003. № 306 (2). Р. 694-702.
- Wincz y k K., Fuss-Chmielewska J., Pawlikowski M., Karasek M., Lawnicka H. Luzindole but not 4-phenyl-2-propionamidotetralin (4P-PDOT) diminishes the inhibitory effect of melatonin on murine Colon 38 cancer growth in vitro//Neuroendocrinology letters. 2009. Vol. 30. P. 657-662.


