Оздоровление микрорастений трех культурных видов картофеля (Solanum tuberosum L., S. phureja Juz. & Buk. и S. stenotomum Juz. & Buk.) от вирусов методом комбинированной термо-химиотерапии
Автор: Антонова О.Ю., Апаликова О.В., Ухатова Ю.В., Крылова Е.А., Шувалов О.Ю., Шувалова А.Р., Гавриленко Т.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Картофелеводство: наука и технологии
Статья в выпуске: 1 т.52, 2017 года.
Бесплатный доступ
Коллекция картофеля, собранная во Всероссийском институте генетических ресурсов растений им. Н.И. Вавилова (ВИР), - одна из крупнейших и старейших в мире. Коллекционные образцы, которые в процессе хранения длительно репродуцируют клубнями, могут накапливать вирусные инфекции, поэтому разработка эффективных методов оздоровления растений картофеля крайне актуальна. Взяв за основу протоколы термо- и химиотерапии, а также комплексной терапии, используемые в ведущих генбанках картофеля (Leibniz Institute of Plant Genetics and Crop Plant Research - IPK, Германия; International Potato Centre - CIP, Перу), мы разработали модифицированный метод комбинированной терапии, включающий три последовательных цикла выращивания in vitro растений на среде Мурасиге и Скуга (MS) с рибавирином (30 мг/л) при температуре 37 °С в течение 4 нед. В промежутках между этими циклами микрорастения в течение 2 сут выдерживались при температуре 26 °С на той же среде с рибавирином. В качестве материала исследований использовали 91 клон 85 образцов трех южно-американских культурных видов из полевой коллекции ВИР: Solanum phureja - 18 образцов, S. stenotomum - 26 образцов, S. tuberosum ( S. tuberosum ssp. andigenum и S. tuberosum ssp. tuberosum ) - 41 образец. Согласно результатам иммуноферментного анализа (ИФА) исходных растений и тестирования микрорастений, полученных после введения в культуру in vitro тех же клонов, в ОТ-ПЦР (ПЦР с обратной транскрипцией), материал был в разной степени поражен вирусами (Y-, X-, S-, M-вирус картофеля и вирус скручивания листьев картофеля - соответственно YВК, XВК, SВК, MВК и ВСЛК). При этом у 25,3 % клонов выявили простые инфекции, у остальных - смешанные (растения были заражены несколькими вирусами одновременно в различных сочетаниях). При сравнении результатов ОТ-ПЦР-анализа до и после проведения разработанной процедуры комбинированной термо-химиотерапии по каждому клону эффективность оздоровления от ВСЛК в целом по выборке (91 клон) составила 72,7 %, от YВК - 71,4 %, от MВК - 63,9 % и от SВК - 57,4 %. Всего 42 клона (46 %) оказались полностью свободными от тестируемых вирусов, у 44 % клонов произошла элиминация отдельных вирусов и 10 % клонов не удалось оздоровить. Различия в эффективности оздоровления растений от каждого из тестируемых вирусов не были значимыми (р > 0,05). Существенных различий между образцами изученных культурных видов картофеля по частоте элиминации вирусов мы также не обнаружили. Предложенная модификация отличается от протоколов IPK (Германия) одновременным воздействием повышенной температуры (37 °С) и рибавирина (вместо их последовательного применения), а от схемы, используемой в CIP (Перу), - меньшим числом этапов.
Картофель, микрорастения, вирусы, оздоровление, от-пцр, термотерапия, химиотерапия
Короткий адрес: https://sciup.org/142214018
IDR: 142214018 | УДК: 635.21:573.6.086.83:[632.935.11+632.934.3 | DOI: 10.15389/agrobiology.2017.1.95rus
Текст научной статьи Оздоровление микрорастений трех культурных видов картофеля (Solanum tuberosum L., S. phureja Juz. & Buk. и S. stenotomum Juz. & Buk.) от вирусов методом комбинированной термо-химиотерапии
Коллекция картофеля, собранная во Всероссийском институте генетических ресурсов растений им. Н.И. Вавилова (ВИР), — одна из крупнейших и старейших в мире. Она насчитывает около 8500 образцов селекционных сортов, диких и культурных видов, а также межвидовых гибридов (1). Образцы картофеля полевых коллекций, длительно репродуцируемые клубнями, могут накапливать вирусные инфекции. Известно около 40 вирусов, поражающих картофель, из них наиболее вредоносны Y-вирус картофеля (YВК), вирус скручивания листьев картофеля (ВСЛК), M-вирус
Статья подготовлена при поддержке Программы фундаментальных научных исследований государственных академий наук на 2013-2020 годы. Завершающий этап работы выполнен при частичной поддержке КЦП РФ «Научное обеспечение деятельности по созданию отечественного посевного фонда, средств защиты растений в целях производства российскими производителями конкурентоспособной сельскохозяйственной продукции, а также по созданию технологий производства (выращивания) и хранения такой продукции на 2016-2025 годы» (по приоритетному направлению «Картофелеводство»).
картофеля (MВК), S-вирус картофеля (SВК), X-вирус картофеля (XВК), A-вирус картофеля (AВК) (2-4). На территории России и стран СНГ чаще всего встречаются YВК, ВСЛК, XВК, SВК, MВК, реже выявляются F-вирус картофеля и AВК (5). В полевых условиях вирусы передаются главным образом насекомыми-переносчиками (преимущественно тлей), а также контактным способом (3).
Для оздоровления растений используют культуру апикальных меристем, химио-, термо-, крио- и электротерапию, а также разные сочетания этих методов (комплексная, или комбинированная, терапия). Метод оздоровления в культуре апикальных меристем, который был разработан одним из первых (6, 7), относительно малозатратен и до сих пор широко применяется. Однако для оздоровления растений в больших коллекциях, насчитывающих тысячи образцов, он становится менее востребованным из-за трудоемкости и в связи с появлением более эффективных комбинированных подходов. При криотерапии в жидком азоте (-196 °С) только клетки меристем, потенциально свободные от вирусов, сохраняют жизнеспособность, а вне меристемной зоны гидратированные клетки гибнут (8). Метод электротерапии основан на пропускании электрического тока через растительные ткани, в результате чего происходит деградация вирусного нуклеопротеина и патоген утрачивает вирулентность (9, 10).
Термотерапия in vivo и in vitro растений основана на снижении титра вирусов в зараженных тканях вследствие нарушения синтеза вирусных РНК при повышенных температурах — 36-40 °С (12). Способ менее эффективен в отношении сферических вирусов (4), поэтому при смешанных инфекциях его рекомендуют сочетать с другими технологиями. Химиотерапия основана на обработке инфицированных растений веществами с противовирусной активностью. К ним относятся ингибиторы синтеза вирусных нуклеиновых кислот — тилофорин и его производные, аналоги пуриновых и пиримидиновых оснований, в том числе рибавирин, и др. (1113), а также РНКаза (14), интерферон (15), стимуляторы роста (16) и фенольные соединения, в частности салициловая кислота (17). Наиболее часто для химиотерапии растений картофеля in vitro применяется рибавирин — синтетический аналог гуанозина (1-бета-D-рибофуранозил-1Н-1,2,4-триазол-3-карбоксамид), но следует помнить, что низкие дозы препарата малоэффективны (11), а в высоких он угнетает развитие растений (8). Оптимальными считаются концентрации 30-50 мг/л (11-13).
В крупных центрах генетических ресурсов растений, таких как International Potato Centre (CIP, Перу) и Leibniz Institute of Plant Genetics and Crop Plant Research (IPK, Германия), для оздоровления коллекционных образцов картофеля используют схемы термо- и химиотерапии, различающиеся числом и продолжительностью этапов, а также комбинированную терапию, которая предусматривает разные сочетания этих методов (18-21). Частота элиминации вирусов может дополнительно повышаться при использовании культуры апикальной меристемы совместно с различными вариантами комбинированной терапии — термотерапией (22, 23), химиотерапией (25, 26) и термо-химиотерапией (12, 26, 27).
Отметим, что приемы антивирусной терапии неодинаковы по эффективности, а в ряде случаев одни и те же подходы в разных лабораториях дают противоречивые результаты. Кроме того, большинство исследований выполнены на единичных сортах или их ограниченном числе, поэтому не известно, насколько предлагаемые методики применимы для больших коллекций. Таким образом, разработка способов оздоровления расте-96
ний картофеля от вирусных инфекций остается крайне актуальной.
Взяв за основу протоколы термо- и химиотерапии, а также комплексной терапии ведущих генбанков картофеля (CIP и IPK), мы модифицировали схему оздоровления для больших выборок генетически разнородных образцов картофеля, в растениях которых были выявлены смешанные вирусные инфекции в различных сочетаниях. От протоколов IPK предложенная нами модификация отличается одновременным, а не последовательным применением повышенной температуры (37 °С) и рибавирина, а от схемы, используемой в CIP, — меньшим числом этапов (21).
Цель работы — сравнив известные протоколы, разработать и верифицировать схему комплексной антивирусной химио-термотерапии для оздоровления растений картофеля in vitro.
Методика . Материалом для исследований послужило 91 растение 85 образцов трех южно-американских культурных видов (аборигенных сортов) картофеля: Solanum phureja (18 образцов), S. stenotomum (26 образцов), S. tuberosum ssp. andigenum (= S. andigenum ) (23 образца), S. tuberosum ssp. tuberosum (= S. tuberosum ) (18 образцов) из коллекции ВИР. В статье указаны названия видов согласно таксономической системе J. Hawkes (1990) (28), которая в настоящее время используется наиболее широко; в скобках приведены обозначения, принятые в коллекции ВИР, которая структурирована по С.М. Букасову (1978) (29). Изучаемые образцы, которые представляют собой экспедиционные сборы разных лет, впоследствии длительное время репродуцировались в полевой коллекции.
Полевые растения анализировали на присутствие MВК, YВК, SВК, ВСЛК и XВК методом иммуноферментного анализа, применяя наборы и рабочий протокол фирмы «Agdia, Inc.», США) (данные не представлены). По результатам иммуноферментного анализа отбирали клоны среди растений полевой коллекции. Для сохранения вирусной инфекции эти клоны вводили в культуру in vitro с использованием апексов крупного (2-4 мм) размера (30). Полученные микрорастения сохраняли как клоновую коллекцию.
Препараты тотальной РНК (включает РНК вирусов) получали из нижних листьев развитых пробирочных растений согласно описанию (31), используя коммерческий набор для выделения на магнитных частицах, покрытых SiO 2 («Силекс», Россия). Препараты хранили при -70 °С. Обратную транскрипцию проводили при помощи набора «Синтез первой цепи кДНК (рендом)» («Силекс», Россия) в соответствии с прилагаемым протоколом (32). В набор входит смесь случайных гексануклеотидных праймеров, позволяющих одновременно получить кДНК для всех вирусных РНК и для РНК гена тубулина (контроль успешного синтеза матрицы). Специфичные праймеры (синтезированы в компании «Евроген», Россия) и режимы амплификации при выявлении вирусов YBK, MBK, XBK, SBK и ВСЛК в ПЦР описаны в литературе (33-36). Эффективность матрицы в ПЦР контролировали с помощью праймеров, специфичных для гена белка тубулина (36). Отрицательным контролем служили пробы без РНК. ПЦР выполняли на амплификаторе Mastercycler nexus gradient («Ep-pendorf», Германия). Для повышения специфичности ПЦР используемые программы предусматривали функцию TOUCHDOWN: исходно температура отжига праймеров устанавливалась на 5 °С выше необходимой и затем в каждом из пяти циклов амплификации понижалась на 1 °С. ПЦР-продукты разделяли при помощи электрофореза в 2,5 % агарозных гелях, окрашивали бромистым этидием и визуализировали в УФ-свете.
Перед началом экспериментов по оздоровлению каждый клон был протестирован на присутствие вирусов методом ОТ-ПЦР. Оздоровление микрорастений проводили модифицированным нами методом комбинированной термо-химиотерапии. При этом использовали питательную среду Мурасиге-Скуга (MS) без гормонов (30), содержащую антивирусный препарат рибавирин (30 мг/л). Комбинированная терапия включала три этапа продолжительностью 4 нед каждый, на которых растения подвергались воздействию рибавирина при повышенных температурах (37 °С), после чего их выдерживали на среде с рибавирином при 26 °С в течение 1 мес.
Статистическую обработку данных проводили, используя t- критерий Стьюдента при уровне значимости р < 0,05.
Результаты . Мы проанализировали известные методы оздоровления растений от вирусов (табл. 1), на основании чего была предложена модифицированная схема антивирусной терапии in vitro (рис. 1) с применением ОТ-ПЦР для выявления инфицированности. Эффективность этой схемы в отношении наиболее распространенных вирусных патогенов картофеля контролировали на выборке из представителей нескольких видов Solanum , используя праймеры, специфичные к различным участкам геномов соответствующих вирусов (табл. 2).
1. Эффективность различных методов оздоровления растений культурных видов картофеля от вирусных инфекций
ХВК YВК ВСЛК SВК МВК
Культура апикальных меристем
|
+б (22) |
+а (37) ++ (8) ++а (23) |
+а (23) |
|
++а (23) |
++ (8) Простая терапия Обработка рибавирином |
|
|
+а (14, 38) |
- а (11) - а (11) +а (11, 14) |
+а (14) |
|
++а (11) |
+а (14, 38) +++а (23, 38) |
+в (12) |
|
+в (12) |
++а (23) |
|
|
++а (8, 16) Обработка РНКазой |
++++а (11) |
|
|
+++а (39, 40) |
- а (11) +а (39, 40) +а (39, 40) +а (40) Термотерапия |
+а (39, 40) |
|
++а (22, 23) |
+а (16) ++а (8) - а (8) |
|
|
+++а (41) |
++а (8, 37) +а (23) Криотерапия |
|
|
++б (22) |
++++а (8) ++++а (8) Комплексная терапия Химио- и термотерапия |
|
|
++++а (11, 23, 28, 41) |
- а (11, 23) - а (11, 23) ++а (23) |
++а (23) |
|
++а (11, 17) ++а (17) ++++а (11, 38) Термотерапия и культура меристем |
+++а (11) |
|
|
++в (22) |
++++а (8, 42) ++++а (8, 42) ++а (24) |
|
|
++++а (23) |
++++а (23, 42) Химиотерапия и культура меристем |
|
|
++++а (25) |
++а, в (26) ++а, в (26) +++а (25) |
|
|
++++а, в (26) |
++++а, в (26) Термо-, химиотерапия и культура меристем |
|
|
+++а (27) |
+++а (27) +++а (27) +++а (27) ++++а (37) Термо-, химио-, электротерапия и культура меристем |
|
|
+++а (9) |
+++а (10) ++++а, в (26) |
++++в (12)
П р и м еч а ни е. ХВК, YВК, SВК, MВК — соответственно X-, Y-, S- и M- вирусы картофеля, ВСКЛ — вирус скручивания листьев картофеля; « - » — отсутствие эффекта оздоровления; «+» — до 40 % безвирус-ных растений, «++» — от 41 до 60 % безвирусных растений, «+++» — от 61 до 89 % безвирусных растений, «++++» — от 90 до 98 % безвирусных растений. В скобках указаны цитируемые ссылки литературы. Тестирование методом иммуноферментного анализа (а), в ПЦР с обратной транскрипцией (б), с помощью растений-индикаторов или электронной микроскопии (в). Пропуски означают отсутствие данных.
По результатам иммуноферментного анализа исходных растений из полевой коллекции (данные не приведены) и ОТ-ПЦР-анализа микрорастений, полученных после введения в культуру in vitro тех же клонов, весь материал был в разной степени поражен вирусами (рис. 2, А). Простые инфекции выявили у 25,3 % растений, однако у большинства отобранных для оздоровления клонов наблюдали смешанные инфекции с одновременным присутствием нескольких видов вирусов в разных сочетаниях, причем максимальное число (пять вирусов) обнаружили у образцов S. tuberosum ssp. tuberosum (см. рис. 2, А).
-
1. Тестирование микрорастений методом ОТ-ПЦР на наличие вирусов
-
2. Микроразмножение инфицированных in vitro растений
-
3. Комплексная химио- и термотерапия:
-
3.1. черенкование микрорастений — для каждого генотипа на среду Мурасиге-Скуга (MS) без гормонов высаживают 10-20 безлиственных черенков (1-21 междоузлия), выдерживают при 26 ° С в течение 1 сут и далее культивируют при 37 ° С в течение 4 нед
-
3.2. получение безлиственных черенков от растений, прошедших этап 3.1, — микрораcтения культивируют на среде MS с добавлением рибавирина (30 мг/л) при 20 ° С в течение 2-3 сут, затем при 37 ° С в течение 4 нед
-
3.3. получение безлиственных черенков от растений, прошедших этап 3.2, — микрорастения культивируют на среде MS с добавлением рибавирина (30 мг/л) при 20 ° С в течение 2-3 сут, затем при 37 ° С в течение 4 нед
-
3.4. получение безлиственных черенков от растений, прошедших этап 3.3, — черенки выдерживают при 26 ° С в течение 1 сут, затем микрорастения культивируют на среде MS с добавлением рибавирина (30 мг/л) при 20 ° С в течение 4 нед
-
3.5. перенос микрорастений на среду MS без гормонов, культивирование при 20 ° С в течение 2 мес
-
-
4. Выделение РНК и тестирование микрорастений методом ОТ-ПЦР на наличие вирусов
-
5. Микроразмножение оздоровленного материала
2. Праймеры, использованные в работе при тестировании на наличие вирусов
Амлифицируемая РНК
Пара паймеров Последовательность
| T, °С
Ссылка
X-вирус картофеля (ХВК)
PVX1-f
PVX1-r
AGGCCACAGGGTCGACTAC
TTGTTGTTCCAGTGATACGACC
57
(33)
Y-вирус картофеля (YВК)
PVY1-f
PVY1-r
ACGTCCAAAATGAGAATGCC TGGTGTTCGTGATGTGACCT
53
(33)
Вирус скручивания листьев картофеля (ВСЛК)
PLRV1-f
PLRV1-r
CGCGCTAACAGAGTTCAGCC GCAATGGGGGTCCAACTCAT
58
(33)
S-вирус картофеля (SВК)
PVS-f
PVS-r
TGGCGAACACCGAGCAAATG
ATGATCGAGTCCAAGGGCACT
57
(35)
M-вирус картофеля (MВК)
PVM4
PVM3
ACATCTGAGGACATGATGCGC TGAGCTCGGGACCATTCAAC
59
(34)
Контроль обратной транскрипции (ОТ)
tubul-f tubul-r
ATGTTCAGGCGCAAGGCTT TCTGCAACCGGGTCATTCAT
54
(36)
Рис. 1. Модифицированная схема оздоровления микрорастений культурных видов картофеля от вирусных инфекций на основе комплексной термо-химиотерапии. ОТ-ПЦР — ПЦР с обратной транскрипцией.
Проведенная комбинированная терапия в целом значительно снизила степень вирусного поражения микрорастений (cм. рис. 2, Б, рис. 3). По результатам ОТ-ПЦР анализа 42 клона (46 %) от числа прошедших процедуру оздоровления оказались полностью свободными от тестируемых вирусов, у 44 % клонов произошла элиминация некоторых вирусов, и 10 % клонов оздоровить не удалось. Были полностью оздоровлены 16 клонов (69,6 %) с простой инфекцией и 26 клонов (38,2 %) со смешанными инфекциями. В остальных случаях после применения комбинированной терапии число клонов с множественной вирусной инфекцией снизилось. Так, не выявлялись клоны с четырьмя-пятью видами вирусов, значительно снизилось число микрорастений с двумя вирусами (см. рис. 2, Б). Эти результаты согласуются с данными других авторов (16, 27) по сравнительному изучению эффектов комбинированной терапии на растениях картофеля со смешанной (YВК, SВК, ВСЛК, ХВК) и простыми вирусными инфекциями. В то же время I.A. Nasir c cоавт. (37) сообщают об оздоровлении растений картофеля со смешанной инфекцией от вирусов S, M, X и отмечают полное отсутствие эффекта оздоровления от YВК и ВСЛК.
Мы не обнаружили существенных различий в частоте оздоровления растений, инфицированных разными вирусами (см. рис. 2, табл. 3). В целом по выборке (91 клон) ВСЛК был элиминирован у 72,7 % микрорастений, YВК — у 71,4 %, MВК — у 63,9 % и SВК — у 57,4 % клонов. При этом различия между изученными культурными видами картофеля по эффективности оздоровления от каждого из вирусов также не были значимыми (р > 0,05).
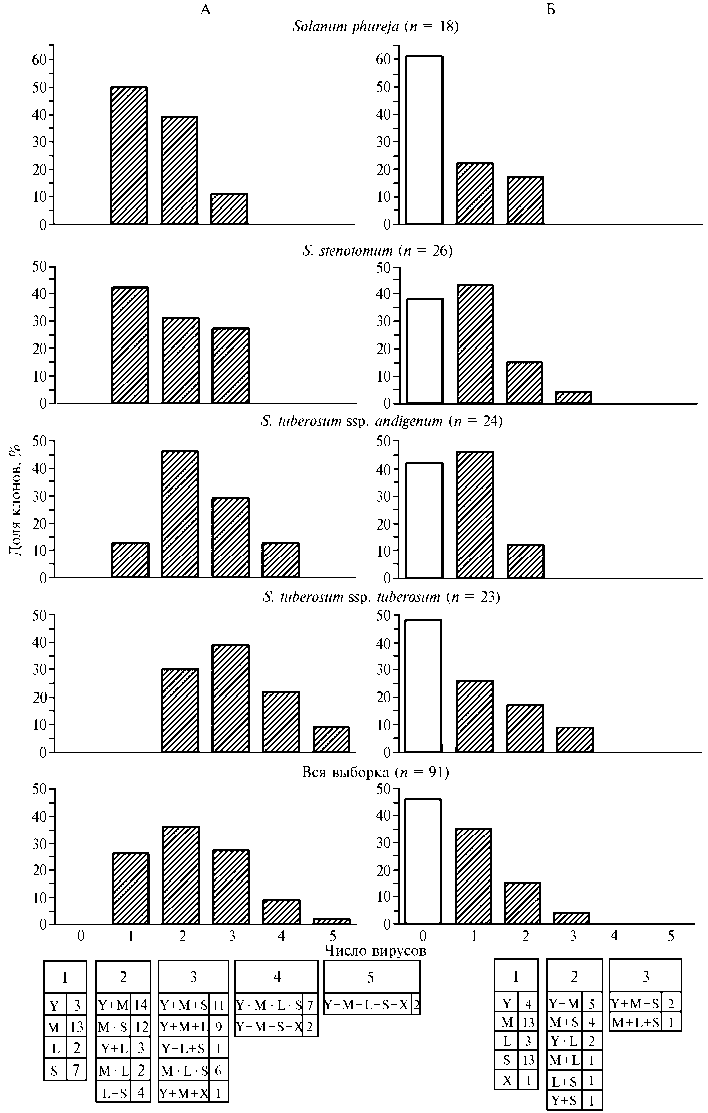
Рис. 2. Доля клонов (%) среди образцов культурных видов картофеля с различными вирусными инфекциями до (А) и после (Б) применения предложенной схемы комплексной термо-химиотерапии in vitro: Y, X, S, M и L — соответственно Y-, X-, S-, M-вирус картофеля и вирус скручивания листьев картофеля.
М 1 2 3 4 5 6 7 8 9 10 И 12 13 14 15 16 М М 1 2 3 4 5 6 7 8 9 10 И 12 13 14 15 16 М
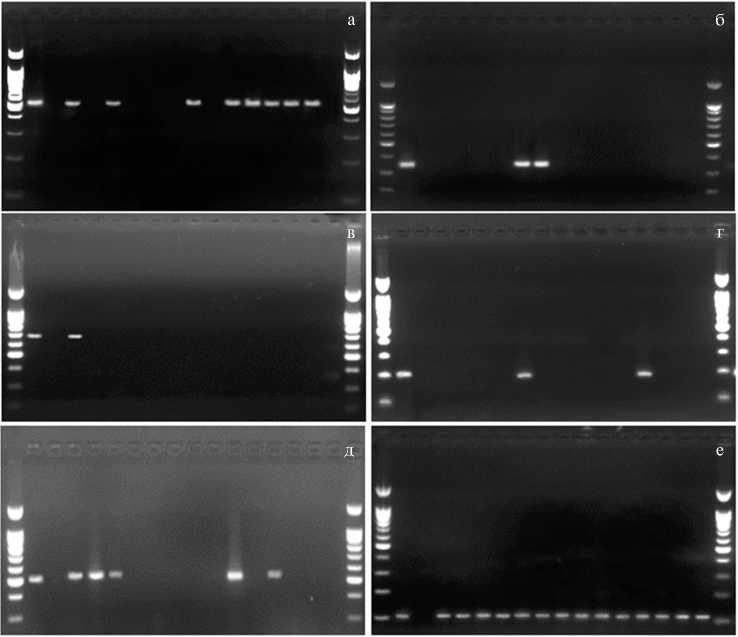
Рис. 3. Пример ОТ-ПЦР-тестирования микрорастений культурных видов картофеля на наличие Y-вируса картофеля (а) , вируса скручивания листьев картофеля (б) , Х-вируса картофеля (в) , S-вируса картофеля (г) , М-вируса картофеля (д) при применении предложенной схемы комплексной термо-химиотерапии с контролем эффективности синтеза матрицы кДНК (е) : 1 — полевое растение клона Solanum tuberosum ssp. tuberosum (номер в коллекции ВИР к-3414), которое по результатам ИФА-анализа поражено всеми пятью вирусами (положительный контроль), 2 — вода (отрицательный контроль); 3 и 4 — клон S. tuberosum ssp. andigenum (к-3172), 5 и 6 — клон S. tuberosum ssp. andigenum (к-3240), 7 и 8 — клон S. tuberosum ssp. andigenum (к-17961), 9 и 10 — клон S. phureja (к-12789), 11 и 12 — клон S. phureja (к-5642), 13 и 14 — клон S. stenoto-mum (к-8929), 15 и 16 — клон S. phureja (к-9835) (попарные сравнения результатов ОТ-ПЦР до и после проведения терапии); М — маркер молекулярных масс 100 b.p. + 1500 («СибЭн-зим», Россия). ОТ-ПЦР — ПЦР с обратной транскрипцией, ИФА — иммуноферментный анализ; ВИР — Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова.
3. Частота (%) оздоровления микрорастений культурных видов картофеля от вирусов при применении предложенной схемы комплексной термо-химиотерапии (n = 91, X±x)
|
Вирус |
Solanum phureja |
S. stenotomum |
S. tuberosum ssp . andigenum |
S. tuberosum ssp. tuberosum |
Всего по выборке |
|
XВК |
0 в |
0 в |
50,0±50,0а, б, в |
100,0±0,0а |
80,0±20,0а, б |
|
YВК |
33,3±21,1б, в |
50,0±18,9б |
93,3±6,7а |
75,0±9,9а, б |
71,4±6,5а, б |
|
SВК |
77,8±14,7а, б |
23,1±12,2в |
57,1±13,7б |
81,8±12,2а, б |
57,4±7,3б |
|
MВК |
63,6±15,2а, б |
66,7±9,8а, б |
61,1±11,8б |
63,2±11,4а, б |
63,9±5,7а, б |
|
ВСЛК |
66,7±33,3а, б |
100,0±0,0а |
77,8±14,7а, б |
66,7±11,4б |
72,7±7,9а, б |
П р и м е ч а н и е. ХВК, YВК, SВК, MВК — соответственно X-, Y-, S- и M-вирус картофеля, ВСКЛ — вирус скручивания листьев картофеля. Значения, отмеченные одинаковыми буквами, достоверно не различаются (р < 0,05).
Полученные нами результаты определения эффективности оздоровления микрорастений от YВК, МВК и ВСЛК методом комбинированной термо-химиотерапии согласуются с данными литературы (9-11, 27, 38, 42) (см. табл. 1). Выход оздоровленных от SВК растений в нашем исследовании составил 57,4 %, тогда как в других работах (11, 38) сообщается о почти полной (более 90 %) элиминации указанного вируса. Отметим, что в этих исследованиях для тестирования авторы использовали метод ИФА (11, 38), обладающий меньшей чувствительностью по сравнению с применяемым нами ОТ-ПЦР-анализом. Обобщение данных литературы показывает, что в большинстве исследований комплексной терапии подвергались единичные образцы картофеля (16, 17) или очень небольшое число образцов (38, 42), пораженных в основном простыми вирусными инфекциями (17).
Итак, нами предложена модифицированная схема комплексной термо-химиотерапии микрорастений картофеля с контролем вирусной инфекции методом ПЦР с обратной транскрипцией (ОТ-ПЦР). В настоящей работе, применив эту схему, мы получили сопоставимые по эффективности результаты элиминации пяти наиболее вредоносных вирусов на обширной выборке генетически разнообразного материала — 85 образцах (91 клон) трех культурных видов картофеля, что указывает на перспективность дальнейшего использования модифицированного метода термохимиотерапии в центрах генетических ресурсов растений. Предложенная модификация отличается от известных протоколов одновременным воздействием повышенной температуры и рибавирина, а также меньшим числом этапов обработки.
Список литературы Оздоровление микрорастений трех культурных видов картофеля (Solanum tuberosum L., S. phureja Juz. & Buk. и S. stenotomum Juz. & Buk.) от вирусов методом комбинированной термо-химиотерапии
- Полевая коллекция картофеля ВИР. Режим доступа: http://vir.nw.ru/otd_r.htm#tuber. Дата обращения 04.10.2016.
- Jeffries C.J. Potato. FAO/IPGRI technical guidelines for the safe movement of germplasm. FAO and IPGRI, Rome, 1998.
- Virus and virus-like diseases of potatoes and production of seed potatoes/G. Loenbenstein, P.H. Berger, A.A. Brunt, R.H. Lawson (eds.). Springer Netherlands, The Netherlands, 2001 ( ) DOI: 10.1007/978-94-007-0842-6
- Власов Ю.И., Ларина Э.И., Трускинов Э.В. Сельскохозяйственная фитовирусология. СПб-Пушкин, 2016.
- Анисимов Б.В., Белов Г.Л., Варицев Ю.А., Еланский С.Н., Журомский Г.К., Завриев С.К., Зейрук В.Н., Иванюк В.Г., Кузнецова М.А., Пляхневич М.П., Пшеченков К.А., Симаков Е.А., Склярова Н.П., Усков А.И., Яшина И.М. Защита картофеля от болезней, вредителей и сорняков. М., 2009.
- Morel G.T., Martin C. Guerison de dahlias atteints dune maladie a virus. Comptes Rendus de l'Académie des Sciences, Ser. III, 1952, 235: 1324-1325.
- Трускинов Э.В. Оздоровление картофеля от вирусных болезней методом культуры меристемных тканей. Сельскохозяйственная биология, 1976, 11(2): 250-255.
- Wang Q.C., Liu Y., Xie Y.H., You M. Cryotherapy of potato shoot tips for efficient elimination of Potato leaf roll virus (PLRV) and Potato virus Y (PVY). Potato Res., 2006, 49(2): 119-129 ( ) DOI: 10.1007/s11540-006-9011-4
- Bădărău C.L., Chiru N. Effect of some therapies on potato plantlets infected with potato virus X (PVX). Journal of EcoAgriTourism, 2014, 10(1/28): 11-17.
- Mahmoud S.Y.M., Hosseny M.H., Abdel-Ghaffar M.H. Evaluation of some therapies to eliminate Potato Y potivirus from potato plants. Int. J. Virol., 2009, 5(2): 64-76 ( ) DOI: 10.3923/ijv.2009.64.76
- Griffiths H.M., Slack S.A., Dodds J.H. Effect of chemical and heat therapy on virus concentration in in vitro plantlets. Can. J. Bot., 1990, 68: 1515-1521.
- Cassells A.C., Long R.D. The elimination of potato viruses X, Y, S and M in meristem and explant cultures of potato in the presence of Virazole. Potato Res., 1982, 25: 165-173.
- Faccioli G., Colalongo M.C. Eradication of Potato virus Y and Potato leafroll virus by chemotherapy of infected potato stem cuttings. Phytopathol. Mediterr., 2002, 41: 76-78.
- Трускинов Э.В., Рогозина Е.В. Оздоровление клоновой коллекции картофеля в культуре ткани. Физиология растений, 1997, 43: 432-439.
- Атабеков И.Г., Тальянский М.Э. Биотехнологические методы в безвирусном растениеводстве. В сб.: Достижения сельскохозяйственной науки. М., 1987: 121-136.
- Nascimento L.C., Pio-Ribeiro G., Willadino L., Andrade G.P. Stock indexing and potato virus Y elimination from potato plants cultivated in vitro. Scientia Agricola, 2003, 60(3): 525-530 ( ) DOI: 10.1590/S0103-90162003000300017
- Dhital S.P., Sakha B.M., Lim H.T. Utilization of shoot cuttings for elimination of PLRV and PVY by thermotherapy and chemotherapy from potato (Solanum tuberosum L.). Nepal Journal of Science and Technology, 2006, 7: 1-6.
- Techniques in plant virology. Section 4.2. Virus eradication: tissue culture of meristems, thermotherapy, and chemotherapy/L. Salazar, U. Jayasinghe (eds.). International Potato Center, Lima, Peru, 1999.
- Panta A., Tay D., Gomez R., Zea B., Rojas E., Simon R., Roca W. Status and impact of the in vitro conservation of root and tubers at the International Potato Centre (CIP). Proc. 15th Triennial Symposium of the International Society for Tropical Root Crops. Lima, Peru, 2009: 15-24.
- Operational Genebank manual of IPK. Gatersleben, 2011.
- Lizarraga R., Panta A., Jayasinghe U., Dodds J. Tissue culture for elimination of pathogens. CIP Research Guide 3. International Potato Center, Lima, Peru, 1991.
- Jianming B., Xiaoling C., Xinxiong L., Huachun G., Xia X., Zhie Z. Can cryopreservation eliminate the Potato virus X (PVX) and Potato spindle tuber viroid (PSTVd)? Bioscience Methods, 2012, 3(5): 34-40 ( ) DOI: 10.5376/bm.2012.03.0005
- Faccioli G. Control of potato viruses using meristem and stem-cutting cultures, thermotherapy and chemotherapy. In: Virus and virus-like diseases of potatoes and production of seed-potatoes/G. Loebenstein, P.H. Berger, A.A Brunt, R.H. Lawson (eds.). Springer Netherlands, 2001: 365-390 ( ) DOI: 10.1007/978-94-007-0842-6_28
- Heldak J. Detection of potato virus S by RT-PCR in potato regenerants derived from in vitro heat-treated shoot tips. Acta fytotechnica et zootechnica, 2001, 4: 275-277.
- Klein R.E., Livingston C.H. Eradication of potato viruses X and S from potato shoot-tip cultures with ribavirin. Phytopathology, 1983, 73(7): 1049-1050 ( ) DOI: 10.1094/Phyto-73-1049
- Yang L., Nie B., Liu J., Song B. A reexamination of the effectiveness of ribavirin on eradication of viruses in potato plantlets in vitro using ELISA and quantitative RT-PCR. Am. J. Potato Res., 2014, 91(3): 304-311 ( ) DOI: 10.1007/s12230-013-9350-z
- Sanchez G.E., Slack S.A., Dodds J.H. Response of selected Solanum species to virus eradication therapy. Am. Potato J., 1991, 68: 299-315 ( ) DOI: 10.1007/BF02853668
- Hawkes J.G. The potato. Evolution, biodiversity, genetic resources. Belhaven Press, London, 1990.
- Букасов С.М. Принципы систематики картофеля. Труды по прикладной ботанике, генетике и селекции (Л.), 1978, 62(1): 3-35.
- Дунаева С.Е., Пендинен Г.И., Антонова О.Ю., Швачко Н.А., Волкова Н.Н., Гавриленко Т.А. Сохранение вегетативно размножаемых культур в in vitro и криоколлекциях/Под ред. Т.А. Гавриленко. СПб, 2011.
- Набор «Выделение тотальной РНК на магнитных частицах, покрытых SiO2». Режим доступа: http://www.sileks.com/ru/production.php?folder=189. Дата обращения 25.09.2016.
- Набор «Синтез первой цепи кДНК (рендом)» фирмы Силекс. Режим доступа: http://www.sileks.com/ru/production.php?folder=65. Дата обращения 25.09.2016.
- Singh R.P. Development of the molecular methods for potato virus and viroid detection and prevention. Genome, 1999, 42: 592-604.
- Xu H., D’Aubin J., Nie J. Genomic variability in Potato virus M and the development of RT-PCR and RFLP procedures for the detection of this virus in seed potatoes. Virol. J., 2010, 7: 25 ( ) DOI: 10.1186/1743-422X-7-25
- Bostan H., Peker P.K. The feasibility of tetraplex RT-PCR in the determination of PVS, PLRV, PVX and PVY from dormant potato tubers. Afr. J. Biotechnol., 2009, 8(17): 4043-4047.
- Nicot N., Hausman J.-F., Hoffmann L., Evers D. Housekeeping gene selection for real-time RT-PCR normalization in potato during biotic and abiotic stress. J. Exp. Bot., 2005, 56(421): 2907-2914 ( ) DOI: 10.1093/jxb/eri285
- Nasir I.A., Tabassum B., Latif Z., Javed M.A., Haider M.S., Javed M.A., Husnain T. Strategies to control potato virus y under in vitro conditions. Pak. J. Phytopathol., 2010, 22(1): 63-70.
- Zapata C., Miller J.C., Jr., Smith R.H. An in vitro procedure to eradicate potato viruses X, Y, and S from Russet Norkotah and two of its strains. In Vitro Cellular & Developmental Biology -Plant, 1995, 31(3): 153-159 ( ) DOI: 10.1007/BF02632012
- Морозова З.Р. Применение бактериальных рибонуклеаз и эндонуклеазы семеноводстве картофеля. Биологические науки, 1992, 338(2): 128-134.
- Леонова Н.С., Салганик Н.И. Применение бактериальной эндонуклеазы для оздоровления картофеля от вирусов. Сибирский вестник сельскохозяйственной науки, 1991, 5: 25-28.
- Lopez-Delgado H., Mora-Herrera M.E., Zavaleta-Mancera H.A., Cadena-Hinojosa M., Scott I.M. Salicylic acid enhances heat tolerance and potato virus X (PVX) elimination during thermotherapy of potato microplants. Am. J. Potato Res., 2004, 81(3): 171-176 ( ) DOI: 10.1007/BF02871746
- Paet C.N., Zamora A.B. Efficacy of thermotherapy and group culture of isolated potato meristems for the elimination of single and mixed infections of Potato Virus Y, Potato Virus S and Potato Leaf Roll Virus. Philipp. J. Crop. Sci., 1990, 15(2): 113-118.


