Паллиативное лечение больных с неоперабельным рецидивным раком гортани
Автор: Рожнов В.А., Андреев В.Г., Гулидов И.А., Панкратов В.А., Барышев В.В., Буякова М.Е., Вдовина С.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 3 (27), 2008 года.
Бесплатный доступ
В исследование включено 217 больных с неоперабельным морфологически верифицированным плоскоклеточным рецидивным раком гортани. Применено три метода паллиативного лечения: химиотерапия (33 пациента), лучевая терапия (97 больных) и химиолучевое лечение (87 пациентов). Повторные курсы лучевой терапии проводились в режиме традиционного фракционирования дозы в СОД от 30 до 60 Гр, общая доза с учетом предшествующего лучевого лечения первичной опухоли колебалась от 80 до 120 Гр. Наиболее эффективным методом является паллиативное лучевое и химиолучевое лечение, которое позволяет более чем в три раза увеличить выживаемость больных этой категории. Однолетняя выживаемость при химиотерапии составила 6,1 %, при лучевой терапии - 26,8 %, при химиолучевом лечении - 19,5 % (различия с химиотерапией статистически достоверны). Проведение паллиативной химиолучевой терапии позволяет добиться улучшения только непосредственных результатов лечения, но не влияет на продолжительность жизни больных по сравнению с лучевой терапией. Повторная лучевая терапия является наиболее эффективной в дозе выше 40 Гр, частота местных лучевых повреждений при этом незначительна. Метод паллиативного лечения рецидивного рака гортани должен определяться индивидуально.
Рецидивный рак гортани, лучевая терапия, химиотерапия
Короткий адрес: https://sciup.org/14054858
IDR: 14054858 | УДК: 616.22-006.6-036.65
Текст научной статьи Паллиативное лечение больных с неоперабельным рецидивным раком гортани
Достижения современной онкологии позволили добиться значительных успехов в лечении первичного рака гортани. Однако причиной смерти подавляющего большинства больных этой категории является местное прогрессирование опухоли. При этом лечение подобных пациентов является очень тяжелой задачей, что в первую очередь связано с неоперабельностью опухоли и высоким риском развития лучевых повреждений при назначении повторного курса лучевой терапии. Основным методом паллиативной терапии больных с неоперабельным рецидивом рака гортани считается проведение химиотерапевтического лечения [1, 3, 5, 7]. Работ, посвященных проведению повторных курсов лучевой терапии с паллиативной целью, крайне мало [2, 4, 6, 8], так как рецидивная опухоль считается радиорезистентной, помимо этого, велика вероятность возникновения лучевых повреждений.
Целью настоящего исследования явилось определение возможности и эффективности проведения повторного лучевого и химиолуче-вого лечения с паллиативной целью у больных с рецидивным раком гортани, возникшим после лучевого или комбинированного лечения.
Материал и методы
В исследование включено 217 человек с морфологически верифицированным реци- дивным плоскоклеточным раком гортани различной степени дифференцировки. Во всех случаях рецидивные опухоли возникли после предшествующего лучевого или химиолуче-вого лечения, которое проводилось либо как предоперационное в плане комбинированного лечения (СОД 40 Гр), либо как самостоятельная («радикальная») лучевая или химиолучевая терапия (СОД 56 Гр и выше). У всех больных рецидивные опухоли были признаны неоперабельными. Сроки между окончанием лечения первичной опухоли и рецидивом колебались от 6 мес до 10 лет. Было применено три метода паллиативного лечения: химиотерапия, лучевая и химиолучевая терапия.
Показанием к проведению повторного курса лучевой терапии являлось наличие рецидива опухоли при умеренно выраженных постлучевых изменениях мягких тканей шеи (не выше II– III cтепени), отсутствии или компенсированном состоянии воспалительных процессов в области опухоли. Предшествующая доза лучевой терапии и сроки между окончанием предыдущего лечения и возникновением рецидива существенно не влияли на назначение лучевого лечения.
Показания к проведению полихимиотерапии, как самостоятельной, так и адъювантной при химиолучевом лечении, значительно не отличались от показаний к проведению лучевой терапии. Противопоказанием к проведению полихимиотерапии являлась выраженная сопутствующая патология, наличие токсичности II–III степени после предшествующего химио-лучевого лечения.
Лучевую терапию осуществляли на отечественных гамма-терапевтических аппаратах типа АГАТ, РОКУС (РИП-75 см) и линейном ускорителе Philips SL-20. Размеры полей облучения варьировали в зависимости от распространенности опухолевого процесса и конституциональных особенностей пациента. Лечение во всех случаях осуществлялось по традиционной методике «дробно-протяженного» фракционирования дозы 2 Гр пять дней в нед. Суммарная очаговая доза определялась индивидуально в процессе лечения в зависимости от степени развившихся местных лучевых реакций и общего состояния пациента и колебалась от 30 Гр (ВДФ – 41 ед.) до 60 Гр. Общая доза лучевой терапии с учетом предшествующего лечения у пациентов, включенных в данное исследование, колебалась от 80 до 120 Гр.
Проведение полихимиотерапии при химио-лучевом лечении начиналось одновременно с первой фракцией лучевой терапии. Использовались различные схемы полихимиотерапии, которые определялись индивидуально в зависимости от использовавшихся ранее схем полихимиотерапии, а также индивидуальной переносимости примененных перпаратов. Расчет дозы химиопрепарата проводился по стандартной методике в зависимости от площади тела больного. Использовались следующие препараты: цисплатин, фторурацил, доксиру-бицин, метотрексат, циклофосфан, блеоцин, винкристин.
Самостоятельная и адъювантная полихи-миотерпия принципиальных отличий не имели. Осуществлялось несколько циклов полихимиотерапии (от 1 до 8) с интервалом в 3–4 нед. Показанием к окончанию лечения являлась выраженная токсичность и прогрессирование опухоли.
Согласно примененным методам лечения все больные были разделены на три группы, которые были сопоставимы по распространенности и локализации опухоли, что позволило нам провести сравнительный анализ с целью выявления наиболее эффективного метода паллиативного лечения:
-
- в I группе из 33 пациентов проводилась только паллиативная химиотерапия (ХТ). В зависимости от локализации опухоли больные распределились следующим образом: неоперабельный рецидив в области первичного очага – 13 (39,4 %) пациентов и неоперабельные рецидивные регионарные метастазы, без признаков опухоли в области первичного очага – 20 (60,6 %) человек. Согласно классификации TNM (2003) у всех пациентов этой группы распространенность рецидивной первичной опухоли соответствовала rT4, распространенность рецидивных метастазов rN2 была у 1 (5 %) больного, rN3 – у 19 (95 %) пациентов. Предшествующая доза лучевой терапии у больных этой группы была не менее 56 Гр;
-
- во II группе – (97 пациентов) получали только паллиативную лучевую терапию (ЛТ). В
зависимости от локализации опухоли больные распределились следующим образом: неоперабельный рецидив в области первичного очага – у 42 (43,3 %), неоперабельные рецидивные регионарные метастазы, без признаков опухоли в области первичного очага - 55 (60,6 %) пациентов. Согласно классификации TNM распространенность рецидивной первичной опухоли, соответствующей rT 3 N 0 M 0 , была у 10 (23,8 %), rT 4 N0-3M0- у 32 (76,2 %) пациентов. Распространенность рецидивного метастаза rN2 выявлена у 13 (23,6 %), rN3 – у 42 (76,4 %) больных;
-
- в III группе (87 пациентов) проводилась паллиативная химиолучевая терапия (ХЛТ). У 35 (40,2 %) больных был рецидив в области первичного очага, у 52 (59,7 %) – наблюдались неоперабельные рецидивные регионарные метастазы. По распространенности опухоли, согласно классификации TNM, больные распределились следующим образом: rT 3 N 0 M 0 - 7 (20 %), rT4N0-3M 0 - 28 (80 %), rN 2 - 13 (25 %), rN3 – 39 (75 %) пациентов соответственно.
Оценка эффективности проведенного лечения осуществлялась по нескольким критериям: средняя продолжительность жизни и общая выживаемость, длительность стабилизации и степень регрессии опухоли, купирование болевого синдрома, изменение общего состояния больного согласно статусу Карновского. Оценивались также осложнения, вызванные применяемым методом, такие как лучевые реакции или лучевые повреждения, вызванные повторным курсом лучевой терапии, токсичность химиотерапии при ее применении.
Результаты и обсуждение
У всех пациентов оценивался непосредственный эффект лечения по степени регрессии опухоли. Отсутствие регрессии рецидива при химиотерапевтическом лечении наблюдалось у 21 (63,0 %) больного, при самостоятельной лучевой терапии – у 17 (17,5 %), при химиолучевом лечении - у 7 (8,0 %) пациентов. Регрессия опухоли более 50 % зарегистрирована у 3 (9,0 %), у 47 (48,5 %) и у 50 (57,5 %) пациентов в группах паллиативной химиотерапии, лучевой и химио-лучевой терапии соответственно.
При всех видах паллиативного лечения отмечено снижение интенсивности болевого синдрома. В группе химиотерапии выраженный болевой синдром был зафиксирован у 11 (33,0 %) больных, а после лечения – у 3 (9,0 %). В группе лучевой терапии выраженный болевой синдром до лечения отмечен у 15 (15,5 %), после лечения – у 5 (5,2 %) пациентов. В группе химиолучевой терапии выраженный болевой синдром до лечения наблюдался у 15 (17,2 %), после лечения – у 2 (2,3 %) пациентов.
У больных, которым проводилась лучевая или химиолучевая терапия, из острых лучевых реакций преобладал пленчатый эпителиит, а со стороны кожных реакций - эритема кожных покровов. При дальнейшем динамическом наблюдении за этими пациентами в группах лучевой и химиолучевой терапии был выявлен постлучевой фиброз III степени в 10 (10,3 %) и 10 (11,5 %) случаях соответственно. В группе лучевой терапии у 4 (4,1 %) и в группе химиолучевой терапии у 1 (1,1%) больного образовались лучевые язвы в области полей повторной лучевой терапии. Токсичность II–III степени как в группе химиотерапии, так и в группе химиолучевого лечения выявлена в 9 % случаев (3 и 8 человек соответственно). При исследовании изменения общего состояния согласно статусу Карновского отмечено, что статус значительно не менялся после завершения лечения и у основной массы больных составлял 40–60.
Основными показателями эффективности паллиативного лечения считается длительность стабилизации опухолевого процесса и выживаемость больных. Эти показатели изучались помесячно. Для сравнительной оценки эффективности лечения по показателю длительности стабилизации опухоли использован срок 6 мес. При контроле в этой точке стабилизация опухоли в группе химиотерапии наблюдалась у 5 (15 %), в группе лучевой терапии – у 23 (23,7 %), в группе химиолучевого лечения – у 26 (29,9 %) пациентов.
Изучалась средняя продолжительность жизни больных в зависимости от метода лечения. В группе химиотерапии этот показатель составил 5,1 ± 0,7 мес, в группе лучевого и химиолуче-вого лечения - 8,9 ± 0,6 и 8,7 ± 0,5 мес соответственно. Однолетняя выживаемость (рис. 1) составила: группа химиотерапии – 6,1 ± 4,2 %; группа лучевой терапии – 26,8 ± 4,5 %; группа
Таблица 1
Причины смерти больных рецидивным раком гортани, (%)
|
Метод лечения |
Местное прогрессирование |
Отдаленные метастазы |
Вторая опухоль |
Осложнения лечения |
Другая |
|
ХТ (n=33) |
29 (87,9) |
3 (9,1) |
- |
1 (3,0) |
- |
|
ХЛТ (n=87) |
68 (78,2) |
9 (10,3) |
7 (8,0) |
2 (2,3) |
1 (1,2) |
|
ЛТ (n=97) |
75 (77,3) |
9 (9,3) |
4 (4,1) |
4 (4,1) |
5 (5,2) |
|
Всего (n=217) |
172 (79,3) |
21 (9,7) |
11(5,1) |
7 (3,1) |
6 (2,8) |
Таблица 2
Эффективность паллиативной лучевой терапии в зависимости от повторной суммарной очаговой дозы облучения, (%)
Таким образом, более высокая непосредственная эффективность наблюдается при проведении паллиативного химиолучевого лечения. Однако общая выживаемость после химиолу-чевой терапии несколько ниже по сравнению
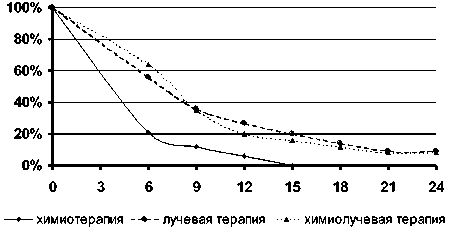
Рис. 1. Общая выживаемость больных рецидивным раком гортани при паллиативном лечении (мес)
с лучевым лечением. Следует учесть, что у больных, включенных в исследование, отмечалась выраженная опухолевая интоксикация, что усугубляло течение сопутствующей патологии, основная масса пациентов принадлежала к старшей возрастной группе. В связи с этим был проведен анализ причин смерти этих пациентов (табл. 1). Основной причиной смерти пациентов является местное прогрессирование опухоли. Наиболее эффективным методом паллиативного лечения местного рецидива опухоли является лучевая и химиолучевая терапия, так как уровень смертности от местной прогрессии ниже, чем при паллиативной химиотерапии.
Одной из наиболее актуальных проблем проведения повторных курсов лучевой терапии является определение суммарной очаговой дозы для достижения эффекта и уменьшения осложнений, связанных с лучевым лечением. Проведенный анализ показал, что различий в эффективности паллиативной лучевой и химио-лучевой терапии практически не наблюдается, хотя эти группы являются сопоставимыми по локализации и распространенности опухоли. В связи с этим мы решили объединить эти группы для увеличения выборки, что позволило провести более достоверный статистический анализ. У всех пациентов суммарная очаговая доза повторного облучения колебалась от 30 до 60 Гр.
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2008. №3 (27)
Мы решили рассмотреть эффективность лечения в зависимости от суммарной очаговой дозы и соответственно разделить пациентов на 3 группы: 1-я группа – СОД 30–39 Гр; 2-я группа – СОД 40–49 Гр; 3-я группа – 50 Гр и выше (табл. 2).
Оказалось, что наиболее высокая выживаемость и длительность стабилизации опухоли наблюдаются при проведении повторной лучевой терапии в суммарной очаговой дозе выше 50 Гр. При этой дозе регрессий опухоли более 50 % наблюдалось в два раза чаще (30,0 % против 66,7 %). Следует отметить, что и лучевые повреждения III–IV степени у пациентов, получивших лучевую терапию в дозе свыше 50 Гр, также в два раза выше. Однако лучевые язвы наблюдались только у 2 больных, получивших дозу повторного облучения 30–39 Гр, и у 2 больных с дозой свыше 50 Гр. Все это говорит о необходимости индивидуального подхода к определению суммарной очаговой дозы повторного курса лучевого лечения.
Заключение
Представленное исследование показало, что проведение повторного лучевого лечения с паллиативной целью возможно и при этом является значительно более эффективным, чем паллиативная химиотерапия. Общая однолетняя выживаемость при лучевом или химиолучевом лечении более чем в два раза выше по сравнению с паллиативной химиотерапией (р≤0,001). Также выше следующие показатели: степень регрессии опухоли, длительность стабилизации опухоли и купирование болевого синдрома. Двухлетняя выживаемость этих больных составляет 8 %, тогда как при паллиативной химиотерапии до этого срока не дожил ни один пациент.
При планировании исследования ожидалось, что комбинация двух методов противоопухолевого лечения (лучевой терапии и химиотерапии) позволит получить более высокие результаты лечения. К сожалению, при химиолучевом лечении отмечено только повышение непосредственной эффективности, при этом общая выживаемость существенно не отличалась от группы, где проводилась только лучевая терапия. Это говорит о необходимости дальнейшего поиска новых, эффективных схем полихимиотерапии. При определении оптимальной дозы повторной лучевой терапии выявлено, что суммарная очаговая доза должна составлять 40–60 Гр, что позволяет добиться более высоких результатов лечения, при удовлетворительной переносимости нормальных тканей.


