Parthenium argentatum A. Gray, Taraxacumkok-saghyz L.E. Rodin и Scorzonera tau-saghyz Lipsch. et Bosse как альтернативные источники натурального каучука: нужны ли они нам? (Обзор)
Автор: Америк А.Ю., Мартиросян Л.Ю., Мартиросян В.В., Мартиросян Ю.Ц.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Обзоры, проблемы
Статья в выпуске: 1 т.57, 2022 года.
Бесплатный доступ
Натуральный каучук (НК) - стратегически важное сырье, используемое для производства более 50 000 различных продуктов из резины и латекса. Во многих случаях, например в авиа- и автомобилестроении, он не может быть заменен синтетическими аналогами. Несколько важных факторов делают актуальным поиск альтернативных источников НК. Среди них сильная аллергическая реакция на изделия, изготовленные из латекса гевеи и опасность распространения южноамериканского фитофтороза (South American Leaf Blight, SALB) в Юго-Восточной Азии. Последнее нанесло бы невосполнимый урон производству природного полимера. В настоящее время единственным коммерчески значимым источником НК служит гевея Hevea brasiliensis (Willd. ex A. Juss.) Müll. Arg. - вечнозеленое дерево, растущее в тропических регионах. Неудивительно, что исследования по поиску и созданию альтернативных источников НК методом генетической инженерии интенсивно развиваются в Европе и Северной Америке. Среди публикаций ведущих исследовательских групп по тематике НК следует выделить работы лаборатории под руководством K. Cornish. Так, в 2000 году был опубликован один из первых детальных обзоров, посвященных альтернативным источникам НК (H. Mooibroek, K. Corhish, 2000). Годом позже был подробно описан биосинтез НК в эволюционно далеких каучуконосах (K. Cornish, 2001). Эти исследования получили развитие в последующих работах (К. Cornish, 2017). Детальные обзоры альтернативных каучуконосов представлены другими лидирующими группами (J. van Beilen с соавт., 2007; S.C. Gronover с соавт., 2011; D.T. Ray с соавт., 2005). Недавно мы опубликовали обзорные статьи, подробно описывающие биохимические и молекулярно-генетические аспекты биосинтеза НК (A.Y. Amerik с соавт., 2018; A.Y. Amerik с соавт., 2021). В представляемом обзоре мы уделяем особое внимание историческим аспектам проблемы, которым, по нашему мнению, не было уделено должного внимания в литературе, и сравниваем потенциальные альтернативные продуценты натурального каучука, способные заменить единственный на сегодняшний день коммерчески значимый источник полимера - H. brasiliensis. В качестве альтернативных каучуконосов рассматриваются два вида - мексиканский кустарник гваюла ( Pаrthenium argentatum A. Gray) и кок-сагыз, или русский одуванчик ( Ta-raxacum kok-saghyz L.E. Rodin). Безусловно, следует также упомянуть незаслуженно забытый, но очень перспективный альтернативный производитель НК - тау-сагыз ( Scorzonera tau-saghyz Lipsch. et Bosse). Наиболее изученный альтернативный каучуконос - T. kok-saghyz . Для биохимических и молекулярно-генетических исследований этого растения применялись современные молекулярно-биологические подходы - улучшенные протоколы трансформации, использование РНК-интерференции (сайленсинг) и EST (Expressed Sequence Tag) библиотек для идентификации новых генов. В результате были идентифицированы ключевые белки, ответственные за биосинтез НК, - цис-пренилтрансферазы 1-3 (СРТ1-3) (T. Schmidt c соавт., 2010) и активатор СРТ (RTA) (J. Epping с соавт., 2015). Необходимо отметить, что внутриклеточная концентрация СРТ регулирует биосинтез НК в клетках T. brevicorniculatum - ближайшего родственника T. kok-saghyz . Трансгенные линии, в которых экспрессия всех трех генов СРТ подавлялась методом РНК-интерференции (RNAi), демонстрировали практически полную супрессию биосинтеза НК (J. Post с соавт., 2012). Тем не менее необходимы дополнительные исследования, прежде чем каучук из T. kok-saghyz станет жизнеспособной альтернативой каучуку из H. brasiliensis. Исследования P. argentatum также интенсивно развиваются. В частности, следует отметить работы, которые проводятся в лаборатории D.K. Ro. Исследователи идентифицировали и охарактеризовали белковый комплекс, включающий СРТ и играющий ключевую роль в биосинтезе НК (А.М. Lakusta с соавт., 2019). К сожалению, исследования тау-сагыза ( S. tau-saghyz ) развиваются не столь успешно. Численность тау-сагыза критически снизилась в течение интенсивной заготовки в 1940-х годах. Работы по восстановлению этого уникального вида, у которого в корнях растений накопление НК в благоприятных условиях достигает 40 % сухой массы, ведутся в настоящее время в Казхахстанском национальном университете (С.К. Турашева с соавт., 2016). Таким образом, постоянно растущий спрос на НК в будущем не может быть удовлетворен за счет одного только каучукового дерева. Необходимы альтернативные культуры, которые можно выращивать на больших площадях в промышленных объемах, и соответствующие технологии переработки и получения конечных продуктов. В долгосрочной перспективе каучук из альтернативных культур, особенно его термостабильные производные, такие как эпоксидированный каучук, могут занять место на рынке, где в настоящее время представлены различные синтетические каучуки, при значительном сокращении углеродного следа.
Натуральный каучук, hevea brasiliensis, южноамериканский фитофтороз, salb, латекс, резина, аллергия, parthenium argentatum, taraxacum kok-saghyz, scorzonera tau-saghyz
Короткий адрес: https://sciup.org/142234467
IDR: 142234467 | УДК: 633.91:581
Текст обзорной статьи Parthenium argentatum A. Gray, Taraxacumkok-saghyz L.E. Rodin и Scorzonera tau-saghyz Lipsch. et Bosse как альтернативные источники натурального каучука: нужны ли они нам? (Обзор)
Натуральный каучук (НК) — один из важнейших биополимеров, синтезируемых высшими растениями, который широко используется в промышленности и медицине. Он обладает уникальными физическими свойствами (эластичность, упругость, удароустойчивость, эффективное тепло-рассеивание) и способен сохранять пластичность при пониженных температурах (1-4). Несмотря на научно-технический прогресс в разработке технологий синтеза каучуков, в настоящее время не существует синтетического каучука, который по основным характеристикам соответствовал бы НК.
При развитии промышленного производства синтетических каучуков (СК) в технологию внесено много новаций, положительно отразившихся на потребительских свойствах каучука. СК представляет собой искусственный эластомер, полученный из различных мономеров; его синтезируют, используя разное сырье (нефть, уголь, природный газ и ацетилен). Одними из наиболее часто используемых синтетических каучуков являются этилен-пропилен-диен, полиизопрен, полибутадиен, стирол-бутадиен и изо-бутилен-изопрен. Они широко применяются для изготовления шин, конвейерных лент, ремней, шлангов, разнообразных уплотнителей, напольных покрытий и обуви. В России также созданы высокотехнологичные производства синтетических каучуков. При применении различных высокоэффективных катализаторов — инициаторов синтеза (условно называемых литиевый и титановый), образуются полиизопрены, содержащие до 93-98 % цис-1,4-звеньев. Однако оба эти вида СК по однородности микроструктуры уступают НК, макромолекулы которого содержат до 100 % цис-1,4-звеньев, присоединенных исключительно по типу 1,4-1,4 («голова к хвосту»). Несовершенства в микроструктуре синтетических полиизопренов проявляются прежде всего в их меньшей способности к ориентации и кристаллизации по сравнению с НК, что отражается на прочностных и динамических характеристиках. Тем не менее необходимо отметить, что некоторые виды синтетических каучуков по ряду технических свойств превосходят натуральный каучук (5).
Спрос на НК на две трети определяется производством автомобилей. Прежде всего речь идет о шинах, которые направляются на первичную комплектацию новых автомобилей. Шина изготавливается из различных материалов, в том числе из нескольких резиновых компонентов, каждый из которых имеет конкретное и уникальное назначение. НК используется в каркасах шин, требующих высокой прочности, в то время как синтетические каучуки используются в материалах протектора для обеспечения сцепления шины с дорогой. В настоящее время доля НК, применяемого в шинной промышленности, составляет примерно 50 % от всех используемых видов каучуков (6).
Природный полимер становится все более востребованным по мере развития высоких технологий. Например, резиновые компоненты авиационных шин, предназначенных для работы с огромными нагрузками и скоростями при минимально возможных размере и массе, изготавливаются только из НК. Для производства крупногабаритных шин также в основном используется НК. Еще одни примером исключительного применения НК служит производство грузовых карьерных шин и шин с цельным металло-кордом в каркасе. Однако по сравнению с СК, НК менее устойчив к воздействию масел, некоторых химикатов и кислорода. Он также более под- вержен старению, эрозии и сохраняет пластичность в меньшем интервале температур по сравнению с СК (7).
Следует отметить, что эти недостатки в значительной степени могут быть нивелированы эпоксидацией НК (8). Эпоксидированный натуральный каучук (ЭНК) представляет собой молекулярную структуру, которая несет эпоксидную группу, заменяющую двойные связи в основной цепи каучукового полимера НК. ЭНК обладает потребительскими свойствами (меньшая газопроницаемость, лучшая маслостойкость), которые позволяют широко применять его в промышленности (9).
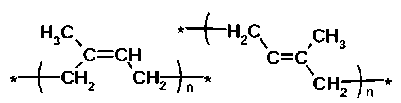
Рис. 1. Структура растительных полиизопренов: каучук (слева) — цис-1,4-полиизопрен, гуттаперча (справа) — транс-1,4-полиизопрен.
По составу свежий латекс содержит около 60 % воды, 35 % цис-1,4-полиизопрена и 5 % неизопреновых молекул. НК, в свою очередь, представляет собой углеводород из группы изопреноидов, в структуре которого мономеры — молекулы изопрена С5Н8. Углево- дородная составляющая НК содержит до 99,5 % и более 1,4-цис-изопрено-вых звеньев (рис. 1). Также в латексе есть 5 % других органических соединений. Это в основном белки, липиды, углеводы, и их распределение во фракциях латекса неоднородно. Хотя эти вещества составляют незначительную часть латекса, некоторые из них остаются в НК после обработки, и считается, что они играют решающую роль в свойствах НК. На самом деле эти примеси, вероятно, обусловливают лучшие механические свойства НК по сравнению с его синтетическими аналогами, но они также служат причиной нестабильного качества НК. Более 2500 видов растений синтезируют HK (10), однако только очень немногие из них способны производить экономически значимые количества высококачественного полимера с молекулярной массой более 106 Да (11-13).
Интересно, что группа растений, синтезирующих высокомолекулярный полиизопрен в транс-конфигурации (см. рис. 1), весьма ограничена. К ним относятся Palaquium gutta , Mimusops balata и Eucommia ulmoides . Образуемые ими полимеры (соответственно гуттаперча, балата и китайская гуттаперча) (14-16) не являются НК.
Несмотря на то, что синтезировать НК могут многие растения, единственным коммерчески значимым источником HK в настоящее время остается Hevea brasiliensis ( Willd. ex A. Juss.) M u ll. Arg. (бразильское каучуковое дерево, гевея) (17). Спрос на натуральный каучук постоянно увеличивается. По предварительным оценкам, ожидается прирост мирового производства НК на 1,8 % (до 13,836 млн т), в то время как в течение 2021 года прогнозировался рост мирового спроса на 8,3 % (до 14,028 млн т). По прогнозам, к 2023 году он составит примерно 16,5 млн т в год и будет расти в дальнейшем (18). Безусловно, существуют опасения, что современные плантации деревьев гевеи не смогут удовлетворить возрастающие потребности в этом продукте. Процесс сбора НК очень трудоемкий и не поддается механизации. Растения начинают производить значительные количества НК с 5-7летнего возраста (19). Кроме того, гевея может расти в достаточно узком климатическом поясе тропических лесов (рис. 2) (17).
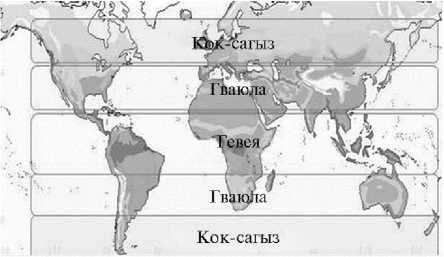
Рис. 2. Географическое распространение гевеи Hevea brasi-liensis (Willd. ex A. Juss.) M u ll. Arg., гваюлы Parthenium argentatum A. Gray и кок-сагыза Taraxacum kok-saghyz L.E. Rodin. Рисунок взят из статьи K. Cornish (17).
Следует также отметить, что производство НК находится в зоне особого риска в связи с тем, что для возделывания гевеи (в отличие от других сельскохозяйственных культур) использовали только несколько близкородственных клонов (17). Таким образом, единственный клон мог составлять основу плантаций площадью в сотни тысяч гектаров. Как следствие, множество фи-топатогенных грибов инфицируют генетически однородные растения, подвергая плантации гевеи огромной опасности. Так, в Бразилии
южноамериканский фитофтороз (South American Leaf Blight, SALB) — летальное для H. brasiliensis заболевание, вызываемое грибом Microcyclus ulei , привел к почти полному прекращению производства НК (рис. 3).

Рис. 3. Симптомы южноамериканского фитофтороза (South American Leaf Blight, SALB, возбудитель — аскомицет Microcyclus ulei ) на листьях (вверху) и стебле (внизу) гевеи Hevea brasiliensis (Willd. ex A. Juss.) M u ll. Рисунок взят из статьи J. Guyot с соавт. (20).
Бывший лидер по поставкам натурального каучука в настоящее время производит лишь 1,5 % его мирового объема, в то время как для собственных нужд необходимо в разы больше. В результате Бразилия сама зависит от импорта НК из Юго-Восточной Азии. В настоящее время проводятся исследования по получению генотипов H. brasiliensis , устойчивых к SALB, однако потребуется как минимум 25 лет для замены существующих растений на клоны, невосприимчивые к болезни (17, 20, 21). Следует также отметить, что многократный контакт с некоторыми белками латекса гевеи приводит к аллергической сверхчувствительности первого типа (17). Таким образом, диверсификация продуцентов НК становится первостепенной задачей для обеспечения потребностей в этом полимере.
Цель настоящего обзора — сравнительный анализ потенциальных альтернативных продуцентов натурального каучука, способных заменить единственный на сегодняшний день коммерчески значимый источник полимера — H. brasiliensis. В настоящее время в качестве таковых рассматриваются Parth enium argentatum A Gray (гваюла) и Taraxacum kok-saghyz L.E. Rodin (кок-сагыз, русский одуванчик). P. argentatum — многолетний кустарник, растущим в мексиканской пустыне Чиуауа и Южном Техасе (22). T. kok-saghyz представляет собой травянистое растение, в природе растущее в Казахстане, Южной Сибири, Узбекистане и Китае (23, 24). В обзоре также уделено внимание многолетнему полукустарнику тау-сагызу (Scorzonera tau-saghyz Lipsch. et Bosse) — представителю рода Козелец.
История производства натурального каучука. То, что НК может быть получен из некоторых деревьев и использован для различных целей, было известно еще во времена древних цивилизаций Центральной и Южной Америки задолго до появления там европейцев. Хроники ацтеков повествуют о том, что НК собирался в качестве дани с покоренных народов и использовался в религиозных церемониях. Он также использовался для изготовления мячей и водонепроницаемой одежды. Для европейцев НК в 1743 году открыл Шарль Мари де ля Кондамин (Charles-Marie de la Conda-mine) — один из первых исследователей Амазонии, составивший довольно точную ее карту. От местных индейцев он узнал о каучуке и хинине и в одной из экспедиций описал процесс изготовления каучуковых изделий и лечение малярии хинином. Способность НК стирать карандашные надписи заметил Джозеф Пристли (Joseph Priestley), который в 1770 году ввел в европейский обиход английское слово «каучук» (rubber). Уникальные гидрофобные свойства НК были обусловлены первые попытки его использования в Европе для изготовления водонепроницаемой одежды и обуви (25).
Однако широкомасштабное применение НК в промышленности было крайне затруднено до тех пор, пока в 1818 году Джэймс Сайм (James Syme) не обнаружил, что бензол способен растворять НК, а Чарльз Макинтош (Charles Mackintosh) использовал это открытие для создания специальной ткани, содержащей водонепроницаемый слой НК. Плащи из этой ткани получили название макинтоши (26). Следует отметить, что изделия, изготовленные из натурального каучука, обладали серьезными недостатками — становились мягкими и липкими при повышенной температуре летом и твердыми и хрупкими зимой. Поэтому интерес к изделиям из НК падал до 1839 года, когда Чарльз Гудиер (Charles Goodyear) после 5 лет исследований, которые едва не привели его к банкротству, открыл, что воздействие высокой температуры и серы стабилизирует НК и приводит к тому, что его уникальные свойства сохраняются в широком диапазоне температур. Позднее этот процесс получил название вулканизации (27). Именно вулканизация с последующими модификациями расширила возможности использования НК в промышленных масштабах. Вулканизированный НК (резина) можно хранить долгое время и транспортировать в любую точку земного шара. Резина быстро стала неотъемлемой частью в авиа- и автомобилестроение (шины), производстве электроприборов (изоляторы) и различных медицинских устройств.
Широкомасштабный сбор НК в бассейне Амазонки начался в конце 19 века около бразильского атлантического порта Пара и со временем распространился на восток Южноамериканского континента. Быстрое развитие автомобильной, медицинской промышленности, электроэнергетики привело к стремительному увеличению спроса на НК. За 12 лет (с 1890 по 1910 год) производство НК выросло в 6 раз (25).
В качестве потенциальных промышленных источников НК исследовали несколько каучуконосов. Это разные виды Sapium (caucho blanco) (28), Castilla (caucho negro) (29) и H. brasiliensis (17, 29-31). Было показано, что именно последнее растение продуцирует высококачественный натуральный каучук. Близкий родственник H. brasiliensis — H. guianensis также синтезирует НК, но низкого качества (32). Гевея H. brasiliensis была найдена только в бассейне реки Путумайо (приток Амазонки). НК H. brasiliensis получают, подсекая кору (рис. 4), но сбор млечного сока возможен только 6 мес в году, так как деревья растут в низинах, подверженных затоплению в сезон дождей.

Рис. 4. Сбор латекса гевеи .
Первоначально ^К также получали круглогодично, используя деревья рода Castilla — C. elastica и C. ulei , растущие на незатопляемых возвышенностях. Однако в этом случае требовалось механическое разрушение и глубокая переработка древесины, и, как и следовало ожидать, сырьевая база быстро иссякла (29). Таким образом, H. brasiliensis была окончательно выбрана в качестве оптимального источника ^К.
В 1857 году Томас Хан-кок (Thomas Hancock) — основатель британской компании
«Thomas Hancock’s clothing» предложил создать плантации H. brasiliensis. В течение 1870-х годов в Королевские ботанические сады в Лондоне (Kew Gardens) были доставлены три коллекции семян H. brasiliensis из Южной Америки. Одна из них принадлежала Генри Уикхему (Henry Wickham), жившему в то время в верхней части Амазонии в районе одного из крупнейших правых притоков Амазонки — Тапажос (17). В 1876 году он привез в Лондон около 70 000 семян, из которых 2700 проросли. Значительное число проростков направили в Малайзию и Цейлон, несколько — в Индонезию и Сингапур. Благодаря упорному труду местного населения и британских переселенцев к 1907 году на плантациях в Юго-Восточной Азии удалось вырастить около 10 млн деревьев гевеи. В 1912 году экспорт латекса из Малайзии и Индонезии составил 8500 т, но это было существенно меньше экспорта из бассейна Амазонки — 38 000 т. Коммерческое производство в Юго-Восточной Азии продолжало расширяться, и в 1917 году азиатские колонии Великобритании, Франции и Голландии экспортировали уже 370 000 т ^К. Это привело к резкому падению цен на ^К, что сделало его производство в Амазонии нерентабельным (25). В 1920-х годах Генри Форд (Henry Ford) попытался возобновить сбор ^К на плантациях Fordlandia в бассейне Амазонки, но SALB (см. рис. 3), вызываемый грибом Microcyclus ulei, свел на нет эти усилия (20, 21).
^еудивительно, что США были заинтересованы в независимом источнике ^К. Альтернативный каучуконос — гваюлу (P. argentatum) сначала использовали в Мексике и несколько позже в США. Однако из-за истоще ния запасов сырья в Мексике, мексиканской революции и Великой депрессии производство ^К достаточно быстро прекратилось. ^а пике развития оно давало около 20 % от общего количества полимера, потребляемого в США (10, 22).
Следующая попытка найти альтернативные источники ^К была вызвана захватом Японией плантаций H. brasiliensis в Юго-Восточной Азии в 1942 году в ходе Второй мировой войны. Это привело к тому, что страны антигитлеровской коалиции лишились источников ^К. В это время в США начало интенсивно развиваться производство СК и вновь проявился интерес к альтернативным источникам ^К. Кроме уже упомянутых гваюлы
( P. argentatum ) и русского одуванчика ( T. kok-saghyz ), в этом качестве рассматривали каучуковую лозу (rubber vine, Cryptostegia grandiflora R. Br.) (33) и золотарник (golden rod , Solidago leavenworthii Torr. & A. Gray) (34). Однако после окончания Второй мировой войны относительно дешевый НК из Юго-Восточной Азии вновь стал доступен на мировом рынке. Это обстоятельство, а также расширение производства синтетического каучука привели к тому, что к середине 1950-х годов альтернативные источники НК практически перестали представлять коммерческий интерес. Однако некоторые исследования, связанные с T. kok-saghyz , проводились в Советском Союзе вплоть до его распада в 1991 году (10, 35, 36).
Интерес к гваюле возобновился после глобального распространения смертельно опасной аллергии 1-го типа к белкам латекса H. brasiliensis (37). Проведенные исследования показали, что латекс из P. argentatum не содержит белков, вызывающих аллергию, и изделия из него могут использоваться людьми, чувствительными к белкам латекса гевеи (38, 39). Но в целом H. brasiliensis пока остается единственным коммерчески значимым каучуконосом.
Синтез каучука у каучуконосов. Структурно полимеры, производимые разными каучуконосами, — это цис-1,4-полиизопрены, синтез которых начинается с образования двух или трех транс-инициаторных единиц (40-44). Однако молекулярная масса, макромолекулярная структура, межмолекулярные связи и химический состав молекулы зависят от конкретного каучуконоса и влияют на свойства НК (10, 44-46). Растения производят много различных цис-полиизопренов, но к НК относятся только полимеры, содержащие как минимум 100 изопреновых единиц, и как минимум 15 000 единиц необходимы для того, чтобы полимер мог быть отнесен к высококачественным НК (17).
НК — эластичный материал, который возвращается к исходному размеру и форме после деформации. Это происходит потому, что НК способен претерпевать деформационную кристаллизацию (47, 48). Кристаллизация представляет собой фазовый переход (от аморфного к кристаллическому состоянию), сопровождаемый выделением тепла, изменением удельного объема и физико-механических свойств. При растяжении каучука кристаллизация происходит достаточно быстро и сопровождается ориентацией молекулярных звеньев вдоль направления растяжения. Под воздействием специальных реагентов (сера, пероксиды, оксиды металлов, соединения аминного типа) происходит вулканизация каучука — сшивание молекул в единую пространственную сетку (27). При этом повышаются прочностные характеристики каучука, его твердость и эластичность, однако снижаются пластические свойства, степень набухания и растворимость в органических растворителях. Скорость вулканизации и плотность сшивок критическим образом зависят от компонентов НК, не относящихся к полиизопренам. Эти компоненты специфичны для каждого каучуконоса, что приводит к существенным различиям в свойствах конечного продукта (17).
Синтез НК происходит в цитоплазматических каучуковых частицах (рис. 5) (49, 50). Такие частицы часто образуются в мультиядерных клетках коры или корней, называемых латициферами (51, 52). Это утверждение справедливо для коры H. brasiliensis и корней T. kok-saghyz . Интересно, что у P. argentatum каучуковые частицы формируются в цитозоле паренхималь-ных клеток коры (53). Вполне вероятно, что различия в химическом составе НК из разных источников обусловлены специфическими особенностями цитозолей, в которых находятся каучуковые частицы (54).
A
Б
В

Рис. 5. Микрофотография каучуковых частиц из Hevea brasiliens (A) , Parthenium argentatum (Б) и Ficus elastica (В) , полученная с помощью электронного сканирующего микроскопа. Размер масштабных линеек 1 мкм (A и Б) и 2 мкм (В). Рисунок взят из статьи K. Cornish (17).
Альтернативные источники натурального каучука и их сравнительная оценка. Хотя генетическую устойчивость гевеи к SALB в последнее время изучают достаточно активно, по прогнозу для создания высокопродуктивных плантаций на основе невосприимчивых к SALB растений потребуется как минимум 25 лет (17). Следовательно, биодиверсификация источников НК остается крайне важной задачей.
В настоящее время в качестве альтернативных каучуконосов рассматриваются P. argentatum (гваюла) и T. kok-saghyz (кок-сагыз, русский одуванчик). Отметим, что три каучуконоса — H. brasiliensis, P . argentatum и T. kok-saghyz произрастают в разных географических областях — соответственно Центральная и Южная Америка; север Мексики и юго-восток США (в основном Техас); Казахстан, юг Сибири, Узбекистан и СевероЗападный Китай, но вместе их ареалы покрывают практически все мировые области, доступные для земледелия (см. рис. 2) (17). Оба альтернативных источника НК интенсивно изучают в США и Европе для обеспечения безопасности и ценовой стабильности рынка НК. Предполагается, что именно гваюла станет новой или альтернативной культурой для засушливых и по-лузасушливых районов юго-запада США, севера центральной части Мексики и регионов с аналогичным климатом по всему миру (22, 25).
А
Б

Рис. 6. Гваюла ( Parthenium argentatum ): растение в условиях природного произрастания (А) и плантационное выращивание гваюлы (Б). Рисунок взят из статей J. van Beilen с соавт. (11, 12).
Гваюёа (Parthenium argentatum). Среди потенциальных альтернативных источников НК гваюла (рис. 6) выделяется тем, что, как уже отмечалось, имеет относительно долгую историю коммерциализации и даже краткосрочные периоды критически важных интенсивных исследований (22). К сожалению, в последующем этим исследованиям уделялось недостаточно внимания, в итоге полученный генетический материал и опыт селекцион- ной работы были утрачены.
Селекция P. argentatum. Фрагментарные селекционные исследования гваюлы в течение XX века привели к частичному одомашниванию P. argentatum. Состояние этих работ было проанализировано дважды — в 1991 (55) и в 2005 (56) годах. Селекция P. argentatum значительно облегчается очень высокой вариабельностью между и внутри линий для каждого анализируемого признака (в частности, количество и качество НК, сухая масса, количество смол, выход НК) (11). Но в то же время для селекционеров P. argentatum и H. brasiliensis — сложные объекты, так как это многолетние растения, к тому же для выполнения соответствующих программ требуются относительно большие площади. Гваюла достигает генеративной фазы развития примерно к 2 годам и размножается преимущественно бесполым способом — апомиксисом (10, 11). Таким образом, селекция в основном сводится к изоляции растений, дающих более высокий выход НК. В этом достигнут существенный прогресс, поскольку несколько новых линий, которые были получены в результате работ, финансируемых министерством сельского хозяйства США (United States Department of Agriculture, USDA), производили в пять раз больше НК, чем линии, используемые в 1940-х и 1950-х годах (56). К сожалению, успех был не полный, так как потомки выбранных линий оказались неспособны воспроизвести результаты высокоэффективных родителей (10, 56). Тем не менее подобный подход, безусловно, имеет потенциал. Аналогичные исследования, выполненные на H. brasiliensis , за 40 лет привели к увеличению продуктивности линий в 10 раз — с 300 кг/га в год до 3000 кг/га в год (10; K. Cornish, персональное сообщение).
Молекулярно -генетические исследования P. argentatum. Дикорастущая гваюла представлена в природе диплоидами (2 n = 2* = 36), триплоидами (2 n = 3* = 54) и тетраплоидами (2 n = 4* = 72). Интересно, что в условиях культивирования были идентифицированы растения с числом хромосом, достигающим октаплоида (2 n = 8* = 144). Следует отметить, что диплоиды размножаются преимущественно половым путем, полиплоиды — факультативным апомиксисом. Гваюла также имеет спорофитную систему самонесовместимости, и многие растения содержат B- или сверхштатные хромосомы (57, 58).
Клонировано достаточно большое число генов P. argentatum, кодирующих ферменты и белки, которые участвуют в биосинтезе НК, включая ген, кодирующий основной белок каучуковых частиц гваюлы (major guayule rubber particle protein, RPP) (59). Также клонирован ген, кодирующий белок с молекулярной массой 24 кДа, прочно ассоциированный с так называемым малым белком каучуковых частиц гваюлы (so called small rubber particle protein, SSRP). Функциональный анализ in vitro с использованием гетерологичной экспрессии в клетках Escherichia coli показал, что ген SSRP может принимать участие в синтезе полиизопреновой цепи (59). Выделены и исследованы несколько других белков, ассоциированных с каучуковыми частицами, однако их функции только предстоит установить (61). Основной белок, связанный с каучуковыми частицами у P. argentatum, — цитохром Р450 с молекулярной массой 53 кДа. Это член семейства CYP74 и обладает высокой степенью гомологии с аллен-оксид-синтазой (allene oxide synthase, AOS). На его долю приходится примерно 50 % от общего белка каучуковых частиц. Несмотря на то, что он каталитически активен (превращает 13(S)-гидроперокси-октадекаденоидиновую кислоту в а- и Y-кетоловые жирные кислоты) и является основным белком промытых каучуковых частиц, способных синтезировать НК, его роль в этом процессе неясна. Более того, он не обладает структурной гомологией с цис-пренилтрансферазами (60, 61).
Существенный прогресс был достигнут в молекулярно-биологических исследованиях белкового комплекса, ответственного за синтез НК у P. argentatum . Этот комплекс включает цис-пренилтрансферазы (CPT), непосредственно участвующие в синтезе полиизопреновой цепи, и белки, необходимые для их активности (CBP/RTA) (62). Транскриптом диплоида гваюлы доступен в базе данных NCBI (National Center for Biotechnological Information, GenBank: PI1478640) (63). Анализ транскиптома с использованием тканей корней, листьев, цветов и стеблей (всего 51947 транскриптов, собранных из 983 076 фрагментов) при сравнении с идентифицированными ранее последовательностями генома салата Lactuca sat^va (64) показал, что в гваюле экспрессируются гены трех белков CPT (PaCPT1-3) и одного белка CBP (CPT-Binding Protein, белок, связывающий CPT) (62, 65).
В клетках эукариот короткий олигоизопреноид долихол с числом мономерных единиц от 8 до 18 необходим при транспорте молекул сахаров для пост-трансляционного гликозилирования (66). Поэтому у всех эукариот присутствует как минимум одна пара СРТ и СВР. Отсутствие одного из этих белков летально для клетки. Дрожжи Sacharomyces cerevisiae имеют один гомолог СВР (Nus1) и два гомолога СРТ (Rer2 и Srt1).
Для исследования функции комплекса СРТ/СВР был сконструирован двойной мутант rer2 A str1 A , который жизнеспособен только в присутствии URA3-плазмиды, несущей ген RER2 (62). На среде, содержащей 5-фтороротовую кислоту (5-FOA), экспрессия Ura3 превращает 5-FOA в токсичное производное — 5-фтороурацил. Таким образом, только клетки, в которых утрачена URA3-плазмида и rer2A srt1A мутации комплементиро-ваны комбинацией PaCBP/РаCPT1-3, могут расти на средах, содержащих 5-FOA. Комплементационный анализ в дрожжах показал, что PaCBP необходим для ферментативной активности PaCPT1-3. Гены PaCBP и PaCPT1-3 поодиночке или в сочетании были экспрессированы в двойном мутанте rer2A srt1A. Действительно, оказалось, что только PaCBP вместе с одной из PaCPT могут комплементировать двойной мутант. По отдельности PaCBP и PaCPT1-3 не способны поддерживать рост дрожжевых клеток на средах, содержащих 5-FOA (62) (рис. 7).
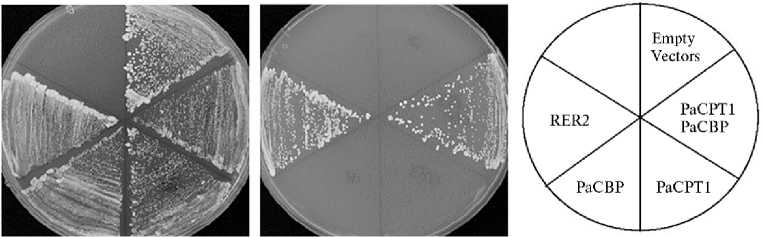
Рис. 7. Функциональная комплементация мутанта rer2∆ srt1∆ ( Sacharomyces cerevisiae) плазмидами, кодирующими PaCPTl и PaCBP. Штамм дрожжей rer2 Д srtl Д является летальным, но поддерживается за счет экспрессии RER2 в URA-селективной плазмиде. Этот штамм использовали для трансформации плазмид, экспрессирующих как PaCPTl-3 , так и PaCBP . Успешные трансформанты высевали штрихами на планшеты для селекции в присутствии 5-FOA для удаления содержащей RER2 URA-плазмиды. Рост дрожжей при селекции на 5-FOA наблюдали только для пар PaCPT/PaCBP или ретрансформированного RER2 в TRP-плазмиде. При экспрессии только PaCPT или только PaCBP роста не наблюдалось. Рисунок взят из статьи A.M. Lokusta c соавт. (62).
Более того, было показано, что экстракты из клеток дрожжей, рас- тущих на средах с 5-FOA, проявляют цис-пренилтрансферазную активность. Следует также отметить, что результаты двугибридного анализа с использованием технологии расщепленного убиквитина и коиммунопреципита-ции убедительно показали, что PaCBP и PaCPT1-3 взаимодействуют друг с другом (62).
Культивирование P. argentatum. Гваюла — многолетний кустарник, растущий в холмистых областях пустыни Чиуауа в Мексике и районе Биг Бенд в Южном Техасе. Температура в этих регионах варьирует от - 18 до +50 ° С. Высокая температура, видимо, не влияет отрицательно на рост растения, но при значениях ниже +4 ° С гваюла впадает в анабиоз. Продолжительное нахождение растения при отрицательных температурах может привести к его гибели (11). Одна из проблем, возникающих при культивировании P. argentatum, — заболевание корней, особенно в стоячей воде (67). Оптимальными для культивирования гваюлы являются хорошо осушенные известняковые и песочно-глинистые почвы с относительно низким содержанием питательных веществ. В целом растение достаточно неприхотливо, его успешно выращивали в условиях пустыни и полупустыни, тропического леса и средней полосы с умеренными температурами и характерным для этих широт количеством осадков (11).
P. argentatum предпочитает регионы, в которых ежегодно выпадает от 280 до 640 мм осадков. Показано, что для максимального выхода НК необходима интенсивная ирригация. Интересно, что образование НК и смол увеличивается пропорционально доступности воды. Несмотря на то, что для интенсивного роста и продукции НК требуется значительное количество воды, растение устойчиво к засушливым условиям, периоды которых могут быть длительными, однако синтез НК при этом прекращается (68).
Выход НК сильно варьирует между линиями. Более того, у растений одной и той же линии он часто заметно различается в зависимости от региона, почвы и погодных условий. Время года и возраст растений также влияют на выход НК и смол. У некоторых сортов содержание НК существенно различалось в зависимости от времени года, у других эффект был не столь очевиден. Для набора из восьми сортов P. argentatum было показано, что с возрастом растений количество биомассы увеличивается, однако динамика накопления НК и биомассы различается (69). Некоторые исследования показывают, что старые растения могут содержать очень большое количество НК. Так, выход биомассы может достигать 20 т/г в год, тогда как НК — 2 т/га в год (K. Cornish, персональное сообщение).
Гваюла синтезирует и накапливает каучуковые частицы преимущественно в эпителиальных клетках паренхиматозной ткани. Технологии получения НК из биомассы гваюлы подробно описаны в литературе. Разработаны и применяются три способа получения НК из гваюлы. Первый и самый старый метод — флотация. Измельченные растения помещают в большую емкость с раствором щелочи, древесная ткань впитывает воду и опускается на дно, а смолистая резина всплывает на поверхность в виде так называемых «червей». В дальнейшем резину с помощью ацетона очищают от смол (70). Второй метод — последовательная экстракция, при которой смолу сначала экстрагируют ацетоном или другим полярным органическим растворителем, а затем каучук экстрагируют гексаном (71). Третий метод обработки — одновременная экстракция, при которой используется смесь растворителей, обычно ацетон и гексан или пентан. После первоначальной экстракции добавляют еще ацетон для коагуляции высокомолекулярного каучука (72).
Согласно экономическим прогнозам, для того, чтобы без субсидий гваюла стала конкурентоспособной культурой, необходимо увеличить выход каучука и/или определить и разработать коммерческое использование побочных продуктов переработки (73). Один из потенциально ценных побочных продуктов — низкомолекулярная фракция каучука, на долю которой приходится примерно 25 % его общего выхода. Эти резиновые смеси с низкой молекулярной массой имеют большое значение в качестве специального каучука, не используемого в шинах (73). Другой побочный продукт переработки — смолы — охарактеризован лишь частично, но преимущественно представляет собой триглицериды жирных кислот и терпеноиды. Смолы успешно используются в качестве консервантов для древесины, сырья для специальных химикатов (покрытий и добавок к резине), а также в качестве высококачественного топлива без золы (11, 73).
Достоинства и недостатки натурального каучука из P. argentatum. Молекулярная масса и свойства НК из гваюлы очень близки к таковым у НК из гевеи. Однако, в отличие от НК из H. brasiliensis , натуральный каучук из гваюлы не содержит белков, способных вызывать сильнейшую аллергическую реакцию (38). Это важное преимущество возродило интерес к НК из P. argentatum . Например, компании «Yulex» (Solana Beach, CA, США) и PanAridus («Casa Grander», AZ, США) производят такой НК, практически не содержащий аллергенных белков. Он может быть использован для изготовления гипоаллергенных перчаток и другой продукции медицинского назначения, в которой прочность и упругость НК сочетается с отсутствием опасной аллергенности.
Выделенный непосредственно из растения и высушенный НК гваюлы может содержать от 20 до 40 % смолы. Если НК экстрагировали растворителями и затем подвергали обработке для удаления смолы, то вязкость такого НК существенно ниже вязкости НК из H. brasiliensis . Для получения из гваюлы высокомолекулярной фракции НК, близкой по свойствам к НК из гевеи, необходима селективная коагуляция (74). НК из H. brasiliensis содержит белки и, следовательно, реакционно-активные группы, способные к сшиванию (crosslinking). Это приводит к образованию разветвленных полимерных цепей, и в результате вязкость НК при хранении в течение долгого времени увеличивается. В лишенном белков НК из P. argentatum , напротив, происходит необратимое расщепление цепей, индуцированное температурой. То есть такой НК менее устойчив к повышенной температуре, чем НК из H. brasiliensis . Более того, триглицериды ненасыщенных жирных кислот, присутствующие в смоле, способствуют окислению полимерных цепей. Для предотвращения процесса окисления и увеличения стабильности НК из гваюлы используется комбинация антиоксидантов и диалкилдитиокарбамата цинка (74).
Кок-сагыз, «русский одуванчик» (T. kok-saghyz). Идеальный каучуконос должен давать урожай ежегодно, быстро расти и производить большое количество биомассы. Растения, дающие ежегодный урожай, можно быстро высаживать и убирать в зависимости от потребностей в продукте и ситуации на рынке. Кок-сагыз ( T. kok-saghyz ) в большей степени соответствует этим критериям, чем гваюла.
T. kok-saghyz (рис. 8) был обнаружен в Казахстане, в долинах Тянь-Шаня и впервые описан ботаником Л. Е. Родиным в 1932 году при реализации стратегической программы СССР по развитию собственного производства НК. Изучение 1048 видов из 316 родов и 95 семейств отечественной флоры показало, что 609 видов синтезируют каучук и каучукоподобные вещества.

Рис. 8. Растения кок-сагыза ( Taraxacum kok-saghyz L.E. Rodin): A — общий вид, выращивание в почве; Б — корни растения, выращенного в почве: В — рост растений кок-сагыза в условиях фитотрона (выращивание методом аэропоники) (фото авторов).
Развитие кок-сагыза происходит в суровых условиях резко континентального климата на засоленных почвах, при недостатке влаги и сильных ветрах (72). На основе семян кок-сагыза, собранных в местах естественного произрастания, во Всесоюзном институте растениеводства им. Н.И. Вавилова (ВИР, г. Санкт-Петербург) была создана коллекция растений, проведено ботаническое описание и определение внутривидового разнообразия растений, позволившее отобрать лучшие генотипы для окультуривания. Были изучены биологические и морфологические особенности растения и установлено, что культура влаголюбива, требует не менее 420-600 мм осадков в год с их равномерным распределением, нуждается в высокоплодородных почвах (поймы рек, окультуренные торфяники, черный пар). Разрабатывалась агротехника культуры для различных типов почв, проводилось изучение болезней и вредителей, осуществлялась селекционная работа (36, 72, 75, 76).
В корнях дикорастущего кок-сагыза накапливается от 4 до 12 % высококачественного каучука, синтезируемого в латициферах — удлиненных секреторных клетках, обнаруженных в листьях и стеблях тех растений, которые продуцируют латекс и каучук в качестве вторичных метаболитов (51, 52).
T. kok-saghyz активно культивировали в СССР с 1930 по 1952 годы. В 1941 году 67 тыс. га посадок растения покрывали примерно 30 % потреб- ности страны в НК (11). С началом Второй мировой войны возникла острая нехватка НК, и несколько стран независимо друг от друга начали реализовывать чрезвычайные программы по разработке технологий получения НК из T. kok-saghyz. Среди них следует отметить США (77), Великобританию (78), Германию (79), Швецию и Испанию (80). Если лучший результат в США составил 110 кг/га, то в СССР удалось превысить показатель 200 кг/га (36).
К сожалению, культивирование T. kok-saghyz трудоемко и дорого. Проростки растения очень маленькие, им трудно конкурировать с сорняками, что делает необходимой постоянную интенсивную прополку. После возобновления поставок на мировой рынок дешевого НК из Юго-Восточной Азии по окончании Второй мировой войны выращивание T. kok-saghyz в СССР продолжалось до начала 1950-х годов, но затем и в СССР эти работы были прекращены по экономическим причинам (36).
Сеёекция T. kok-saghyz . Чтобы кок-сагыз стал экономически конкурентоспособным, содержание каучука в латексе нужно повышать. Основная цель всех селекционных программ заключается в увеличении выхода каучука с единицы площади. Следует отметить, что программы по селекции кок-сагыза осуществлялись с момента его описания, изучения, но велись непоследовательно, с большими временными интервалами. Кроме того, селекция осложнялась тем, что этот вид имеет систему самостерильности (са-монесовместимости), предотвращающую самооплодотворение (81). Генетический материал, использованный в США в течение реализации чрезвычайной каучуковой программы, по сути представлял собой улучшенные образцы кок-сагыза дикого типа, полученные от СССР. Если у наиболее продуктивных растений выход НК составлял около 5-6 % от сухой массы корней, то в большинстве случаев он не превышал 2-3 % (10, 36). Примечательно, что, согласно опубликованным данным, в СССР выход НК достигал 15 % (82). В 1953 году методом множественных скрещиваний было показано, что размер корней кок-сагыза и накопление в них НК можно значительно увеличить (83). На основании этих исследований было сделано предположение, что селекция кок-сагыза потенциально позволит повысить выход НК до 15-25 % (84).
Выход каучука можно повысить за счет увеличения биомассы и/или содержания в ней каучука. Увеличение содержания каучука более желательно, поскольку при этом повышается эффективность обработки растений. Увеличение биомассы связано с дополнительными затратами, связанными со сбором урожая, транспортировкой и переработкой. Для того, чтобы превратить T. kok-saghyz в коммерчески привлекательный продукт, необходимо значительно улучшить его агрономические свойства, например скорость роста. Это возможно посредством скрещивания T. kok-saghyz с обыкновенным одуванчиком T. officinale . На опытных полях в Новой Зеландии выход сухих корней T. officinale составил 6-9 т/га после 6 мес роста (85). Таким образом, теоретически гибрид кок-сагыза и обыкновенного одуванчика мог бы производить НК в количестве около 1200-1800 кг/га.
Несколько особенностей делают T. kok-saghyz исключительно привлекательной модельной системой для изучения биосинтеза НК, в том числе в селекционных целях. Он имеет очень короткий жизненный цикл (68 мес) по сравнению с другими каучуконосами. Например, в случае H. brasil-iensis требуется в среднем 7 лет, чтобы оценить фенотип растения по способности производить НК. Для кустарника P. argentatum аналогичный период составляет 2 года. Более того, T. kok-saghyz может быть сравнительно легко генетически модифицирован (например, трансформирован для полу-16
чения трансгеных растений). Анализ содержания НК в корнях кок-сагыза можно проводить уже через 3-6 мес после трансформации (41, 42).
Moёeкyёяp^o-гe^emuчecкue uccёeдoвa^uя T. kok-saghys. Для использования T. kok-saghyz в качестве модельного организма при изучении биосинтеза НК требуются современные молекулярно-биологические подходы— улучшенные протоколы трансформации, применение РНК-интерференции (сайленсинга) для подавления экспрессии генов и EST (Expressed Sequence Tag) библиотеки. В молекулярной биологии м етка экспрессируемой последовательности (EST) представляет собой короткую подпоследовательность кДНК. Идентификация EST осуществляется быстро, и сейчас в общедоступных базах данных (например, GenBank на 1 января 2013 года, все виды) имеется около 74,2 млн EST. Ранее мы подробно описали молекулярно-генетические подходы к исследованию биосинтеза НК в клетках T. kok-saghyz (42).
Ключевыми ферментами в биосинтезе НК выступают цис-прени-лтрансферазы, ассоциированные с каучуковыми частицами (каучуковые трансферазы, CPT, RT); они синтезируют полиизопреновую цепь и могут быть выделены в отдельное подсемейство (CPT) (62). Классы CPT различаются по клеточной локализации, способности связывать молекулы субстрата и размерам образуемых продуктов реакции. Примечательно, что только ферменты RT класса способны синтезировать высокомолекулярный полиизопрен (41, 42, 86). Для клонирования CPT T. kok-saghyz были использованы вырожденные праймеры, соответствующие консервативным участкам последовательностей ферментов H. brasiliensis HRT1 и HRT2 (87), Arabidobsis thaliana ACPT (88) и S. cerevisiae Rer2 (89). RT-PCR (reverse transcription polymerase chain reaction) анализ, проведенный с использованием тотальной РНК из латекса (млечный сок каучуконосных растений) в качестве матрицы, привел к идентификации трех кДНК, кодирующих структурно родственные CPT1-3 (90). Крайне важно отметить тот факт, что внутриклеточная концентрация CPT регулирует биосинтез натурального каучука в клетках T. brevicorniculatum — ближайшего родственника T. kok-saghyz . Для более полного понимания роли CPT1-3 в латексе были получены трансгенные растения T. brevicorniculatum, в которых экспрессия всех трех генов CPT подавлялась с использованием метода РНК-интерференции (RNAi) (91). Трансгенные линии демонстрировали практически полную супрессию биосинтеза НК. Примечательно, что трансгенные растения были морфологически неотличимы от растений дикого типа.
Белки, функционально связанные с СРТ, идентифицированы относительно недавно. Один из них — SRPP, обнаруженный в латексе H. brasiliensis кислый белок (pI 4,8) с молекулярной массой 23 кДа (92). Сообщалось о важной роли SRPP в биосинтезе натурального каучука (42). Сравнительный анализ EST-последовательностей T. kok-saghyz с использованием известной последовательности SRPP из H. brasiliensis привел к идентификации пяти кДНК, кодирующих потенциальные SRPP1-5 (90). Изучение про-теома T. kok-saghyz показало, что три из этих белков (TkSRPP3, TkSRPP4 и TkSRPP5) ассоциированы с каучуковыми частицами (93). Основную изоформу, связанную с каучуковыми частицами, — TkSRPP3 изучили более детально. Для того чтобы охарактеризовать функциональную роль SRPP в биосинтезе НК, ген белка TkSRPP3 был сверхэкспрессирован в трансгенном T. kok-saghyz. Анализ методом RT-PCR в реальном времени показал, что у трансгенных линий количество транскрипта гена TkSRPP3 повышено (более чем в 2 раза). Вестерн-блот также подтвердил повышение уровня TkSRPP3 в сверхэкспрессирующих трансгенных линиях. Измерение содер- жания НК в этих линиях продемонстрировало его повышение (примерно на 30 %) по сравнению с контролем. Молекулярная масса природного каучука в сверхэкспрессирующих линиях практически не отличалась от таковой в контрольной линии и варьировала в пределах 1,0-1,2x106 Да (95). Фенотипически трансгенные растения не отличались от растений дикого типа. Для изучения роли SRPP в биосинтезе НК экспрессия гена TkSRPP3 в T. kok-saghyz была подавлена посредством РНК-интерференции (RNAi). Были получены несколько трансгенных линий, в которых уровень мРНК белка TkSRPP3 был значительно ниже, чем в контрольной линии. Вестерн-блот показал, что в этих линиях накопление белка TkSRPP3 также понижено (на 60 %). Молекулярная масса каучука у трансгенных линий также была значительно ниже, чем в контроле (93). Таким образом, подавление экспрессии гена TkSRPP3 в клетках T. kok-saghyz существенно влияет на количество синтезируемого НК и его молекулярную массу.
Семейство CPT включает не только ферменты, ответственные за биосинтез НК, но и другие CPT, способные синтезировать полиизопреновые цепи с максимальной длиной до 50 мономеров (94, 95). У эукариот эти ферменты синтезируют долихол, необходимый для гликозилирования белков, и другие полиизопреноиды, выполняющие различные функции, включая адаптацию к стрессу (96, 97). У человека CPT, ответственная за биосинтез долихола, содержащего 22 изопреновые единицы, взаимодействует с Nogo-B рецепторным белком (NgBR). Этот белок стабилизирует фермент посредством прямых белок-белковых взаимодействий. Он также необходим для ферментативной активности CPT (98, 99). Изучая, могут ли белки, родственные NgBR, стабилизировать ответственные за биосинтез НК цис-пре-нилтрансферазы, находящиеся в составе трансферазного комплекса на поверхности каучуковых частиц, обнаружили такой белок в клетках T. brevi-tacorniculatum. Он содержит три консервативных участка (мотивы I, II и III), которые характерны для NgBR растений и млекопитающих. Исходя из предполагаемой функциональной аналогии с NgBR, авторы назвали этот белок активатором цис-пренилтрансферазы (TbRTA) (100). RT-PCR анализ показал, что концентрация мРНК, кодирующей TbRTA, в латексе гораздо выше, чем в тканях растения. Это коррелирует с уровнем экспрессии гена CPT1-3 и предполагает, что TbRTA принимает участие в биосинтезе НК. Для изучения роли TbRTA в этом процессе экспрессию гена TbRTA в клетках T. brevicorniculatum подавляли с использованием RTA-RNAi. Полученные трансгенные линии показали выраженное ингибирование (100). Примечательно, что подавление экспрессии гена TbRTA не влияло на рост и развитие трансгенных растений, они были неотличимы от контрольных растений дикого типа. Было также изучено влияние подавления экспрессии гена TbRTA на синтез НК. У растений дикого типа латекс после центрифугирования образовывал пенообразный верхний слой, содержащий каучуковые частицы, а у трансгенных растений верхний слой отсутствовал. Отсутствие НК в трансгенных линиях подтвердил 1Н-ЯМР анализ (100). Чтобы выяснить, связано ли отсутствие натурального каучука у трансгенных растений с ингибированием экспрессии гена TbCPT1-3 или происходит посттрансляционная потеря белков TbCPT1-3, провели RT-PCR анализ и ве-стерн-блот. Было показано, что уровни мРНК генов TbCPT1-3 примерно одинаковы в трансгенных RNAi линиях и контрольном растении дикого типа, однако вестерн-блот не выявил белки TbCPT1-3 в трансгенных линиях. Эти результаты предполагают, что TbRTA необходим для поддержания активной конформации TbCPT1-3 в составе трансферазного комплекса на мембране каучуковых частиц и объясняют отсутствие полиизопрена в TbRTA-RNAi трансгенных линиях. Таким образом, TbRTA не только активирует TbCPT1-3, но и предохраняет трансферазы от деградации. Более того, принимая во внимание тот факт, что TbCPT1-3 не имеют трансмембранного домена, TbRTA может играть важную роль в локализации трансфераз на поверхности каучуковых частиц (100). Таким образом, TbRTA является ключевым компонентом трансферазного комплекса.
Технология получения НК из биомассы T. kok-saghyz описана в литературе (77, 79). Она постоянно модернизуется и усовершенствуется, однако чтобы новые каучуконосные культуры стали экономически конкурентоспособные, также необходима эффективная комплексная переработка побочных продуктов из листьев и остатков биомассы корней после выделения каучука, смол и инулина (80).
Достоинства и недостатки натурального каучука из T. kok-saghyz . Лабораторные исследования физических и химических свойств НК из T. kok-saghyz показали, что этот природный каучук обладает отличным качеством и во многом сходен с НК из H. brasiliensis. Показательно, что автомобильные покрышки, изготовленные из этого материала, по всем характеристикам лучше покрышек, сделанных из НК P. argentatum (6). Высокая молекулярная масса (2,2х106 Да) полностью подтверждает этот вывод (13, 17, 101). Одна из потенциальных проблем, связанная с НК из русского одуванчика, заключается в высоком содержании белков, которое даже выше, чем в каучуке из H. brasiliensis (11). Следовательно, люди, чувствительные к НК из гевеи, могут также испытывать аллергию к полимеру из T. kok - saghyz (37, 38), поэтому НК из кок-сагыза предпочтительнее использовать в областях, не связанных с медициной, например в автомобилестроении.

Рис. 9. Тау-сагыз ( Scorzonera tau-saghyz Lipsch. et Bosse): A — растения тау-сагыза в условиях природного произрастания; Б — корни растений тау-сагыза из мест природного произрастания; В — млечный сок тау-сагыза. Фото любезно предоставлены К.К. Богуспаевым (Казахстан).
Тау-сагыз (Scorzonera tau-saghyz). Многолетний полукустарник козелец тау-сагыз (Scorzonera tau-saghyz) (рис. 9) — безусловно, один из наиболее перспективных альтернативных источников НК, которому, по нашему мнению, научное сообщество уделяет недостаточно внимания. Его родина — горный хребет Каратау в Южном Казахстане. Содержание НК в корнях тау-сагыза изменяется с возрастом. Корни однолетнего растения обычно содержат 1-8 % НК в расчете на сухую массу. В 2-3-летних растениях содержание увеличивается до 8-30 %. Интересно, что при выращивании тау-сагыза в оптимальных условиях накопление НК в корнях может достигать 40 % от сухой массы. К сожалению, численность тау-сагыза в природных условиях критически сократилась в 1940-х годах из-за интенсивной заготовки. Для нужд военной промышленности было использовано более 12 млн корней с общей сухой массой около 900 т. Этого хватило для получения около 300 т НК (102-104). В настоящее время тау-сагыз редко встречается в природе, а восстановление его естественных ареалов происходит очень медленно. Тау-сагыз менее конкурентоспособен, чем другие растения в тех же местах обитания, а интенсивное освоение прилегающих территорий ведет к еще большему сокращению численности этого редкого вида. Для его восстановления могут использоваться технологии, основанные на применении микробиологических препаратов, в частности грибов, образующих микоризы арбускулярного типа.
Арбускулярная микориза (эндомикориза) — это широко распространенный в природе взаимовыгодный симбиоз микроскопических грибов отдела Glomemmycoia с высшими сосудистыми растениями, значительно повышающий жизнеспособность хозяина. Эндомикориза увеличивает доступность питательных элементов (в частности, фосфора и азота) для растения-хозяина, способствует повышению интенсивности фотосинтеза, что, в свою очередь, ведет к существенному накоплению корневой и надземной массы микоризного растения (105-107). При микоризации проростков тау-сагыза с использованием грибов родов Claroideoglomus и Rhizophagus (104) в корнях были выявлены структуры (несептированный мицелий, везикулы и арбус-кулы), характерные для грибов, образующих микоризы арбускулярного типа. У контрольных образцов эти структуры отсутствовали. Растения, обработанные инокулюмом гриба-микоризообразователя, росли заметно лучше, чем немикоризованные (107). Средняя высоты и число листьев у микоризованных растений были в 1,5-2,0 раза выше, чем у немикоризованных. Проведенные исследования указывают на то, что микоризы арбускулярного типа играют существенную роль в жизни тау-сагыза, и на их основе могут быть разработаны оптимизированные биотехнологии выращивания этого редкого и исчезающего вида и перспективного каучуконоса .
Подводя итог обсуждению проблемы природных каучуконосов, отметим, что интерес к растениям, способным функционировать в качестве источников различных материалов, обусловлен многими причинами. НК не только один из наиболее важных полимеров, используемый человечеством, но и возобновляемый полимером. К большому сожалению, источник этого полимера — H. brasiliensis находится под воздействием негативных биотических (SALB) (20, 21) и абиотических факторов (развитие экономик, отрицательно влияющее на естественную среду обитания, и изменение климата). Развитие альтернативных источников НК, безусловно, крайне важно в средне- и дальнесрочной перспективе, потому что оно не только обеспечит большую доступность этого полимера, но и уменьшит зависимость человечества от ископаемого топлива, необходимого для получения синтетических аналогов НК. Каучуконосы также могут использоваться для производства других важных продуктов, таких как биоэтанол из лигноцеллюлозы (S. tau-saghyz, P. argentatum) или инулин из T. kok-saghyz. Достижения геномики, протеомики, метаболомики, биотехнологии, безусловно, помогут значительно продвинуться в понимании процессов биосинтеза НК. Это, в свою очередь, приведет к созданию новых форм и генотипов растений с высокой скоростью роста и развития, способностью сверхсинтеза НК, а также позволит разработать оптимальные технологии их выращивания.
Итак, постоянно растущий спрос на натуральный каучук (НК) не может быть удовлетворен в будущем за счет одного только каучукового дерева. Необходимы альтернативные культуры, которые можно выращивать на больших площадях в промышленных объемах, и соответствующие технологии переработки и получения конечных продуктов. Экономическая целесообразность внедрения новых культур — продуцентов НК зависит не только от повышения продуктивности растения, но и от комплексной переработки всего растения с получением дополнительных продуктов. Внедрение любой новой культуры — чрезвычайно сложная задача. В случае каучуконосов при этом требуется одновременное скоординированное расширения сельскохозяйственных площадей и перерабатывающих мощностей. В долгосрочной перспективе каучук из альтернативных культур, особенно его термостабильные производные, такие как эпоксидированный каучук, может дополнить долю рынка, занимаемую в настоящее время различными синтетическими каучуками, со значительным сокращением углеродного следа.
Список литературы Parthenium argentatum A. Gray, Taraxacumkok-saghyz L.E. Rodin и Scorzonera tau-saghyz Lipsch. et Bosse как альтернативные источники натурального каучука: нужны ли они нам? (Обзор)
- Eng A.H., Ong E.L. Hevea natural rubber. In: Plastics engineering handbook of elastomers. V. 61 /A.K. Bhowmick, H.L. Stephens (eds.). Marcel Dekker, NY, 2000: 29-59.
- McIntyre D., Stephens H.L., Schloman W.W. Jr., Bhowmick A.K., Guayule rubber. In: Plastics engineering: handbook of elastomers. V. 61 /A.K. Bhowmick, H.L. Stephens (eds.). Marcel Dekker, NY, 2000: 1-27.
- Puskas J.E. Producers and world market of synthetic rubbers. In: Biopolymers, Polyisoprenoids. V. 2 /T. Koyama, A. Steinbuchel (eds.). Wiley, Weinheim, 2001: 287-320.
- Gronover S.C., Wahler D., Prufer D. Natural rubber biosynthesis and physic-chemical studies of plant derived latex. In: Biotechnology of Biopolymers /M. Elnashar (ed.) InTech, Rijeka, 2011: 7588 (doi: 10.5772/17144).
- Насыров И.Ш., Фаизова В.Ю., Жаворонков Д.А., Шурупов О.К., Васильев В.А. Натуральный и синтетический цис-полиизопрены. Часть 1. Современное состояние и перспективы развития производства. Промышленное производство и использование эластомеров, 2020, 2: 34-47 (doi: 10.24411/2071-8268-2020-10206).
- Araujo-Morera J., Verdejo R., Lopez-Manchado M.A., Santana M.H. Sustainable mobility: the route of tires through the circular economy model. Waste Management, 2021, 126: 309-322 (doi: 10.1016/j.wasman.2021.03.025).
- Schwerin M.R., Walsh D.L., Coleman Richardson D., Kisielewski R.W., Kotz R.M., Rout-son L.B., David Lytle C. Biaxial flex-fatigue and viral penetration of natural rubber latex gloves before and after artificial aging. J. Biomed. Mater. Res., 2002, 63(6): 739-745 (doi: 10.1002/jbm. 10467).
- Ахмедьянова Р.А., Милославский Д.Г., Харлампиди Х.Э., Ву Минх Дак, Нгуен Тай Тхай, Нгуен Тханх Лием. Эпоксидирование бутадиен-стирольного и натурального каучуков в форме латекса пероксидом водорода в присутствии пероксофосфовольфраматной каталитической системы. Промышленное производство и использование эластомеров, 2015, 4: 3-6.
- Hamzah R., Bakar M.A., Dahham O.S., Zulkepli N.N., Dahham S.S. A structural study of epox-idized natural rubber (ENR-50) ring opening under mild acidic condition. J. Appl. Polym. Sci., 2016, 133(43): 44123 (doi: 10.1002/app.44123).
- Cornish K. Biochemistry of natural rubber, a vital raw material, emphasizing biosynthetic rate, molecular weight and compartmentalization, in evolutionarily divergent plant species. Natural Product Report, 2001, 18(2): 182-189 (doi: 10.1039/a902191d).
- van Beilen J., Poirier Y. Guayule and Russian dandelion as alternative sources of natural rubber. Critical Reviews in Biotechnology, 2007, 27: 217-231 (doi: 10.1080/07388550701775927).
- van Beilen J., Poirier Y. Establishment of new crops for the production of natural rubber. Trends in Biotechnology, 2007, 25(11): 522--529 (doi: 10.1016/j.tibtech.2007.08.009).
- Mooibroek H., Cornish K. Alternative sources of natural rubber. Applied Microbiology and Biotechnology, 2000, 53: 355-365 (doi: 10.1007/s002530051627).
- Metcalfe C.R. Distribution of latex in the plant kingdom. Economic Botany, 1967, 21: 115-127 (doi: 10.1007/BF02897859).
- Buchanan R.A, Swanson C.L, Weisleder D., Cull I.M. Gutta-producing grasses. Phytochemistry, 1979, 18(6): 1069-1071 (doi: 10.1016/S0031-9422(00)91486-9).
- Tangpakdee J., Tanaka Y., Shiba K., Kawahara S., Sakurai K., Suzuki Y. Structure and biosynthesis of trans-polyisoprene from Eucommia ulmoides. Phytochemistry, 1997, 45(1): 75-80 (doi: 10.1016/S0031-9422(96)00806-0).
- Cornish K. Alternative natural rubber crops: why should we care? Technology and Innovation, 2017, 18: 245-256 (doi: 10.21300/18.4.2017.245).
- Association of Natural Rubber Producing Countries. ANRPC Releases natural rubber trends & statistics, Dec. 2018. Режим доступа: http://www.anrpc.org/html/news-secretariat-de-tails.aspx?ID=9&PID=39&NID=2271. Дата обращения: 10.12.2021.
- Kramer P.J., Kozlowski T.T. Physiology of woody plants /S.G. Pallardy (ed.). Academic Press, NY, 1979.
- Guyot J., Le Guen V. A review of a century of studies on South America leaf blight of the rubber tree. Plant Disease, 2018, 102: 1052-1065 (doi: 10.1094/PDIS-04-17-0592-FE).
- Guyot J., Cilas C., Sache I. Influence of host resistance and phenology on South American leaf blight of the rubber tree with special consideration of temporal dynamics. European Journal of Plant Pathology, 2008, 120(2): 111-124 (doi: 10.1007/s10658-007-9197-6).
- Rousset A., Amor A., Punvichai T., Perino S., Palu S., Dorget M., Pioch D., Chemat F. Guayule (Parthenium argentatum A. Gray), a renewable resource for natural polyisoprene and resin: composition, processes and applications. Molecules, 2021, 26(3): 664 (doi: 10.3390/mol-ecules26030664).
- Arias M., Herrero J., Ricobaraza M., Hernandez M., Ritter E. Evaluation of root biomass, rubber and inulin contents in nine Taraxacum kok-saghyz Rodin populations. Industrial Crops and Products, 2016, 83: 316-321 (doi: 10.1016/j.indcrop.2016.01.023).
- Боссэ Г. Г., Ильин М.М. Поиски источников каучука и гуттаперчи в СССР. В кн.: Каучук и каучуконосы. Т. 2. М., 1953: 136-137.
- Cornish K. Rubber production. In: Encyclopedia of Applied Plant Sciences (Second Edition). V. 3 /B. Thomas, B.G. Murray, D.J. Murphy (eds.). Elsevier, 2017b: 410-419 (doi: 10.1016/B978-0-12-394807-6.00088-5).
- Schurer H. The Macintosh: the paternity of an invention. Transaction of the Newcomen Society, 1951, 28(1): 77-87 (doi: 10.1179/tns.1951.005).
- Bebb R.L. Chemistry of rubber processing and disposal. Environmental Health Perspectives, 1976, 17: 95-102 (doi: 10.1289/ehp.761795).
- He Q., Zhang L., Li T., Li C., Song H., Fan P.J. Genus Sapium (Euphorbiaceae): a review on traditional uses, phytochemistry, and pharmacology. J. Ethnopharmacology, 2021, 277: 114206 (doi: 10.1016/j.jep.2021.114206).
- Cook O.F. Rubber production from Castilla and Hevea. Science, 1937, 85(2208): 406-407 (doi: 10.1126/science.85.2208.406).
- Priyadarshan P.M., Goncalves P. de S. Hevea gene pool for breeding. Genetic Resources and Crop Evolution, 2003, 50:101-114 (doi: 10.1023/A:1022972320696).
- Priyadarshan P.M., Clement-Demange A. Breeding Hevea rubber: formal and molecular genetics. Advances in Genetics, 2004, 52: 51-115 (doi: 10.1016/S0065-2660(04)52003-5).
- Seibert R.J. A study of hevea (with its economic aspects) in the Republic of Peru. Annals of the Missouri Botanical Garden, 1947, 34(3): 261-352 (doi: 10.2307/2394407).
- McFadyen R.E., Harvey G.J. Distribution and control of rubber vine, Cryptostegia grandiflora, a major weed in northern Queensland. Plant Protection Quarterly, 1990, 5: 153-155.
- Shen X., Zou Z.R. Review on research progress of chemical constituents and bioactivities of Soli-dago. China Journal of Chinese Materia Medica, 2016, 41: 4303-4313 (doi: 10.4268/cjcmm20162303).
- Гаршин М.В., Картуха А.И., Кулуев Б.Р. Кок-сагыз: особенности культивирования, перспективы возделывания и внедрения в современное производство. Биомика, 2016, 8(4): 323-333.
- Кутузова С.Н., Брач Н.Б., Конькова Н.Г., Гаврилова В.А. Кок-сагыз — Taraxacum koksaghyz (Asteraceae, Compositae) — источник ценного растительного сырья для резиновой, пищевой и фармацевтической промышленности. Биосфера, 2015, 7(4): 392-402 (doi: 10.24855/biosfera.v7i4.124).
- Bousquet J., Flahault A., Vandenplas O., Ameille J., Duron J. J., Pecquet C., Chevrie K., Annesi-Maesano I. Natural rubber latex allergy among health care workers: A systematic review of the evidence. Journal of Allergy and Clinical Immunology, 2006, 118(2): 447-454 (doi: 10.1016/j.jaci.2006.03.048)
- Siler D.J., Cornish K., Hamilton R.G. Absence of cross-reactivity of IgE antibodies from subjects allergic to Hevea brasiliensis latex with a new source of natural rubber latex from guayule (Parthenium argentatum). Journal of Allergy and Clinical Immunology, 1996, 98(5, Pt.1): 895-902 (doi: 10.1016/s0091-6749(96)80005-4).
- Nakayama F.S. Guayule future development. Industrial Crops and Products, 2005, 22(1): 3-13 (doi: 10.1016/j.indcrop.2004.05.006).
- Tanaka Y. Structural characterization of natural polyisoprenes: solve the mystery of natural rubber based on structural study. Rubber Chemistry and Technology, 2001, 74(3): 355-375 (doi: 10.5254/1.3547643).
- Amerik A.Yu., Martirosyan Yu.Tc., Gachok I.V. Regulation of natural rubber biosynthesis by proteins associated with rubber particles. Russian Journal of Bioorganic Chemistry, 2018, 44(2): 140-149 (doi: 10.1134/S106816201801003X).
- Amerik A.Y., Martirosyan Y.T., Martirosyan L.Y., Goldberg V.M., Uteulin K.R., Varfolo-meev S.D. Molecular genetic analysis of natural rubber biosynthesis. Russian Journal of Plant Physiology, 2021, 68(1): 31-45 (doi: 10.1134/S1021443721010039).
- Yamashita S., Takahashi S. Molecular mechanisms of natural rubber biosynthesis. Annual Review of Biochemistry, 2020, 89: 24.1-24.31 (doi: 10.1146/annurev-biochem-013118-111107).
- Cornish K., Siler D.J., Grosjean O.K., Goodman N. Fundamental similarities in rubber particle architecture and function in three evolutionarily divergent plant species. Journal of Natural Rubber Research, 1993, 8(4): 275-285.
- Cornish K. Similarities and differences in rubber biochemistry among plant species. Phytochem-istry, 2001, 57: 1123-1134 (doi: 10.1016/s0031-9422(01)00097-8).
- McMahan C.M., Kostyal D., Lhamo D., Cornish K. Protein influences on guayule and hevea natural rubber sol and gel. Journal of Applied Polymer Science, 2015, 132(23): 42051-42057 (doi: 10.1002/app.42051).
- Ikeda Y., Junkong P., Ohashi T., Phakkeeree T., Sakaki Y., Tohsan A., Kohjiya S., Cornish K. Strain-induced crystallization behaviours of natural rubbers from guayule and rubber dandelion revealed by simultaneous time-resolved WAXD/tensile measurements: indispensable function for sustainable resources. RSC Advances, 2016, 6: 95601-95610 (doi: 10.1039/C6RA22455E).
- Thuong N.T., Yamamoto O., Nghia P.T., Cornish K., Kawahara S. Effect of naturally occurring crosslinking junctions on green strength of natural rubber. Polymers Advanced Technologies, 2016, 28(3): 303-311 (doi: 10.1002/pat.3887).
- Cornish K., Wood D.F., Windle J.J. Rubber particles from four different species, examined by transmission electron microscopy and electron-paramagnetic-resonance spin labeling, are found to consist of a homogeneous rubber core enclosed by a contiguous, monolayer biomembrane. Planta, 1999, 210(1): 85-96 (doi: 10.1007/s004250050657).
- Wood D.F., Cornish K. Microstructure of purified rubber particles. International Journal of Plant Sciences, 2000, 161(3): 435-445 (doi: 10.1086/314269).
- Castelblanque L., Balaguer B., Marti C., Rodriguez J.J., Orozco M., Vera P. Multiple facets of laticifer cells. Plant Signaling & Behavior, 2017, 12(7): e1300743 (doi: 10.1080/15592324.2017.1300743).
- Ramos M.V., Demarco D., da Costa Souza I.C., de Freitas C.D.T. Laticifers, latex, and their role in plant defense. Trends in Plant Science, 2019, 24(6): 553-567 (doi: 10.1016/j.tplants.2019.03.006).
- Backhaus R.A. Rubber formation in plants — a mini-review. Israel Journal of Botany, 1985, 34(2-4): 283-293.
- Siler D.J., Goodrich-Tanrikulu M., Cornish K., Stafford A.E., McKeon T.A. Composition of rubber particles of Hevea brasiliensis, Parthenium argentatum, Ficus elastica, and Euphorbia lac-tiflua indicates unconventional surface structure. Plant Physiology and Biochemistry, 1997, 35(11): 881-889.
- Estilai A., Ray D.T. Genetics, cytogenetics, and breeding of guayule. In: Guayule natural rubber. A technical publication with emphasis on recent findings /J.W Whitworth, E.E. Whitehead (eds.). USDA, Tucson, 1991: 47-92.
- Ray D.T., Coffelt T.A., Dierig D A. Breeding guayule for commercial production. Industrial Crops and Products, 2005, 22(1): 15-25 (doi: 10.1016/j.indcrop.2004.06.005).
- Thompson A.E., Ray D.T. Breeding guayule. In: Plant Breeding Reviews /J. Janick (ed.). Willley, 1989: 93-165 (doi: 10.1002/9781118061039.ch4).
- Thompson A.E. Breeding new industrial crops. In: Advances in new crops /J. Janick, J.E. Simon (eds.). Timber Press, Portland, OR, 1990: 100-103.
- Kim I.J., Ryu S.B., Kwak Y.S., Kang H. A novel cDNA from Parthenium argentatum Gray enhances the rubber biosynthetic activity in vitro. Journal of Experimental Botany, 2004, 55(396): 377-385 (doi: 10.1093/jxb/erh039).
- Benedict C.R., Madhavan S., Greenblatt G.A., Venkatachalam K.V., Foster M.A. The enzymatic synthesis of rubber polymer in Parthenium argentatum Gray. Plant Physiology, 1990, 92(3): 816821 (doi: 10.1104/pp.92.3.816).
- Pan Z., Durst F., Werck-Reichhart D., Gardner H.W., Camara B., Cornish K., Backhaus R.A. The major protein of guayule rubber particles is a cytochrome P450. Characterization based on cDNA cloning and spectroscopic analysis of the solubilized enzyme and its reaction products. Journal of Biological Chemistry, 1995, 270(15): 8487-8494 (doi: 10.1074/jbc.270.15.8487).
- Lakusta A.M., Kwon M., Kwon E.J.G., Stonebloom S., Scheller H.V., Ro D.K. Molecular studies of the protein complexes involving cis-prenyltransferase in guayule (Parthenium argentatum), an alternative rubber-producing plant. Frontiers in Plant Science, 2019, 10: 165 (doi: 10.3389/fpls.2019.00165).
- Hodgins K.A., Lai Z., Oliveira L.O., Still D.W., Scascitelli M., Barker M.S., Kane N.C., Dempe-wolf H., Kozik A., Kesseli R.V., Burke J.M., Michelmore R.W., Reiseberg L.H. Genomics of Compositae crops: reference transcriptome assemblies and evidence of hybridization with wild relatives. Molecular Ecology Resources, 2014, 14(1): 166-177 (doi: 10.1111/1755-0998.12163).
- Qu Y., Chakrabarty R., Tran H.T., Kwon E.J., Kwon M., Nguyen T.D., Ro D.K. A lettuce (Lactuca sativa) homolog of human Nogo-B receptor interacts with cis-prenyltransferase and is necessary for natural rubber biosynthesis. Journal of Biological Chemistry, 2015, 290(4): 1898-1914 (doi: 10.1074/jbc.M114.616920).
- Kwon M., Kwon E.J.G., Ro D.K. cis-Prenyltransferase and polymer analysis from a natural rubber perspective. Methods in Enzymology, 2016, 576: 121-145 (doi: 10.1016/bs.mie.2016.02.026).
- Welti M. Regulation of dolichol-linked glycosylation. Glycoconjugate Journal, 2013, 30(1): 51-56 (doi: 10.1007/s10719-012-9417-y).
- Mihail J.D., Alcorn S.M., Whitworth J.W. Plant health: the interactions of Guayule, microorganisms, arthropods, and weeds. In: Guayule natural rubber. A technical publication with emphasis on recent findings /J.W. Whitworth, E.E. Whitehead (eds.). USDA, Tucson, 1991: 173-216.
- Nakayama F.S. Influence of environment and management practices on rubber quantity and quality. In: Guayule natural rubber. A technical publication with emphasis on recent findings /J.W. Whitworth, E. E. Whitehead (eds.). USDA, Tucson, 1991: 217-240.
- Estilai A. Biomass, rubber, and resin yield potentials of new guayule germplasm. Bioresource Technology, 1991, 35(2): 119-125 (doi: 10.1016/0960-8524(91)90018-F).
- Jones E.P. Recovery of rubber latex from Guayule shrub. Industrial & Engineering Chemistry, 1948, 40(5): 864-874.
- Wagner J.P., Parma D.G. Continuous solvent extraction process for recovery of natural rubber from guayule. Polymer-Plastics Technology and Engineering, 1988, 27(3): 335-350 (doi: 10.1080/03602558808070113).
- Cornish K., McMahan C.M., Pearson C.H., Ray D.T., Shintani D K. Biotechnological development of domestic rubber producing crops. Rubber World, 2005, 233(2): 40-44.
- Ray D.T. Guayule: a source of natural rubber. In: New crops /J. Janick, J.E. Simon (eds.). Wiley, New York, 1993: 338-343.
- Schloman W.W. Processing guayule for latex and bulk rubber. Industrial Crops and Products, 2005, 22(1): 41-47 (doi: 10.1016/j.indcrop.2004.04.031).
- Ильин М.М. Каучуконосность флоры СССР. В кн.: Каучук и каучуконосы. Т. 2. М.-Л., 1953: 9-104.
- Липшиц С.Ю. Кок-сагыз. В кн.: Каучук и каучуконосы. Т. 2. М.-Л., 1953: 153-172.
- Whaley W.G., Bowen J.S. Russian dandelion (Kok-saghyz). An emergency source of natural rubber. USDA, government publication no. 6. Washington DC, 1947.
- Russian rubber plants. Nature, 1945, 155: 229-230 (doi: 10.1038/155229a0).
- Heim S. Kalorien, Kautschuk, Karrieren. Pflanzenzu chtung und Landwirtschaftliche Forschung in Kaiser- Wilhelm-Instituten 1933-1945. Wallstein Verlag, Gottingen, 2003.
- Polhamus L.G. Rubber: botany, production, and utilization. Leonard Hill Limited, London, 1962.
- Wollenweber T.E, van Deenen N., Roelfs K.-U., Prüfer D., Gronover C.S. Microscopic and transcriptomic analysis of pollination processes in self-incompatible Taraxacum koksaghyz. Plants, 2021, 10(3): 555 (doi: 10.3390/plants10030555).
- Kupzow A.J. Theoretical basis of plant domestication. Theoretical and Applied Genetics, 1980, 57(2): 65-74 (doi: 10.1007/BF00276404).
- Tysdal H.M., Rands R.D. Breeding for disease resistance and higher rubber yield in Hevea, Guayule and Kok-saghyz. Agronomy Journal, 1953, 45(6): 234-243 (doi: 10.2134/agronj1953.00021962004500060003x).
- Ramirez-Cadavid D.A., Cornish K., Michel F.C. Jr. Taraxacum kok-saghyz (TK): compositional analysis of a feedstock for natural rubber and other bioproducts Industrial Crops and Products, 2017, 107: 624-640 (doi: 10.1016/j.indcrop.2017.05.043).
- Parmenter G. Taraxacum officinale — common dandelion, Lion's tooth. Annual Report. New Zealand Institute for Crops and Food Research, Mana Kai Rangahau, 2002.
- Yamashita S., Yamaguchi H., Waki T., Aoki Y., Mizuno M., Yanbe F., Ishii T., Funaki A., Tozawa Y., Miyagi-Inoue Y., Fushihara K., Nakayama T., Takahashi S. Identification and reconstitution of the rubber biosynthetic machinery on rubber particles from Hevea brasiliensis. eLife, 2016, 5: e19022 (doi: 10.7554/eLife.19022).
- Asawatreratanakul K., Zhang Y.-W., Wititsuwannakul D., Wititsuwannakul R., Takahashi S., Rattanapittayaporn A., Koyama T. Molecular cloning, expression and characterization of cDNA encoding cis-prenyltransferases from Hevea brasiliensis. A key factor participating in natural rubber biosynthesis. European Journal of Biochemistry, 2003, 270(23): 4671-4680 (doi: 10.1046/j.1432-1033.2003.03863.x).
- Oh S.K., Hwan Han K., Ryu S.B., Kang H. Molecular cloning, expression, and functional analysis of a cis-prenyltransferase from Arabidopsis thaliana. Implications in rubber biosynthesis. Journal of Biological Chemistry, 2000, 275(24): 18482-18488 (doi: 10.1074/jbc.M002000200).
- Sato M., Sato K., Nishimura S., Hirata A., Kato J., Nakano A. The yeast RER2 gene, identified by endoplasmic reticulum protein localization mutations, encodes cis-prenyltransferase, a key enzyme in dolichol synthesis. Molecular and Cellular Biology, 1999, 19(1): 471-483 (doi: 10.1128/mcb.19.1.471).
- Schmidt T., Hillebrand A., Wurbs D., Wahler D., Lenders M., Gronover C.H., Prufer D. Molecular cloning and characterization of rubber biosynthetic genes from Taraxacum koksaghyz. Plant Molecular Biology Reporter, 2010, 28(2): 277-284 (doi: 10.1007/slll05-009-0145-9).
- Post J., van Deenen N., Fricke J., Kowalski N., Wurbs D., Schaller H., Eisenreich W., Huber C., Twyman R.M., Prufer D., Gronover C.S. Laticifer-specific cis-prenyltransferase silencing affects the rubber, triterpene, and inulin content of Taraxacum brevicorniculatum. Plant Physiology, 2012, 158(3): 1406-1417 (doi: 10.1104/pp.111.187880).
- Oh S.K., Kang H., Shin D.H., Yang J., Chow K.S., Yeang H.Y., Wagner B., Breiteneder H., Han K.H. Isolation, characterization, and functional analysis of a novel cDNA clone encoding a small rubber particle protein from Hevea brasiliensis. Journal of Biological Chemistry, 1999, 274(24): 17132-17138 (doi: 10.1074/jbc.274.24.17132).
- Collins-Silva J., Nural A.T., Skaggs A., Scott D., Hathwaik U., Woolsey R., Schegg K., McMahan C., Whalen M., Cornish K., Shintani D. Altered levels of the Taraxacum kok-saghyz (Russian dandelion) small rubber particle protein, TkSRPP3, result in qualitative and quantitative changes in rubber metabolism. Phytochemistry, 2012, 79: 46-56 (doi: 10.1016/j.phytochem.2012.04.015).
- Kharel Y., Koyama T. Molecular analysis of cis-prenyl chain elongating enzymes. Natural Product Reports, 2003, 20: 111-118 (doi: 10.1039/b108934j).
- Kharel Y., Takahashi S., Yamashita S., Koyama T. Manipulation of prenyl chain length determination mechanism of cis-prenyltransferases. FEBS Journal, 2006, 273(34): 647-657 (doi: 10.1111/j.1742-4658.2005.05097.x).
- Kera K., Takahashi S., Sutoh T., Koyama T., Nakayama T. Identification and characterization of a cis,trans-mixed heptaprenyl diphosphate synthase from Arabidopsis thaliana. FEBS Journal, 2012, 279(20): 3813-3827 (doi: 10.1111/j.1742-4658.2012.08742.x).
- Surmacz L., Plochocka D., Kania M., Danikiewicz W., Swiezewska E. cis-Prenyltransferase atCPT6 produces a family of very short-chain polyisoprenoids in planta. Biochimica et Biophysica Acta, 2014, 1841(2): 240-250 (doi: 10.1016/j.bbalip.2013.11.011).
- Harrison K.D., Park E.J., Gao N., Kuo A., Rush J.S., Waechter C.J., Lehrman M.A., Sessa W.C. Nogo-B receptor is necessary for cellular dolichol biosynthesis and protein N-glycosylation. EMBO Journal, 2011, 30(12): 2490-2500 (doi: 10.1038/emboj.2011.147).
- Park E.J., Grabinska K.A., Guan Z, Stranecky V., Hartmannova H., Hoda ova K., Baresova V., Sovova J., Jozsef L., Ondruskova N., Hansikova H., Honzik T., Zeman J., Hülkova H., Wen R. Kmoch S., Sessa W.C. Mutation of Nogo-B receptor, a subunit of cis-prenyltransferase, causes a congenital disorder of glycosylation. Cell Metabolism, 2014, 20(3): 448-457 (doi: 10.1016/j.cmet.2014.06.016).
- Epping J., van Deenen N., Niephaus E., Stolze A., Fricke J., Huber C., Eisenreich W., Twyman R.M., Prufer D., Gronover C.S. A rubber transferase activator is necessary for natural rubber biosynthesis in dandelion. Nature Plants, 2015, 1: 15048 (doi: 10.1038/nplants.2015.48).
- Hallahan D.L., Keiper-Hrynko N.M. Cis-prenyltransferases from the rubber-producing plants Russian dandelion (Taraxacum kok-saghyz) and sunflower (Helianthus annus). US Patent 2004/044173. 2004.
- Богуспаев К.К., Портной В.Х., Фалеев Д.Г., Касымбеков Б.К., Турашева С.К. Таусагыз (Scorzonera tau-saghyz Lipsch. et Bosse) — альтернативный источник получения натурального каучука. Вестник КазНУ, серия биологическая, 2015, 3(65): 323-331.
- Турaшевa С.К., Богустев К.К., Фaлеев Д.Г., Альнуровa А.А., KamiM^ А.И. Восстановление численности дикорастущего каучуконосного эндемика Scorzonera tau-saghyz Lipsch. et Bosse. Вестник КазНУ, серия экологическая, 2016, 2(47): 141-150.
- Фалеев Д.Г., Касымбеков Б.К., Фалеев Е.Г., Мырзагалиев Ж.Ж., Богуспаев К.К. Разработка технологии культивирования растений тау-сагыза (Scorzonera tau-saghyz Lipsch. et Bosse) с использованием почвенной микрофлоры: 4. Микоризация в условиях лабораторного эксперимента. Вестник КазНУ, серия биологическая, 2018, 3(76): 143-151.
- Smith S., Read D. Mycorrhizalsymbiosis, 3rdEdition. Academic Press, NY, 2008 (doi: 10.1016/B978-0-12-370526-6.X5001-6).
- Vigneron N., Radhakrishnan G.V., Delaux P-M. What have we learnt from studying the evolution of the arbuscular mycorrhizal symbiosis? Current Opinion in Plant Biology, 2018, 44: 49-56 (doi: 10.1016/j.pbi.2018.02.004).
- Miozzi L., Vaira A.M., Catoni M., Fiorilli V., Accotto G.P., Lanfranco L. Arbuscular mycorrhizal symbiosis: plant friend or foe in the fight against viruses? Frontiers in Microbiology, 2019, 10: 1238 (doi: 10.3389/fmicb.2019.01238).


