Патогенетическая значимость системы матриксных металлопротеиназ при плоскоклеточном раке головы и шеи
Автор: Кондакова Ирина Викторовна, Клишо Елена Владимировна, Савенкова Ольга Владимировна, Шишкин Дмитрий Александрович, Чойнзонов Евгений Лхамацыренович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 (43), 2011 года.
Бесплатный доступ
Изучена взаимосвязь компонентов системы ММП, включающей протеазы, их тканевые ингибиторы (ТИМП) и индуктор экстраклеточных матриксных металлопротеиназ (EMMPRIN), в опухолевых и стромальных клетках, а также изменение этих параметров при лимфогенном метастазировании. Материалом для исследования послужили 62 послеоперационных образца плоскоклеточных карцином головы и шеи. Исследование экспрессии ММП-1,-2,-9, ТИМП-1,-2 и EMMPRIN проводили иммуногистохимическим методом. Показано, что в плоскоклеточных карциномах головы и шеи экспрессия ММП-1, -2, -9 и ТИМП-1 была значительно выше в строме по сравнению с опухолевыми клетками, в то время как преимущественная экспрессия ТИМП-1 и EMMPRIN наблюдалась в злокачественных клетках. Обнаружены корреляционные связи между экспрессией компонентов системы ММП, позволяющие предположить важную роль EMMPRIN, локализованного на по- верхности опухолевых клеток, в экспрессии ММП микроокружением. Зарегистрировано достоверное снижение уровня экспрессии ТИМП-2 в опухолевых клетках и ТИМП-1 в строме при наличии регионарных лимфогенных метастазов. На основании полученных результатов предложена схема вероятной регуляции прогрессии плоскоклеточных карцином головы и шеи компонентами системы ММП.
Плоскоклеточный рак головы и шеи, лимфогенное метастазирование, матриксные металлопротеиназы, тканевые ингибиторы металлопротеиназ, индуктор экстраклеточных матриксных металлопротеиназ
Короткий адрес: https://sciup.org/14055877
IDR: 14055877 | УДК: 617.51/.53-006.6-092.18
Текст научной статьи Патогенетическая значимость системы матриксных металлопротеиназ при плоскоклеточном раке головы и шеи
Плоскоклеточный рак головы и шеи, который занимает шестое ранговое место в общей структуре онкологической заболеваемости и составляет в среднем 18–20 %, относится к числу социально значимой онкологической патологии. Несмотря на то, что указанные новообразования относятся к опухолям наружной локализации, они характеризуются частой запущенностью, связанной с бессимптомным течением, выяв- ляемостью на поздних стадиях и более чем 50 % ежегодной смертностью из-за высоких показателей рецидивирования и метастазирования [2, 4]. Все это обусловливает важность исследования механизмов метастазирования плоскоклеточных карцином головы и шеи.
Известно, что ключевую роль в развитии злокачественных опухолей играют протеолитические процессы, которые могут наделять опухолевые клетки способностью к инвазии и метастазированию [3]. Среди всего множества протеаз особое значение в онкогенезе занимает семейство матриксных металлопротеиназ (ММП), которое имеет большое значение в деградации структурных белков соединительной ткани, таких как коллагены, эластин, протеогликаны, гликопротеины и молекулы межклеточных и белково-клеточных контактов [1]. Кроме этого, ММП обладают способностью регулировать функции биологически активных молекул, включая ростовые факторы, молекулы адгезии и другие [6]. Благодаря этим свойствам ММП обеспечивают инвазивный рост опухолевых клеток в базальной мембране и строме, пенетрацию в лимфатические и кровеносные сосуды и метастазирование [1, 6, 8].
Регуляция каталитической активности ММП осуществляется тканевыми ингибиторами металлопротеиназ (ТИМП), а экспрессии – индуктором экстраклеточных матриксных металлопротеиназ (EMMPRIN, СD 147). В настоящее время известны 4 представителя семейства тканевых ингибиторов, из которых наиболее изученными являются ТИМП-1 и ТИМП-2. Они были идентифицированы во многих нормальных тканях и злокачественных опухолях, и их уровни были выше в неметастатических опухолях, чем метастатических [5]. Определяющее значение для осуществления протеолиза имеет нарушение баланса уровня протеаз и их ингибиторов. EMMPRIN является высоко гли-колизированной трансмембранной молекулой, локализованнной на плазматической мембране, и обладает способностью стимулировать продукцию ММП как опухолевыми клетками, так и клетками микроокружения [7, 9, 10]. Увеличенная продукция ММП клетками стромальной популяции способствует опухолевой инвазии и ангиогенезу.
ММП, их тканевые ингибиторы и EMMPRIN образуют систему ММП. Учитывая важную роль системы ММП в инвазии и метастазировании злокачественных опухолей, в данной работе исследовалась патогенетическая значимость протеаз и их регуляторных молекул при прогрессировании плоскоклеточных карцином головы и шеи.
Материал и методы
В исследование были включены 62 больных опухолями головы и шеи (гортань, ротоглотка, гортаноглотка, органы полости рта) стадии Т1–3N0–3M0 в возрасте от 31 до 77 лет, которые проходили лечение в НИИ онкологии СО РАМН с 2006 по 2009 г. Материалом для исследования служили послеоперационные образцы опухолевой ткани. Полученный материал подвергался рутинному гистологическому исследованию. Во всех случаях опухоли имели гистологическое строение плоскоклеточных карцином разной степени дифференцировки.
Иммуногистохимическое исследование экспрессии ММП-1,-2,-9, ТИМП-1,-2 и EMMPRIN было проведено с использованием антител фирмы «Новокастра» ММП-2 (NCL–MMP2–507, для парафиновых блоков, высокотемпературная демаскировка антигена в 1мМ ЭДТА рН=8,0, рабочее разведение 1:40 – 1:80); ММП-9 (NCL–ММР9, для парафиновых блоков, рабочее разведение 1:40); ТИМП-1 (NCL–ТIМР1-485, для замороженной ткани и парафиновых блоков, рабочее разведение 1:200); ТИМП-2 (NCL–ТIМР2-487, для парафиновых блоков, высокотемпературная демаскировка антигена в 1мМ ЭДТА, рН=8,0, рабочее разведение 1:20); EMMPRIN (СD 147) (NCL–СD147, для парафиновых блоков, высокотемпературная демаскировка антигена в 0,01 М цитратном буфере рН=6,0, рабочее разведение 1:20 – 1:40). Инкубацию с первыми антителами проводили 60 мин при температуре 25°С. Использовали полимерную систему визуализации фирмы «BioGenex», в качестве хромогена – диаминобензидин, препараты докрашивали гематоксилином. Оценку экспрессии маркеров проводили полуколиче-ственным методом с учетом интенсивности окрашивания и количества антигенпозитивных клеток в опухолевых структурах и строме и представляли в баллах. Реакция окрашивания оценивалась следующим образом: негативная – 1 балл, слабая – 2 балла, средняя (умеренная) – 3 балла и выраженная – 4 балла.
Статистический анализ был проведен с использованием программы STATISTICA 6.0. Результаты исследования были проверены на нормальность распределения с использованием критерия Колмагорова–Смирнова. При нормальном распределении значений применялся параметрический t-критерий Стьюдента. Для значений, закон распределения которых отличался от нормального, был применен непараметрический критерий Манна–Уитни. Наличие связи между изучаемыми признаками проводили с использованием корреляционного анализа и оценивали по коэффициенту корреляции Спирмена (R).
Результаты и обсуждение
Иммуногистохимическое исследование показало, что экспрессия ММП-1 и ММП-2 в тканях опухолей головы и шеи была слабоположительной и отмечалась в 50 % образцов, в то время как ММП-9, ТИМП-1, ТИМП-2 и EMMPRIN определялись в большинстве тканей карцином головы и шеи.
Накопление ММП, ТИМП и EMMPRIN обнаруживалось как в опухолевых клетках, так и в клетках стромы, в частности фибробластах, макрофагах, сосудистых эндотелиоцитах. Наблюдалось неравномерное распределение всех исследуемых показателей между раковыми и стромальными клетками. В табл. 1 представлены обобщенные данные, характеризующие экспрессию изучаемых показателей в опухолевых и стромальных структурах. Показано, что в плоскоклеточных карциномах головы и шеи экспрессия ММП-1, -2, -9 и ТИМП-2 была значительно выше в строме по сравнению с опухолевыми клетками, наряду с этим преимущественная экспрессия ТИМП-1 и EMMPRIN наблюдалась в злокачественных клетках.
Выраженная экспрессия ТИМП-1 злокачественными клетками, по-видимому, необходима для ограничения локального протеолиза путем ингибирования каталитической активности ММП непосредственно в прилегающем пространстве к опухолевым клеткам, тогда как ТИМП-2 структурно связан с клетками стромы. Корреляционный анализ связи экспрессии ММП и ТИМП в стромальных и опухолевых клетках показал, что в опухолевых структурах повышение экспрессии ММП-2 и ММП-9 связано с увеличением экспрессии ТИМП-2 (R=0,416, p=0,001 и R=0,267, p=0,036 соответственно), а ТИМП-1 – с ММП-1 (R=0,371, р=0,003), тогда как в строме повышение экспрессии ТИМП-1 также связано с ММП-1 (R=0,420, р=0,020) и с экспрессией ММП-1 опухолевыми клетками (R=0,484, р=0,000). Таким образом, полученные в представленной работе данные свидетельствуют о сложной взаимосвязи между протеазами и их ингибиторами в опухолевых и стромальных структурах.
Вероятно, увеличение продукции ММП микроокружением происходит вследствие влия-
Таблица 1
Экспрессия ММП и ТИМП в опухолевых структурах и в строме плоскоклеточных карцином головы и шеи (в баллах)
|
Показатель |
ТИМП-1 |
ТИМП-2 |
ММП-1 |
ММП-2 |
ММП-9 |
EMMPRIN |
|
Опухоль |
3,06 ± 0,10 |
1,20 ± 0,06 |
1,61 ± 0,11 |
1,24 ± 0,07 |
1,58 ± 0,10 |
3,00 ± 0,12 |
|
Строма |
2,63 ± 0,12 |
2,32 ± 0,12 |
2,02 ± 0,12 |
2,69 ± 0,13 |
2,34 ± 0,11 |
2,05 ± 0,11 |
|
р |
0,017 |
0,001 |
0,015 |
0,001 |
0,001 |
0,001 |
Примечание: р – уровень значимости различий между опухолью и стромой.
Таблица 2
Корреляционные связи между экспрессией ММП и EMMPRIN в стромальных и опухолевых клетках
|
Группы сравнения |
R при (р<0,05) |
р |
|
Оп EMMPRIN & Стр ММП-2 |
0,298 |
0,019 |
|
Оп EMMPRIN & Стр ММП-9 |
0,279 |
0,028 |
|
Стр EMMPRIN & Оп ММП-1 |
0,316 |
0,012 |
|
Стр EMMPRIN & Стр ММП-9 |
0,346 |
0,005 |
Примечание: Оп – экспрессия показателей опухолевыми клетками, Стр – экспрессия показателей клетками стромы, R – коэффициент ранговой корреляции Спирмена, р – уровень значимости различий между показателями опухоли и стромы.
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2011. №1 (43)
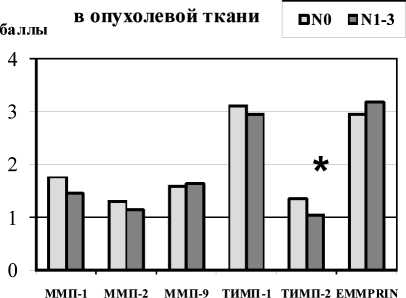
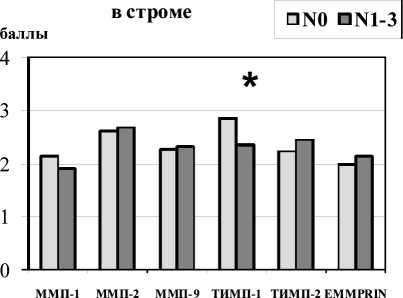
Рис.1. Экспрессия ММП, ТИМП и EMMPRIN в зависимости от лимфогенного метастазирования (N) в плоскоклеточных карциномах головы и шеи. Примечание: * – различия статистически значимы по сравнению с группой пациентов с N0
ния, оказываемого на него раковыми клетками путем секреции EMMPRIN. Это предположение подтверждается обнаруженной прямой корреляционной связью между экспрессией EMMPRIN в опухолевых клетках и ММП-2, -9 (табл. 2). Экспрессия EMMPRIN на поверхности стромальных клеток была выражена в меньшей степени, чем на поверхности опухолевых клеток, и связана с экспрессией ММП-1 клетками опухоли и экспрессией ММП-9 в строме.
Анализ экспрессии компонентов системы ММП в зависимости от метастазирования является достаточно важным, так как считается, что эндотелиальные базальные мембраны в норме представляют непроницаемый барьер для миграции клеток. Деградация ЭКМ, особенно базальной мембраны, рассматривается как один из критических фенотипов, необходимый для инвазии опухолевых клеток [8].
Результаты исследования экспрессии ММП, ТИМП и EMMPRIN в зависимости от регионарного метастазирования представлены на рис. 1. В проведенных исследованиях не было получено убедительных данных об изменениях экспрессии ММП в зависимости от лимфогенного метастазирования. Это несколько расходится с литературными данными. Так, S. Wieqand et al. была показана связь экспрессии ММП-2, ММП-3 и ММП-14 в плоскоклеточных карциномах головы и шеи с метастазированием [8]. Следует заметить, что в это исследование вошла гораздо более значительная группа пациентов, которая составляла 710 больных, что, вероятно, и позволило повысить достоверность полученных данных.
В представленном исследовании было зарегистрировано достоверное снижение уровня экспрессии ТИМП-2 в опухолевых клетках при
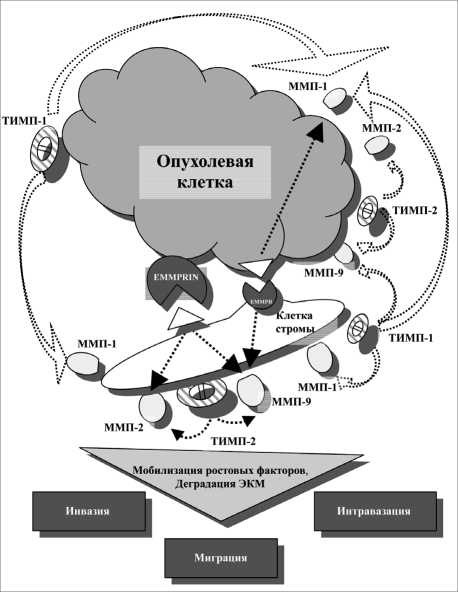
Рис. 2. Схема возможной регуляции опухолевой прогрессии плоскоклеточных карцином головы и шеи матриксными металлопротеиназами (ММП), их тканевыми ингибиторами (ТИМП) и индуктором ММП (EMMPRIN)
наличии метастазов в регионарные лимфатические узлы (рис. 1). Уровень экспрессии ТИМП-1 стромальными клетками также достоверно снижался в опухолях с регионарными метастазами по сравнению с неметастатическими опухолями. Полученные результаты свидетельствуют о важной роли ингибиторов ММП в метастазировании плоскоклеточных карцином головы и шеи. По-видимому, при метастазировании снижается ингибирующее влияние исследуемых ингибиторов на каталитическую активность ММП в злокачественных опухолях. На основании полученных результатов мы предлагаем схему вероятной регуляции прогрессии плоскоклеточного рака головы и шеи компонентами системы ММП (рис. 2).
Согласно предложенной схеме, клетки карциномы экспрессируют EMMPRIN, который, находясь на цитоплазматической мембране опухолевых клеток, может увеличивать продукцию ММП-2 и ММП-9 клетками микроокружения. Сама опухоль также способна к продукции ММП-1 и ММП-9, уровень и активность которых регулируются ингибиторами. Сниженный уровень ингибиторов в опухоли и строме способствует повышению каталитической активности ММП, что, в свою очередь, приводит к усилению инвазии и метастазирования опухолевых клеток. Таким образом, представленные в данной работе результаты свидетельствуют о важной роли стромального микроокружения в продукции ММП, что, вероятно, вносит существенный вклад в механизмы инвазивного роста и метастазирования злокачественных карцином головы и шеи.
Работа выполнена в рамках реализации ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009–2013 гг. (ГК № П320).


