Патогенетические и корреляционные взаимосвязи между уровнем короткоцепочечных жирных кислот и характером биологических процессов в клетках экзоцервикса в процессе канцерогенеза
Автор: Каюкова Елена Владимировна, Белокриницкая Татьяна Евгеньевна, Каюкова Татьяна Васильевна, Хышиктуев Баир Сергеевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.17, 2018 года.
Бесплатный доступ
Введение. Изменение спектра короткоцепочечных жирных кислот (КЖК) является одним из звеньев канцерогенеза. Цель исследования: используя ранее полученные нами данные о составе КЖК, параметрах пролиферативной активности, апоптоза и кинетики фаз клеточного цикла экзоцервикса при дис-и неопластической трансформации, провести корреляционный анализ между этими показателями. Результаты. Вероятнее всего, КЖК обладают антиканцерогенным действием, реализуя его через следующие эффекты: антипролиферативный, проапоптотический, а также модулирующее влияние на фазы клеточного цикла. Заключение. Наличие большого количества корреляционных взаимосвязей между уровнем КЖК и параметрами апоптоза, некроза, фазами клеточного цикла указывает на их тесное патогенетическое участие в процессах цервикального онкогенеза.
Рак шейки матки, короткоцепочечные жирные кислоты, апоптоз, пролиферативная активность клеток, канцерогенез
Короткий адрес: https://sciup.org/140254159
IDR: 140254159 | УДК: 618.146-006.6-092-091.818:612.397.23 | DOI: 10.21294/1814-4861-2018-17-1-32-37
Текст научной статьи Патогенетические и корреляционные взаимосвязи между уровнем короткоцепочечных жирных кислот и характером биологических процессов в клетках экзоцервикса в процессе канцерогенеза
Введение. Изменение спектра короткоцепочечных жирных кислот (КЖК) является одним из звеньев канцерогенеза. Цель исследования: используя ранее полученные нами данные о составе КЖК, параметрах пролиферативной активности, апоптоза и кинетики фаз клеточного цикла экзоцервикса при дис- и неопластической трансформации, провести корреляционный анализ между этими показателями. Результаты. Вероятнее всего, КЖК обладают антиканцерогенным действием, реализуя его через следующие эффекты: антипролиферативный, проапоптотический, а также модулирующее влияние на фазы клеточного цикла. Заключение. Наличие большого количества корреляционных взаимосвязей между уровнем КЖК и параметрами апоптоза, некроза, фазами клеточного цикла указывает на их тесное патогенетическое участие в процессах цервикального онкогенеза.
Альтерация липидного гомеостаза является одним из проявлений метаболического перепрограммирования опухолевой клетки [1]. Имеется большое количество публикаций, посвященных изучению модификации состава высших жирных кислот мембран клеток при разных онкологических заболеваниях [2–4]. Появляются научные данные об участии короткоцепочечных жирных кислот (КЖК) в процессе канцерогенеза, при этом последние в основном рассматриваются как продукт жизнедеятельности микроорганизмов [5, 6]. Крайне малочисленны и противоречивы сведения, касающиеся особенностей метаболизма и патогенетической роли КЖК у больных злокачественными новообразованиями [7–9].
Цель исследования – провести корреляционный анализ полученных нами ранее величин спектра КЖК клеток плоского цервикального эпителия, с одной стороны, и параметров пролиферативной активности, апоптоза и кинетики фаз клеточного цикла клеток экзоцервикса при дис- и неопластической трансформации – с другой.
Материал и методы
В работе были использованы полученные нами ранее лабораторные данные [7, 10]. В качестве образцов для исследования служили фрагменты шейки матки, полученные путем прицельной ножевой биопсии или в ходе проведения оперативного пособия. Одновременно проводился их морфологический контроль. В соответствии с данными гистологического исследования было выделено 2 сопоставимые клинические группы:
– I клиническая группа – 32 больных с предраковыми заболеваниями шейки матки: цервикальная интраэпителиальная неоплазия III степени, средний возраст которых составил 38 ± 8,26 года;
– II клиническую группу составили 45 пациенток с впервые выявленными инвазивными формами плоскоклеточного рака шейки матки (РШМ) Iа–Ib стадии аналогичного возраста.
В каждой группе выделены 2 фрагмента исследования: А – локус злокачественной трансформации или предопухолевое поражение шейки матки; Б – интактная ткань без признаков злокачественного роста и предраковых изменений.
Образцы контрольной группы были взяты у 25 гинекологически здоровых женщин-добровольцев, средний возраст – 34,5 ± 6,5 года, ознакомленных с дизайном исследования и давших информированное согласие на участие. Выполнялся морфологический контроль биоптатов.
Для получения клеточной суспензии кусочки биоптата измельчали и гомогенизировали в гомогенизаторе Gentle MACS Dissociator (Miltenyi Biotec GmbH, Германия) с пробирками С типа и с использованием набора реагентов Tumor Dissociation Kit (Miltenyi Biotec GmbH, Германия). Затем суспензию клеток фильтровали через капроновый фильтр с размером ячеек 30 мкм. Полученные клетки отмывали в среде RPMI-1640 с добавлением 10 % телячьей сыворотки и стандартного набора антибиотиков.
Исследование состава КЖК в отмытой суспензии клеток проводили по методике М.Д. Ардатской (2004). Регистрацию апоптоза, фаз клеточного цикла в выделенных клетках осуществляли с помощью проточной цитофлуометрии FC500 с использованием набора реагентов Annexin V Kit.
Расшифровка обозначений: спектр короткоцепочечных жирных кислот: С3:0 – пропионовая, С4:0 – масляная, isoC4:0 – изомасляная, С5:0 – валериановая, С6:0 – капроновая кислоты; пролиферативная активность, апоптотическая реактивность, некротический потенциал клеток: CD45 (–), Ki67 (+) эпителиальные, пролиферирующие клетки; CD45–, Ki67+, А+ клетки, находящиеся в раннем апоптозе; CD45–, Ki67+, А+, Р+ клетки, находящиеся в позднем апоптозе; CD45–, Ki67+, Р+ клетки, находящиеся в стадии некроза; для оценки кинетики клеточного цикла изучали следующие параметры соответственно его фазам: SubG0 (%) клетки, G0–G1 (%) клетки, S (%) клетки, G2–М (%) клетки.
Для выявления патогенетических и корреляционных взаимосвязей между изучаемыми параметрами производился корреляционный анализ изучаемых величин с помощью метода ранговой корреляции Спирмена.
Результаты
Результаты корреляционного анализа представлены в виде схем (за исключением табл. 1), на которых отражены только статистически значимые зависимости. Все остальные выявленные нами корреляции не показаны, чтобы не перегружать текст лишней информацией. При оценке изучаемых взаимосвязей в здоровых клетках экзоцервикса (контрольная группа) выявлена прямая корреляционная зависимость средней силы между уровнем iС4:0 (r=0,5; р<0,05), С5:0 (r=0,5; р<0,05) и пулом клеток, находящихся в фазе G0–G1 клеточного цикла (рис. 1). Кроме того, установлена обратная взаимосвязь (r от –0,71 до –0,78; р≤0,003) между концентрацией всех КЖК и долей клеток в фазе G2–М.
Анализ корреляционных взаимоотношений между исследуемыми параметрами в I группе выявил множество статистически значимых связей (табл. 1). Так, в IА группе установлена тесная прямая зависимость между концентрацией С3:0, iС4:0, С5:0, С6:0 и пулом клеток, находящихся в фазе SubG0, G1, S (r от 0,75 до 0,84; р≤0,001).
Таблица 1
Коэффициент корреляции Спирмена между величинами КЖК, пролиферативной активностью, апоптотической реактивностью, некротическим потенциалом, параметрами клеточного цикла в очаге диспластической трансформации (IА группа)
|
Параметры |
С 3:0 |
С4:0 |
iС4:0 |
С5:0 |
С6:0 |
|
CD45-, Ki67+ |
0,84 |
0,62 |
0,75 |
0,82 |
0,85 |
|
р<0,001 |
р=0,011 |
р<0,001 |
р<0,001 |
р<0,001 |
|
|
CD45-, Ki67+,A+ |
0,85 |
0,62 |
0,82 |
0,84 |
0,82 |
|
р<0,001 |
р=0,011 |
р<0,001 |
р<0,001 |
р<0,001 |
|
|
CD45-, Ki67+, |
0,85 |
0,62 |
0,94 |
0,85 |
0,83 |
|
A+PI+ |
р<0,001 |
р=0,011 |
р<0,001 |
р<0,001 |
р<0,001 |
|
CD45-, Ki67+, |
0,83 |
0,62 |
0,86 |
0,85 |
0,81 |
|
PI+ |
р<0,001 |
р=0,011 |
р<0,001 |
р<0,001 |
р<0,001 |
|
SubG0 |
0,85 |
0,62 |
0,82 |
0,78 |
0,84 |
|
р<0,001 |
р=0,011 |
р<0,001 |
р<0,001 |
р<0,001 |
|
|
G1 |
0,84 |
0,62 |
0,75 |
0,84 |
0,89 |
|
р<0,001 |
р=0,011 |
р<0,001 |
р<0,001 |
р<0,001 |
|
|
S |
0,83 |
0,62 |
0,88 |
0,87 |
0,84 |
|
р<0,001 |
р=0,011 |
р<0,001 |
р<0,001 |
р<0,001 |
|
|
G2-М |
-0,51 |
0,62 |
-0,51 |
-0,51 |
-0,51 |
|
р=0,04 |
р=0,011 |
р=0,04 |
р=0,04 |
р=0,04 |
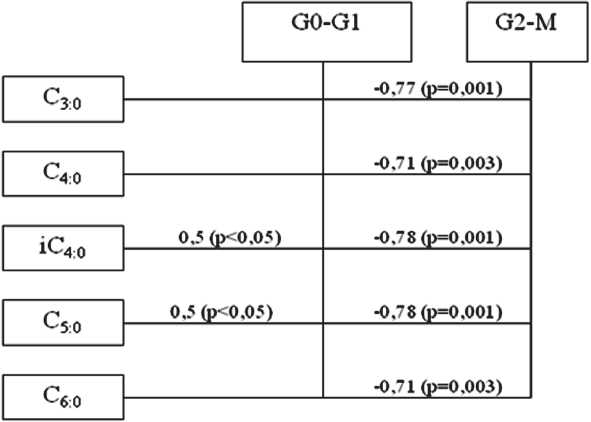
Рис. 1. Схема корреляционных взаимосвязей между величинами КЖК и параметрами клеточного цикла в клетках шейки матки контрольной группы
Аналогичные взаимосвязи были выявлены и для С4:0, однако их сила была немного слабее (r=0,62; р=0,011). Кроме того, зарегистрирована прямая корреляционная зависимость между уровнем КЖК и пролиферативной, апоптотической способностью клеток цервикального эпителия в I группе (r от 0,62 до 0,85; р≤0,011).
Оценивая взаимосвязи изучаемых параметров в IБ группе, мы обнаружили сильную прямую корреляционную зависимость между концентрациями КЖК и пролиферативным потенциалом клеток (r от 0,82 до 0,88; р<0,001), а также долей клеток, находящихся в фазе SubG0 (r от 0,82 до 0,88; р<0,001) и синтетической фазе (r от 0,80 до 0,96; р<0,001) (рис. 2).
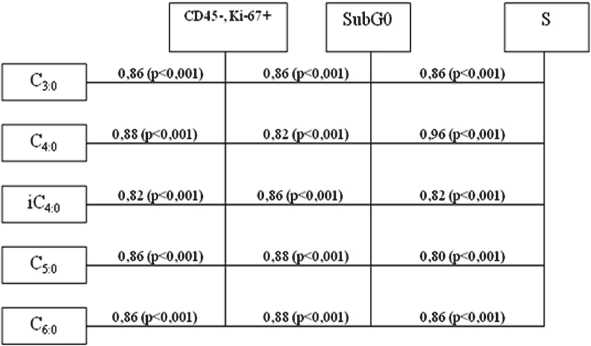
Рис. 2. Схема корреляционных взаимосвязей между величинами КЖК, пролиферативной активностью, параметрами клеточного цикла в парадиспластических клетках шейки матки (IБ группа)
В очаге цервикального рака статистически значимая взаимосвязь средней силы выявлена между концентрацией всех КЖК и пулом клеток, находящихся в стадии позднего апоптоза, при этом установленная зависимость носила обратный характер (r от –0,65 до –0,70; р≤0,004) (рис. 3). Кроме того, в данных клетках зарегистрирована прямая зависимость средней силы между короткоцепочечными аналогами и долей клеток, находящихся в фазе G2-М клеточного цикла (r от 0,51 до 0,62; р≤0,032).
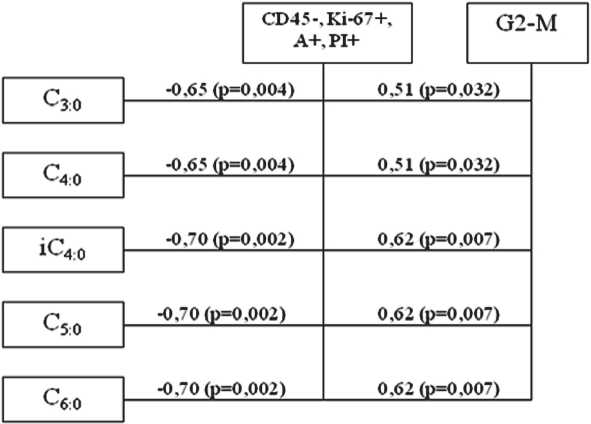
Рис. 3. Схема корреляционных взаимосвязей между величинами КЖК, апоптотической реактивностью, параметрами клеточного цикла в малигнизированных клетках шейки матки (IIА группа)
Во IIБ группе корреляционные взаимосвязи между величинами КЖК, параметрами апоптоза и клеточного цикла были иные (рис. 4). Обратная сильная зависимость зарегистрирована между пулом iС4:0 (r=–0,75; р<0,001), С5:0 (r=–0,75; р<0,001), С6:0 (r=–0,75; р<0,001) и уровнем CD45 негативных клеток, экспрессирующих маркер Ki67. Аналогичные корреляции наблюдались между всеми представителями КЖК и количеством некротических клеток (r=–0,8; р<0,001), а также G2-М-клеток (r=–0,6; р=0,009). Пул G0-G1 клеток находился в прямой сильной зависимости от концентрации iС4:0 (r=0,72; р<0,001), С5:0 (r=0,72; р<0,001), С6:0 (r=0,72; р<0,001).
Обсуждение
На основе анализа выявленных корреляционных взаимоотношений между пролиферативной активностью, параметрами апоптоза, клеточного цикла и пулом короткоцепочечных жирных кислот в клетках шейки матки при дис- и неопластической трансформации можно сделать заключение об их тесном взаимодействии в процессе малигнизации цервикального эпителия. Основываясь на сведениях современной литературы и результатах собственных исследований, мы полагаем, что КЖК обладают антиканцерогенным действием, реализуя его через следующие эффекты: во-первых, антипролиферативный, проявляющийся наличием отрицательных взаимосвязей между концентрациями КЖК, с одной стороны, и пулом CD45 негативных клеток, экспрессирующих Ki67 (IIБ группа – –0,75; р<0,001), долей G2-М клеток (IА

Рис. 4. Схема корреляционных взаимосвязей между величинами КЖК, пролиферативной активностью, некротическим потенциалом, параметрами клеточного цикла в паранеопластических клетках шейки матки (IIБ группа)
группа – –0,51; р<0,05; IIБ группа – –0,6; р=0,009 и контроль – от –0,71 до –0,78, р<0,05) – с другой. Наличие положительных корреляций уровня бутирата с долей пролиферирующих клеток (0,62, р=0,011) и G2-М клеток (0,62, р=0,011) в I группе, вероятнее, следует считать «парадоксальным» эффектом последних, что нашло свое отражение и в литературных источниках. Показано, что бутират стимулирует физиологическую пролиферацию в криптах толстой кишки, в то время как в локусе аденокарциномы его эффект противоположный [8, 11]. Выявление прямых взаимосвязей между величиной КЖК и G2-М клетками в локусе рака (r от 0,51 до 0,62; р<0,05), вероятно, следует рассматривать как участие первых в формировании G2-М клеточного блока [4].
Во-вторых, КЖК проявляют проапоптотический эффект, что ярко визуализируется в IА группе, где обнаружена сильная связь последних с клетками, находящимися в разных стадиях апоптоза. Кроме того, КЖК оказывают модулирующее влияние на фазы клеточного цикла, что установлено в каждой исследуемой группе.
Выявленные механизмы действия КЖК на клетки цервикального эпителия при предопухоле-вой трансформации и малигнизации отражают их степень участия в опухолевом процессе. Известно, что КЖК являются ингибиторами гистоновых деацетилаз и способны изменять экспрессию некоторых генов, влияя на процессы пролиферации, дифференцировки, апоптоза и некроза. Так, установлено, что КЖК возбуждают работу транскриптона р21waf1, ингибирующего циклинзависимую киназу CIP1, что нарушает нормальное прохождение клетки по циклу и приводит к ее остановке в фазе G1 [12]. Кроме того, они увеличивают уровень p27kip1, супрессорного белка, предотвращающего активацию киназы cdk4, что останавливает жизнедеятельность клетки в фазе G0 или ранней фазе G1 [8].
КЖК повышают экспрессию «рецепторов смерти» – DR4 и DR5, индуцирующих ТRAIL- опосредованный апоптоз (TNF-зависимый лиганд, индуцирующий апоптоз) [13, 14]. КЖК способны подавлять синтез антиапоптотических белков – Bcl-2, Bcl-x; с-FLIP, а также стимулируют выброс цитохрома, что в конечном итоге активирует апоптоз в клетках [8].
B.R. Han et al. [8] приводят данные о стимуляции апоптоза в культуре клеток РШМ под действием представителя короткоцепочечных аналогов – вальпроата. Следует отметить, что механизмы С5:0 действия, за счет которых реализуется его проапоптотическое действие, разнообразны. Установлено, что под влиянием пентановой кислоты в клетках повышается активность каспаз 3, -8, -9. Кроме того, С5:0 ингибирует PARP (поли(АДФ-рибоза)-полимеразы) – ферменты, участвующие в репарации поврежденной ДНК и ремоделировании хроматина за счет поли-АДФ-рибозилирования гистонов. Пентаноат изменяет трансмембранный потенциал митохондрий, потенцируя проапопто-тический механизм.
Обобщая полученные данные, можно сделать заключение, что в условиях дефицита КЖК в клетках экзоцервикса как при предраковых состояниях, так и при малигнизации цервикального эпителия антиканцерогенный эффект КЖК минимален, что приводит к дестабилизации фаз клеточного цикла, повышению пролиферативного потенциала, изменению апоптотической реактивности клеток.
Заключение
Таким образом, наличие большого количества корреляционных взаимосвязей между уровнем КЖК и параметрами апоптоза, некроза, фазами клеточного цикла указывает на их тесное патогенетическое участие в процессах цервикального онкогенеза.
Работа выполнена при финансовой поддержке гранта президента Российской Федерации для государственной поддержки молодых российских ученых МК-6143.2018.7 (договор № 14.W01.18.6143-МК от 17.01.18).
Список литературы Патогенетические и корреляционные взаимосвязи между уровнем короткоцепочечных жирных кислот и характером биологических процессов в клетках экзоцервикса в процессе канцерогенеза
- Каюкова Е.В., Терешков П.П. Изменение состава короткоцепочечных жирных кислот в клетках шейки матки при тяжелой дисплазии и злокачественной трансформации. Современные проблемы науки и образования. 2015; 21. URL: https://www.science-education.ru/ru/article/view?id=18999 (дата обращения: 06.01.2017).
- Каюкова Е.В. Пролиферативная активность и апоптотическая реактивность клеток шейки матки при предраковых состояниях и неоплазии шейки матки. Врач-аспирант. 2015; 2.1 (69): 117-124.
- Куликов В.А., Беляева Л.Е. Метаболическое перепрограммирование раковых клеток. Вестник ВГМУ. 2013; 12 (2): 6-18.
- Хышиктуев Б.С., Каюкова Е.В., Каюков В.А., Терешков П.П. Спектр высших жирных кислот опухолевой ткани при раке шейки матки с различной степенью дифференцировки. Сибирский онкологический журнал. 2013; 1 (55): 47-51.
- Alrawi S.J., Schiff M., Carroll R.E., Dayton M., Gibbs J.F., Kulavlat M., Tan D., Berman K., Stoler D.L., Anderson G.R. Aberrant crypt foci. Anticancer Res. 2006; 26: 107-119.


