Патогенетические связи маркеров костного метаболизма и клинико-лабораторных показателей у детей с хронической низкодозовой нагрузкой металлами
Автор: Зайцева Н.В., Устинова О.Ю., Землянова М.А., Кирьянов Д.А.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Медико-биологические науки
Статья в выпуске: 10, 2009 года.
Бесплатный доступ
Определены основные патогенетически значимые механизмы формирования нарушений костного метаболизма у детей, проживающих в условиях негативного внешнесредового воздействия химических техногенных факторов. Установлены прямые и опосредованные механизмы влияния тяжелых металлов на процессы костного ремоделирования.
Короткий адрес: https://sciup.org/147204458
IDR: 147204458 | УДК: 616-036.1:
Текст научной статьи Патогенетические связи маркеров костного метаболизма и клинико-лабораторных показателей у детей с хронической низкодозовой нагрузкой металлами
В структуре нарушений здоровья детского населения болезни костно-мышечной системы занимают первое место, что предопределяет социально-экономические потери общества. На территориях интенсивного промышленного освоения с высокой степенью техногенной химической нагрузки окружающей среды острота этих проблем особенно высока (Л.А. Щепляги-на, 2003). Нарушение формирования костной массы в детском возрасте создает реальные предпосылки развития остеопороза у взрослых (Е.Е. Михайлов, 2001; Л.Я. Рожинская, 2001). Среди причин формирования остеопенических состояний у детей наибольшее значение имеют генетические факторы, нарушения минерального и витаминного обменов, неполноценное питание, различные патологические процессы, сопровождающиеся нарушением продукции кальцийрегулирующих и системных гормонов, усилением свободнорадикальных процессов. Особую роль играет поступление в организм ребенка токсических веществ промышленного происхождения, прежде всего тяжелых металлов (Л.А. Щеплягина, 2005; Н.В. Торопцова, 2005). Конкурентно взаимодействуя с кальцием в костной ткани и разбалансируя витаминноминеральный обмен, тяжелые металлы в ходе длительной кумуляции и метаболизма приводят к деминерализации костной ткани (Л.А. Щепля-гина, 1998). Спектр воздействий на молекулярном, тканевом, клеточном и системном уровнях во многом зависит от экспозиции токсического вещества, комбинации его с другими факторами, предшествующего состояния здоровья ребенка, его иммунологической реактивности, наличия генетически обусловленной чувствительности к влиянию ксенобиотиков (В.С. Масюк, 2003). Вместе с тем следует отметить, что до настоящего времени остаются малоизучен- ными механизмы влияния ксенобиотиков, распределенных в областях быстрого обмена, на процессы костного метаболизма.
Комплекс этих вопросов является весьма актуальным для Пермского края, где заболевания костно-мышечной системы у детей уже в дошкольном возрасте становятся преобладающим видом патологии. За последние 10 лет по промышленным городам края на фоне роста загрязнения окружающей среды веществами I-III классов опасности прирост заболеваемости детей болезнями костно-мышечной системы в среднем составил более 1200%. Распространенность этой патологии до 1,5 раз превышает среднероссийский уровень. Таким образом, исследование механизмов влияния токсикантной нагрузки на процессы ремоделирования костной ткани весьма актуально.
Цель исследования : выполнить анализ патогенетических взаимосвязей маркеров костного метаболизма и клинико-лабораторных показателей при хроническом низкодозовом воздействии тяжелых металлов.
Материалы и методы
В исследовании использованы: комплекс иммунологических, биохимических, химикоаналитических методов, методы математического моделирования, элементы системного анализа и расчет рисков. Объектом исследования являлись дети, проживающие в условиях постоянной техногенной химической нагрузки (на примере городов Пермского края Лысьва и Чусовой) и в условиях относительно благоприятной санитарно-гигиенической ситуации. Предметы исследований - параметры клиниколабораторных показателей и их межсистемные патогенетически значимые взаимосвязи. Углубленное лабораторное исследование осуществлено по двум выборкам: основная группа – 135
детей в возрасте 7-14 лет, проживающих в городах Чусовой и Лысьва, и группа сравнения – 100 детей в возрасте 7-14 лет, проживающих в условиях относительного санитарно-гигиенического благополучия. Клинико-лабораторная диагностика выполнена с помощью гематологического анализатора"PS-5" (Венгрия), автоматического биохимического "Skreen Master" (США) и им-муноферментного "Stat Faх-2600" (США) анализаторов. Исследование и оценку прооксидантно-антиоксидантного равновесия в организме осуществляли на основании определения общей антиоксидантной активности и содержания малонового диальдегида в плазме крови (И.Д. Стальная, 1977). Исследование гормонального профиля предусматривало определение содержания гормонов методом ИФА с использованием наборов фирмы “Хема-Медика” (Москва). Состояние гуморального иммунитета оценивалось по содержанию сывороточных иммуноглобулинов классов A, M, G (г/дм3) методом иммунодиффузии по G. Mancini. О функционировании системы неспецифической защиты судили по показателям фагоцитарной активности нейтрофилов. Степень сенсибилизации организма оценивали по уровню содержания общего иммуноглобулина Е методом ИФА с использованием тест-системы «Вектор-Бест» (Новосибирск). Показатели костного метаболизма определяли методом моноклональных антител с использованием наборов «Elisa Kit», Дания (N-остеокальцин и C-N концевые телопептиды), «BAP», США (костный изофермент щелочной фосфатазы), «BioVendor», Чехия (тартрат-резистентная фосфатаза). Исследования крови на содержание металлов (свинца, ванадия, хрома, никеля, марганца) выполнены на атомноабсорбционном спектрофотометре Perkin Elmer 3110 с использованием в качестве окислителя ацетилено-воздушной смеси с детектированием в режиме пламенной атомизации, согласно методическим указаниям МУК 44.763-99-4.1.79999 МЗ РФ. Для сравнения использованы показатели содержания контаминантов и микроэлементов в крови 100 практически здоровых детей условно чистых территорий области, без объектов промышленного производства.
Для выявления причинно-следственных связей в нарушении формирования костной систе-
Параметры зависимости вероятности изменения мы разрабатывались математические модели и проводилось многоступенчатое вычисление показателя отношения шансов. Для выявления наличия и патогенетического характера связей активности маркеров костного метаболизма с клинико-лабораторными показателями и параметрами контаминации биосред проведено статистическое моделирование на базе построения моделей логистической регрессии с использованием стандартных (SAS V 6.04, STATGRAF и др.) и специально разработанных программных продуктов. Математическую обработку осуществляли с помощью параметрических методов вариационной статистики. Расчет вероятности изменения исследуемых показателей включал кластерный анализ, анализ временных рядов, множественный корреляционно-регрессионный анализ, факторный анализ. Оценивалась величина относительного риска, этиологической доли токсикантной нагрузки (Э.М. Денисов, 2002), пропорции риска и отношения шансов, осуществлялся расчет атрибутивного риска. Статистические гипотезы относительно параметров моделей оценивались с помощью критериев Стьюдента и Фишера. Различия считали статистически значимыми при р<0,05.
Результаты и обсуждение
В ходе моделирования параметров вероятности изменения маркеров костного метаболизма на фоне повышения содержания в крови промышленных токсикантов (табл. 1) установлена взаимосвязь между пониженным уровнем маркеров синтеза костной ткани и наличием в крови промышленных токсикантов в концентрациях, превышающих референтные пределы: свинец – N-остеокальцин (D=0,13), хром – костный изофермент щелочной фосфатазы (D=0,25), марганец – костный изофермент щелочной фосфатазы (D=0,15). Одновременно установлена зависимость повышенного содержания маркера остеорезорбции от наличия в крови токсикантов в концентрациях, превышающих референтные пределы: С-концевые телопептиды – ванадий (D=0,79). Адекватных моделей зависимости вероятного изменения активности тартрат-резистентной кислой фосфатазы от повышения концентрации изучаемых токсикантов не установлено.
Таблица 1 маркеров костного метаболизма от повышенного содержания промышленных токсикантов в крови
|
Фактор |
Маркер остеогенеза |
Повышение/(+) Понижение (-) |
b 0 |
b 1 |
D |
|
Свинец |
N-остеокальцин |
- |
2,04±0,15 |
7,25±2,79 |
0,13 |
|
Хром |
Костный изофермент щелочной фосфатазы |
- |
0,95±0,02 |
27,24±5,47 |
0,25 |
|
Марганец |
Костный изофермент щелочной фосфатазы |
- |
0,88±0,03 |
19,75±4,97 |
0,15 |
|
Ванадий |
С-концевые телопептиды |
+ |
2,53±0,09 |
602,47±10,84 |
0,79 |
Таблица 2
Вероятность и атрибутивный риск изменения маркеров костного метаболизма при повышении содержания промышленных
|
токсикантов в к |
рови |
|||
|
Фактор |
Маркеры остеогенеза |
Повышение / (+) Понижение (-) |
р оп |
AR, % |
|
Свинец |
N-остеокальцин |
- |
0,26 |
4,4 |
|
Хром |
Костный изофермент щелочной фосфатазы |
- |
0,53 |
8,2 |
|
Марганец |
Костный изофермент щелочной фосфатазы |
- |
0,40 |
1,9 |
|
Ванадий |
С-концевые телопептиды |
+ |
0,79 |
23,0 |
Углубленный анализ моделей позволил провести количественную оценку вероятности и атрибутивного риска изменений маркеров костного метаболлизма при повышении содержания в биосредах отдельных промышленных токсикантов выше референтного уровня (табл. 2).
В ходе исследования было установлено, что содержание свинца в крови выше референтного предела на уровне 0,1344±0,0001 мг/дм3 увеличивает вероятность снижения содержания N-остеокальцина до 0,26 ниже физиологической нормы, а атрибутивный риск развития этого процесса составляет 4,4%. Если в качестве референтного рассматривать рекомендуемый в настоящее время уровень содержания свинца в крови 0,01 мг/дм3, то при аналогичной вероятности снижения содержания N-остеокальцина атрибутивный риск составляет 13,3% (рис. 1). Анализ влияния хрома на процессы остеосинтеза показал, что при концентрации хрома выше референтной величины, на уровне 0,0395±0,0042 мг/дм3 , вероятность снижения активности костного изофермента щелочной фосфатазы составляет 0,53, а атрибутивный риск – 8,2% (рис. 2). В ходе исследования влияния марганца на процессы остеосинтеза установлено, что при повышении его содержания до уровня 0,0233±0,0005 мг/дм3 вероятность снижения костного изофермента щелочной фосфатазы составляет 0,40, а атрибутивный риск – 1,9%.
Таким образом, анализ показателей вероятности и атрибутивного риска снижения содержания и активности маркеров остеосинтеза в сыворотке крови позволяет говорить о наиболее значимом влиянии на исследуемые процессы хрома и марганца, в то время как на повышение содержания маркера резорбции (С-концевых телопептидов) – ванадия.
Учитывая, что воздействие на организм является не моно-, а поливалентным, рассчитали вероятность изменения маркеров костного метаболизма в ответ на суммарное действие ток-сикантной нагрузки по правилу сочетаний вероятностей независимых в совокупности событий.
Вероятность снижения активности процессов остеосинтеза, опосредованная хронической токсикантной нагрузкой, составила по показателю N-остеокальцина 0,69, а по активности костного изофермента щелочной фосфатазы – 0,95, при этом атрибутивный риск развития достигал 15% и 5% соответственно.
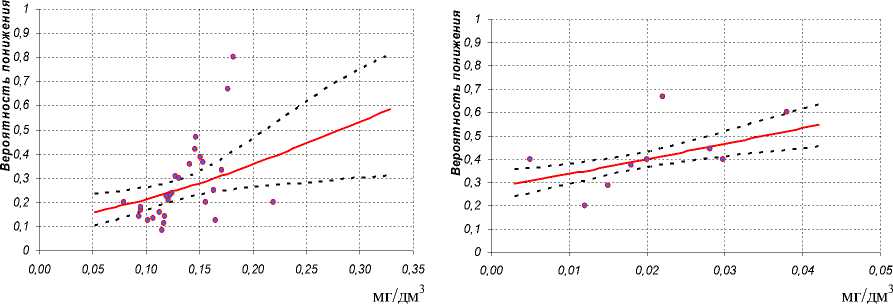
Рис. 1. Модель зависимости содержания N-остеокальцина в сыворотке крови от уровня свинца
Рис. 2. Модель зависимости активности костного изофермента щелочной фосфатазы в сыворотке крови от уровня хрома
Последующее изучение моделей зависимости вероятности изменения клиниколабораторных показателей от уровня содержания в крови токсикантов и моделей зависимости вероятности отклонения маркеров костного метаболизма при изменении клиниколабораторных показателей позволило выявить некоторые звенья патогенеза нарушений метаболизма костной ткани в условиях хронического токсикантного воздействия.
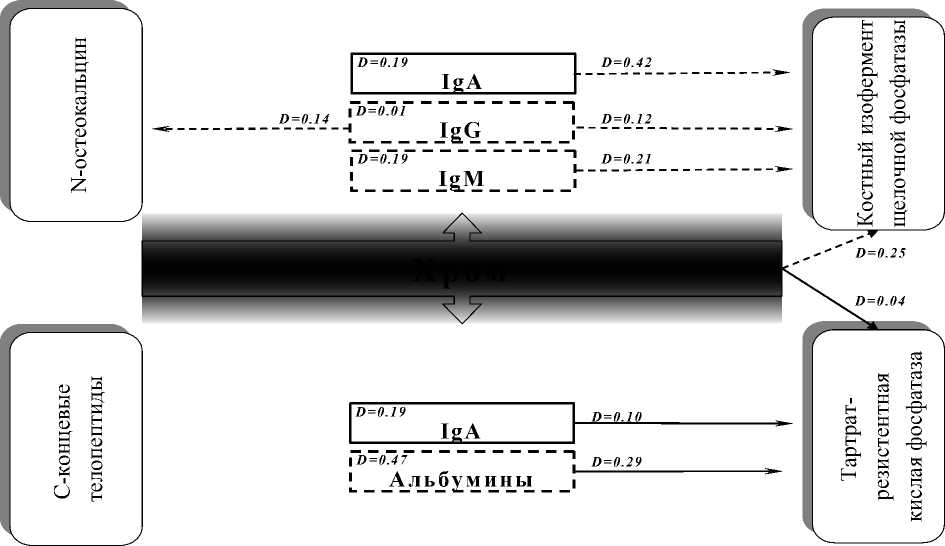
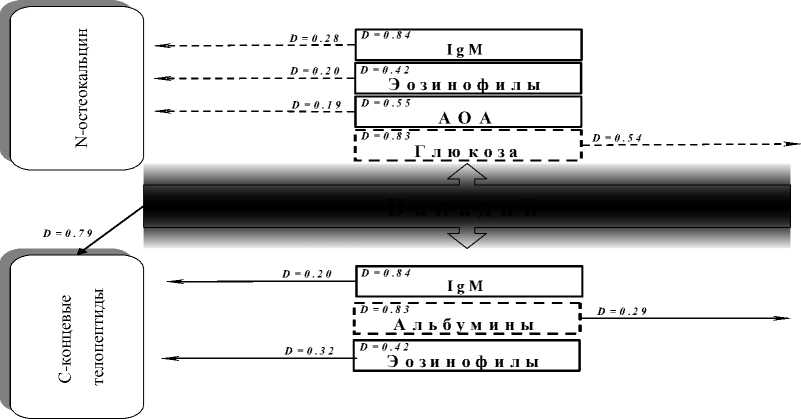
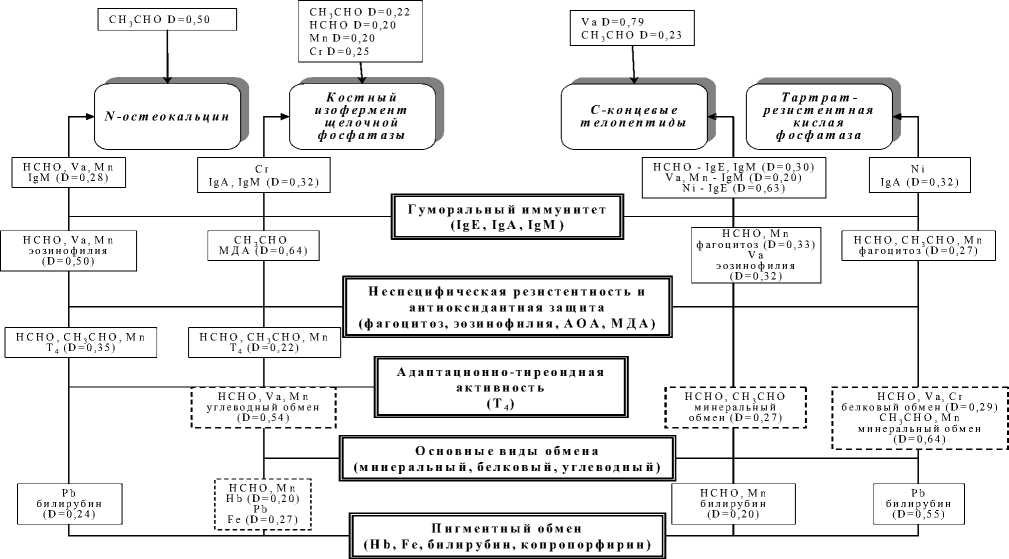
Для дифференциальной оценки степени связи анализируемых моделей была принята градация: пара обладает слабой связью, если 0,1 Установлено, что содержание в крови свинца выше референтного предела приводит к повышению показателей пигментного обмена с высокими связями – свинец–сывороточное железо (D=0,85); заметными – свинец–билирубин прямой (D=0,52); слабыми – свинец–билирубин общий (D=0,1) (рис. 5). С другой стороны, увеличение содержания в крови свинца находится в высокой связи со снижением уровня гемоглобина (D=0,72), общего холестерина (D=0,84) и в заметной связи – с некоторыми показателями неспецифической резистентности (процент фа- гоцитоза – D=0,61). Большинство перечисленных показателей находится в связи с маркерами костного синтеза – N-остеокальцином и костным изоферментом щелочной фосфатазы (рис. 3). Снижение содержания N-остеокальцина имеет слабовыраженную связь с повышением уровня прямого билирубина (D=0,24), снижением общего холестерина (D=0,13) и процента фагоцитоза (D=0,17). Снижение активности костного изофермента щелочной фосфатазы находится в слабой связи с повышением прямого билирубина (D=0,21), сывороточного железа (D=0,27), снижением гемоглобина (D=0,2) и общего холестерина (D=0,08). Повышение активности маркера костной резорбции – тартрат-резистентной фосфатазы – имеет заметную связь с повышением содержания общего билирубина (D=0,55). Таким образом, содержание в крови свинца выше референтного предела приводит к формированию тесных связей между клиниколабораторными показателями, отражающими формирование гемолитического процесса и нарушения пигментного обмена, и маркерами костного метаболизма. Наиболее существенное воздействие формируется на уровне синтетического звена костного метаболизма (рис. 3). Повышенное, относительно референтного предела, содержание в крови хрома приводит к R2=0.24 R2=0.52 Билирубин прям ой R2=0.85 Ж елезо сывороточное IR2=0.72 Гемоглобин R2=0.21 R2=0.27 R2=0.20 R2=0.13 I R2=0.84 -----------( R2=0.08 Общий холестерин I R2=0.17 f R2=0.61 I Процент фагоцитоза Свинец R2=0.10 Билирубин общий R2=0.55 ;_____j--— Модели риска занижения зависимого показателя I I — Модели риска завышения зависимого показателя Рис. 3. Патогенетические механизмы влияния свинца на костный метаболизм :_____j—- Риск снижения показателя Риск повышения показателя Рис. 4. Патогенетические механизмы влияния хрома на костный метаболизм изменению показателей гуморального звена иммунного ответа, о чем свидетельствует наличие достоверных моделей слабой связи – хром– иммуноглобулин А (D=0,19), хром– иммуноглобулин М (D=0,19). Повышение содержания хрома в сыворотке крови имеет умеренную связь с понижением уровня альбуминов (D=0,47). В свою очередь, изменение показателей гуморального звена иммунной защиты и уровня альбуминов оказывает влияние на снижение синтетических и активацию резорбтивных процессов костного метаболизма (рис. 4). Снижение содержания N-остеокальцина находится в слабой связи с уровнем иммуноглобулина G (D=0,2), а снижение активности костного изофермента щелочной фосфатазы – в умеренной с иммуноглобулином А (D=0,42) и слабой – с иммуноглобулином М (D=0,21), иммуноглобулином G (D=0,12). Повышение активности маркера костной резорбции (тартрат-резистентной фосфатазы) слабо связано с повышением уровня иммуноглобулина А (D=0,1) и понижением содержания альбуминов (D=0,29). Таким образом, содержание в крови хрома, превышающее референтный предел, приводит к формированию связей между клиниколабораторными показателями, преимущественно отражающими развитие вторичного иммунодефицита, и маркерами костного метаболизма, отражающими состояние синтетического звена костного метаболизма. Изучение патогенетических механизмов влияния ванадия в концентрациях выше референтных выявило его высокую связь с повышением иммуноглобулина М (D=0,84), снижением уровня альбуминов (D=0,83) и глюкозы (D=0,83); заметную – с нарастанием антиоксидантной активности крови (D=0,55); умеренную – с повышением абсолютного числа эозинофилов (D=0,42) (рис. 7). Снижение уровня содержания N-остеокальцина слабо связано с повышением иммуноглобулина М (D=0,28), абсолютного числа эозинофилов (D=0,2) и антиоксидантной активности крови (D=0,19). Cнижение активности костного изофермента щелочной фосфатазы имеет заметную связь с понижением содержания глюкозы (D=0,54). Содержание С-концевых телопептидов слабо связано с повышением иммуноглобулина М (D=0,2) и умеренно – с повышением абсолютного числа эозинофилов (D=0,32). Увеличение активности тартрат-резистентной фосфатазы слабо связано со снижением содержания альбуминов (D=0,29) (рис. 5). Следовательно, содержание в крови ванадия, превышающее референтный предел, сопровождается развитием механизмов активации иммунного ответа, сенсибилизации, антиоксидантной защиты, нарушениями белкового и углеводного обменов. Полученные модели связи Риск снижения показателя Рис. 5. Патогенетические механизмы влияния ванадия на костный метаболизм Риск повыш ения показателя этих показателей с маркерами костного метаболизма свидетельствуют о наличии сопряженности формирующихся клинико-лабораторных сдвигов как со снижением процессов синтеза, так и с активацией резорбции костной ткани. Таким образом, содержание в крови ванадия, превышающее референтный предел, сопровождается развитием механизмов активации иммунного ответа, сенсибилизации, антиоксидантной защиты, нарушениями белкового и углеводного обменов. Полученные модели связи этих показателей с маркерами костного метаболизма свидетельствуют о наличии сопряженности формирующихся клинико-лабораторных сдвигов как со снижением процессов синтеза, так и с активацией резорбции костной ткани. Моделирование связей «содержание в крови марганца выше референтных пределов – клинико-лабораторные данные» позволило выявить адекватные модели со слабой связью: повышение уровня иммуноглобулина М (D=0,13), фагоцитарного индекса (D=0,16), общего билирубина (D=0,16), снижение иммуноглобулинов G (D=0,21), альбуминов (D=0,22), глюкозы (D=0,28); модели с умеренной связью: повышение индекса эозинофилии (D=0,44), скорости оседания эритроцитов (D=0,49), снижение кальция (D=0,39); модель с заметной связью: понижение уровня гемоглобина (D=0,55); модель с весьма высокой связью: повышение содержания Т4 свободного (D=0,93) (рис. 6). Снижение содержания N-остеокальцина связано с повышением показателей специфической и иммунной защиты. Модели демонстрируют наличие слабой связи этого маркера с понижением фагоци- тарного индекса (D=0,09), IgM (D=0,28) и высокой связи с индексом эозинофилии (D=0,80). Помимо показателей неспецифической и иммунной защиты установлена умеренная связь N-остеокальцина с повышением содержания в крови Т4 свободного (D=0,35). Снижение активности костного изофермента щелочной фосфатазы находится в слабой связи со снижением иммуноглобулина G (D=0,12), гемоглобина (D=0,2) и заметной связи с содержанием глюкозы (D=0,54). Cнижение активности костного изофермента щелочной фосфатазы находится в слабой связи с увеличением содержания в сыворотке крови Т4 свободного (D=0,22) и повышением скорости оседания эритроцитов (D=0,23). Повышение содержания С-концевых телопеп-тидов имеет слабую связь с повышением IgМ (D=0,2), фагоцитарного индекса (D=0,29) и общего билирубина (D=0,19). Увеличение активности тартрат-резистентной фосфатазы имеет слабую связь с фагоцитарным индексом (D=0,19) и увеличением скорости оседания эритроцитов (D=0,11), умеренную – с повышением индекса эозинофилии (D=0,32), заметную – с содержанием кальция (D=0,64). Таким образом, ванадий, марганец оказывают влияние на оба звена костного метаболизма: супрессируют процессы синтеза с одновременной стимуляцией механизмов резорбции костной ткани. Для остальных изученных токсикантов установлена более узкая направленность влияния: так, для свинца и хрома характерно преимущественное угнетение синтетических процессов остеогенеза. Анализ механизмов формирования нарушений костного Глюкоза i D=0.55 D=0.20 Гем лобин । к к D=0.01 D=0.15 D=0.20 D =0.13 IgM D=0.32 D=0.29 D=0.19 D=0.49 D=0.11 СОЭ D=0.19 D=0.29 I D=0.64 Риск снижения показателя Риск повышения показателя Рис. 6. Патогенетические механизмы влияния марганца на костный метаболизм D=0.16 Фагоцитарный индекс D=0.44 Индекс эозинофилии D=0.16 Билирубин общий iD=0.22 i Альбумины iD=0.39 i Кальций метаболизма под влиянием хронического токси-кантного воздействия выявил нарушение разнообразных процессов поддержания гомеостаза: иммунологического равновесия, антиоксидантной защиты, гормонального статуса, минерального, белкового и углеводного обменов, развитие сенсибилизации и цитолиза. Для выявления наиболее значимых связей маркеров костного метаболизма с клиниколабораторными показателями был проведен анализ моделей с учетом принятой градации выраженности связей. N-остеокальцин имеет умеренную связь с повышением содержания Т4 свободного (D=0,35) и гуморальными факторами иммунного ответа (D=0,28), высокая степень связи прослеживается с показателями сенсибилизации (D=0,8). Кислый изофермент щелочной фосфатазы имеет заметную степень связи с состоянием антиоксидантной защиты (D=0,64) и нарушениями углеводного обмена (D=0,54), умеренную связь – с гуморальными факторами иммунного ответа (D=0,42). С-концевые тело-пептиды имеют высокую степень связи с цитолитическим синдромом (D=0,74), заметную – с показателями сенсибилизации (D=0,63), умеренную – с показателями иммунного статуса (D=0,47), слабую – с показателями неспецифической защиты (D=0,29). Активность тартрат- резистентной кислой фосфатазы имеет весьма высокую степень связи с процессами сенсибилизации (D=0,8), заметную – с нарушениями кальциевого обмена (D=0,64), слабую – с нарушениями белкового обмена (D=0,29). Таким образом, маркеры синтеза имеют высокую и заметную связь с процессами сенсибилизации, антиоксидантной защиты и с состоянием углеводного обмена; гуморальное звено иммунного ответа и гормональный профиль находятся с этими маркерами в умеренной и слабой связи. Маркеры резорбции находятся в весьма высокой, высокой и заметной связи с процессами сенсибилизации, обменом кальция и цитолизом; связь с показателями неспецифической защиты и специфического иммунитета носит умеренный и слабый характер. На основании полученных данных предложена схема отдельных звеньев патогенетических механизмов нарушений костного метаболизма в условиях хронического токсикантного воздействия (рис. 7). В основе нарушений костного метаболизма при хроническом токсикантном воздействии лежат процессы нарушения гомеостаза иммунной системы, неспецифической резистентности, гормонального статуса, основных видов обмена и системы крови. Возникающие под действием Рис. 7. Схема отдельных звеньев патогенетических механизмов нарушения костного метаболизма при хроническом токсикантном воздействии ацетальдегида, формальдегида, хрома, ванадия и марганца нарушения в иммунной системе (D=0,28-0,32), системе неспецифической резистентности (D=0,50-0,64), гормональном статусе (D=0,22-0,35), углеводном обмене (D=0,54) и системе крови (D=0,20-0,27) провоцируют снижение синтеза белков костного матрикса. С другой стороны, хроническое воздействие на организм ацетальдегида, формальдегида, никеля, хрома, ванадия и марганца в концентрациях, превышающих референтный предел, оказывает через иммунную систему (D=0,20-0,63), факторы неспецифической резистентности (D=0,27-0,33), белковый (D=0,29), минеральный (D=0,27-0,64) обмены и систему крови (D=0,20) стимулирующее действие на функцию остеокластов и деградацию коллагена I типа. Дискоординация синтетических и резорбтивных процессов в костной ткани, провоцируемых хронической токсикантной нагрузкой, является одной из причин замедления формирования костного скелета, снижения его устойчивости к внешним воздействиям, создает основу для его деформаций и недоразвития. Выводы Риск нарушений костного метаболизма, лежащих в основе развития остеопенических состояний у детей, детерминируется прямым (АRΣ – 5,0÷53,0%) и опосредованным воздействием тяжелых металлов и кислородсодержащих соединений на процессы остеосинтеза и резорбции костной ткани с вовлечением основных звеньев минерального (D=0,27÷0,64), пигментного (D=0,2÷0,55), белкового (D=0,29), углеводного (D=0,54) обменов, гуморального иммунитета (D=0,2÷0,63), неспецифической резистентности (D=0,27÷0,64) и адаптационнотиреоидной активности (D=0,22÷0,35).






Список литературы Патогенетические связи маркеров костного метаболизма и клинико-лабораторных показателей у детей с хронической низкодозовой нагрузкой металлами
- Гмурман В.Е. Руководство к решению задач по теории вероятностей и математической статистике: учеб. пособие для студентов вузов. Изд. 4-е./В.Е. Гмурман М.: Высш. шк., 1998. 400 с.
- Гмурман В.Е. Теории вероятностей и математическая статистика: учеб. пособие для вузов. Изд. 6-е./В.Е. Гмурман. М.: Высш. шк., 1998. 479 с.
- Денисов Э.И. Способ определения степени зависимости болезни от работы/Э.И. Денисов, Б.Р. Башарова//Патент РФ Ru. 2189589C2 от 08.06.2002.
- Масюк В.С. Состояние иммунной системы у детей в районе экологического неблагополочия/В.С. Масюк.//Рос. педиатр. журн. 2003. № 4. С. 52-55.
- Михайлов Е.Е. Эпидемиологическая характеристика остеопороза в популяционной выборке городского населения: автореф. дис.... д-ра мед. наук./Е.Е. Михайлов. М., 2001.
- Рожинская Л.Я. Остеопенический синдром при заболеваниях эндокринной системы и постменопаузальный остеопороз (патогенетические аспекты, диагностика и лечение): дис. д-ра мед. наук./Л.Я. Рожинская. М., 2001. 318 с.
- Торопцова Н.В. Подходы к профилактике и лечению остеопороза/Н.В. Торопцова, Л.И. Беневоленская//Лечащий врач. 2005. № 4. С. 31-35.
- Щеплягина Л.А. Антропогенное загрязнение среды и заболеваемость детей/Л.А. Щеплягина//Экологические и гигиенические проблемы здоровья детей и подростков. М., 1998.
- Щеплягина Л. А. Возрастные особенности минерализации костной ткани у детей/Щеплягина Л. А., Моисеева Т. Ю., Круглова И. В.//Рос. педиатр. журн. 2002. № 6. С. 37-39.
- Щеплягина Л.А. Проблемы остеопороза в педиатрии: возможности профилактики/Л.А. Щеплягина, Т.Ю. Моисеева//Рус. мед. журн. 2003. № 27. С. 1554-1556.
- Щеплягина Л.А. Остеопения у детей: диагностика, профилактика и коррекция: пособие для врачей/Л.А. Щеплягина, Т.Ю. Моисеева, М.В. Коваленко М., 2005. 40 с.


